Похожие презентации:
Кислотно-основное состояние
1. Кислотно-основное состояние (КОС)
2. ОБЩИЕ СВЕДЕНИЯ О КОС
• КОС - определенное соотношениеконцентрации протонов водорода (Н+)
гидроксильных анионов (ОН-) в
биологических средах организма, которое
выражает рН крови.
3.
• рН это отрицательный десятичныйлогарифм
концентрации
водородных
ионов (протонов) в растворе, выраженной
в моль/литр.
• Цифра
рН
показывает,
в
какую
отрицательную степень надо возвести
основание десятичного логарифма, а оно
равно соответственно 10, чтобы получить
концентрацию
ионов
водорода
в
моль/литр.
4. pH определяется уравнением Гендерсона—Гассельбальха
pH определяетсяуравнением
Гендерсона—
Гассельбальха
5. Зачем это все?
рН является наиболее жесткой физико-химическойконстантой.
Концентрация Н+ во внеклеточной жидкости составляет одну
миллионную от содержания натрия и калия, а регуляция
на два порядка точнее.
6. ЗНАЧЕНИЕ ПОСТОЯНСТВА КОС ДЛЯ ОРГАНИЗМА
1. рН определяет физико-химические свойстваколлоидных структур;
2. рН определяет активность, конформацию белков;
3. рН определяет чувствительность клеточных
рецепторов;
4. рН определяет проницаемость клеточных
мембран;
5. рН регулирует сосудистый тонус;
6. рН определяет состояние дыхательного центра;
7. рН влияет на состояние ЦНС
7.
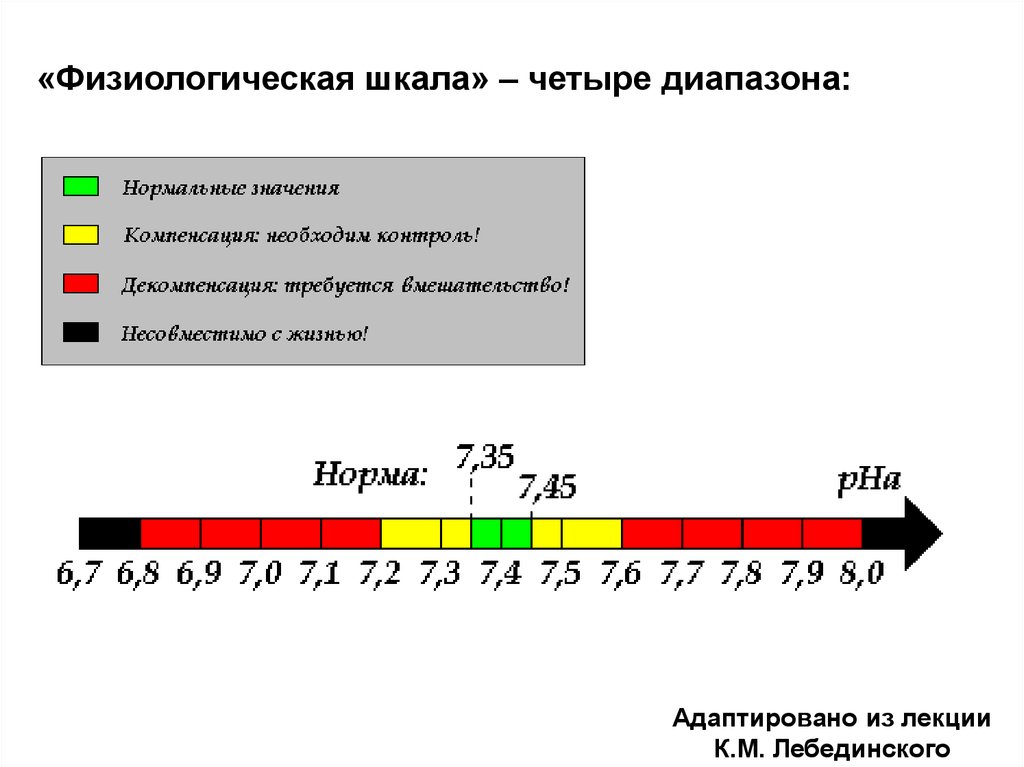
«Физиологическая шкала» – четыре диапазона:Адаптировано из лекции
К.М. Лебединского
8. Механизмы КОС
1. физико-химические буферные системыорганизма;
2. физиологические механизмы регуляции.
9. Физико-химические буферные системы организма
Вода:1. образование иона гидроксония.
2. образование иона аммония;
3. разведение.
10. Первая линия защиты – буферные системы
– Бикарбонатная– Гемоглобиновая
– Белковая
– Фосфатная
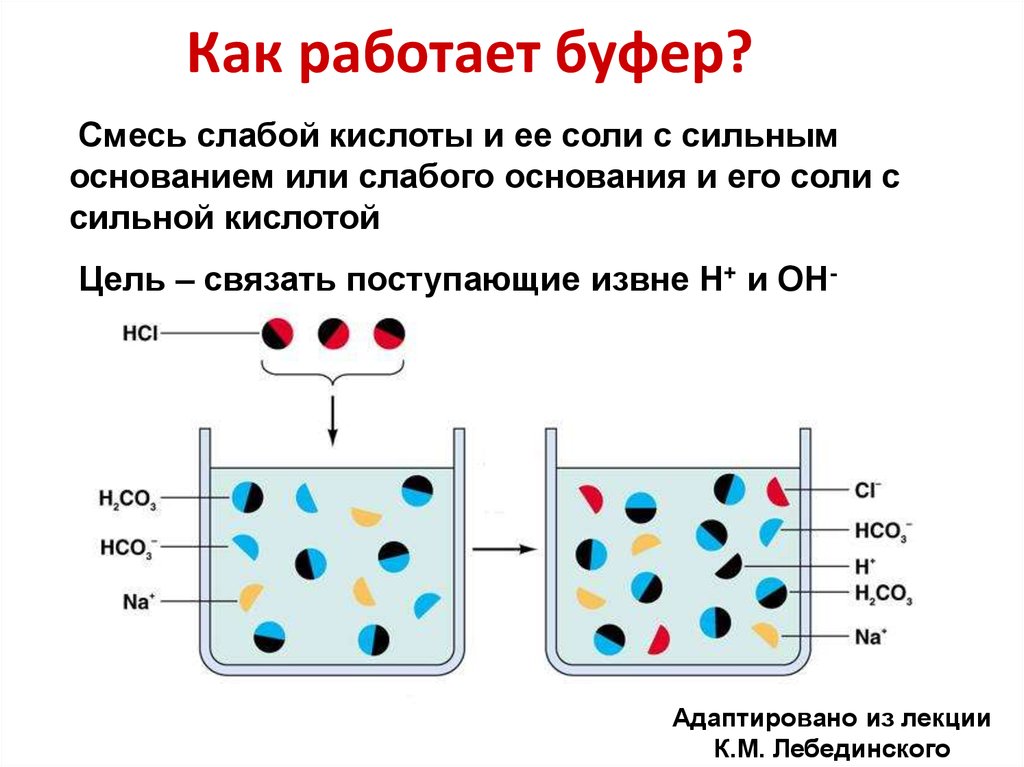
11. Как работает буфер?
Смесь слабой кислоты и ее соли с сильнымоснованием или слабого основания и его соли с
сильной кислотой
Цель – связать поступающие извне Н+ и ОН-
Адаптировано из лекции
К.М. Лебединского
12. Гидрокарбонатный буфер крови и межклеточной жидкости
• Н2СО3/NaHCO3, соотношение 1/20.• Состав: угольная кислота и гидрокарбонат
натрия.
• В клетках вместо натрия - калий или
магний.
• Удельный вес - 7-9 % общей буферной
емкости крови.
Емкость бикарбонатного буфера 25%. Его компоненты и определяются
в качестве индикаторов КОС, что имеет большое диагностическое
значение.
13. Гемоглобин
• его емкость составляет до 75 % всейбуферной емкости крови.
Его компоненты:
• восстановленный и оксигенированный
гемоглобин: НHb/КНbО2.
Восстановленный гемоглобин ведет себя как
кислота, а оксигенированный - как
основание
14. Белки
Главный внутриклеточный буфер. Составляют 3/4буферной емкости внутриклеточной жидкости.
•- карбоксильная группа (R-СООН) в зависимости от
условий обеспечивает нейтрализацию как избытка
кислот, так и избытка щелочей;
•- аминогруппа (R-NH2)обеспечивает основные
свойства.
•-выступают в роли сильного основания и по другому
механизму –в виде натриевой или калиевой соли
15. Фосфатный внутриклеточный буфер
NaH2P04/Na2HPO4, соотношение 1/4:•- NaH2P04 – кислый компонент (натрий
дигидрофосфат, однозамещенный фосфат);
•Na2HPO4 – основной компонент (натрий
гидрофосфат, двузамещенный фосфат).
Он есть и в крови, но там он поддерживает,
прежде всего «регенерацию»
гидрокарбонатного буфера.
16. Вторая линия защиты- физиологические механизмы регуляции
Вторая линия защитыфизиологические механизмырегуляции
Легкие
Почки
Печень
ЖКТ
Кожа
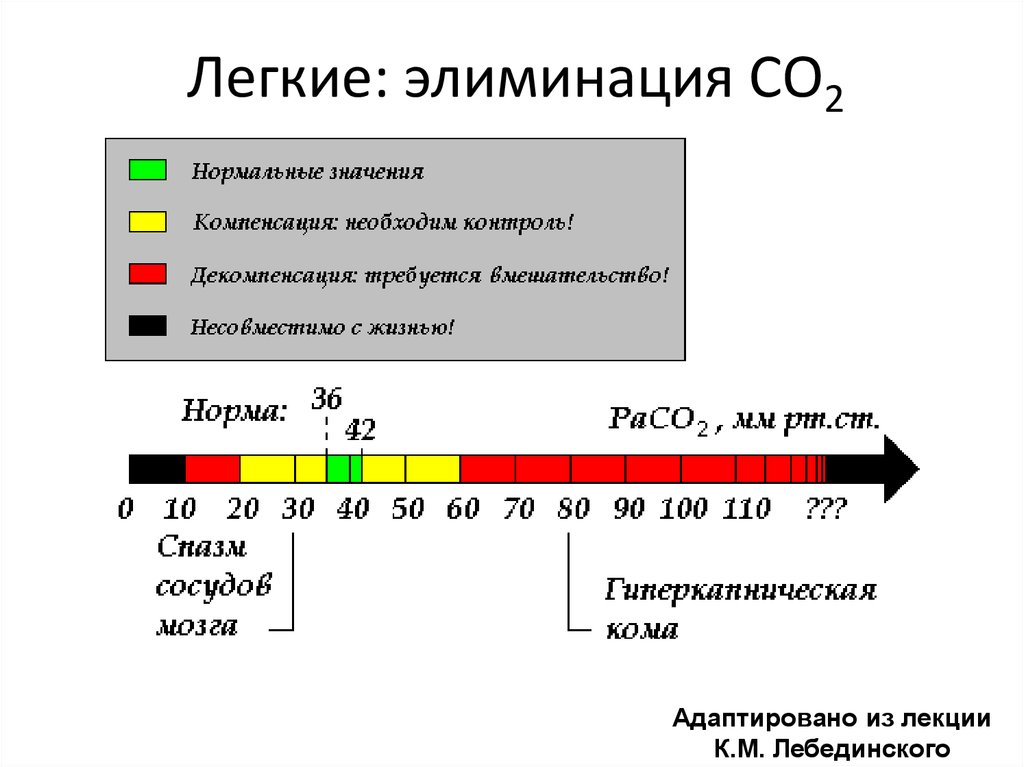
17. Легкие: элиминация СО2
Адаптировано из лекцииК.М. Лебединского
18. Почки
• имеют три механизма устранения сдвигаКОС:
1. ацидогенез;
2. аммониогенез;
3. сопряженный процесс: одновременная
секреция кислых фосфатов с реабсорбцией
гидрокарбонатов
19. Участи печени в поддержании КОС
1. в ней действуют внутри и внеклеточные буферныесистемы;
2. метаболизм гепатоцитов напрямую определяет
возможность
смещения
или
наоборот
поддержания рН. Это определено следующим:
− составляющие белкового буфера – синтезируются в
печени;
− образуется аммиак нейтрализующий кислоты;
− гликонеогенез;
− выведение нелетучих кислот и оснований
20. Участие ЖКТ в поддержании КОС:
• за счет секреции соляной кислоты;• за счет секреции кишечником сока с
большим содержанием гидрокарбонатов
• за счет всасываемой жидкости;
• за
счет
реабсорбции
компонентов
буферных систем;
• за счет секреции поджелудочной железы
21. ПАРАМЕТРЫ КОС ОПРЕДЕЛЯЕМЫЕ В КЛИНИКЕ
1. актуальный рН;2. парциальное давление (напряжение) углекислоты в крови;
3. парциальное давление (напряжение) кислорода в крови;
4. стандартный бикарбонат плазмы крови (SB) – концентрация
бикарбоната в плазме крови 21,3-21,8 ммоль/л в условиях
температуры 37,0, рСО2=40 мм рт. ст., рО2=98 мм рт.ст.;
5. буферные основания крови (BB) – это сумма анионов: бикарбонатов
и белков – в норме 40-60 ммоль/л;
6. нормальные буферные основания (NBB) – это сумма всех анионов
крови, которые обладают буферными свойствами. Эта сумма равна –
155 ммоль/л. Она включает анионы: хлора, бикарбоната, белков,
фосфатов, сульфатов, органических кислот;
7. избыток или дефицит оснований (BE)=BB-NBB. В норме от +2,3 до –
2,3 ммоль/л;
8. актуальный бикарбонат (АВ) –– отражает концентрацию
бикарбоната в плазме крови в физиологическом состоянии. В норме
равен 19-25ммоль/л
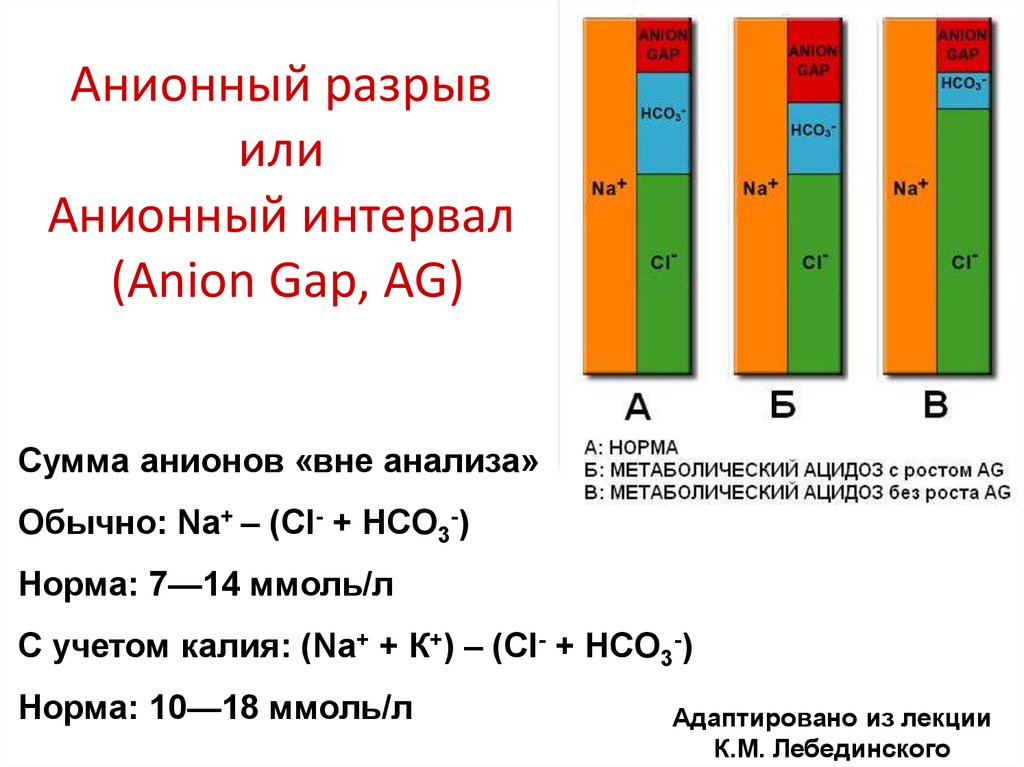
22. Анионный разрыв или Анионный интервал (Anion Gap, AG)
Сумма анионов «вне анализа»Обычно: Na+ – (Cl- + HCO3-)
Норма: 7—14 ммоль/л
С учетом калия: (Na+ + К+) – (Cl- + HCO3-)
Норма: 10—18 ммоль/л
Адаптировано из лекции
К.М. Лебединского
23.
Патологические типы и формы нарушений КОС:дыхательный
метаболический
смешанный
ацидоз
алкалоз
компенсированный
субкомпенсированный
некомпенсированный
24. Типовые патологические изменения КОС
рН 7,4±0,05Н+
ас
Ув
Н+
Ум. НСО3Ув. H+ и НСО3-
НСО3-
КОС
аl
Ув. НСО3Ум. Н+
Ув. Н+ и НСО3-
25. Метаболический ацидоз БЕЗ увеличения анионного разрыва: BE < –2,3 ммоль/л, AG < 14 ммоль/л
Метаболический ацидозБЕЗ увеличения анионного разрыва:
BE < –2,3 ммоль/л, AG < 14 ммоль/л
Потери НСО3- через ЖКТ (диарея, свищи, ОКН,
уретероэнтеростомия, ионообменные смолы)
Почечные потери НСО3- (тубулярный ацидоз,
ингибиторы КА, избыток Cl-)
Нарушения функций почек (пиелонефрит, низкая
активность ренина плазмы)
Дефицит альдостерона (гипоальдостеронизм,
верошпирон)
Редкие причины (гипералиментация, быстрая
гипергидратация и др.)
26. Метаболический ацидоз С увеличением анионного разрыва: BE < –2,3 ммоль/л, AG > 14 ммоль/л
Метаболический ацидозС увеличением анионного разрыва:
BE < –2,3 ммоль/л, AG > 14 ммоль/л
Повышенная продукция кислот (кетоацидозы,
лактатацидоз, азотемия, ферментопатии)
Отравления кислотами (муравьиная, щавелевая,
этиленгликоль, метанол, салицилаты и др.)
Нарушения выведения кислот (ОПН и ХПН)
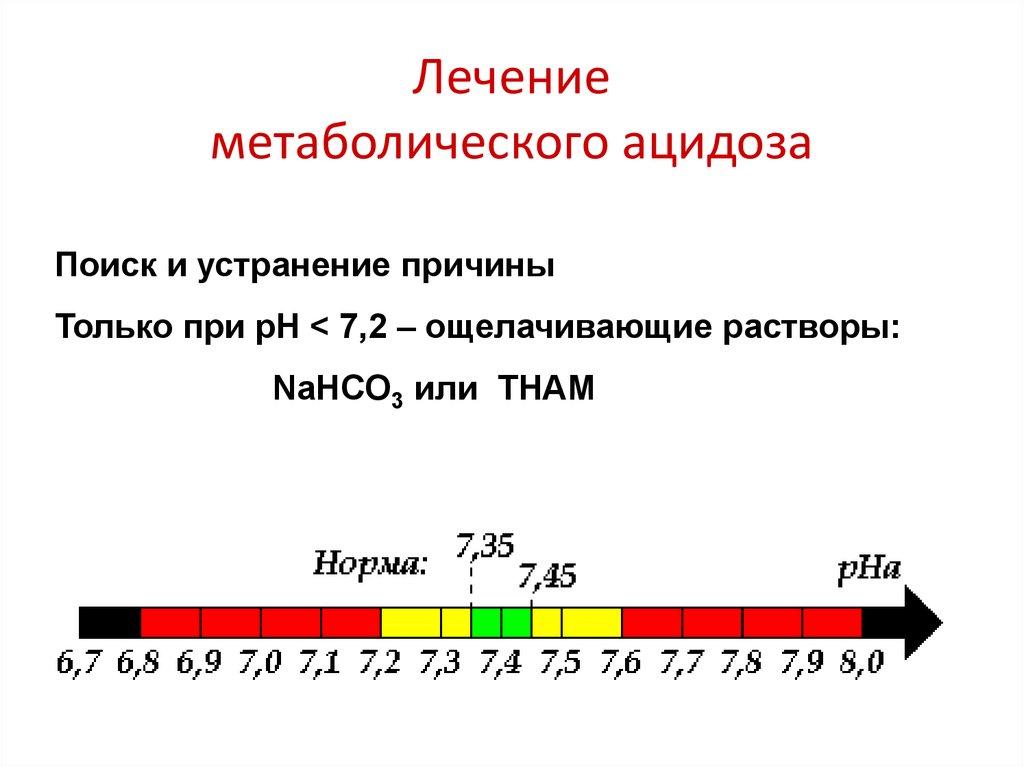
27. Лечение метаболического ацидоза
Поиск и устранение причиныТолько при рН < 7,2 – ощелачивающие растворы:
NaHCO3 или THAM
28. Гидрокарбонат натрия («сода»)
Растворы NaHCO3 бывают 3% и 4%Каждый 1% дает 0,12 ммоль/мл
Расчет: число ммоль NaHCO3 = BE 0,2 МТ
Дает перегрузку натрием (гиперосмолярность!) и
СО2
За рубежом доступен KHCO3
Никогда не лить «просто так», кроме случаев СЛР
(и то, очень спорный вопрос)!
29. Трисамин (трометамин, трис-буфер, трисгидроксиаминометан, ТНАМ)
Корригирует внутриклеточный ацидоз!рН раствора 10,2—10,7
Изотоничный плазме 3,66% раствор = 0,3 ммоль/мл
Расчет: число мл 3,66% ТНАМ = BE МТ
Интервал между инфузиями не менее 48—72 ч!
Не перегружает натрием и СО2!
Оптимален при глубокой гиперкапнии
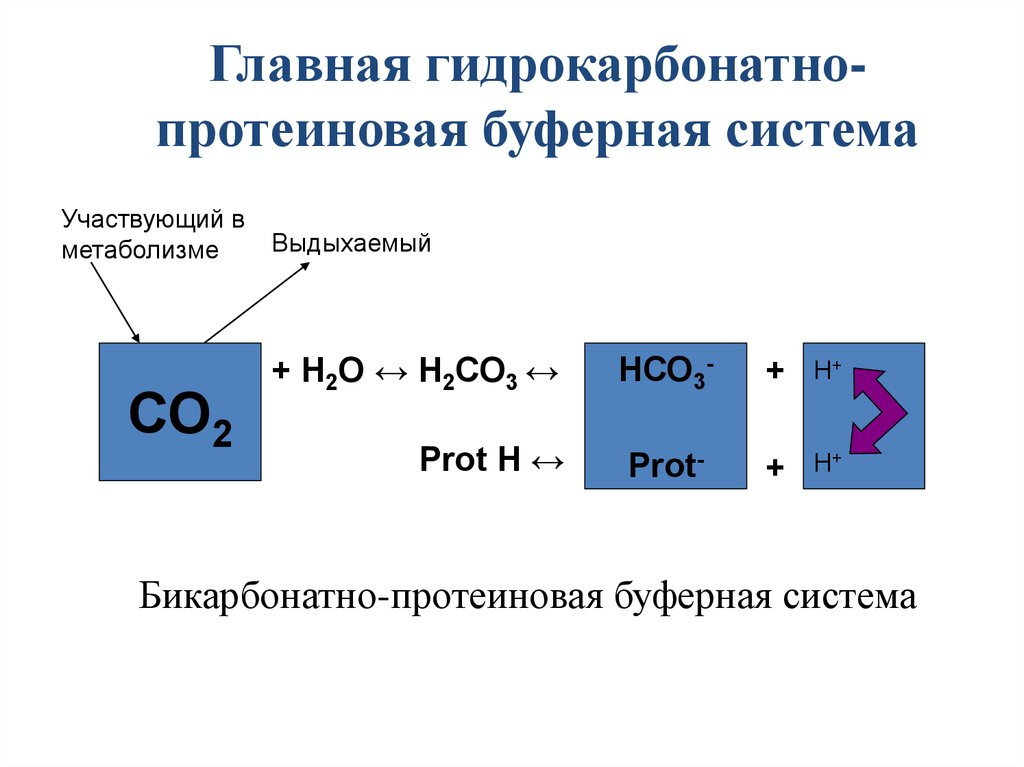
30. Бикарбонатно-протеиновая буферная система
Главная гидрокарбонатнопротеиновая буферная системаУчаствующий в
метаболизме
СО2
Выдыхаемый
+ Н2О ↔ Н2СО3 ↔
НСО3-
+
H+
Prot H ↔
Prot-
+
H+
Бикарбонатно-протеиновая буферная система
31. Метаболический алкалоз: ВЕ > 2,3 ммоль/л
Метаболический алкалоз:ВЕ > 2,3 ммоль/л
Избыточное поступление оснований (антациды)
Потери кислот из ЖКТ (рвота, дренаж)
Нарушение ацидогенеза (салуретики, тиазиды)
Почечный тубулярный алкалоз (дефицит К+ или Cl-,
избыток Na+, альдостеронизм, синдром Кушинга,
глюкокортикоиды)
Быстрая дегидратация
Быстрая коррекция хронической гиперкапнии
Массивная трансфузия цитратной крови
Непаратиреоидная гиперкальциемия
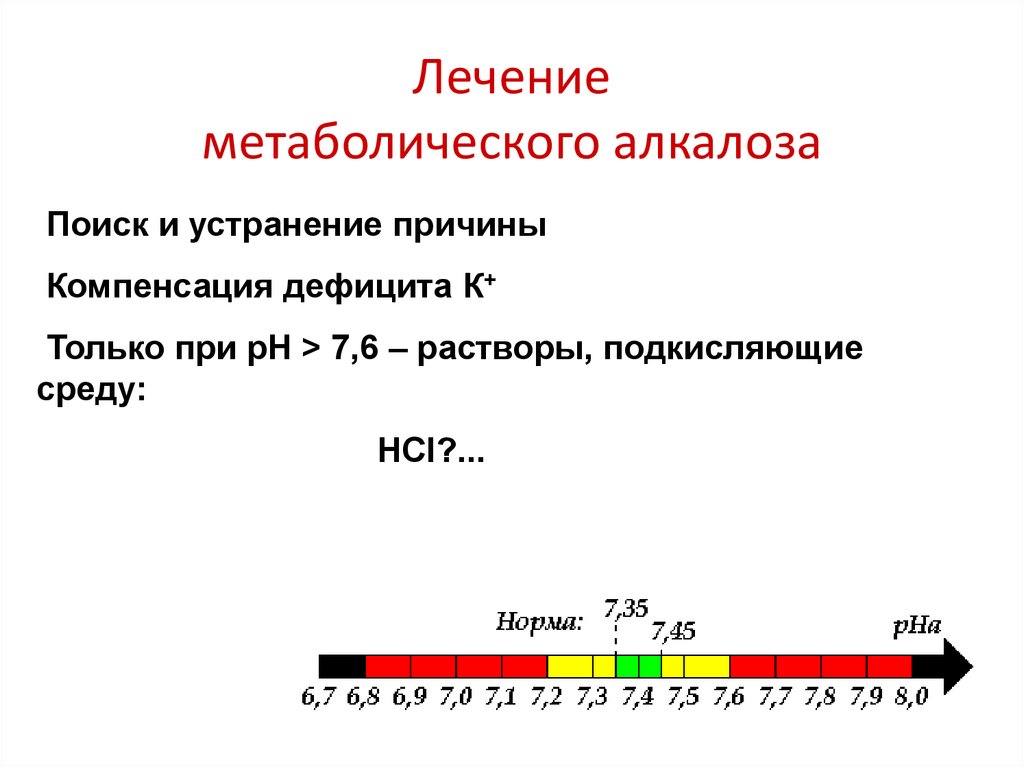
32. Лечение метаболического алкалоза
Поиск и устранение причиныКомпенсация дефицита К+
Только при рН > 7,6 – растворы, подкисляющие
среду:
HCl?...
33. Респираторный алкалоз: PaCO2 < 36 mm Hg
Респираторный алкалоз:PaCO2 < 36 mm Hg
Гипервентиляция альвеол
34. Респираторный ацидоз: PaCO2 > 42 mm Hg
Респираторный ацидоз:PaCO2 > 42 mm Hg
Гиповентиляция альвеол – абсолютная или
относительная
Нужен ли при этом NaHCO3 ???




























 Биология
Биология








