Похожие презентации:
Окислительно-восстановительные реакции. Химическое равновесие
1.
Федеральное агенство по образованиюМосковская государственная академия тонкой
химической технологии имени М.В. Ломоносова
Кафедра неорганической химии
Савинкина Е.В.
Лекции по общей и неорганической химии
Окислительно-восстановительные реакции.
Химическое равновесие
Учебное пособие
Москва
МИТХТ им. М.В. Ломоносова
2010
1
2. УДК 546.04 ББК 24.1
Рецензент: д.х.н. Киселев Ю.М. (химический факультет МГУ)Рекомендовано к изданию кафедрой неорганической химии МИТХТ
(протокол № 3 от 10.11.2010)
Е.В. Савинкина 2010
МИТХТ им. М.В. Ломоносова 2010
Утверждено Библиотечно-издательской комиссией МИТХТ им.
М.В.Ломоносова в качестве учебного пособия для студентов 1 курса
бакалавриата по направлениям 020100 62 (Химия), 240100 62
(Химическая технология и биотехнология), 150600 62
(Материаловедение и технология новых материалов), 280200 (Защита
окружающей среды), 200500 62 (Метрология, стандартизация и
сертификация), 080500 (Менеджмент).
Один оптический диск
2
Объем данных 2,9 Мб
3. Рекомендуемая литература
34. Введение
Классификация и номенклатуранеорганических веществ
4
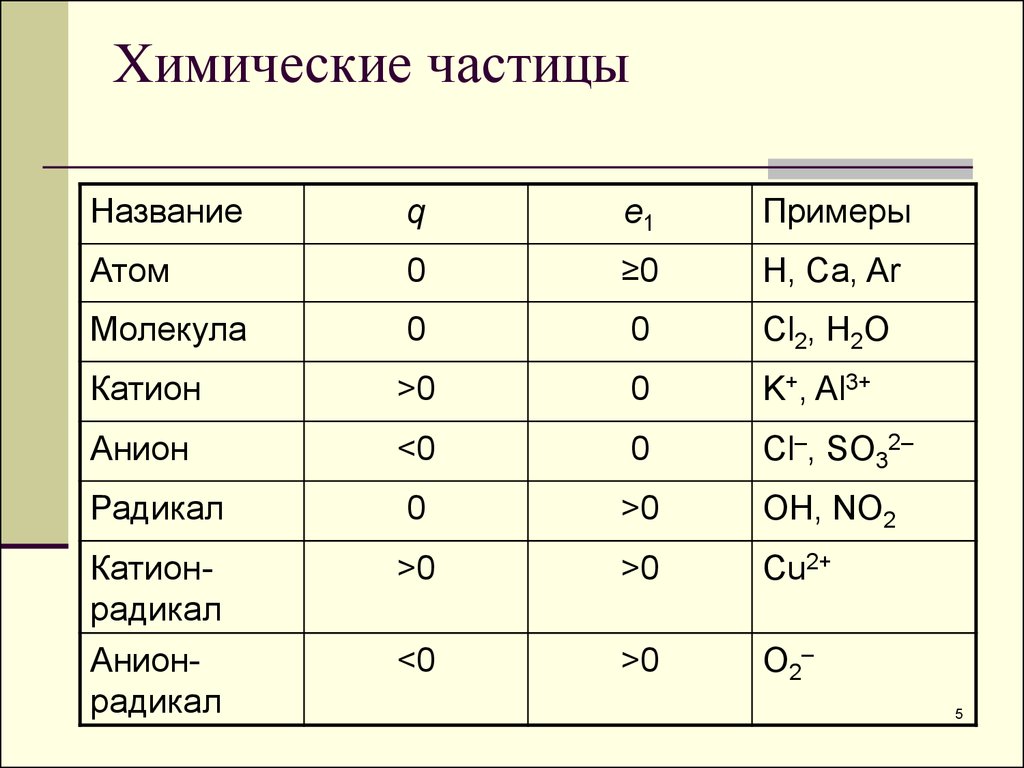
5. Химические частицы
Названиеq
e1
Примеры
Атом
0
≥0
H, Ca, Ar
Молекула
0
0
Cl2, H2O
Катион
>0
0
K+, Al3+
Анион
<0
0
Cl–, SO32–
Радикал
0
>0
OH, NO2
Катионрадикал
Анионрадикал
>0
>0
Cu2+
<0
>0
O 2–
5
6. Вещество
ансамбль любых химических частиц или ихсовокупностей
1 частица = 1 формульная единица
Ar – вещество "аргон" (атомы)
H2O – вещество "вода" (молекулы)
NO3– – вещество "нитрат-ион" (ионы)
KNO3 – вещество "нитрат калия"
(совокупность катионов и анионов)
6
7. Формульные единицы
H2SO4серная кислота
NO2
диоксид азота
CuSO4.5H2O
пентагидрат сульфата
меди
H2SO4.2H2O, или
(H3O)2SO4
сульфат оксония
N2O4
тетраоксид диазота
CuSO4
сульфат меди
7
8. Обменные реакции в растворе
Правило Бертолле:Обменные реакции в растворе протекают
практически до конца, если один из
продуктов
газ
осадок
слабый электролит
8
9. Уравнения реакций:
молекулярноеBaCO3(т) + H2SO4(разб.) = BaSO4 + CO2 + H2O
CuSO4 + K2S = CuS + K2SO4
ионное
(сильные электролиты – в ионной форме)
BaCO3(т) + 2H+ + SO42– = BaSO4 + CO2 + H2O
Cu2+ + S2– = CuS
(любая растворимая соль CuII + любой растворимый
сульфид)
9
10. Составление уравнений
AlCl3 + Na2S + H2O Al(OH)3 + H2S + NaClAl3+ + S2– + H2O Al(OH)3 + H2S
2Al3+ + 3S2– + 6H2O = 2Al(OH)3 + 3H2S
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S + 6NaCl
10
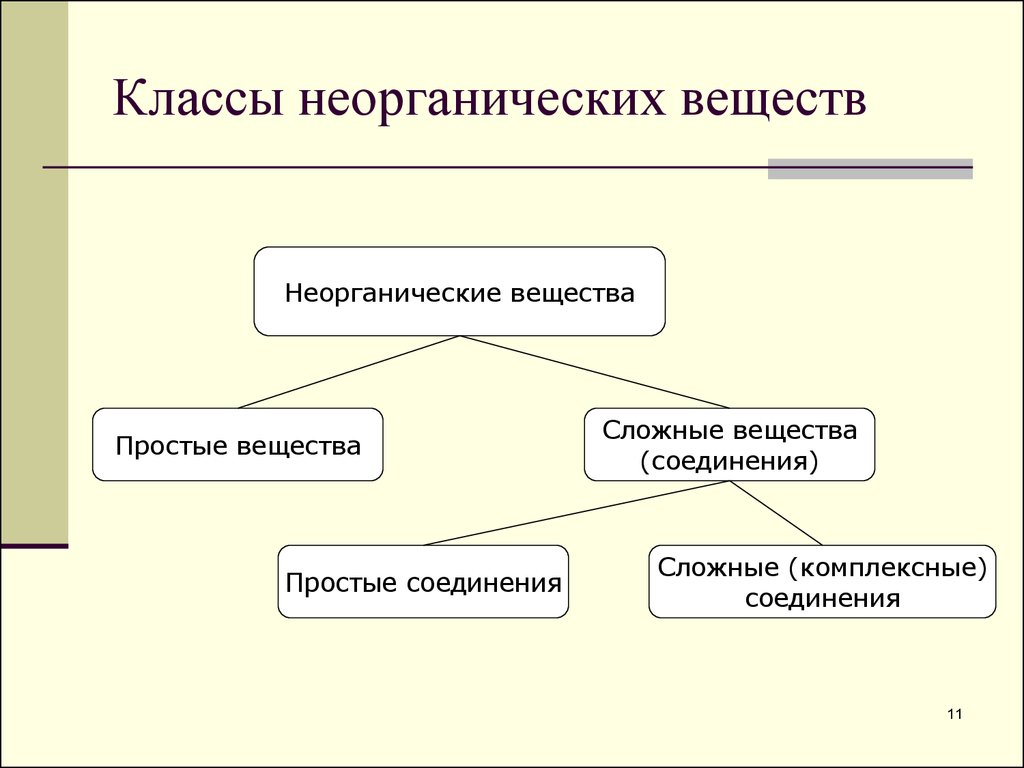
11. Классы неорганических веществ
Неорганические веществаПростые вещества
Простые соединения
Сложные вещества
(соединения)
Сложные (комплексные)
соединения
11
12. Простые вещества
Неметаллы22, включая 6
благородных газов
Имеют высокие
значения
электроотрицательности (χ):
F 4,1; O 3,5; N 3,1
Образуют анионы
Металлы
11 типичных, остальные
– "амфотерные"
Имеют низкие значения
электроотрицательности (χ):
K 0,91; Li 0,97; Ca 1,04
Образуют катионы
12
13. Диагональ амфотерности
χBe
Al
Ge
Sb
Po
1,47
1,47
2,02
1,82
1,76
(для А-групп)
В Б-группах все элементы проявляют амфотерные свойства
Входят в состав и катионов, и анионов
13
14. Классификация простых соединений (по составу)
основана на отношениик кислороду
самый распространенный элемент на
Земле
образует соединения со всеми элементами
кроме He, Ne, Ar
к воде
самое распространенное соединение
кислорода
14
15. Классы неорганических соединений
Оксиды ЭхО–IIуNa2O, CO2, ZnO
(OF2, H2O2 к оксидам не относятся)
Гидроксиды ЭхОу.nH2O
NaOH, H2CO3, Zn(OH)2
Соли
Na2CO3, NaHCO3, Zn2CO3(OH)2
Бинарные соединения
NH3, OF2, CaC2
15
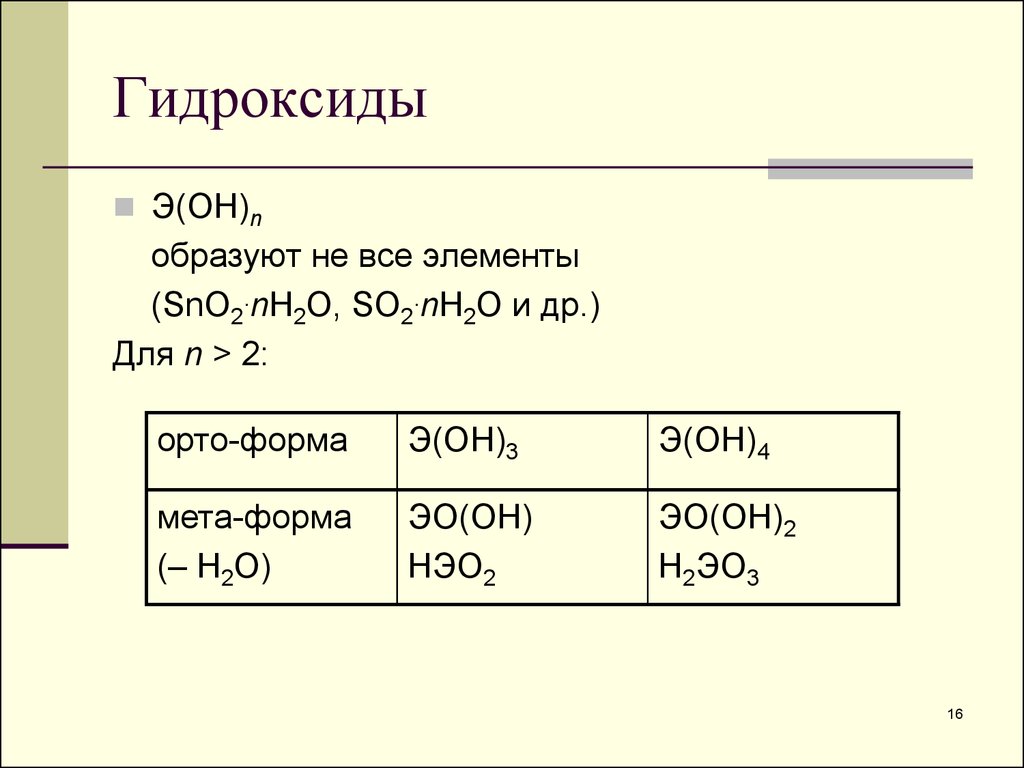
16. Гидроксиды
Э(ОН)nобразуют не все элементы
(SnO2.nH2O, SO2.nH2O и др.)
Для n > 2:
орто-форма
Э(ОН)3
Э(ОН)4
мета-форма
(– H2O)
ЭО(ОН)
НЭО2
ЭО(ОН)2
Н2ЭО3
16
17. Гидроксиды
Основные NaOH, Mg(OH)2Амфотерные Pb(OH)2, AlO(OH)
Кислотные H2SO4, HNO3
17
18. Кислотные гидроксиды (кислородсодержащие кислоты)
Большинство –в мета-форме
Замещаемый
атом Н
Кислотный
остаток
H2 SO4
H NO3
H2 PHO3
B(OH)3
Не всегда Н замещается сразу:
H3PO4 KH2PO4 K2HPO4 K3PO4
18
19. Номенклатура кислородсодержащих кислот
ТрадиционныеH2CO3 угольная кислота
CO32– карбонат
HCO3– гидрокарбонат и т.д.
Систематические
НхЭОу "у"-оксо-Э(лат.корень)-ат(с.о. или заряд) водорода
H2XeO4 тетраоксоксенонат(VI) водорода
H4I2O9 нонаоксодииодат(VII) водорода
H2S4O6 гексаокостетрасульфат(2–) водорода
19
20. Основные гидроксиды (основания)
Содержат гидроксидные группы,способные замещаться на кислотные
остатки
Всегда в орто-форме
Номенклатура:
LiOH гидроксид лития
Cr(OH)2 гидроксид хрома(II)
20
21. Важнейшее химическое свойство кислотных и основных гидроксидов
взаимодействие их между собой собразованием солей (реакция
нейтрализации, или солеобразования)
2NaOH + H2SO4 = Na2SO4 + 2H2O
21
22. Амфотерные гидроксиды
Проявляются свойства и кислотных, и основныхгидроксидов
Основные свойства
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Кислотные свойства
Al(OH)3 + NaOH = Na[Al(OH)4]
В орто- и мета-формах
Al(OH)3 ортогидроксид алюминия
AlO(OH) метагидроксид алюминия
22
23. Оксиды
Продукты полной дегидратации гидроксидов(реальной или мысленной)
Кислотные
H2SO4 = H2O + SO3 триоксид серы
(ангидрид серной кислоты)
Основные
2LiOH = H2O + Li2O оксид лития
Амфотерные
2FeO(OH) = H2O + Fe2O3 оксид железа(III)
Li2O + SO3 = Li2SO4
23
24. Соли
СредниеBa3(PO4)2 ортофосфат бария
Кислые (содержат Н)
Ba(H2PO4)2 дигидроортофосфат бария
Основные (содержат ОН или О)
CoNO3(OH) гидроксид-нитрат кобальта(II)
Двойные (содержат > 1 катиона)
KAl(SO4)2 сульфат алюминия-калия
Смешанные (содержат > 1 аниона)
Na3CO3(HCO3) гидрокарбонат-карбонат натрия
24
25. Бинарные соединения
LiH гидрид литияHBr бромоводород
Mg3P2 дифосфид
PCl5 пентахлорид
тримагния
NF3 трифторид азота
CS2 дисульфид
углерода
фосфора
Br3N нитрид триброма
SF6 гексафторид серы
25
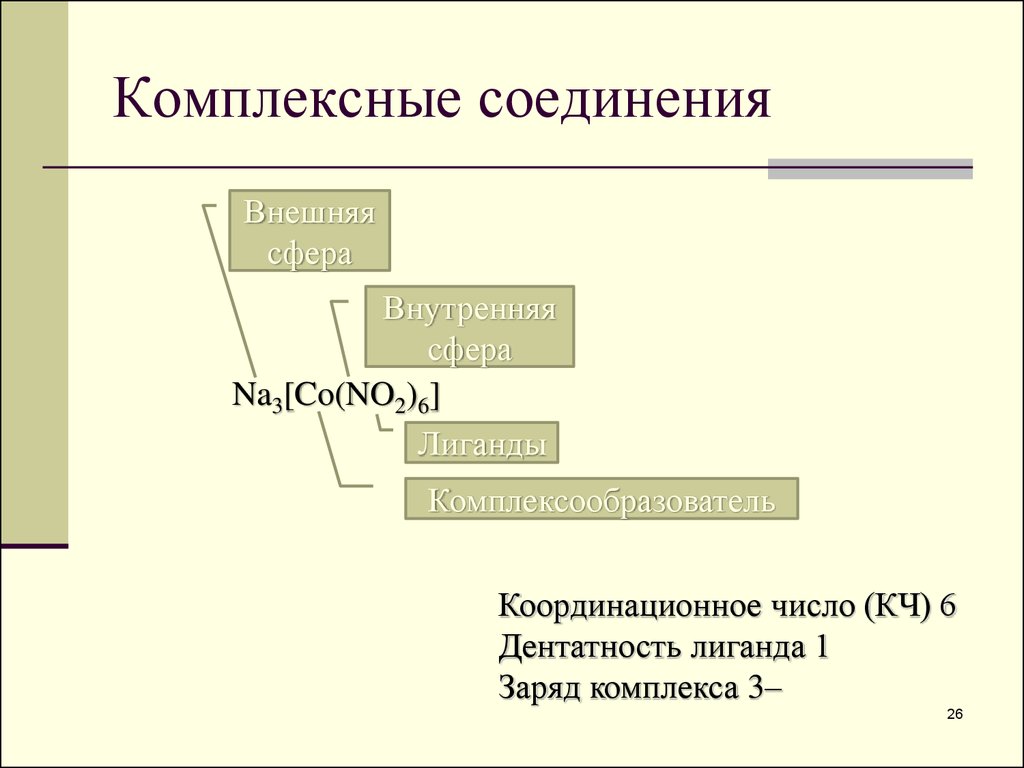
26. Комплексные соединения
Внешняясфера
Внутренняя
сфера
Na3[Co(NO2)6]
Лиганды
Комплексообразователь
Координационное число (КЧ) 6
Дентатность лиганда 1
Заряд комплекса 3–
26
27. Комплексные соединения
сложные частицы, образованные изреально существующих более простых
Включают внутреннюю сферу
(ковалентные связи) и внешнюю сферу
(ионные связи)
В растворе – диссоциация внешней сферы
Na[Al(OH)4] = Na+ + [Al(OH)4]–
27
28. Номенклатура комплексных соединений
Число лигандовмоно, ди, три, тетра, пента и т.д.
Названия лигандов
Анионные
Cl– хлоро, H– гидридо, OH– гидроксо, O2– оксо, S2– тио
Нейтральные
H2O аква
Катионные
H+ гидро
Комплексообразователь
Нейтральный или катионный комплекс
русский корень
Анионный комплекс
латинский корень
Степень окисления
28
29. Примеры
[Cu(H2O)4]2+ катион тетрааквамеди(II)[Zn(OH)4]2– тетрагидроксоцинкат-ион
[Cr(H2O)5OH]2+ катион
гидроксопентааквахрома(III)
K[BF4] тетрафтороборат калия
29
30. Окислительно-восстановительные реакции (ОВР)
Окислительновосстановительныереакции (ОВР)
Химические реакции
Без изменения степени
окисления (обменные)
С изменением степени
окисления (ОВР)
30
31. Степень окисления
формальный (условный) заряд атома в соединении,вычисленный, исходя из предположения, что
соединение состоит из ионов
Степень окисления: ClVII, MoVI, F–I (римские цифры)
Заряд иона в растворе: Ba2+, Na+, S2– (арабские цифры)
SO SO
-II
3
23
31
32. Степень окисления
не совпадает с истинным зарядом атома всоединении
H+0,17Cl–0,17
не совпадает с валентностью (числом
ковалентных связей)
H–O–I–O–I–H
32
33. Изменение степени окисления
= перераспределение электроннойплотности ("передача электронов")
2e–
HClO + H2S = HCl + S
Окислитель (Ок)
ClI, HClO
Понижает степень окисления
+ H 2O
Восстановитель (Вс)
S–II, H2S
Повышает степень
окисления
Принимает электроны
Отдает электроны
Восстанавливается
Окисляется
ClI
+
2e–
=
Cl–I
S–II
–
2e–
=
S0
33
34. Подбор коэффициентов в уравнениях ОВР Метод электронного баланса
1. Записывают формулы реагентов ипродуктов, находят элементы, которые
понижают и повышают степени
окисления
2. Записывают атомы с указанием
изменяющихся степеней окисления
3. Составляют уравнения полуреакций
восстановления и окисления,
соблюдая для каждой из них законы
сохранения числа атомов и заряда
4. Находят наименьшее общее кратное
(н.о.к.) числа переданных в каждой
полуреакции электронов и подбирают
дополнительные множители для
уравнений полуреакций так, чтобы
число принятых электронов стало
равным числу отданных электронов
5. Проставляют полученные
коэффициенты в схему реакции
6. Уравнивают числа остальных
атомов
MnCO3 + KClO3 MnO2 + KCl + ...
MnII → MnIV
ClV → Cl–I
MnII – 2e– = MnIV
ClV + 6e– = Cl–I
н.о.к. 6
MnII – 2e– = MnIV
ClV + 6e– = Cl–I
3MnCO3 + KClO3 3MnO2 + KCl + ...
3MnCO3 + KClO3 3MnO2 + KCl + 3CO2
|3
|1
34
35. Подбор коэффициентов в уравнениях ОВР Метод электронного баланса
FeS2 + O2 Fe2O3 + SO2FeII – 1e– = FeIII
–11e–
2S–I – 10e– = 2SIV
O2 + 4e– = 2O–II
+4e–
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
4
11
35
36. Подбор коэффициентов в уравнениях ОВР Метод электронно-ионных полуреакций
1. Записывают формулы реагентов ипродуктов, находят окислитель,
восстановитель и среду
2. Записывают формулы окислителя
и восстановителя и соответствующие
продукты реакции в ионном виде
3. Составляют ионные уравнения
полуреакций восстановления и
окисления, соблюдая для каждой из
них законы сохранения числа атомов
и заряда
4. Находят наименьшее общее
кратное (н.о.к.) числа переданных в
каждой полуреакции электронов и
подбирают дополнительные
множители для уравнений
полуреакций так, чтобы число
принятых электронов стало равным
числу отданных электронов
5. Составляют ионное уравнение
реакции
6. Уравнивают числа остальных
атомов, участвующих в реакции, и
получают уравнение реакции с
подобранными коэффициентами
K2Cr2O7 + H2SO4 + H2S S + ...
Ок
Среда Вс
Cr2O72– + H+ + H2S S + Cr3+ + H2O
Cr2O72– (Оф) → Cr3+ (Вф)
H2S (Вф) → S (Оф)
Cr2O72– + 8H+ + 6e– = 2Cr3+ + 7H2O
H2S – 2e– = S + 2H+
н.о.к. 6
Cr2O72– + 8H+ + 6e– = 2Cr3+ + 7H2O | 1
H2S – 2e– = S + 2H+
|3
Cr2O72– + 8H+ + 3H2S = 3S + 2Cr3+ + 7H2O
K2Cr2O7 + 4H2SO4 + 3H2S = 3S + Cr2(SO4)3 +
7H2O + K2SO4
36
37. Подбор числа атомов водорода и кислорода
Кислотная среда[HI] = H+
[O–II] + 2H+ = H2O
Щелочная среда
[HI] + OH– = H2O
[O–II] + H2O = 2OH–
Пример
[Cr(OH)6]3– CrO42–
Щелочная среда
6[HI] + 6OH– = 6H2O
2[O–II] + 2H2O = 4OH–
[Cr(OH)6]3– + 2OH– – 3e– = CrO42– + 4H2O
37
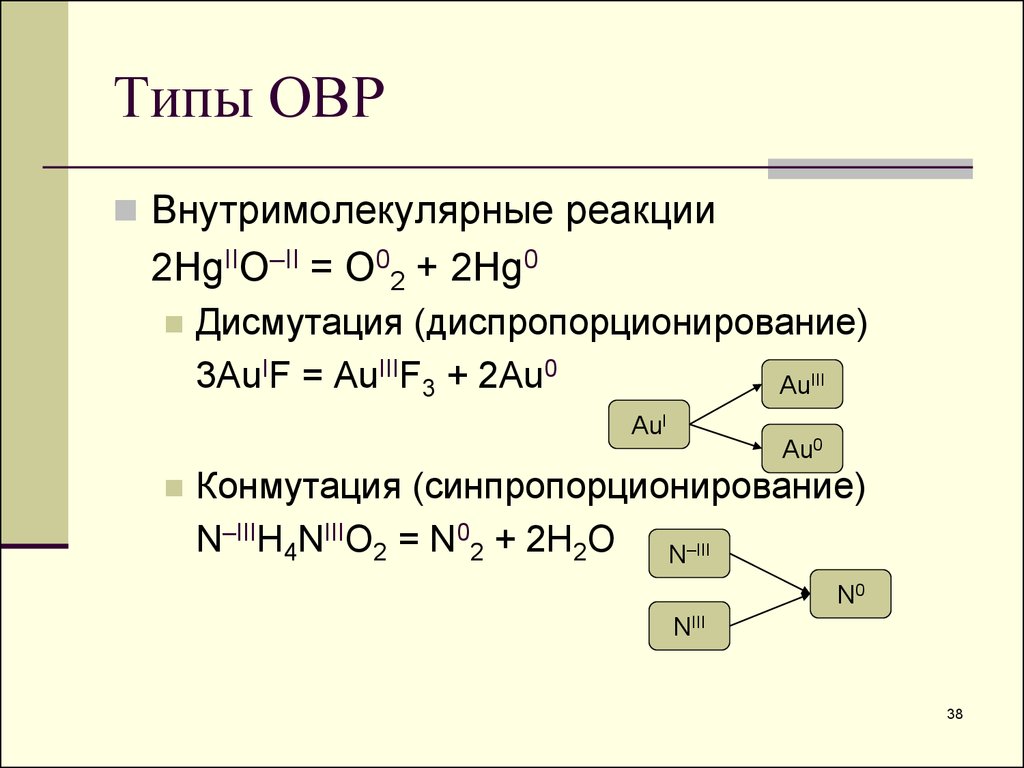
38. Типы ОВР
Внутримолекулярные реакции2HgIIO–II = O02 + 2Hg0
Дисмутация (диспропорционирование)
3AuIF = AuIIIF3 + 2Au0
AuIII
AuI
Au0
Конмутация (синпропорционирование)
N–IIIH4NIIIO2 = N02 + 2H2O N–III
N0
NIII
38
39. Типы ОВР
Межмолекулярные реакции2Mg0 + O02 = 2MgIIO–II
PbS–II + 4H2O–I2 = PbSVIO4 + 4H2O–II
Конмутация
2H2S–II + SIVO2 = 3S0 + 2H2O
S–II
S0
SVI
Дисмутация
2NO2 + H2O = HNO2 + HNO3
NIII
NIV
NV
39
40. Типичные окислители и восстановители
Окислители:Простые вещества –
элементы с высокой
электроотрицательностью (F2, O2, Cl2 и
т.д.)
Сложные вещества –
содержащие элементы
в высоких степенях
окисления (Fe3+,
CrVI2O72–, MnVIIO4– и т.д.)
Окислительная
активность возрастает
в кислотной среде
Восстановители:
Простые вещества –
элементы с низкой
электроотрицательностью (металлы, С, H2
и т.д.)
Сложные вещества –
содержащие элементы
в низких степенях
окисления (Sn2+, S2–,
NIIIO2– и т.д.)
Восстановительная
способность возрастает в
щелочной среде
40
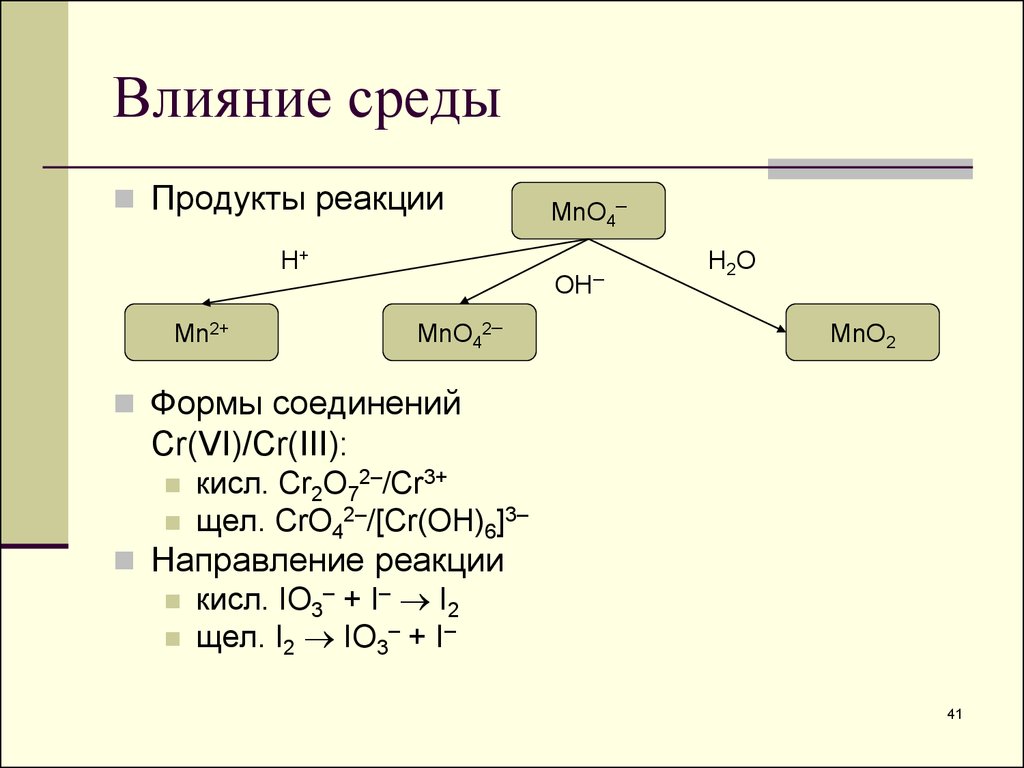
41. Влияние среды
Продукты реакцииH+
Mn2+
MnO4–
OH–
MnO42–
H2O
MnO2
Формы соединений
Cr(VI)/Cr(III):
кисл. Cr2O72–/Cr3+
щел. CrO42–/[Cr(OH)6]3–
Направление реакции
кисл. IO3– + I– I2
щел. I2 IO3– + I–
41
42. Направление ОВР
Br– + PbO2 + H+ Br2 + Pb2+ + H2OBr– + Fe3+ ≠ Br2 + Fe2+
Br2 + Fe2+ Br– + Fe3+
Количественная мера окислительной способности
Ок (и восстановительной способности Вс) –
электродный потенциал φ
42
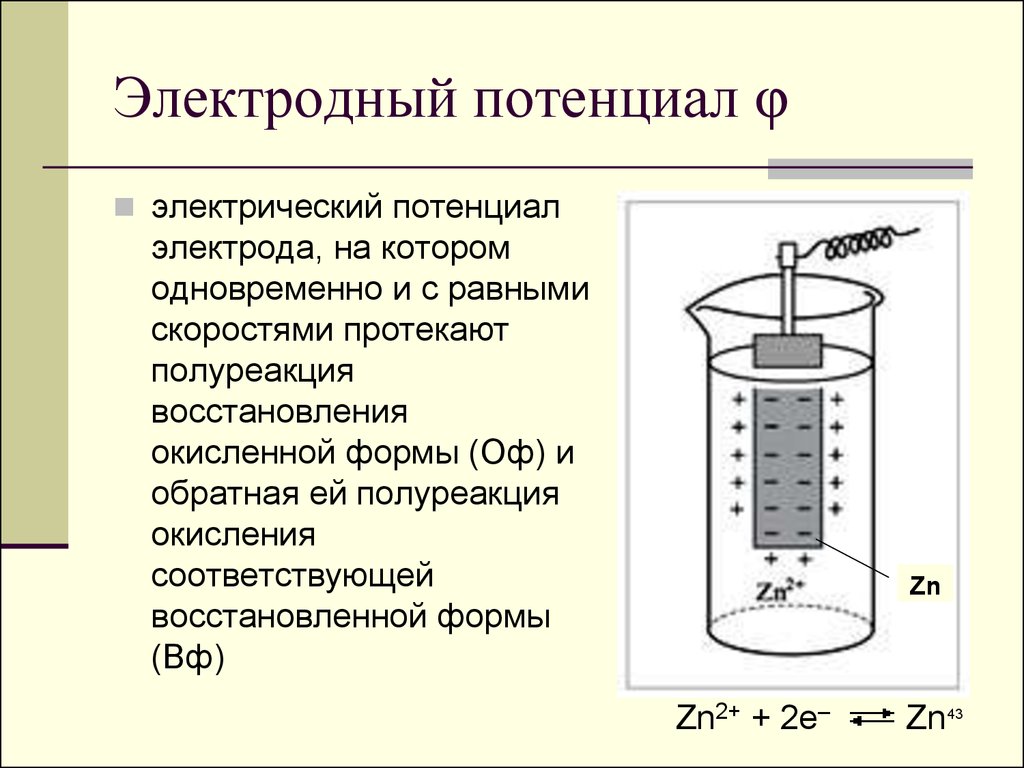
43. Электродный потенциал φ
электрический потенциалэлектрода, на котором
одновременно и с равными
скоростями протекают
полуреакция
восстановления
окисленной формы (Оф) и
обратная ей полуреакция
окисления
соответствующей
восстановленной формы
(Вф)
Zn
Zn2+ + 2e–
Zn43
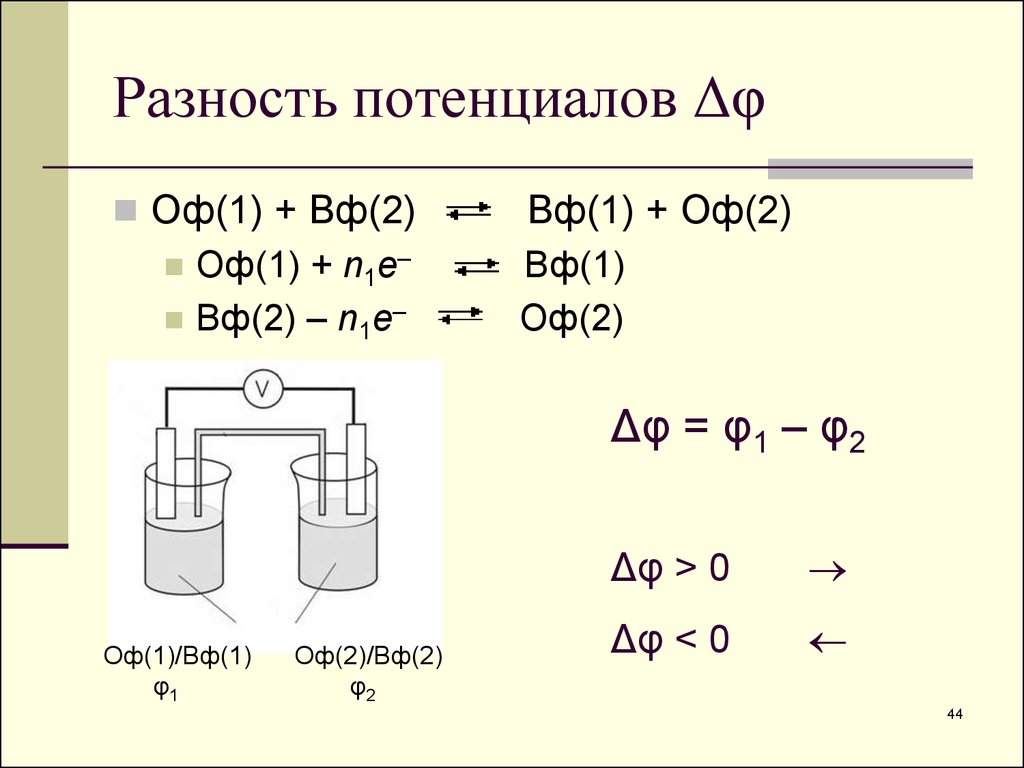
44. Разность потенциалов Δφ
Оф(1) + Вф(2)Оф(1) + n1e–
Вф(2) – n1e–
Вф(1) + Оф(2)
Вф(1)
Оф(2)
Δφ = φ1 – φ2
Оф(1)/Вф(1)
φ1
Оф(2)/Вф(2)
φ2
Δφ > 0
Δφ < 0
44
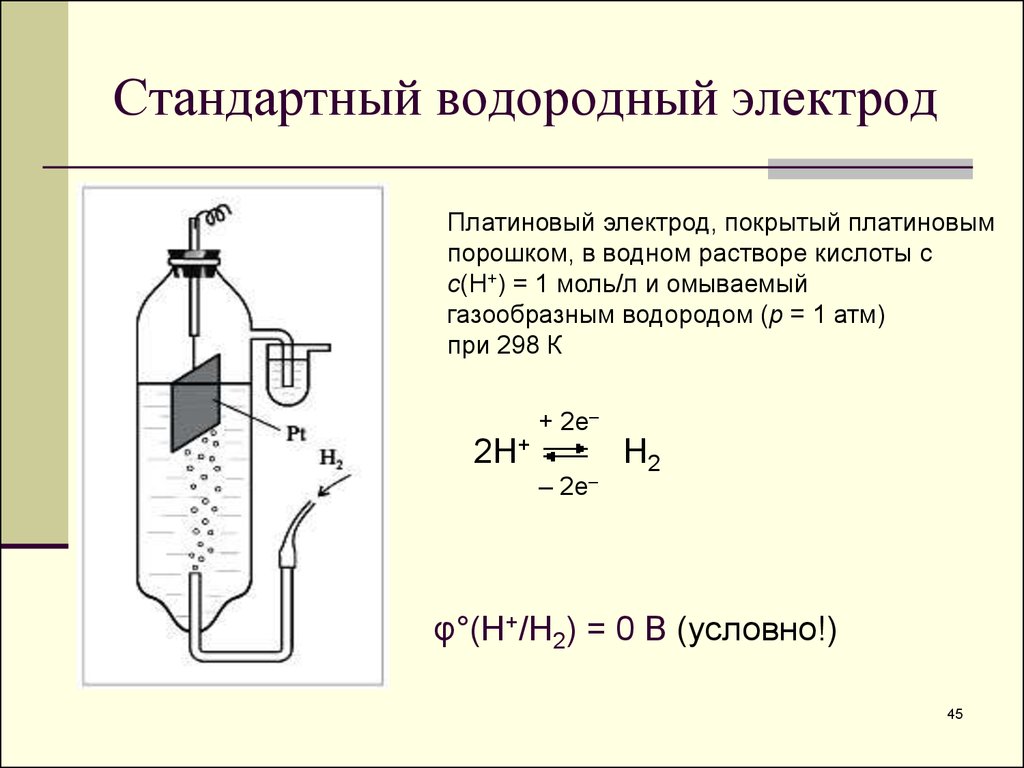
45. Стандартный водородный электрод
Платиновый электрод, покрытый платиновымпорошком, в водном растворе кислоты с
с(Н+) = 1 моль/л и омываемый
газообразным водородом (р = 1 атм)
при 298 К
+ 2e–
2H+
– 2e–
H2
φ°(H+/H2) = 0 В (условно!)
45
46. Стандартный потенциал полуреакции восстановления φ°
Оф + Н2Вф + 2Н+
Δφ° = φ°(Оф/Вф) – φ°(Н+/Н2) = φ°(Оф/Вф)
Данные приведены в справочниках
Стандартные условия:
ci = 1 моль/л (для каждого участника
реакции в растворе)
pi = 1 атм (для каждого газообразного
участника реакции)
Т = 298 К (обычно)
ст.у. ≠ н.у. (0°С, 1 атм)
46
47. Сравнение φ°
ЭХРНLi
φ°, В
Zn
Pb
–3,1 –0,8 –0,1
H
0
Cu
Au
+0,3 +1,4
(Mn+/M)
Вф
φ°, В
PbO2
Pb2+
1,5
Br2
Br–
1,1
Сила Ок
Оф
Сила Вс
Сила Ок и Вс
47
48. Критерий протекания ОВР в стандартных условиях
ОВР протекает в прямом направлении встандартных условиях, если
Δφ° = φ°(Ок) – φ°(Вс) > 0 В
ОВР протекает в обратном направлении в
стандартных условиях, если
Δφ° = φ°(Ок) – φ°(Вс) < 0 В
48
49. Уравнение Нернста
На практике стандартные условия не используютсяОф + ne– = Вф
RT c(Оф)
(Оф/Вф) (Оф/Вф)
ln
nF с(Вф)
0
MnO4– + 8H+ + 5e– = Mn2+ + 4H2O
8
RT
[
MnO
][
H
]
2
0
2
4
(MnO 4 , H /Mn ) (MnO 4 , H /Mn )
ln
nF
[Mn 2 ]
Во время протекания реакции φ измерить нельзя,
но можно вычислить
По мере протекания реакции φ(Ок) , а φ(Вс)
Когда φ(Ок) = φ(Вс), реакция прекращается
49
50. Критерий полноты протекания ОВР
ОВР протекает в прямом направлении доконца при любых начальных условиях,
если Δφ° > 0,4 В
ОВР протекает в обратном направлении
до конца при любых начальных условиях,
если Δφ° < –0,4 В
Можно изменить направление ОВР, меняя
условия, если 0 < Δφ° < 0,4 В (в ст.у. )
или –0,4 < Δφ° < 0 В (в ст.у. )
50
51. Пример
Cu(т) + 2H2SO4 = CuSO4 + SO2(г) + 2H2OΔφ° = –0,179 В
В стандартных условиях
CuSO4 + SO2(г) + 2H2O = Cu(т) + 2H2SO4
При повышении c(H2SO4), удалении SO2
Температура почти не влияет на φ°,
влияет на скорость реакции, удаление
газообразных веществ
51
52. Кинетические затруднения
Обычно ОВР идут быстро, но не всегдаFe3+ + NH4+ ≠ N2 + Fe2+ + H+
Δφ° = 0,499 В
2 катиона
I– + NO3– + H+ ≠ I2 + NO + H2O
Δφ° = 0,420 В
2 аниона
+ Zn:
NO3– + Zn + 3H+ = HNO2 + H2O + Zn2+
2I– + 2HNO2 + 2H+ = I2 + 2NO + H2O
анион + молекула
52
53. Пример
Какие галогениды могут быть окисленыкатионом Fe3+ в стандартных условиях?
2Г– + 2Fe3+ = Г2 + 2Fe2+
Оф/Вф
φ°, В
Δφ°, В
ст.у.
Fe3+/Fe2+
0,77
F2/F–
2,86
–2,09
Cl2/Cl–
1,36
–0,59
Br2/Br–
1,07
–0,30
I2/I–
0,54
+0,23
53
54. Диаграмма Латимера
–0,440,77
Fe3+
(Fe / Fe)
0
3
Fe2+
1e–
2e–
0 (Fe3 / Fe2 ) 2 0 (Fe2 / Fe)
3
Fe
0,77 2( 0,44)
0,04 В
3
54
55. Диаграмма Латимера
MnO4–
0,56
MnO4
2–
2,22
MnO2
0,95
Mn3+
1,51
Mn2+
2H+ + 2e– = H2
O2 + 4H+ + 4e– = 2H2O
φ° = 0 В
φ° = 1,23 В
–1,18
Mn
55
56. Зависимость φ° от среды
Оф + hH+ + ne– = Вф + H2O0
щел.
0
кисл .
h
0,828
n
IO3– + I– I2 ?
φ°(I2/I–) = 0,54 В
2IO3– + 12H+ + 10e– = I2 + 6H2O
φ°щел.(IO3–/I2) = 0,196 В
φ°кисл.(IO3–/I2) = 0,196 + 0,828(12/10) = 1,190 В
Среда
Δφ° = φ°(IO3–/I2) – φ°(I2/I–) Направление реакции
Кисл.
1,190 – 0,54 > 0
Щел.
0,196 – 0,54 > 0
56
57. Зависимость φ° от среды
I2 I- + IO3-I- + IO3- I2
58. Стехиометрические расчеты по уравнению реакции
n, мольM, г/моль
VM, л/моль
с, моль/л (М)
n = m/M
n = V/VM
n=cV
Для реакции aA + bB + ... = dD + eE + ...
n(A)/a = n(B)/b = n(D)/d = n(E)/e = ...
58
59. Стехиометрические расчеты по уравнению реакции
5960. Задача
Смешали 0,2 л 0,25 М водного раствора KMnO4 и0,2 л 0,25 М водного раствора KI. Определить
массу осадка.
m(ос.) = ?
V(р. KMnO4) = 0,2 л
c(KMnO4) = 0,25 моль/л
V(р. KI) = 0,2 л
c(KI) = 0,25 моль/л
Решение
2KMnO4 + 4H2O + 6KI=
2MnO2 + 8KOH + 3I2
M(MnO2) = 87 г/моль, M(I2) = 254 г/моль
60
61. Задача
n(KMnO4) = c(KMnO4)V(p.KMnO4)n(KMnO4) = 0,25 . 0,2 = 0,05 (моль)
n(KI) = c(KI)V(p.KI)
neq(KI) = 0,25 . 0,2 = 0,05 (моль)
По уравнению реакции
n(KMnO4)/2 = n(KI)/6 = n(MnO2)/2 = n(I2)/3
KMnO4 в избытке, расчет по KI
n(MnO2) = m(MnO2) / M(MnO2)
m(MnO2) = n(KI)M(MnO2) / 3
m(I2) = n (KI)M(I2) / 2
m(ос.) m(MnO 2 ) m(I 2 ) с(KI)V (p.KI)(
M (MnO 2 ) M (I 2 )
) 7,8г
3
2
61
62. Стехиометрические расчеты по закону эквивалентов
Эквивалент – условная (реально не существующая)частица, в z раз меньшая, чем формульная единица
z – эквивалентное число (≥1)
Для ОВР
N (e )
z
N (ф.е.)
(в уравнении полуреакции)
K2Cr2O7 + 4H2SO4 + 6HCl = 3Cl2 + Cr2(SO4)3 + 7H2O + K2SO4
Cr2O72– + 14H+ + 6e– = 2Cr3+ + 7H2O
2Cl– – 2e– = Cl2
z(Cr2O72–) = 6, z(Cr3+) = 3, z(Cl–) = 1, z(Cl2) = 2
63. Основные соотношения
Формульная единицаn, моль
M, г/моль
VM, л/моль
с, моль/л (М)
Эквивалент
neq = z n, моль
Meq = M / z, г/моль
Veq = VM /z, л/моль
ceq = z c, моль/л (н., N)
Закон эквивалентов
Для реакции aA + bB + ... = dD + eE + ...
neq(A) = neq(B) = neq(D) = neq(E) = ...
64. Задача (решение по закону эквивалентов)
Смешали 0,2 л 0,25 М водного раствора KMnO4 и0,2 л 0,25 М водного раствора KI. Определить
массу осадка.
m(ос.) = ?
V(р. KMnO4) = 0,2 л
c(KMnO4) = 0,25 моль/л
V(р. KI) = 0,2 л
c(KI) = 0,25 моль/л
Решение
MnO4– + 2H2O + 3e– =
MnO2 + 4OH–
2I– – 2e– = I2
M(MnO2) = 87 г/моль, M(I2) = 254 г/моль
z(KMnO4) = 3, z(KI) = 1, z(MnO2) = 3, z(I2) = 2
65. Задача (решение по закону эквивалентов)
neq(KMnO4) = z(KMnO4)c(KMnO4)V(p.KMnO4)neq(KMnO4) = 3 . 0,25 . 0,2 = 0,15 (моль)
neq(KI) = z(KI)c(KI)V(p.KI)
neq(KI) = 1 . 0,25 . 0,2 = 0,05 (моль)
KMnO4 в избытке, расчет по KI
neq(MnO2) = z(MnO2)m(MnO2) / M(MnO2) = neq(KI)
m(MnO2) = neq(MnO2)M(MnO2) / z(MnO2) = neq(KI)M(MnO2) / z(MnO2)
m(I2) = neq(KI)M(I2) / z(I2)
m(ос.) m(MnO 2 ) m(I 2 ) с(KI)V (p.KI) z (KI)(
M (MnO 2 ) M (I 2 )
) 7,8г
z (MnO 2 )
z (I 2 )
66. Химическое равновесие
Основные положенияЗакон действующих масс
Смещение равновесия
67. Химические реакции
НеобратимыеОбратимые
A+B→D+E
A+B
Hg(NO3)2 + K2S →
HgS↓ + 2KNO3
D+E≠
1
D+E
2
1 – прямая реакция
2 – обратная реакция
H2 + I2
2HI
D+E
A+B
68. Система
Произвольно выбранная частьпространства, содержащая одно или
несколько веществ и отделенная от
окружающей среды поверхностью раздела
(реальной или мысленной)
Параметры системы: p, V, T, c, ...
69. Системы
ГомогенныеГетерогенные
(состоят из одной
(состоят из двух или
фазы)
более фаз)
Фаза – часть гетерогенной системы,
ограниченная поверхностью раздела
и характеризующаяся одинаковыми
физическими свойствами
во всех своих точках
70. Равновесное состояние
Такое состояние системы, когда припостоянных внешних условиях параметры
системы не изменяются во времени
Динамическое равновесие:
с одинаковой скоростью
71. Химическое равновесие
ИстинноеCO + H2O
Метастабильное
CO2 + H2
2H2 + O2 = 2H2O
72. Признаки истинного химического равновесия
Признаки1. В отсутствие внешних
воздействий состояние
системы остается
неизменным.
2. При наличие внешних
воздействий система
переходит в другое
состояние равновесия.
3. При прекращении
внешних воздействий
система возвращается в
исходное состояние.
4. Состояние системы не
зависит от того, с какой
стороны она подходит к
равновесию.
Комментарии
Этот признак характерен
как для истинного, так и
для метастабильного
равновесия.
Это также справедливо и
для истинного, и для
метастабильного
равновесия.
Для метастабильного
равновесия это
невозможно ("шарик
скатился вниз").
Это существенное отличие
истинного равновесия от
метастабильного.
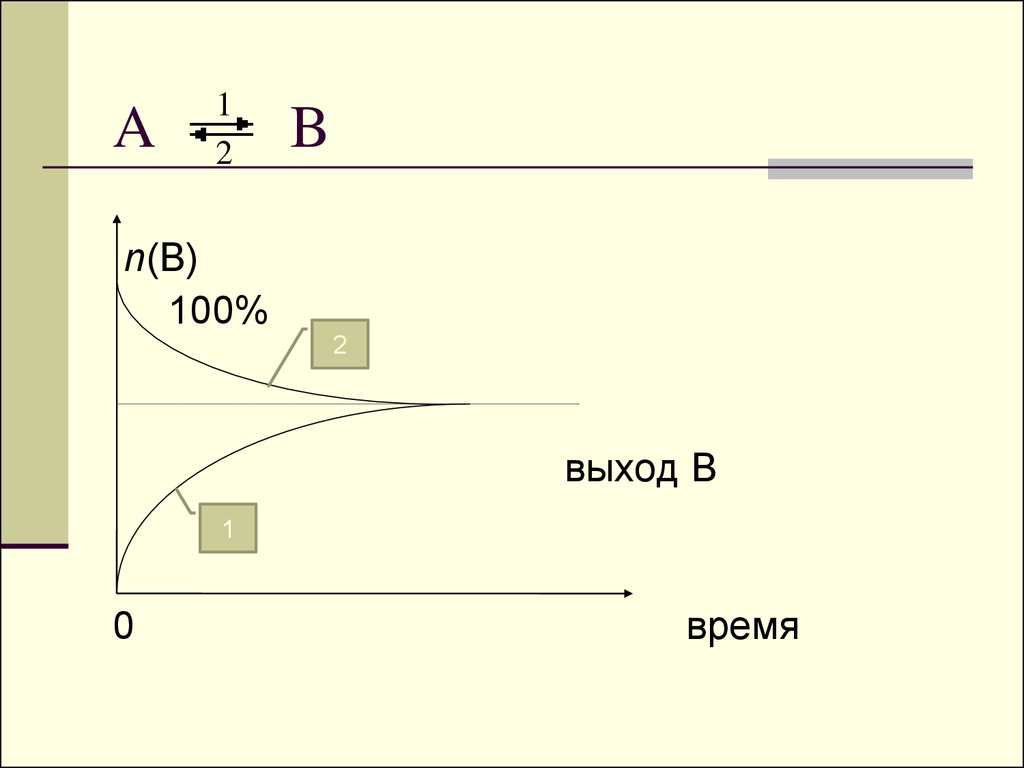
73. A B
A1
2
B
n(В)
100%
2
выход В
1
0
время
74. Закон действующих масс
Като Максимилиан Гульдберг и Петер Вааге(1864–1867):
В условиях химического равновесия при
постоянной температуре отношение
произведения молярных концентраций продуктов
реакции, взятых в степенях, равных их
стехиометрическим коэффициентам, к
произведению молярных концентраций
остающихся неизрасходованными исходных
веществ, также взятых в степенях, равных их
стехиометрическим коэффициентам, является
величиной постоянной
75. Закон действующих масс (гомогенные системы)
aA + bBc(A) = [A] = const
c(B) = [B] = const
c(D) = [D] = const
c(E) = [E] = const
dD + eE
d
e
[ D] [ E ]
Kc
a
b
[ A] [ B]
Концентрации участников реакции не более 0,1 моль/л
76. Закон действующих масс (гетерогенные системы)
aA(ж) + bB(г)dD(т) + eE(г)
n( A) m( A) / M ( A) ( A)
[ A]
const
V ( A) m( A) / ( A) M ( A)
Kc
[ D( т) ]d [ E( г ) ]e
n(A) – количество вещества
V(A) – объем вещества
m(A) – масса вещества
(A) – плотность вещества
M(A) – молярная масса вещества
[ A( ж ) ]a [ B( г ) ]b
const
Kc
[ E( г ) ]
[ B( г ) ]
e
b
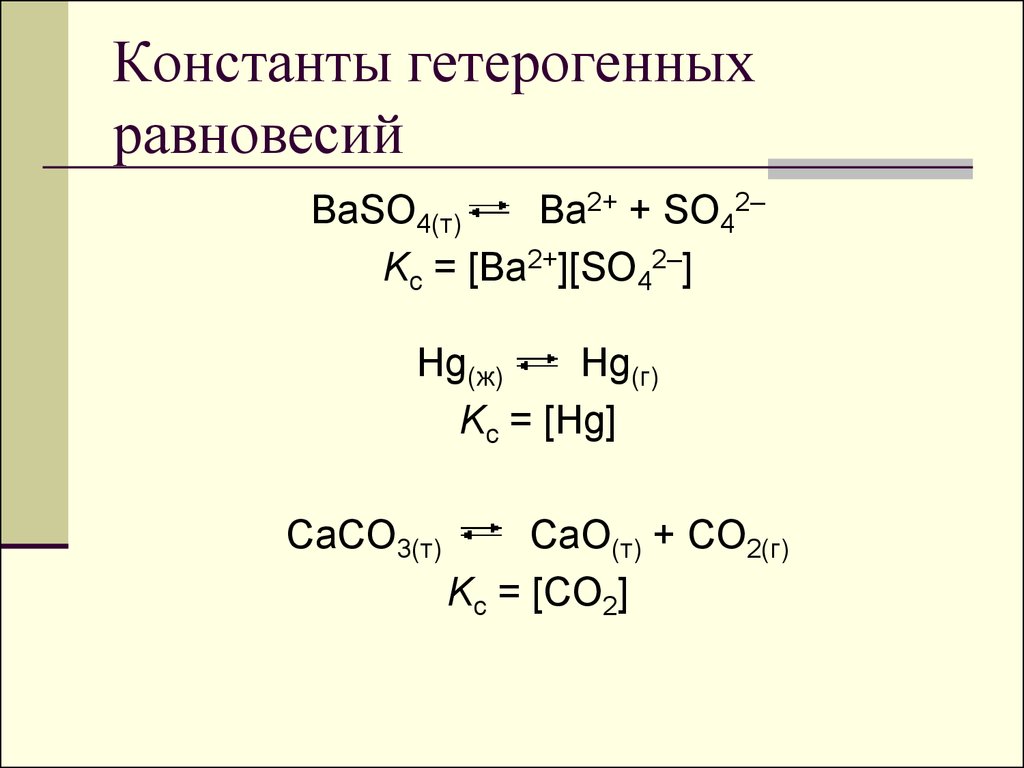
77. Константы гетерогенных равновесий
BaSO4(т)Ba2+ + SO42–
Kc = [Ba2+][SO42–]
Hg(ж)
Hg(г)
Kc = [Hg]
CaCO3(т)
CaO(т) + CO2(г)
Kc = [CO2]
78. Константа равновесия
При постоянной температуре являетсявеличиной постоянной
Не зависит от концентраций участников
реакции
Kc = 0, если реакция не идет: A + B
Kc = , если реакция идет до конца:
A+B=D+E
79. Сложные химические реакции
Известны константы равновесия дляреакций
(I) 2 CO2
2 CO + O2; Kc(I)
(II) 2 SO2 + O2
2 SO3; Kc(II)
Определите константу химического
равновесия для реакции
(III) SO2 + CO2
SO3 + CO; Kc = ?
80. Сложные химические реакции
(I) 2 CO22 CO + O2
(II) 2 SO2 + O2
2 SO3
(III) SO2 + CO2
SO3 + CO
(I) + (II) = 2 (III)
=> Kc(I) Kc(II) = Kc2
[ SO3 ][CO]
[CO] 2 [O2 ][ SO3 ] 2
Kc
K c ( I ) K c ( II )
2
2
[ SO2 ][CO2 ]
[CO2 ] [ SO2 ] [O2 ]
81. Задача
Константа равновесия для реакцииPCl5(г) PCl3(г) + Cl2(г)
при некоторой температуре Kc = 0,04.
Рассчитайте равновесные концентрации
реагента и продуктов, если начальная
концентрация пентахлорида фосфора
c0(PCl5) = 1,2 моль/л
82. Задача
Концентрация,моль/л
с0
с
[В]
Ответ:
[B]
PCl5
PCl3 + Cl2
1,2
х
1,2 – x
1,0
0
х
x
0,2
2
[ PCl3 ][Cl2 ]
x
Kc
0,04
[ PCl5 ]
1,2 x
0
х
x
0,2
х = 0,2 моль/л
83. Задача
Константа равновесия для реакции2 NO2(г)
2 NO(г) + O2(г)
при некоторой температуре Kc = 12,8.
Определите начальную концентрацию
диоксида азота, если равновесная
концентрация кислорода 0,2 моль/л.
84. Задача
2NO2Концентрация,
моль/л
с0
с
[В]
[B]
?
2х
c0 – 2x
c0 – 0,4
[ NO]2 [O2 ]
0,4 2 0,2
Kc
12,8
2
2
[ NO2 ]
(c0 0,4)
2NO + O2
0
2х
2x
0,4
0
х
x
0,2
х = 0,2 моль/л
Ответ: с0 = 0,45 моль/л
85. Сдвиг химического равновесия
Анри Луи Ле Шателье (1884):Любое воздействие на систему,
находящуюся в состоянии химического
равновесия, вызывает в ней изменения,
стремящиеся ослабить это воздействие
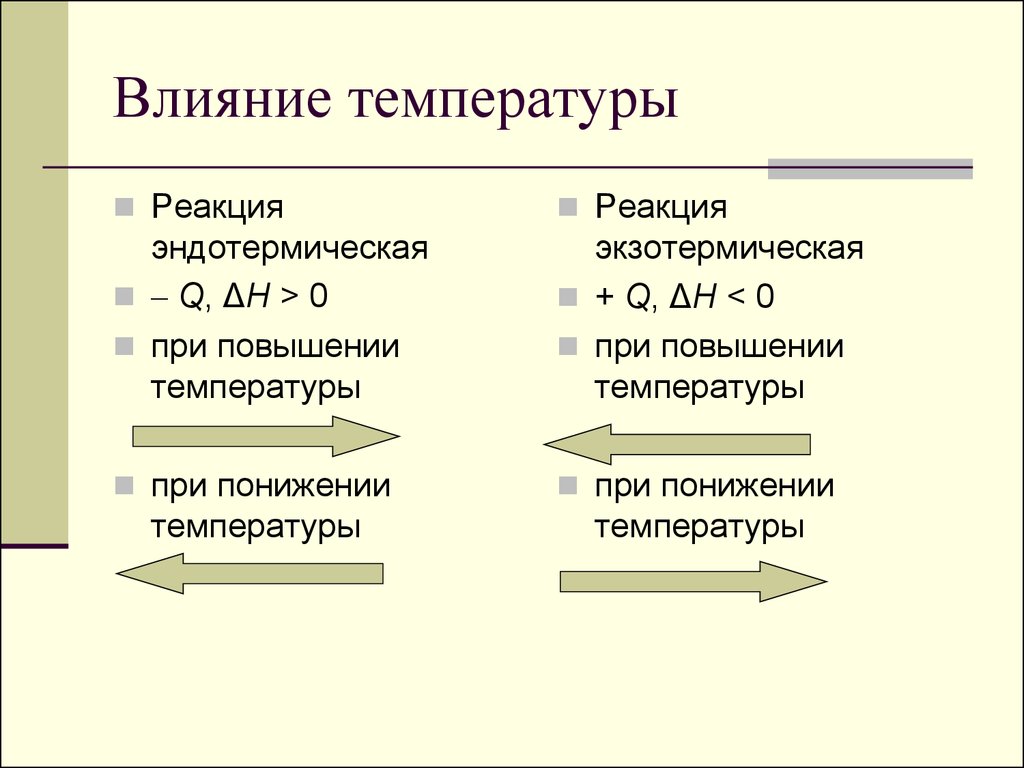
86. Влияние температуры
РеакцияРеакция
эндотермическая
– Q, ΔH > 0
при повышении
температуры
экзотермическая
+ Q, ΔH < 0
при повышении
температуры
при понижении
при понижении
температуры
температуры
87. Влияние температуры
CaCO3CaO + CO2 – Q (ΔH > 0)
при повышении температуры
2NO
N2 + O2 + Q (ΔH < 0)
при повышении температуры
Kc = f(T)
88. Влияние концентрации
[ D] d [ E ] eKc
[ A]a [ B]b
При V = const:
Введение реагента
Введение продукта
Удаление реагента
Удаление продукта
Kc = const
89. Влияние концентрации
2SO2 + O22SO3
при увеличении концентрации О2
90. Влияние давления
aA + bBdD + eE
d
e
[ D] [ E ]
Kc
a
b
[ A] [ B]
если d + e = a + b
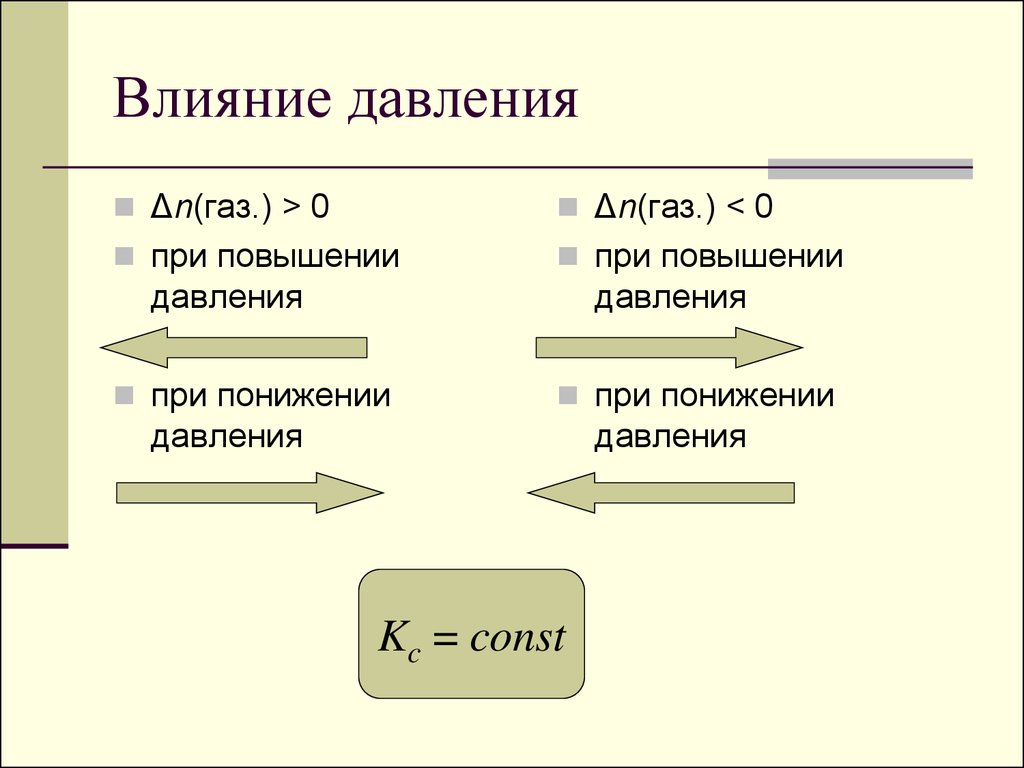
Δn(газ.) = 0
давление не влияет
91. Влияние давления
Δn(газ.) > 0Δn(газ.) < 0
при повышении
при повышении
давления
давления
при понижении
при понижении
давления
давления
Kc = const
92. Влияние давления
N2 + 3H22NH3
Δn(газ.) = 2 – 4 < 0
при повышении давления
93. Введение инертного газа
при V = constпри p = const
концентрации
объем увеличивается
постоянны
не влияет
концентрации
Kc = const
уменьшаются
парциальные
давления понижаются
см. "Влияние
давления"
94. Влияние катализатора
не влияет на Kcне является реагентом или продуктом
=> не смещает химическое равновесие
ускоряет его достижение

















































































 Химия
Химия








