Похожие презентации:
Энергетика химических реакций
1. Энергетика химических реакций
Физика горения ивзрыва НИФ КемГУ
2. Основные понятия термодинамики
ТЕРМОДИНАМИКА (ТД) – этонаука о взаимных
превращениях различных
видов энергии.
3. Химическая термодинамика изучает:
Переходы химической энергии в другиеформы- тепловую, электрическую и. т.д.,
Каковы энергетические эффекты
химических реакций,
Возможность и направление
самопроизвольно протекающей реакции,
Состояние химического равновесия и
условия его смещения.
4. Основные понятия ТД
Объектом изучения в термодинамикеявляется система.
Система - это совокупность веществ
находящихся во взаимодействии,
мысленно (или фактически)
обособленная от окружающей среды.
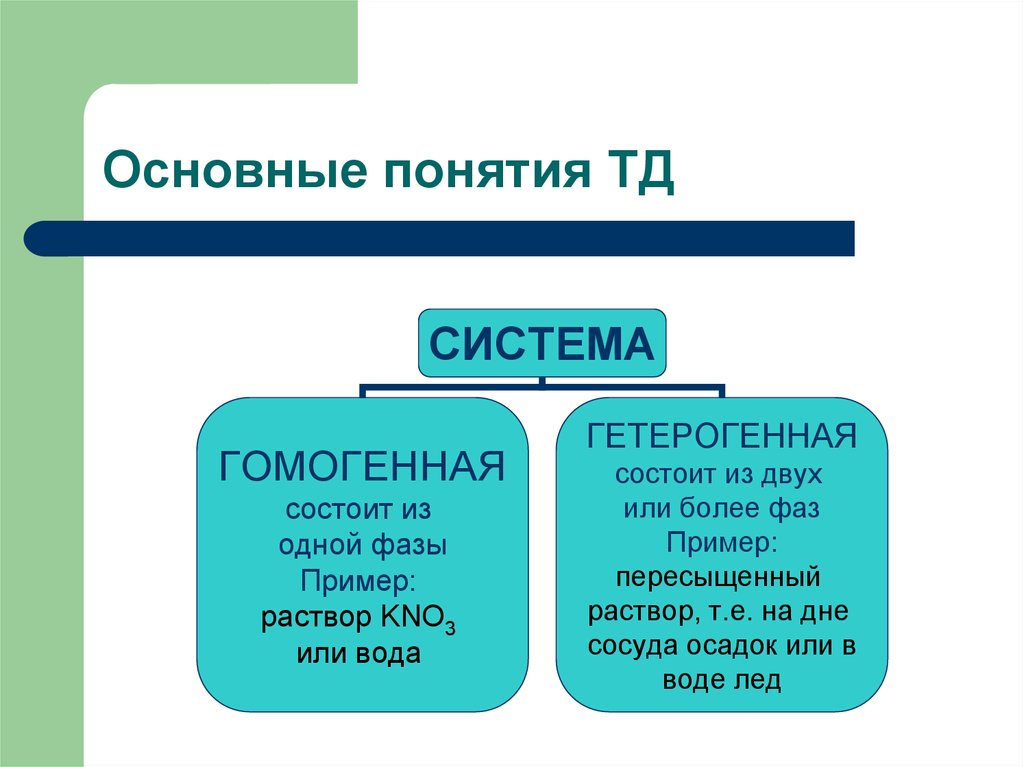
5. Основные понятия ТД
СИСТЕМАГОМОГЕННАЯ
состоит из
одной фазы
Пример:
раствор KNO3
или вода
ГЕТЕРОГЕННАЯ
состоит из двух
или более фаз
Пример:
пересыщенный
раствор, т.е. на дне
сосуда осадок или в
воде лед
6. Основные понятия ТД
Фаза-это часть системы,однородная во всех точках по
составу и свойствам и
отделенная от других частей
системы поверхностью
раздела.
7. Основные понятия ТД
СИСТЕМАоткрытая
обменивается с
окружающей средой
веществом и
энергией
замкнутая
изолированная
обменивается
энергией, а
веществом нет
не обменивается ни
веществом ни энергией.
Это условное понятие
100% изолированных
систем практически нет
8. Термодинамические параметры
Температура – ТДавление – Р
Плотность – ρ
Концентрация - С
Теплоемкость –
Изменение хотя бы одного параметра
приводит к изменению состояния системы
в целом
9. Параметры химической термодинамики
U - внутренняя энергияН - энтальпия
S - энтропия
G - энергия Гиббса
10. Внутренняя энергия системы
Внутренняя энергия системы (U) представляет собой ее полную энергию,которая складывается из кинетической и
потенциальной энергий молекул,
атомов, атомных ядер и электронов.
Она не включает потенциальную
энергию положения системы в
пространстве и кинетическую энергию
движения системы как целого.
11. Единицы измерения
Единицы измерения внутренней энергии:[U] = Дж, кДж.
Абсолютное значение внутренней
энергии определить невозможно, однако
можно измерить ее изменение ΔU при
переходе из одного состояния в другое.
12. Внутренняя энергия системы
Внутренняя энергия - это функция состояния,которая характеризует полный запас энергии
системы.
Изменение внутренней энергии не зависит от
пути и способа перехода системы из одного
состояния в другое.
ΔU=U2 –U1
U2 и U1 - внутренняя энергия системы в конечном и
начальном состояниях соответственно.
13. Термодинамический процесс
- этоизменение состояния
системы, сопровождающийся
изменением хотя бы одного из
параметров системы во
времени.
14. Термодинамический процесс
В зависимости от условий переходасистемы из одного состояния в
другое в термодинамике различают
следующие процессы:
изотермические Т- const,
изобарные Р-const,
изохорные V-const.
15. Теплота
- является мерой энергиипереданной от одного
тела к другому, за счет
разницы температур этих
тел.
16. Работа
- является мерой энергии,переданной от одного тела
к другому за счет
перемещения масс под
действием каких-либо сил.
17. Первый закон термодинамики
Выражает количественное соотношениемежду изменением внутренней энергии,
теплотой и работой:
Q=ΔU +A
Т.е. теплота Q, подведенная к системе,
расходуется на увеличение ее внутренней
энергии ΔU и на совершение системой
работы А.
работа расширения A=P×ΔV
18. Закон сохранения энергии
- энергия не исчезает и невозникает, она переходит из
одной формы в другую в
строго определенных,
всегда в эквивалентных
количествах.
19. Изохорный процесс
Первый закон ТД:Q=ΔU +A = ΔU + P×ΔV
Для изохорного процесса
V=const , тогда ΔV=0 A=0
Запишем первый закон ТД для
изохорного процесса:
Q=ΔU
20. Изобарный процесс
Для изобарного процесса Р=const.В изобарных процессах тепловой эффект химической
реакции равен изменению энтальпии (Н).
Первый закон ТД:
Qр =ΔU+P×ΔV=(U2-U1) + P(V2-V1)=(U2+PV2)-(U1+PV1)
обозначим через Н =U+PV
Тогда Qр =H2-H1=ΔН.
Величина Н- характеризует теплосодержание системы.
21. Тепловой эффект реакции
- это количество теплоты,которое выделяется или
поглощается системой
после протекания
химической реакции
22. Тепловой эффект реакции равен изменению энтальпии системы:
если H2 > H1ΔH= H2 – H1
>
0
реакция эндотермическая
Q=ΔH
если H1 > H2
ΔH= H2 – H1
<
0
реакция экзотермическая
Q=–ΔH
23. Энтальпия образования
- количество теплоты, котороевыделяется или поглощается
при образовании 1 моля
сложного вещества из простых
веществ.
24. Стандартная энтальпия образования
Для сравнения энтальпий образования различныхсоединений их определяют при одинаковых
стандартных условиях:
Т=298 К
Р=101,3 КПа, 1 атм., 760 мм.рт.ст.
Энтальпия образования определенная при
стандартных условиях называется стандартной
энтальпией образования вещества и обозначается
Н
0
обр
25. Единицы измерения
Единицы измерения энтальпииобразования:
кДж
[ Н ]
моль
0
обр
Значения стандартных энтальпий
образования приведены в таблицах,
необходимо обращать внимание на
агрегатные состояния веществ
26. ПРИМЕР
Н 0;0
О2
кДж
Н 142
;
моль
кДж
0
Н О 246
.
моль
0
О3
27. ПРАВИЛО!
энтальпииобразования простых веществ
равны нулю
для устойчивых простых веществ
энтальпия равна нулю
Например:
Для твердого йода энтальпия образования
равна нулю, а для газообразного йода не
равна нулю.
28. Термохимические уравнения
этоуравнения химической
реакции в котором указан
тепловой эффект
химической реакции и
агрегатные состояния.
29. Виды агрегатного состояния вещества
т – твердоек – кристаллическое,
ам. – аморфное,
ж – жидкое,
г – газообразное,
р – растворимое
30. ПРИМЕР
CaCO3( к ) CaO( к ) СО2( г )31. Особенности термохимических уравнений
в термохимических уравнениях могутбыть дробные стехиометрические
коэффициенты.
1
1
Н 2 Сl2 HCl
2
2
Н 2 Сl2 2 HCl
Н
0
298
кДж
92
;
моль
Н
0
298
кДж
184
;
моль
32. Особенности термохимических уравнений
С термохимических уравнениямиможно производить
алгебраические действия. Их
можно складывать, вычитать,
умножать на любые
коэффициенты вместе с
тепловым эффектом
33. Закон Гесса
Тепловойэффект химической
реакции определяется лишь
начальным и конечным
состояниями системы
реагирующих веществ и не
зависит от пути ее протекания.
34. Пример. Получение СО2
1 путь:С + О2 = СО2
2 путь:
С + 1/2О2 = СО
СО + 1/2О2 = СО2
ΔН1
ΔН2
ΔН3
ΔН1 = ΔН2 + ΔН3
35. Следствие из закона Гесса
Теплота химической реакции равнаразности между суммой энтальпий
образования продуктов реакции и
суммой энтальпий образования
исходных веществ.
Необходимо учитывать
стехиометрические коэффициенты.
36. Тепловой эффект реакции
Н0
хим. р .
(nпрод. Н
0
H f
n
0
f , прод
) (nисх. Н
стандартная энтальпия
образования вещества
количество вещества
0
f ,исх
)
37. Пример. Рассчитать ΔН0 химической реакции
2Mg CO2 2MgO CкДж
H 611
моль
кДж
0
H СO 393,5
моль
0
0
0
H хим
2
*
H
H
. р.
MgO
СO
0
MgO
2
2
0
H хим
. р . 2 * ( 611) ( 393,5) 828,5кДж
38. Пример. Рассчитать ΔН0 MgO
SiO2 2 Mg 2 MgO Si 350 .7 кДж0
Н SiO
827 .2
2
кДж
моль
Решение :
0
0
0
Н хим
2
Н
Н
. р.
MgO
SiO
2
0
Н MgO
0
0
Н хим
Н
. р.
SiO
2
2
0
Q Н Н хим
. р . 350 .7 кДж
Н
0
MgO
( 350 .7) ( 827 .2)
кДж
588 .95
2
моль
39. Задача
Вычислите ΔН0 SO3 если при сгорании 64гсеры выделилось 790 кДж тепла.
Решение:
S +3/2O2 =SO3
64 г
32 г
S
–
790
S
–
Х
Х=395 кДж тепла
кДж
кДж
ΔН0 SO3 = - 395кДж/моль
40. Задача
Сколько тепла выделится привзаимодействии 4,48 литров N2 (н.у.) с Н2 ,
если ΔН0 (NH3)=–46 кДж/моль.
Решение:
½N2 +3/2H2 =NH3
11,2 л
N2 –
– 46 кДж
4,48 л
N2 –
Х
кДж
Х=18,4кДж тепла.
41.
Возможность инаправление
протекания
химических
реакций
42. Самопроизвольность протекания реакции
При изучении химических взаимодействий важнооценить возможность или невозможность их
самопроизвольного протекания при данных
условиях.
Самопроизвольно могут протекать как
экзотермические, так и эндотермические
реакции.
Самопроизвольный процесс протекает без
затраты энергии извне (смешение газов,
передача тепла от горячего к холодному, вода
стекает с крыши)
43. Второй закон термодинамики
Определяет критерийсамопроизвольного
протекания процесса в
изолированных системах энтропию
44. Энтропия
этопараметр
характеризующий
хаотичность движения
частиц, является мерой
молекулярного, атомного и
ионного беспорядка.
45. Параметры состояния вещества
Параметрымакросостояния системы:
Р -давление, Т – температура ,V – объем
Параметры микросостояния системы:
1. мгновенные координаты каждой молекулы
(Хi, Yi, Zi)
2. скорости их перемещения (Vхi, Vyi, Vzi)
Каждому
макросостоянию отвечает большое
число микросостояний.
46. Термодинамическая вероятность состояния системы (W)
эточисло микросостояний, с
помощью которых
осуществляется данное
макросостояние
47. Уравнение Больцмана
S R ln WДж
[S ]
энтропия
моль К
Уравнение Больцмана придало
энтропии физический смысл.
48. Основные положения
Энтропия- это мера термодинамическойвероятности состояния веществ и систем.
Любая изолированная система
предоставленная самой себе, изменяется в
направлении состояния обладающего
максимальной вероятностью.
Все процессы в изолированной системе
происходят в направлении увеличения
энтропии.
49. Изменение энтропии
ΔS = S2 –S1если ΔS > 0, то процесс протекает в
прямом направлении,
если ΔS < 0, то процесс протекает в
обратном направлении.
50. Энтропия химической реакции
S0
хим. р .
(nпрод. S
0
S f
n
0
f , прод
) (nисх. S
стандартная энтропия
образования вещества
количество вещества
0
f ,исх
)
51. Основные положения
значениястандартных
энтропий приведены в
таблице;
значение энтропий зависит от
агрегатного состояния
веществ.
52. Пример:
S0
H 2Oтв
S
0
H 2 Oж
S
0
H 2 Oг
Дж
44,2
моль К
Дж
70
моль К
Дж
189
моль К
53. Абсолютное значение энтропии
В отличие от энтальпии и внутренней энергии можноопределить абсолютное значение энтропии всех
веществ, т.к. для энтропии есть нулевая точка
отсчета.
Энтропия вещества при Т=0 К равна нулю,
вероятность = 1. Данное макросостояние достигается
единственным микросостоянием.
При фазовых переходах (плавление, кипение)
энтропия растет скачкообразно. Если в реакции
участвуют газообразные вещества, то об изменении
энтропии можно судить по изменению объема
газообразных веществ.
54. Пример
Сграфит тв. + СО2=
2СОгаз
ΔS=175,4
1моль
2 моль ΔS>0
твердые и жидкие вещества не
учитываются , в данной реакции объем
увеличивается, беспорядок системы
возрастает ΔS>0.
55. Пример
2Н2(г) + О2(г) = 2Н2О(г) ΔS<02
1 2
в данной реакции объем уменьшается,
беспорядок системы уменьшается
56. Факторы неизолированных систем
1.Энтальпийный ΔН- отражает стремление системы кобразованию связей в результате взаимного
притяжения частиц, что приводит к их усложнению.
Энергия при этом выделяется и ΔН<0. (Стремление
системы перейти в состояние с минимальной Е, при
этом выделяется тепло ΔН<0.)
2. Энтропийный (TΔS) – отражает стремление к
усилению процессов диссоциации сложных частиц на
более простые и их менее упорядоченному состоянию
в результате ΔS>0. (Стремление системы перейти в
состояние с большим беспорядком ΔS>0.)
57. Энергия Гиббса
Энтропийный и энтальпийный факторыобычно действуют в противоположных
направлениях и общее направление
реакции определяется влиянием
преобладающего фактора.
В неизолированных системах критерием
является ΔG –энергия Гиббса, ее
рассчитывают при разных температурах.
58. Уравнение энергии Гиббса
G H T S0
0
59. Величина и знак ΔG позволяют судить о принципиальной возможности и направлении процесса.
ΔG<0 самопроизвольно протекает впрямом направлении,
Δ G>0 прямая реакция невозможна и
протекает в обратном направлении,
Δ G=0 реакция находится в состоянии
равновесия, т.е. скорость прямой
реакции равна скорости обратной.
60. Пример
Fe2O3(тв) +3Н2 (г) =2Fe (тв) +3Н2О(г)ΔН х.р. = 96,61 кДж
Возможна ли данная реакция при стандартных
условиях, если ΔSх.р. = 138,7 Дж/град?
Решение:
Вычисляем : ΔG= ΔH – T ΔS
ΔG= 96,61 -298×138,7×10–3 =55,28 кДж,
т.к. Δ G>0 ,то реакция при стандартных
условиях невозможна, в этих условиях идет
61. Пример
При какой температуре начнется этареакция?
Решение:
Найдем температуру при которой ΔG=0?
ΔH =T ΔS
T = ΔH/ ΔS =96,61/0,1387=696.5 K
Следовательно при температуре >696,5K
начнется реакция восстановления Fe2O3
водородом.
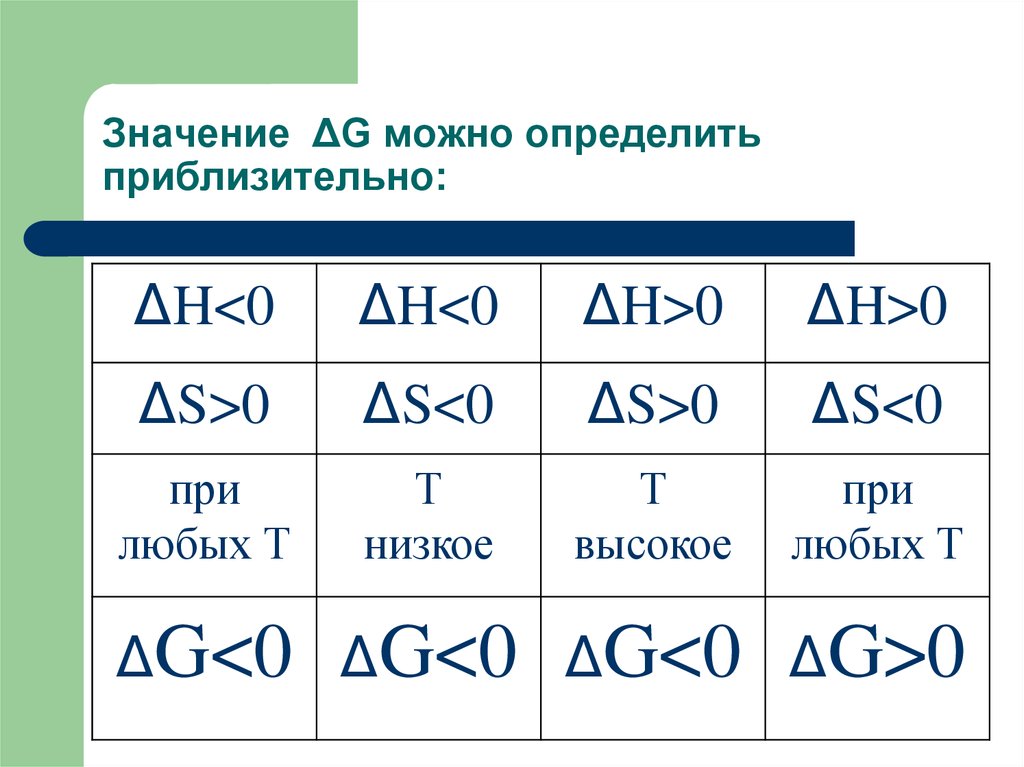
62. Значение ΔG можно определить приблизительно:
ΔH<0ΔH<0
ΔH>0
ΔH>0
ΔS>0
ΔS<0
ΔS>0
ΔS<0
при
любых Т
Т
низкое
Т
высокое
при
любых Т
ΔG<0 ΔG<0 ΔG<0 ΔG>0
63. Энергия Гиббса химической реакции
G0
хим. р .
(nпрод. G
G
0
f
n
0
f , прод
) (nисх. G
стандартная энергия
Гиббса образования
вещества
количество вещества
0
f ,исх
)
64. Стандартная энергия Гиббса образования химического соединения ΔG°
это энергия Гиббса реакции образования одногомоля этого соединения находящегося в
стандартных условиях, из простых веществ
ΔG° простых веществ так же как ΔH°, ΔS° равны
нулю
Единицы измерения ΔG° - кДж/моль
Стандартная энергия Гиббса образования
химического соединения ΔG° приведена в
справочниках
65. Устойчивость соединений
G0
обр
G
0
обр
0
0
такие вещества
термодинамически
неустойчивы, они не
могут быть получены из
простых веществ
вещество
термодинамически
устойчиво и может быть
получено из простых
веществ
66. ПРИМЕР
NO, NO2 , при стандартныхусловиях их получают косвенным
путем:
Cu + HNO3 → Cu(NO3)2 +NO + H2O
67. ВАЖНО!
Любая реакция припостоянных температуре и
давлении протекает
самопроизвольно в
направлении убыли энергии
Гиббса.
68. Химическое равновесие и константа равновесия
69. Состояние равновесия
это такое состояние системы прикоторой ΔG = 0, а скорость прямой
реакции равна скорости обратной:
аА + вВ = сС + dD
V прямой = V обратной
70. Константа равновесия
характеризует количественноесостояние равновесия
c
d
[C ] [ D]
Кр
a
b
[ A] [ B]
71. Расчет константы равновесия
Для расчета константы равновесияиспользуются равновесные
концентрации.
Если в реакции все вещества
находятся в газообразном состоянии,
то вместо равновесных концентраций
можно использовать значения
парциальных давлений.
72. Парциальное давление
этотакое давление газа,
входящего в смесь, которое
он оказывал бы, если бы
занимал тот объем, который
занимает вся смесь.
73. ПРИМЕР
N 2 3H 2 2 NH 3( г )NH
2
Kp
3( г )
N H
3
2
2
S( тв ) O2 SO2 ( г )
Kp
SO
2( г )
O
2
74. Связь Кр и ΔG°
Константа равновесия связана состандартной энергией Гиббса
следующим соотношением:
G R T ln K p 5,71 lg K p
0
Зная значения ΔG° для химической реакции
можно рассчитать константу равновесия и
равновесные концентрации.
75. Смещение равновесия
При изменении внешних условийменяются равновесные концентрации,
происходит смещение равновесия.
Направление смещения химического
равновесия при изменении внешних
условий определяется правилом
Ле-Шателье.
76. Принцип Ле–Шателье
При внешнем воздействииравновесие смещается в
сторону ослабления
этого воздействия.
77. 1. Влияние температуры на равновесие химической реакции
Повышениетемпературы смещает равновесие в сторону
эндотермической реакции
Понижение температуры смещает равновесие в сторону
экзотермической реакции.
78. 2. Влияние давления на равновесие химической реакции
Повышениедавления смещает
равновесие в сторону меньшего
объема.
3Н2 + N2 → 2NH3
3
1 → 2
Если равные объемы, то давление не
влияет на смещение равновесия.
79. 3. Влияние концентрации на равновесие химической реакции
Повышениеконцентрации исходных
веществ смещает равновесие в
сторону продуктов реакции.
Повышение концентрации продуктов
реакции смещает равновесие в
сторону исходных веществ.
80. 4. Влияние катализатора на равновесие химической реакции
Введение катализатора невлияет на смещение
равновесия, но ускоряет
процесс достижения
равновесия.














































































 Химия
Химия








