Похожие презентации:
Строение и физические свойства вещества
1. Лекция № 7 (2.05.12г.) Раздел IV «СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА» Тема «Основы атомной физики»
1)2)
3)
4)
5)
6)
7)
Опыты Резерфорда по изучению строения атома.
Квантовые постулаты Бора. Закономерности
спектров излучения атомов водорода.
Дискретность энергетических уровней в атоме.
Опыты Франка и Герца .
Недостатки теории Бора. Волновая функция и ее
свойства. Уравнение Шредингера.
Уравнение Шредингера для атома водорода.
Главное, орбитальное и магнитное квантовые
числа.
Кратность вырождения уровней энергии.
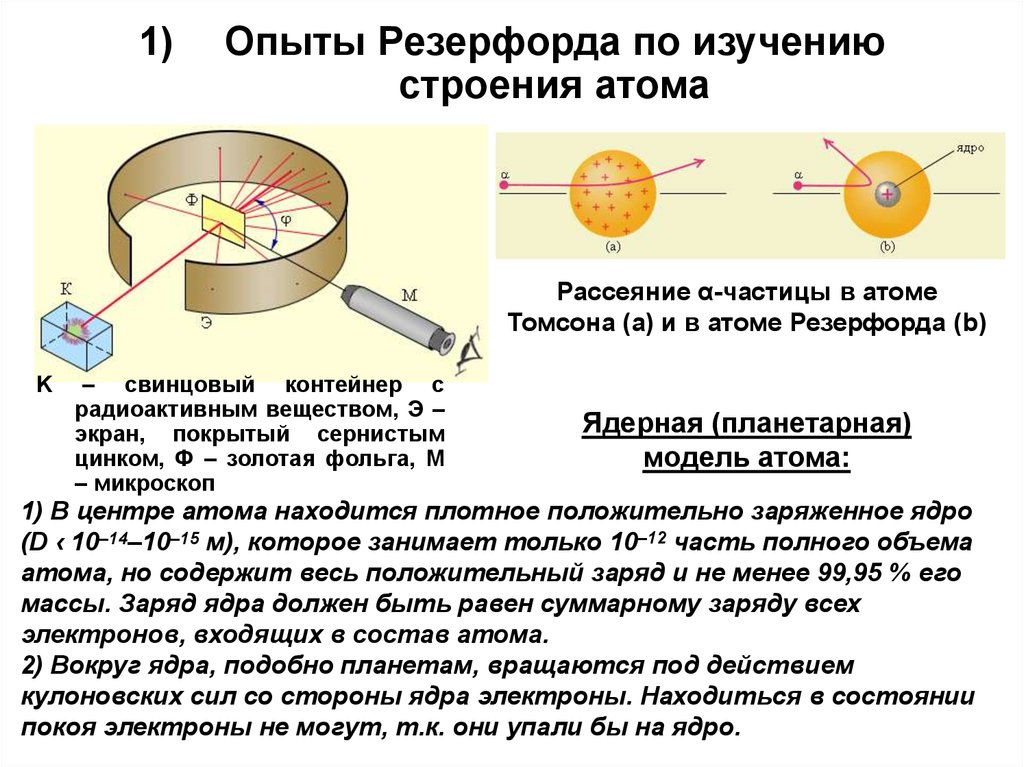
2. Опыты Резерфорда по изучению строения атома
1)Опыты Резерфорда по изучению
строения атома
Рассеяние α-частицы в атоме
Томсона (a) и в атоме Резерфорда (b)
K
– свинцовый контейнер с
радиоактивным веществом, Э –
экран, покрытый сернистым
цинком, Ф – золотая фольга, M
– микроскоп
Ядерная (планетарная)
модель атома:
1) В центре атома находится плотное положительно заряженное ядро
(D ‹ 10–14–10–15 м), которое занимает только 10–12 часть полного объема
атома, но содержит весь положительный заряд и не менее 99,95 % его
массы. Заряд ядра должен быть равен суммарному заряду всех
электронов, входящих в состав атома.
2) Вокруг ядра, подобно планетам, вращаются под действием
кулоновских сил со стороны ядра электроны. Находиться в состоянии
покоя электроны не могут, т.к. они упали бы на ядро.
3. 2) Квантовые постулаты Бора
Первый постулат Бора (постулат стационарных состояний):Атомная система может находится только в особых стационарных или
квантовых состояниях, каждому из которых соответствует определенная
энергия En. В стационарных состояниях атом не излучает
Согласно первому постулату Бора, атом
характеризуется системой энергетических уровней,
каждый из которых соответствует определенному
стационарному состоянию.
Величина |E1| называется энергией ионизации.
Состояние с энергией E1 называется основным
состоянием атома.
Второй постулат Бора (правило частот):
Энергетические уровни
атома и условное
изображение
процессов поглощения
и испускания фотонов
При переходе атома из одного
стационарного состояния с энергией En в
другое стационарное состояние с энергией
Em излучается или поглощается квант,
энергия которого равна разности энергий
стационарных состояний:
hνnm = En – Em
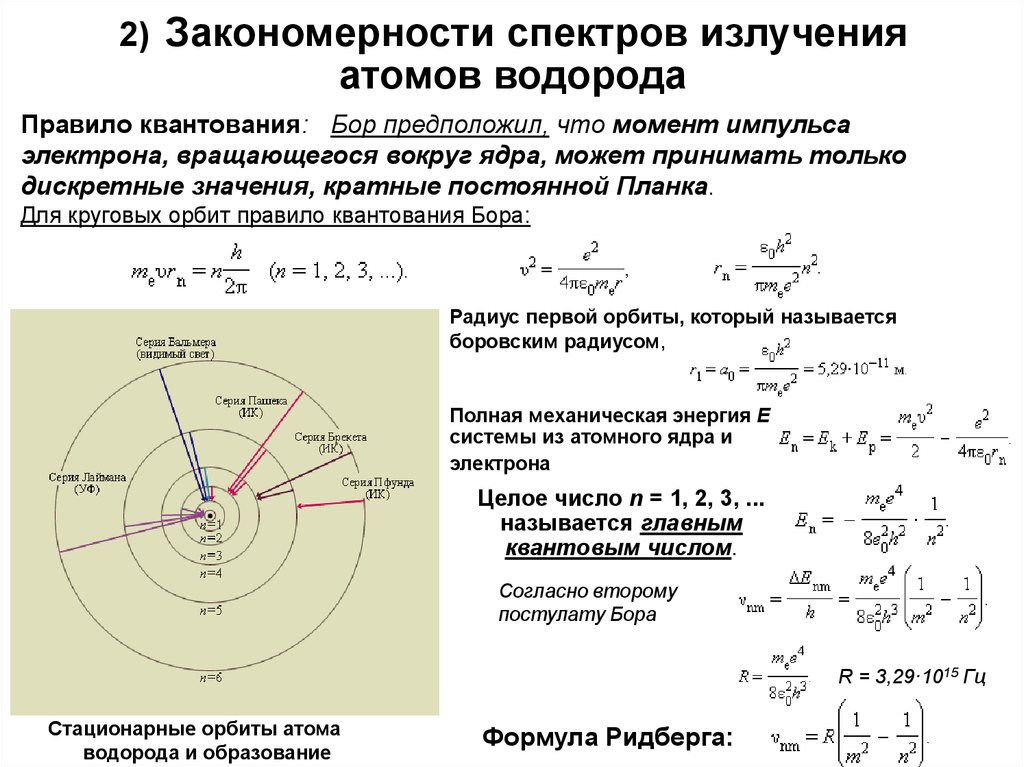
4. 2) Закономерности спектров излучения атомов водорода
Правило квантования: Бор предположил, что момент импульсаэлектрона, вращающегося вокруг ядра, может принимать только
дискретные значения, кратные постоянной Планка.
Для круговых орбит правило квантования Бора:
Радиус первой орбиты, который называется
боровским радиусом,
Полная механическая энергия E
системы из атомного ядра и
электрона
Целое число n = 1, 2, 3, ...
называется главным
квантовым числом.
Согласно второму
постулату Бора
R = 3,29·1015 Гц
Стационарные орбиты атома
водорода и образование
Формула Ридберга:
5. 3) Дискретность энергетических уровней в атоме.
Физическая интерпретация правила квантования на основе представлений о волновых свойствах
частиц (гипотеза де Бройля).
Иллюстрация идеи де Бройля
возникновения стоячих волн
на стационарной орбите для
случая n = 4
Де Бройль предложил, что каждая орбита в атоме
водорода соответствует волне,
распространяющейся по окружности около ядра
атома. Стационарная орбита возникает в том случае,
когда волна непрерывно повторяет себя после
каждого оборота вокруг ядра. Или - стационарная
орбита соответствует круговой стоячей
волне де Бройля на длине орбиты .
В стационарном квантовом состоянии атома водорода
на длине орбиты должно укладываться по идее
де Бройля целое число длин волн λ, т. е. nλn = 2πrn
Т.к. длина волны де Бройля λ = h / p, где p = mev –
импульс электрона, то
Таким образом, боровское правило квантования связано с
волновыми свойствами электронов
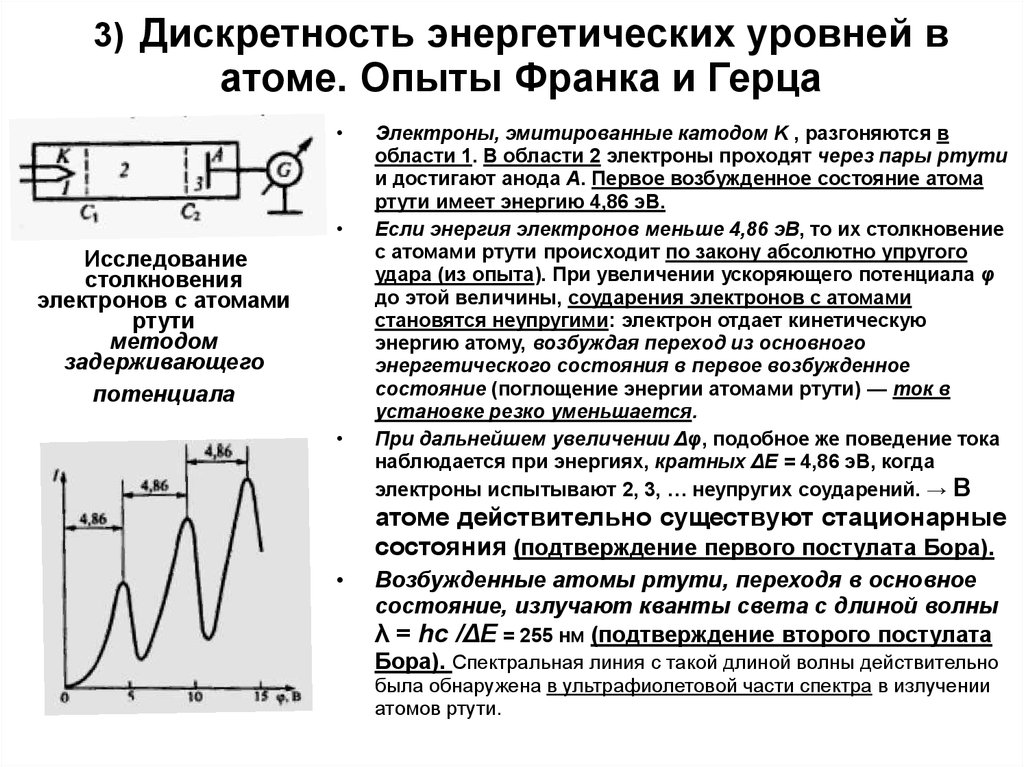
6. 3) Дискретность энергетических уровней в атоме. Опыты Франка и Герца
Исследование
столкновения
электронов с атомами
ртути
методом
задерживающего
потенциала
Электроны, эмитированные катодом K , разгоняются в
области 1. В области 2 электроны проходят через пары ртути
и достигают анода A. Первое возбужденное состояние атома
ртути имеет энергию 4,86 эВ.
Если энергия электронов меньше 4,86 эВ, то их столкновение
с атомами ртути происходит по закону абсолютно упругого
удара (из опыта). При увеличении ускоряющего потенциала φ
до этой величины, соударения электронов с атомами
становятся неупругими: электрон отдает кинетическую
энергию атому, возбуждая переход из основного
энергетического состояния в первое возбужденное
состояние (поглощение энергии атомами ртути) — ток в
установке резко уменьшается.
При дальнейшем увеличении Δφ, подобное же поведение тока
наблюдается при энергиях, кратных ΔE = 4,86 эВ, когда
электроны испытывают 2, 3, … неупругих соударений. → В
атоме действительно существуют стационарные
состояния (подтверждение первого постулата Бора).
Возбужденные атомы ртути, переходя в основное
состояние, излучают кванты света с длиной волны
λ = hc /ΔE = 255 нм (подтверждение второго постулата
Бора). Спектральная линия с такой длиной волны действительно
была обнаружена в ультрафиолетовой части спектра в излучении
атомов ртути.
7. 4) Недостатки теории Бора. Волновая функция и ее свойства
В теории Бора существовали недостатки:трудность объяснения спектральных закономерностей сложных атомов и молекул;
проблемы при создании физической теории хим. реакций;
непоследовательность теории в целом - введенное правило квантования момента импульса
или через длину волны де Бройля правило квантования
2πr = nλ в принципе несовместимо с классическим поведением электрона.
Движение электрона в атоме очень мало похоже на движение планет или спутников.
Интенсивность волн де Бройля в данной точке пространства связана с числом частиц,
попавших в эту точку (см. опыты по дифракции микрочастиц). Поэтому волновые
свойства микрочастиц требует статистического (вероятностного) подхода
к их описанию.
Для описания поведения квантовых систем вводится волновая функция Ψ (x, y, z, t).
Физический смысл имеет только вероятность обнаружить электрон в том
или ином месте, описываемая квадратом модуля волновой функции |Ψ|2.
Волновая функция Ψ определяется таким образом, чтобы вероятность dw того, что частица находится
в элементе объема dV была равна:
Волновая функция должна быть: 1) конечной (вероятность не может быть больше единицы),
2) однозначной (вероятность не может быть неоднозначной величиной) и 3) непрерывной
(вероятность не может изменяться скачком).
Волновая функция удовлетворяет принципу суперпозиции: если система может
находиться в различных состояниях, описываемых волновыми функциями Ψ1, Ψ2 ,…,Ψn,
то она также может находиться в состоянии, описываемом линейной комбинацией этих
функций (где Cn (n = 1, 2,…) — произвольные, или комплексные числа):
8. 4) Уравнение Шредингера
Волновая функция Ψ является решением основного уравнения квантовой механики –уравнения Шредингера:
— потенциальная функция частицы в силовом поле, Ψ (x, y, z, t) — искомая волновая функция
частицы.
Важный частный случай общего уравнения Шредингера - уравнение Шредингера для
стационарных состояний, в котором исключена зависимость Ψ от времени. В этом случае функция
U = U (x, y, z) не зависит явно от времени и имеет смысл потенциальной энергии. Решение
уравнения может быть представлено в виде произведения двух функций — функции только
координат и функции только времени:
где E — полная
энергия частицы.
Уравнение Шредингера:
после упрощений:
— уравнение Шредингера для стационарных состояний.
Набор значений энергий Е, при котором волновая функция Ψ имеет физический смысл
(Ψ — конечная, однозначная и непрерывная) называются собственными значениями энергии.
Решения, которые соответствуют собственным значениям энергии, называются
собственными функциями.
Собственные значения E могут образовывать как непрерывный, так и дискретный ряд (спектр).
Для свободной частицы U (x) = 0 (пусть она движется вдоль оси x) решение уравнения Шредингера:
соответствует непрерывному спектру энергий.
Таким образом, свободная квантовая частица описывается плоской монохроматической волной де
Бройля.
9. 5) Уравнение Шредингера для атома водорода
10. 6) Главное, орбитальное и магнитное квантовые числа
Главное квантовое число n определяет энергетические уровни электрона в атоме:
n = 1, 2, 3,….
Орбитальное квантовое число l при заданном n принимает значения: l = 0,1, 2,…, (n −1) и
определяет величину момента импульса (механический орбитальный момент)
электрона в атоме:
В атоме водоpода электpон совеpшает вpащательное движение около ядpа. Роль импульса pz (см.
формулу для непрерывного спектра энергии движения свободной частицы) здесь игpает
пpоекция момента импульса Mz (существует аналогия и в квантовой механике между законами
поступательного и вpащательного движения). Стационаpное состояние в этом случае
описывается волновой функцией ψ
α - угол вpащения электpона
Однако между поступательным и вpащательным движениями
есть и существенная pазница: поступательное движение по
пpямой, к котоpому относятся и волны де Бpойля,
незамкнуто (инфинитно), тогда как вpащательное движение
(в данном случае - по окpужности) замкнуто (финитно).
Замкнутость движения электpона в атоме водоpода накладывает
на волновую функцию важное огpаничение: она должна замыкаться
сама на себя после полного обоpота, т.е.
→
Если функцию ψ(α) пpедставить как
→
синусоида (и косинусоида) должна замыкаться сама на себя
m называется магнитным квантовым числом, т.к. обычно, пpи изучении
моментов pассматpиваются атомы, локализованные в магнитном поле. Ось
z выбиpается в напpавлении магнитных силовых линий. → название числа m.









 Физика
Физика








