Похожие презентации:
Газообразное состояние вещества
1. Тема: Газообразное состояние вещества
2.
Агрегатныесостояния вещества
Газообразное
Жидкое
Твёрдое
3.
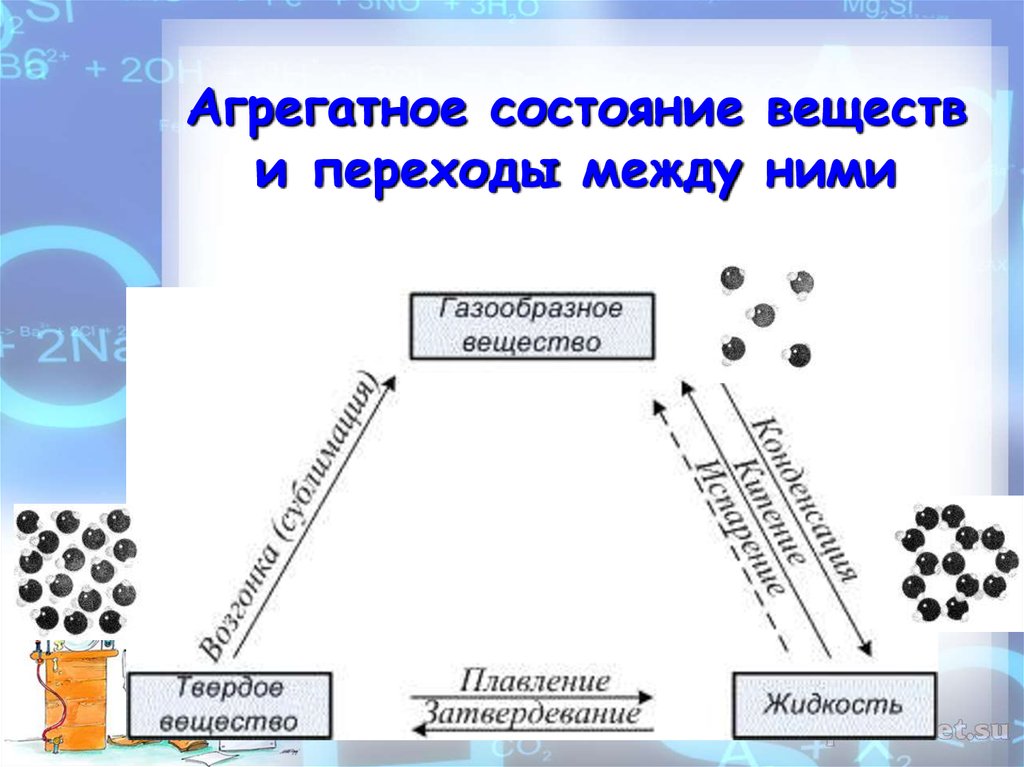
Агрегатное состояние веществи переходы между ними
4. Газ (газообразное состояние) — агрегатное состояние вещества, характеризующееся очень слабыми связями между составляющими его частицам
Газ (газообразное состояние) —агрегатное состояние вещества,
характеризующееся очень
слабыми связями между
составляющими его частицами
(молекулами, атомами или
ионами), а также их большой
подвижностью.
5. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение харак
Частицы газа почти свободно ихаотически движутся в промежутках
между столкновениями, во время
которых происходит резкое
изменение характера их движения.
Газообразное состояние вещества в
условиях, когда возможно
существование устойчивой жидкой
или твёрдой фазы этого же вещества,
обычно называется паром.
6. Особенности газов
• Легко сжимаются.• Не имеют собственной формы
и объёма.
• Любые газы смешиваются друг
с
другом
в
любых
соотношениях.
7. Закон Авогадро:
8. Амедео Авогадро высказал предположение в 1811 году, что в одинаковых объемах различных газов находится одно и тоже число молекул. Позже эта г
Амедео Авогадровысказал предположение в 1811 году, что
в одинаковых объемах различных газов находится одно и
тоже число молекул.
Позже эта гипотеза стала законом
Авогадро.
9. Закон Авогадро: В равных объемах различных газов при одинаковых условиях (температура, давление) содержится одинаковое число молекул.
10. Первое следствие из закона Авогадро: Одинаковое число молекул различных газов при одинаковых условиях занимают одинаковый объем.
11. Молярный объем газа Vm — величина, определяемая отношением объема данной порции газа V к химическому количеству вещества n в этой порции: Вт
Молярный объем газа Vm —величина, определяемая
отношением объема данной
порции газа V к химическому
количеству вещества n в этой
порции:
V
Vm
n
Второе следствие из закона Авогадро
12.
1моль
любого
газа
при
нормальных условиях (760 мм рт.
ст. и 00C) занимает объём 22,4 л.
Vm = 22,4 л/моль – молярный объём
газов
13. Закон объемных отношений (закон Гей-Люссака):
14. Гей-Люссак (1778-1850) При неизменных температуре и давлении объемы вступающих в реакцию газов относятся друг к другу, а также к объемам образую
Гей-Люссак (1778-1850)При неизменных температуре и
давлении объемы вступающих в
реакцию газов относятся друг к другу,
а также к объемам образующихся
газообразных продуктов как
небольшие целые числа.
15. Важнейшие природные смеси газов
• Воздух• Природный газ (смесь
углеводородов).
16. Химический состав воздуха
Атмосферный воздух это смесь
различных газов.
В его составе имеются:
кислород (21%),
азот (78,08%),
углекислота (0,03%)
инертные газы (0,94%).
17. Свойства воздуха
Не имеет цвета,
Прозрачный,
Не имеет запаха,
Не имеет вкуса,
Сжимаем и упруг,
Расширяется при нагревании,
Сжимается при охлаждении,
Теплый воздух легче холодного,
Сохраняет тепло.
18. Природный газ
одно из важнейшихгорючих ископаемых,
важное сырьё для
химической
промышленности. Почти
на 90% он состоит из
углеводородов, главным
образом метана СН4.
19. Состав природного газа
СН4- 80-98%
С2Н6 – 0,5-4%
С3Н8 – 0,2-1,5%
С4Н10 – 0,1-1%
С5Н12 -1%
N2
CO2
H2S
20. Загрязнение воздуха
В наше время происходитактивное загрязнение воздуха
промышленной деятельностью
человека, в частности
автомобильными выхлопами;
заводами, которые выбрасывают
в атмосферу переработанные
вещества.
21. Глобальные экологические проблемы атмосферы
• Парниковый эффект.• Озоновые дыры.
• Кислотные дожди.




















 Химия
Химия