Похожие презентации:
Термодинамика полимеризации
1.
КАФЕДРА ХИМИИ И ТЕХНОЛОГИИ ВЫСОКОМОЛЕКУЛЯРНЫХСОЕДИНЕНИЙ МИТХТ
Курс «СИНТЕЗ ПОЛИМЕРОВ-СПЕЦГЛАВЫ»
Лекция 1. ТЕРМОДИНАМИКА ПОЛИМЕРИЗАЦИИ
Кузнецов Александр Алексеевич
Московский технологический университет
ИСПМ им. Н.С.Ениколопова РАН
1
2.
План лекции•Способность соединений с кратными связями
к полимеризации;
•Предельная температура и предельная концентрация
мономера;
•Факторы, влияющие на ΔН и ΔS (сопряжение, стерические
эффекты, сольватация, комплексообразование,
фазовые превращения );
•Разные сочетания ΔН и ΔS;
•Полимеризация циклических мономеров.
3.
Термодинамические условия, необходимые для образованияполимера из мономера
Свободная энергия вещества
G H TS
ΔG G полимера G мономера H п H м T Sп Sм ΔH T S
Мономер ---> полимер ΔG<0
Предельная температура
Полимеризации Тпр
Полимеризация идет
Мономер полимер ΔG>0 Полимеризация невозможна
Tпр
Мономер ---> полимер ΔG=0
ΔH п
ΔS п
ккал 83,6 кДж
ΔH 2EC-C EC C 2 83 146 20 моль
моль
ΔH
ΔS
ΔG<0
Пример
ΔH<0
ΔS<0
T<Tпр
ММА
ΔH>0
ΔS>0
T>Tпр
S8 (S8)n
ΔH>0
ΔS<0
Нет
-
ΔH<0
ΔS>0
T любая
4.
Способность соединений с кратными связями к полимеризации.Изменение свободной энергии при полимеризации:
5.
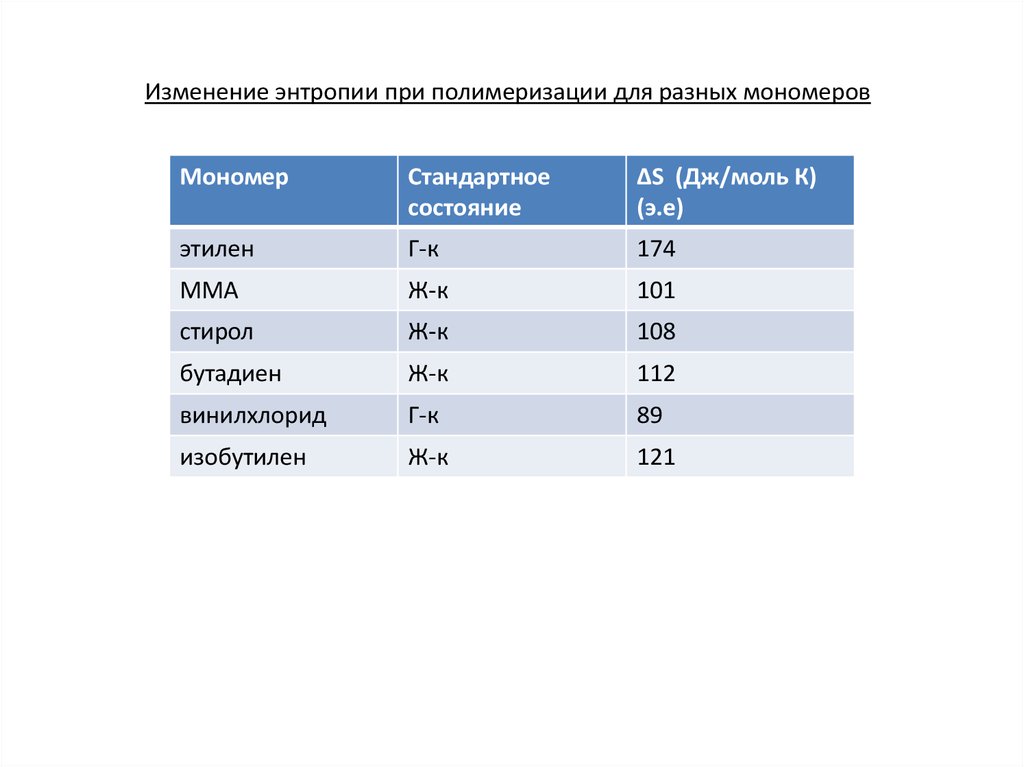
Изменение энтропии при полимеризации для разных мономеровМономер
Стандартное
состояние
ΔS (Дж/моль К)
(э.е)
этилен
Г-к
174
ММА
Ж-к
101
стирол
Ж-к
108
бутадиен
Ж-к
112
винилхлорид
Г-к
89
изобутилен
Ж-к
121
6.
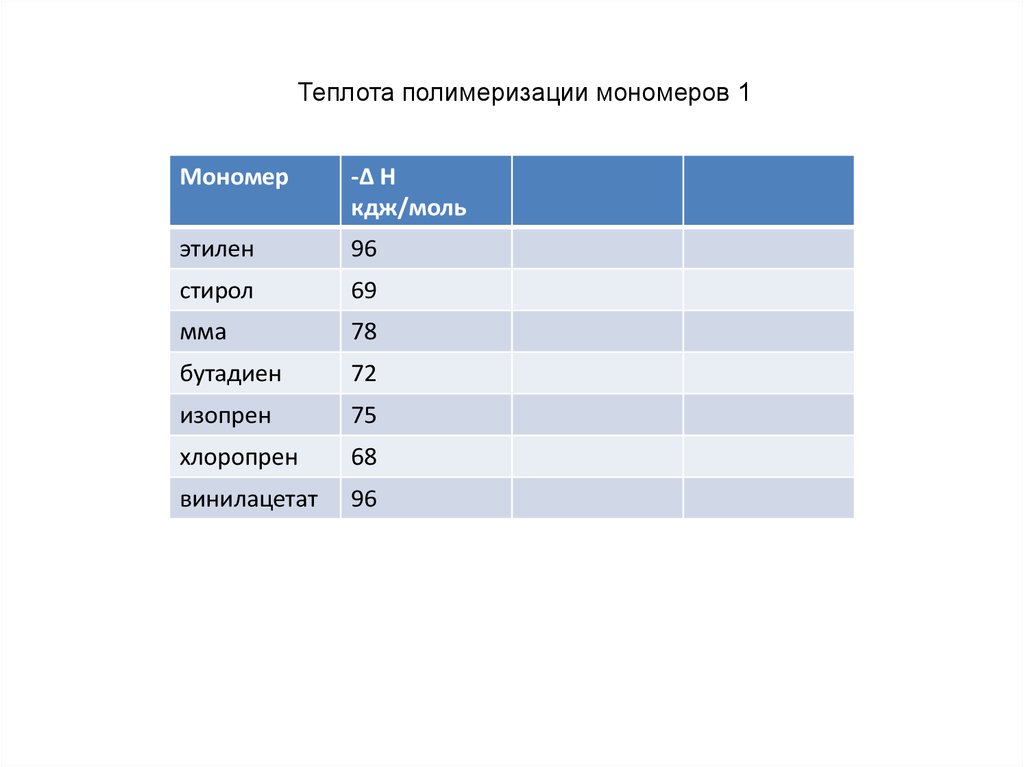
Теплота полимеризации мономеров 1Мономер
-Δ H
кдж/моль
этилен
96
стирол
69
мма
78
бутадиен
72
изопрен
75
хлоропрен
68
винилацетат
96
7.
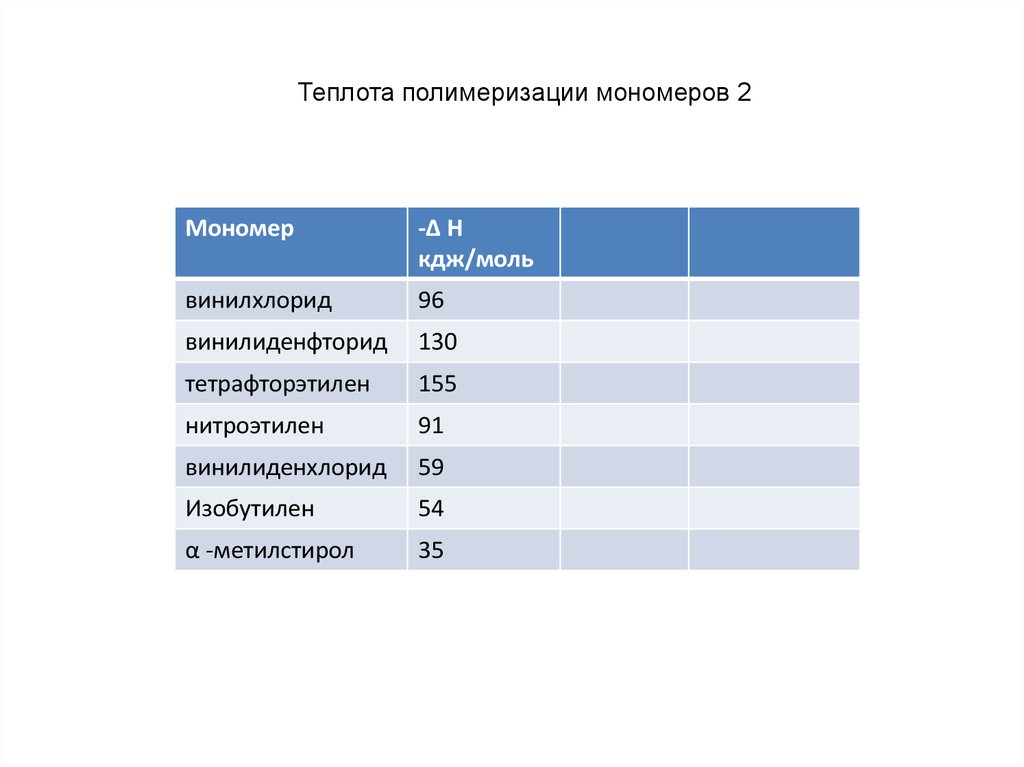
Теплота полимеризации мономеров 2Мономер
-Δ H
кдж/моль
винилхлорид
96
винилиденфторид
130
тетрафторэтилен
155
нитроэтилен
91
винилиденхлорид
59
Изобутилен
54
α -метилстирол
35
8.
Теплота полимеризации мономеров 3Мономер
-Δ H
кдж/моль
метилметакрилат
54
Акриловая к-та
79
Метакриловая кта
59
акриламид
75
метакриламид
54
Ацетальдегид
0 (Tпр=-31̊°
С)
9.
Предельная температура полимеризации:термодинамический подход
10.
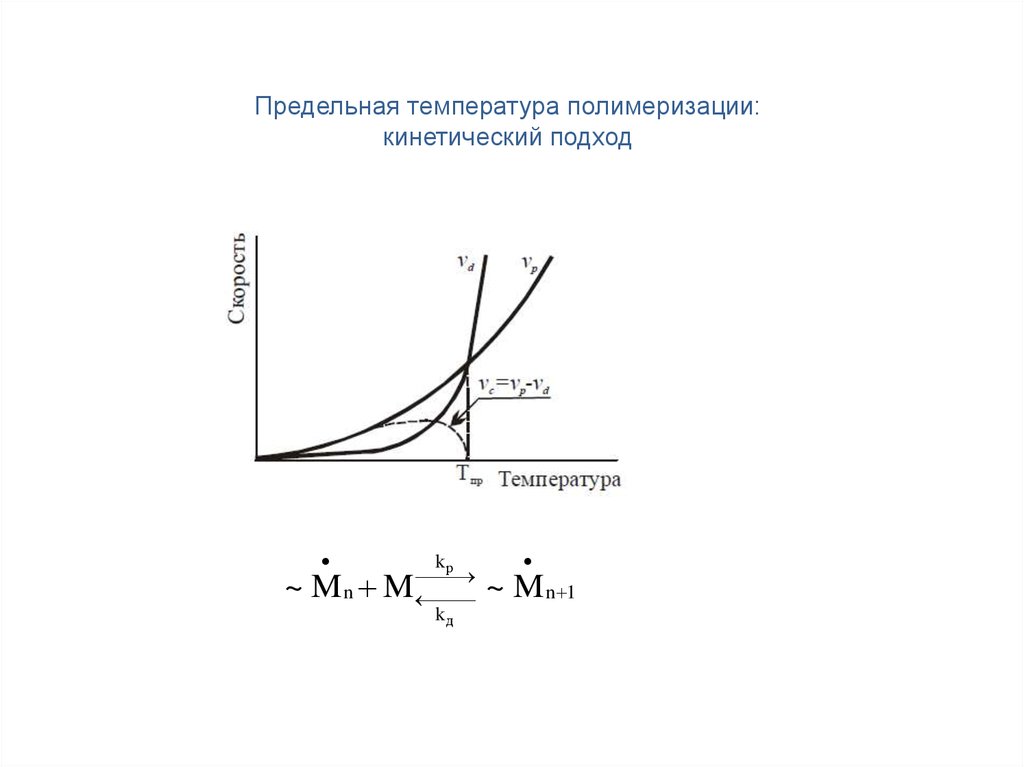
Предельная температура полимеризации:кинетический подход
~ Mn M
kр
kд
~ M n 1
11.
Предельная температура полимеризации:кинетический подход
kр
~ M n M
~ M n 1
kд
Рост цепи
d M
Vр
k р [M n ][M]
dt
Vд k д [ M n ]
Деполимеризация
k р [M n ][M р ] k д [M n ]
k р [M р ] k д
K равн 1 [M р ]
K равн k р k д
k A exp E RT
Уравнение Аррениуса
A р exp E р RT [M р ] A д exp E д RT
Tпр
Eр Eд
Rln (A р [M р ] A д )
ΔH пол
Rln (A р [M р ] A д )
Теория активированного комплекса
A
р
ΔS ΔS ΔS
д
ΔS
kT
exp
h
R
lnA р ln
kT ΔS р
h
R
ΔS R ln A р ln Aд R ln A р Aд
ΔS р R lnA р R ln
Tпр
kT
h
ΔH
ΔS Rln M р
12.
Изменение химического потенциала при полимеризацииРешаемые задачи:
1) определение возможности проведения полимеризации;
2) Поиск условий, позволяющих сдвинуть равновесие.
13.
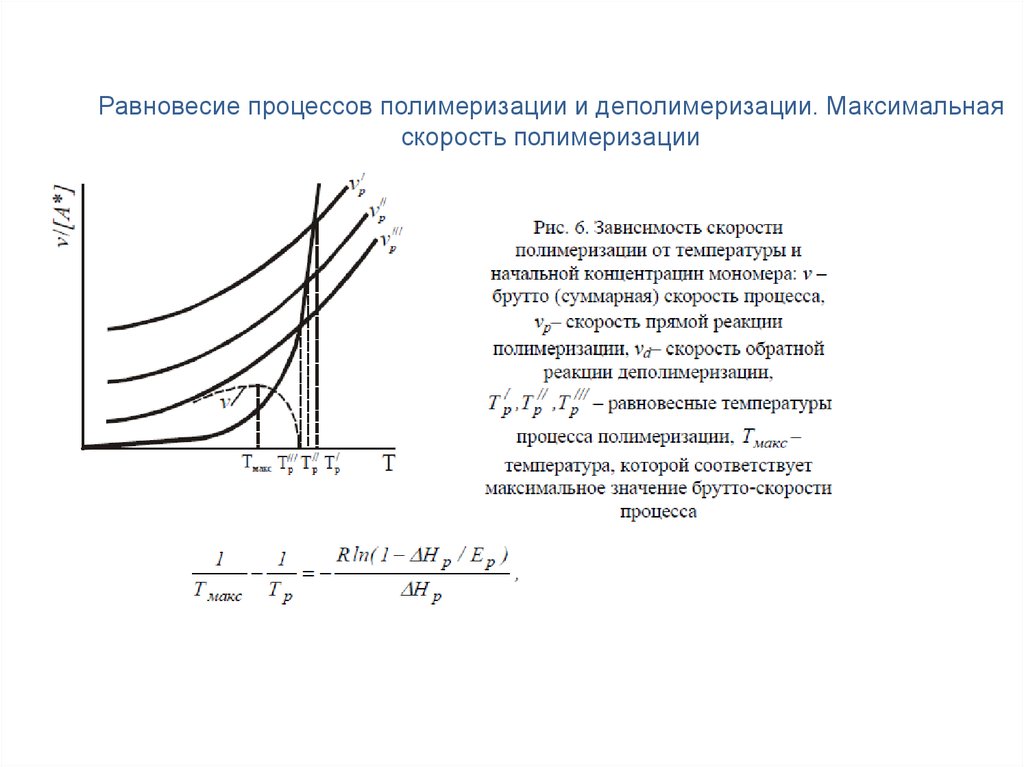
Равновесие процессов полимеризации и деполимеризации. Максимальнаяскорость полимеризации
14.
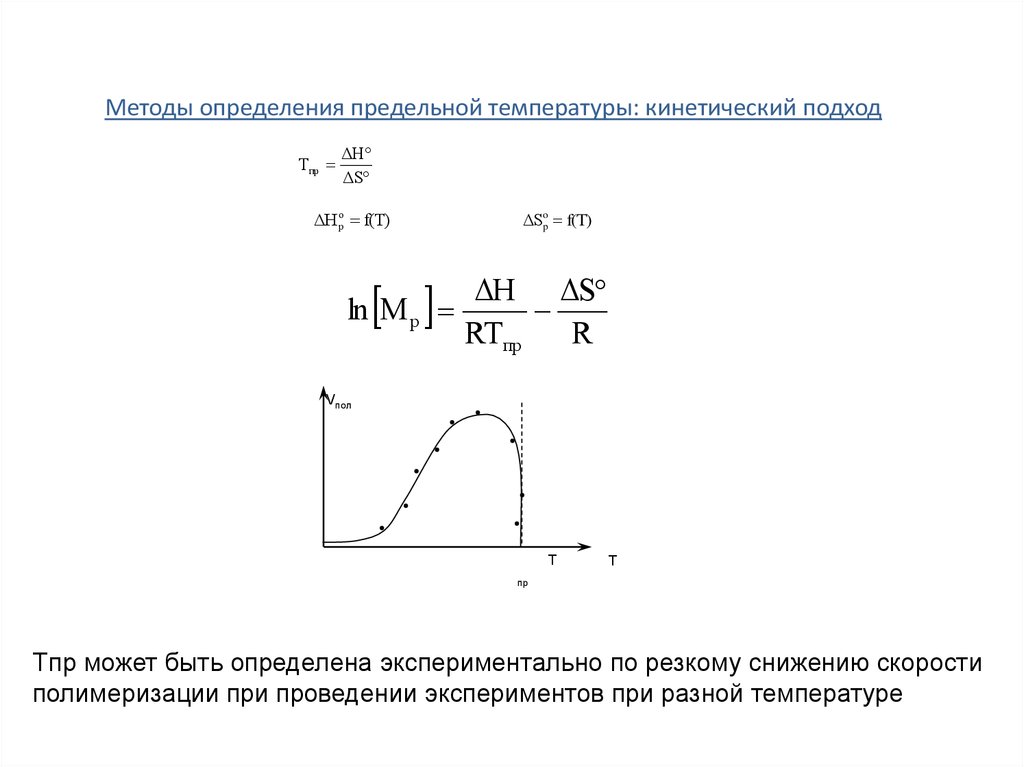
Методы определения предельной температуры: кинетический подходTпр
ΔH
ΔS
ΔH op f(T)
ΔSop f(T)
ΔH ΔS
ln M р
RTпр
R
Vпол
Т
Т
пр
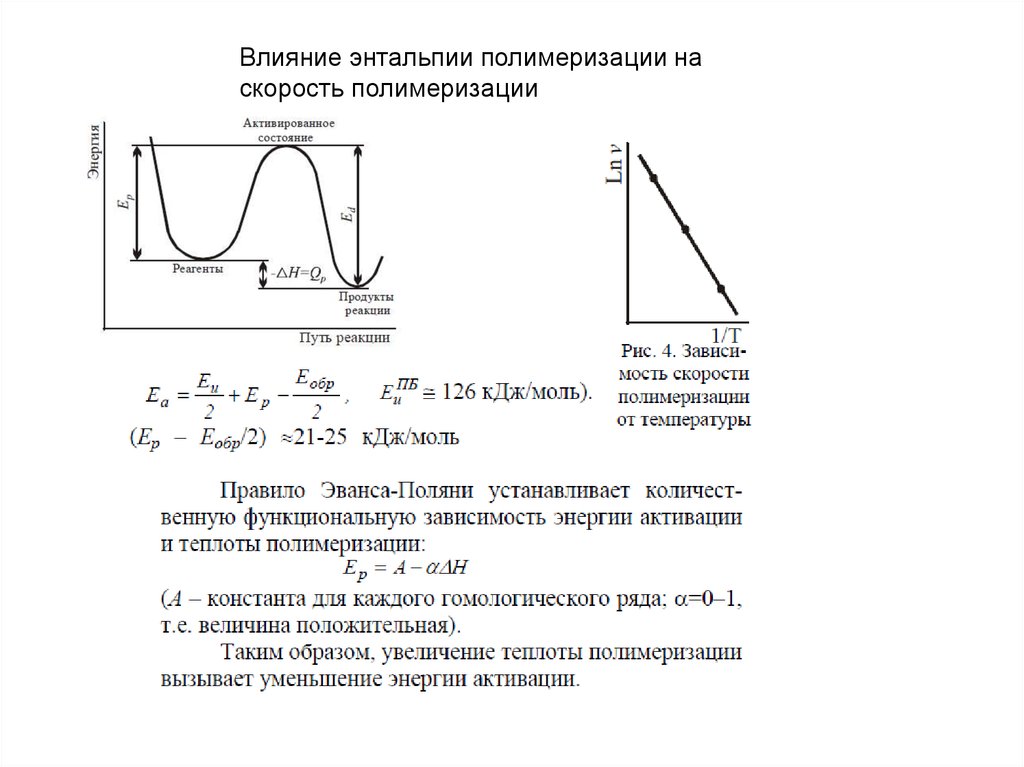
Tпр может быть определена экспериментально по резкому снижению скорости
полимеризации при проведении экспериментов при разной температуре
15.
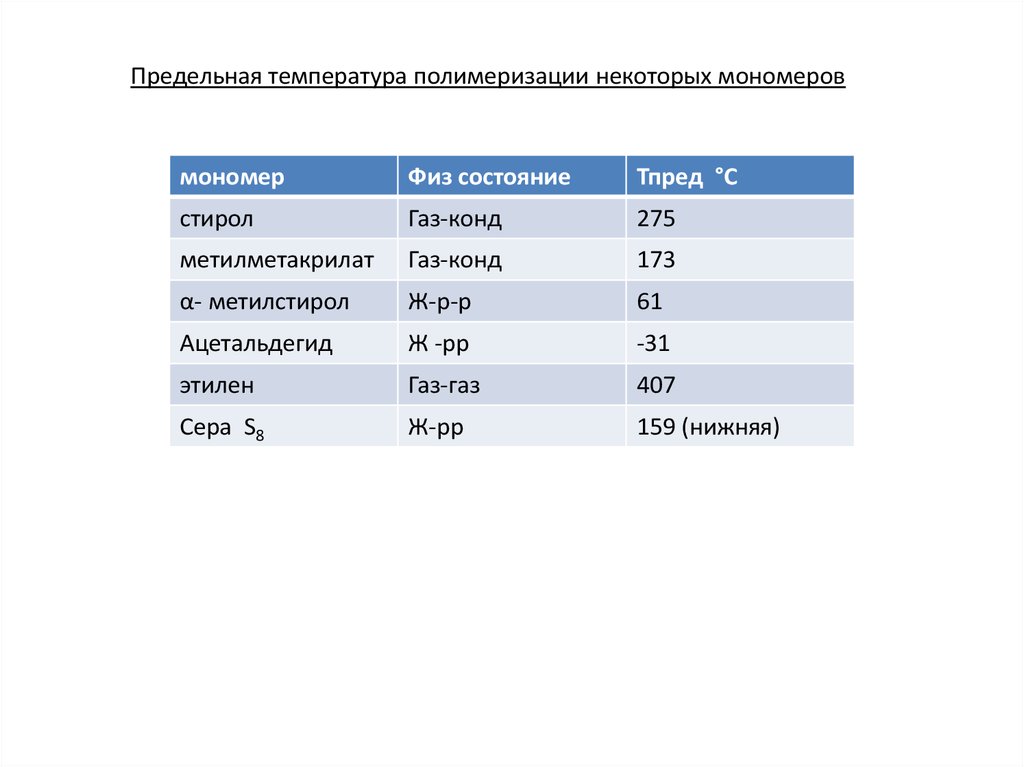
Предельная температура полимеризации некоторых мономеровмономер
Физ состояние
Тпред °С
стирол
Газ-конд
275
метилметакрилат
Газ-конд
173
α- метилстирол
Ж-р-р
61
Ацетальдегид
Ж -рр
-31
этилен
Газ-газ
407
Сера S8
Ж-рр
159 (нижняя)
16.
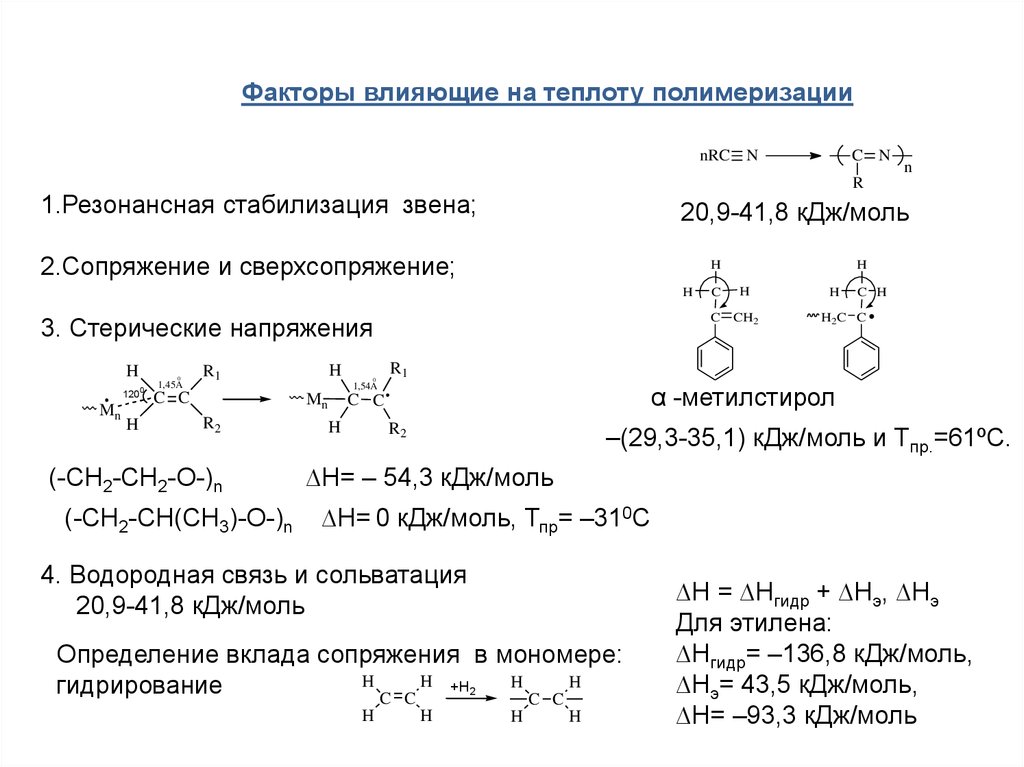
Факторы влияющие на теплоту полимеризацииnRC N
20,9-41,8 кДж/моль
2.Сопряжение и сверхсопряжение;
H
H
3. Стерические напряжения
1200
Mn
H
0
1,45A
H
R1
C C
(-CH2-CH2-O-)n
(-CH2-CH(CH3)-O-)n
C
H
C
CH2
H
C H
H2C C
α -метилстирол
C C
H
H
R1
1,54A
Mn
R2
0
n
R
1.Резонансная стабилизация звена;
H
C N
R2
–(29,3-35,1) кДж/моль и Tпр.=61ºC.
∆H= – 54,3 кДж/моль
∆H= 0 кДж/моль, Тпр= –310С
4. Водородная связь и сольватация
20,9-41,8 кДж/моль
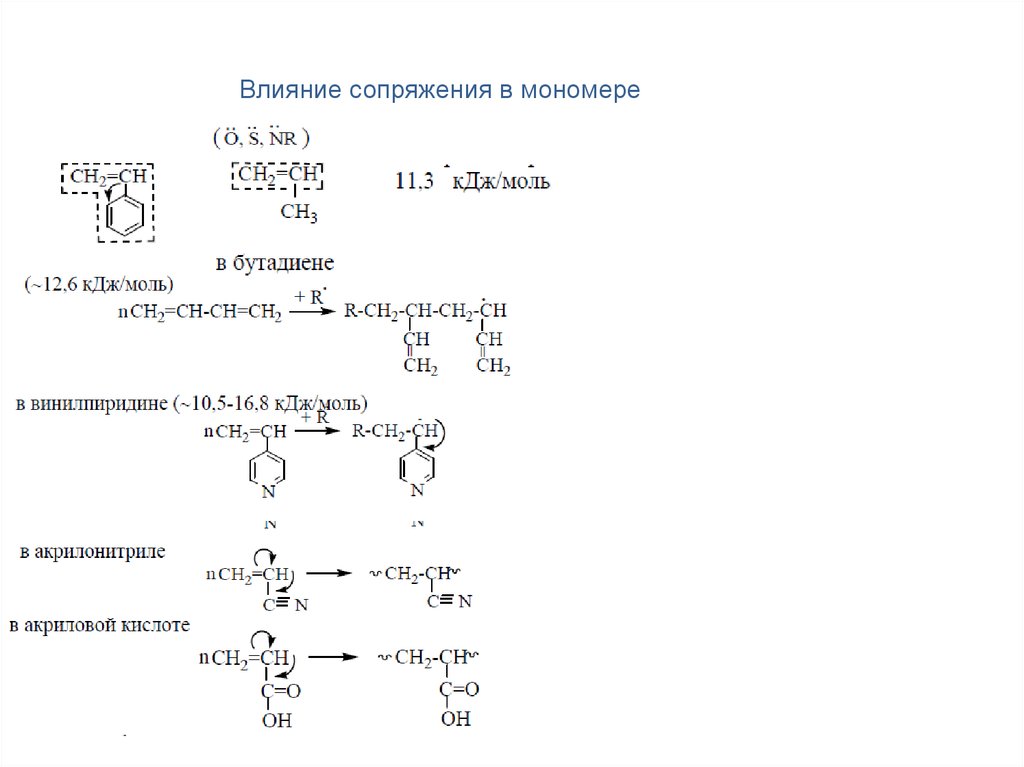
Определение вклада сопряжения в мономере:
H
H +H2
H
H
гидрирование
C C
C C
H
H
H
H
∆H = ∆Hгидр + ∆Hэ, ∆Hэ
Для этилена:
∆Hгидр= –136,8 кДж/моль,
∆Hэ= 43,5 кДж/моль,
∆H= –93,3 кДж/моль
17.
Влияние сопряжения в мономере18.
Влияние структурных факторов на тепловой эффектНаличие альфа-заместителя при двойной связи:
Альфа- алкил
19.
Влияние структурных факторов на тепловой эффектМезомерный эффект +М; -М :
поляризация двойной связи в п-замещенных стиролах
Индуктивный эффект: понижение теплоты
полимеризации за счет более сильной связи в мономере
20.
21.
Влияние комплексообразования мономераПолимеризация пиридина в присутствии ZnCl2
22.
Влияние сольватации мономера и полимера на теплотуполимеризации: снижение теплоты полимеризации за
счет более сильной сольватации мономера
23.
Влияние кристаллизации полимера на возможность протеканияполимеризации
Кристаллизация полимера способствует полимеризации
полиоксиметилен –
высококристаллический полимер
Альфа –
метилстирол:
атактический :
изотактический :
•Выделение полимера в новую фазу
также может смещать равновесие ;
24.
Влияние давления на предельную температуру полимеризациимономер
-ΔV, мл/моль
-ΔН, кДж/моль
ΔV/ΔН, мл/кДж
стирол
19.8
74.3
0.26
ММА
24.5
57.9
0.42
α-метилстирол
14.1
34.0
0.41
Сера S8
6.15 (159°С)
13.3
-0.46
Спл SO2 –гексен-1
66.0
87.0
0.76
формальдегид
14.3 (-30°С)
70.0
0.20
циклогептан
17.8
21.4
0.83
Предельная температура возрастает примерно на 7°С
при увеличении давления на 100 МПа
25.
Полимеризация циклических мономеровполимеризуются напряженные циклические мономеры с
количеством атомов в цикле 3,4,5, 7
Не полимеризуются с количеством атомов 6.
26.
Влияние энтальпии полимеризации наскорость полимеризации
27.
ЧТО ЧИТАТЬ ПО ТЕМЕ :1. Ал.Ал.Берлин,С.А.Вольфсон, Н.С.Ениколопян,
«Кинетика полимеризационных процессов», М.,Химия,1978, 320 с.;
2.Дж.Савада , «Термодинамика полимеризации»
3. Ал.Ал.Берлин,С.А.Вольфсон, «Кинетический метод в синтезе полимеров,
М.Химия,1973,344 с.










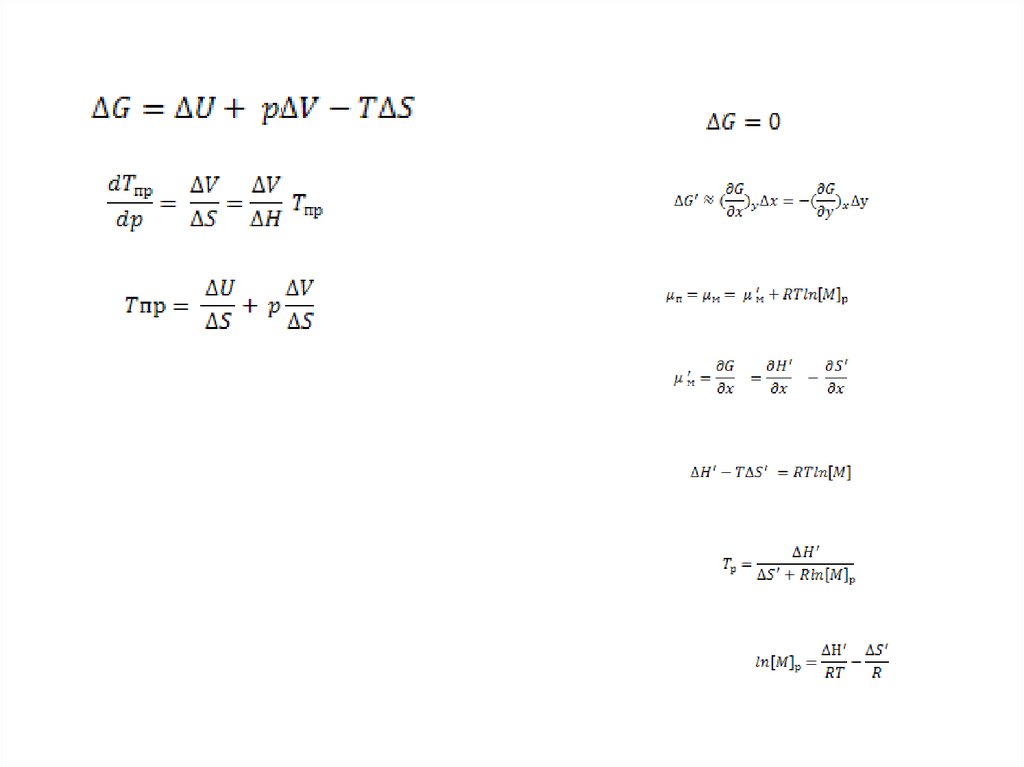






 Химия
Химия








