Похожие презентации:
Растворы ВМС
1. Растворы ВМС
Лекция 18Растворы
ВМС
2.
ПЛАН18.1 Общая
характеристика ВМС
18.2 Набухание и
растворение ВМС
18.3 Полиэлектролиты
18.4 Коллоидная защита
3.
18.1 Высокомолекулярнымисоединениями (ВМС) называют
вещества, имеющие
молекулярную массу от
10 тысяч до нескольких
миллионов.
Длина макромолекулы в
вытянутом состоянии
составляет ~1 000 нм.
4.
К природным ВМС(биополимерам)
относятся крахмал,
целлюлоза, декстраны,
нуклеиновые кислоты,
белки, натуральные
каучуки.
5.
Cинтетическиеполимеры являются
продуктами реакций
полимеризации и
поликонденсации.
6.
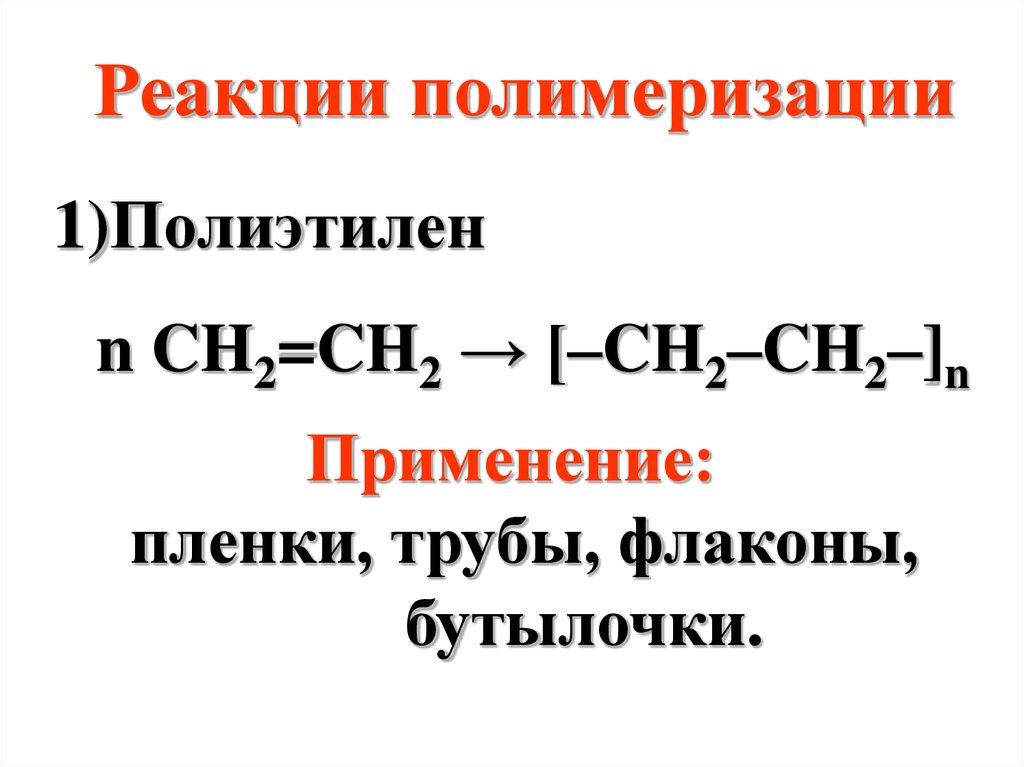
Реакции полимеризации1)Полиэтилен
n CH2=CH2 → [–CH2–CH2–]n
Применение:
пленки, трубы, флаконы,
бутылочки.
7.
2) ТефлонnCF2=CF2 → [–CF2–CF2–]n
Применение:
протезы сердечного клапана
и кровеносных сосудов.
8.
Реакции поликонденсацииНайлон-продукт
поликонденсации адипиновой
кислоты с
гексаметилендиамином;
используется для получения
искусственных волокон и
шовного материала в хирургии.
9.
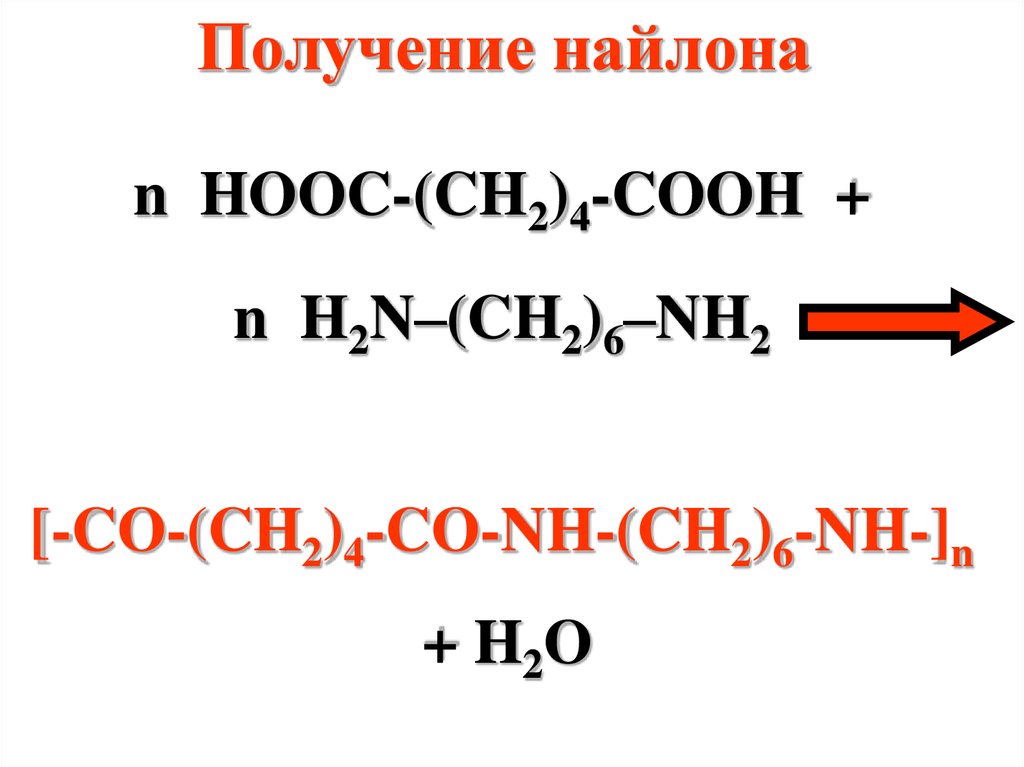
Получение найлонаn HOOC-(CH2)4-COOH +
n H2N–(CH2)6–NH2
[-CO-(CH2)4-CO-NH-(CH2)6-NH-]n
+ H2O
10.
Классификация ВМС1.По конфигурации
цепи
а) линейные
желатин, натуральный каучук
11.
б) разветвленныекрахмал, гликоген
12.
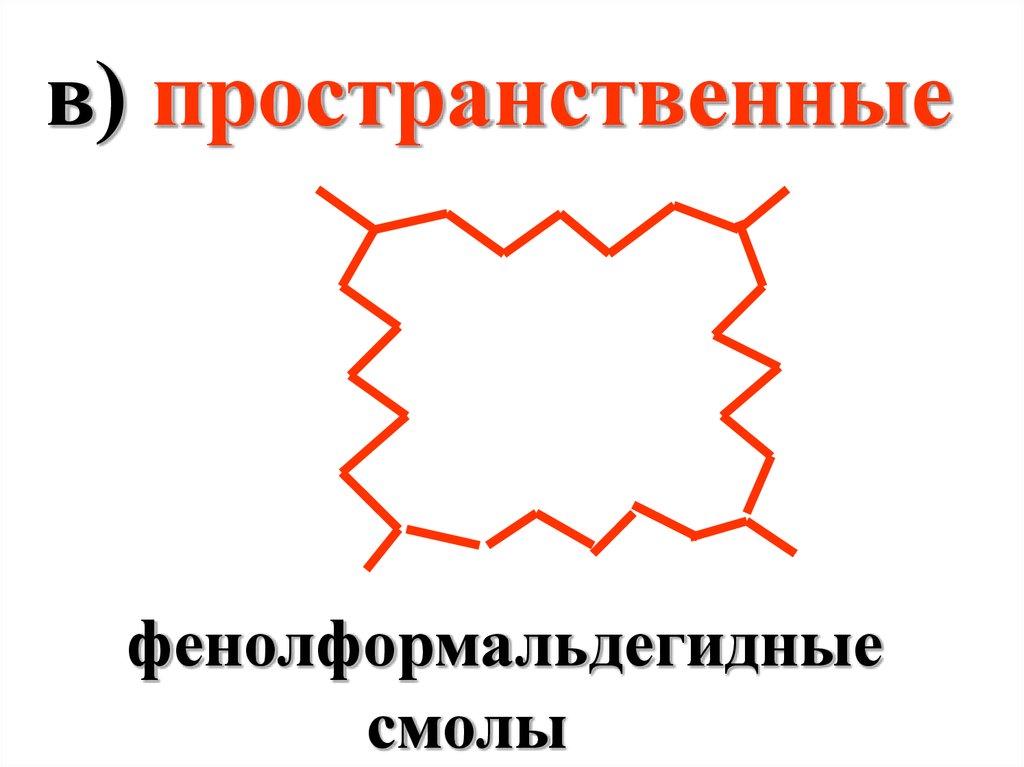
в) пространственныефенолформальдегидные
смолы
13.
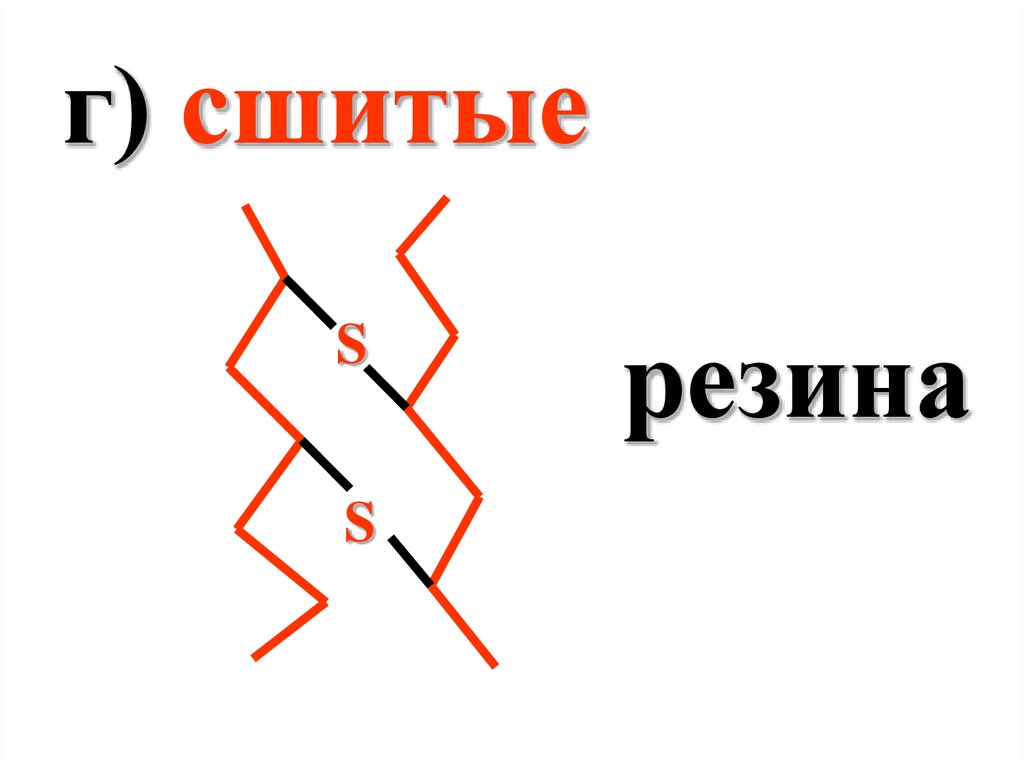
г) сшитыеS
S
резина
14.
2. По элементному составу:•Гомоцепные ВМС
полимерные цепи состоят
только из атомов углерода;
их получают реакцией
полимеризации (тефлон)
15.
• Гетероцепные ВМСсодержат в цепи не только
углерод, но и гетероатомы
(N, S и др.); их получают
реакцией поликонденсации
(найлон).
16.
3. По значению молярноймассы
• Монодисперсные ВМС
состоят из молекул,
имеющих одинаковую
молярную массу
(гемоглобин и др. белки);
17.
• Полидисперсные ВМС состоятиз молекул различной массы
(ДНК, фибриллярные белки,
каучуки). Для них рассчитывается
среднеарифметическая молярная
масса:
Ì
M
n1 M 1 n2 M 2 ...
n1 n2 ...
18.
Специфическимисвойствами полимеров
являются:
•Гибкость цепей,
• Наличие прочных
межмолекулярных связей
19.
18.2ВМС могут
образовывать как
истинные, так и
коллоидные
растворы.
20.
Истинные растворыобразуются при растворении
полярного полимера в
полярном растворителе (белок
в воде) или неполярного
полимера в неполярном
растворителе (каучук в
бензоле).
21.
Растворениюполимеров
предшествует их
набухание.
22.
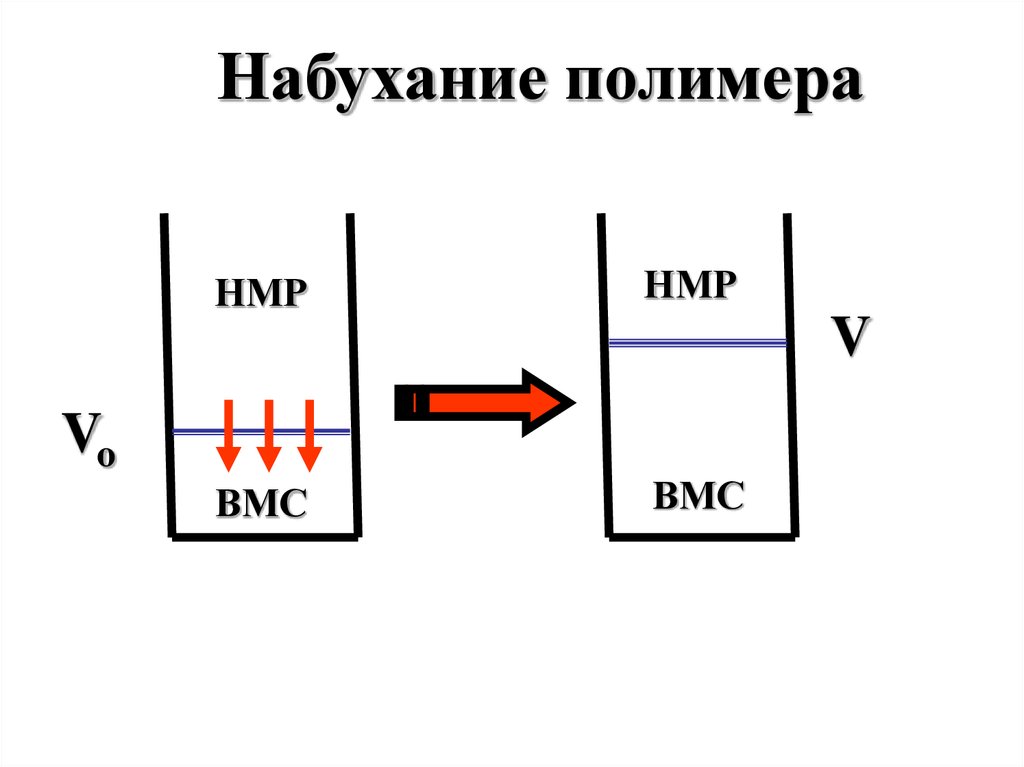
Набухание ВМС– это увеличение объема и
массы полимера вследствие
односторонней диффузии
низкомолекулярного
растворителя в
высокомолекулярное
вещество.
23.
Диффузия молекул ВМСв растворитель не
протекает
из-за их низкой подвижности,
обусловленной большой
молярной массой и наличием
межмолекулярных сил.
24.
Набухание полимераНМР
НМР
V
Vo
ВМС
ВМС
25.
Мерой набухания служит степеньнабухания полимера (α):
α=
V - Vo
Vo
где Vo и V – начальный и
конечный объем полимера
26.
α=m - mo
mo
где mo и m – начальная и
конечная масса полимера
27.
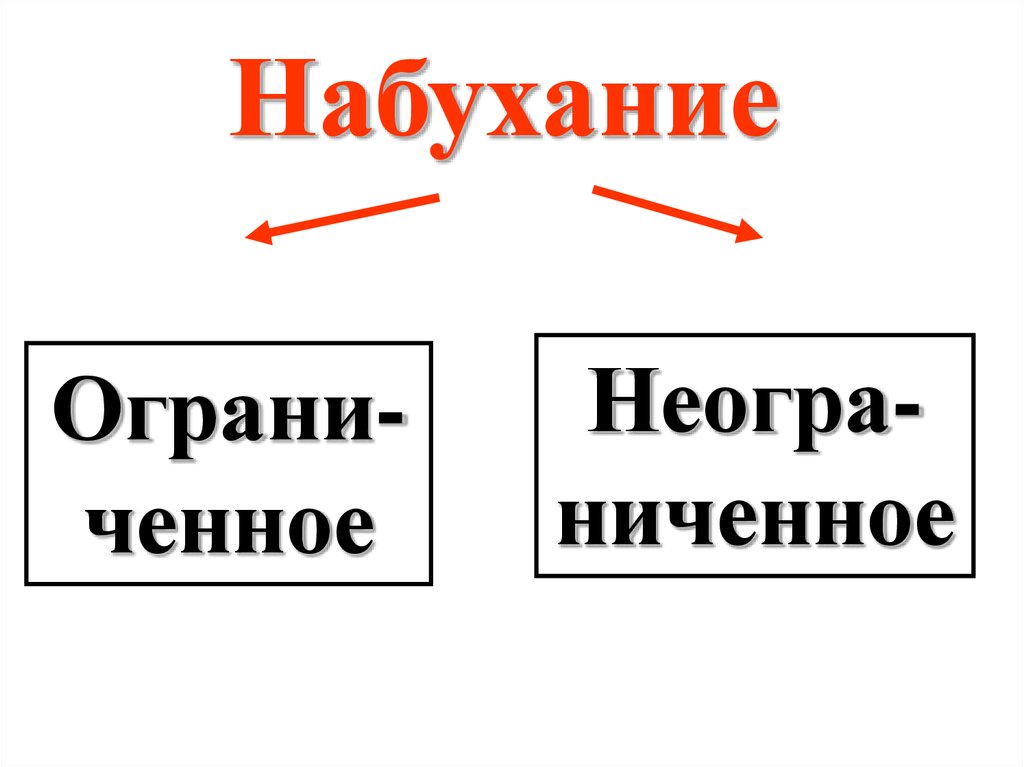
НабуханиеОграниченное
Неограниченное
28.
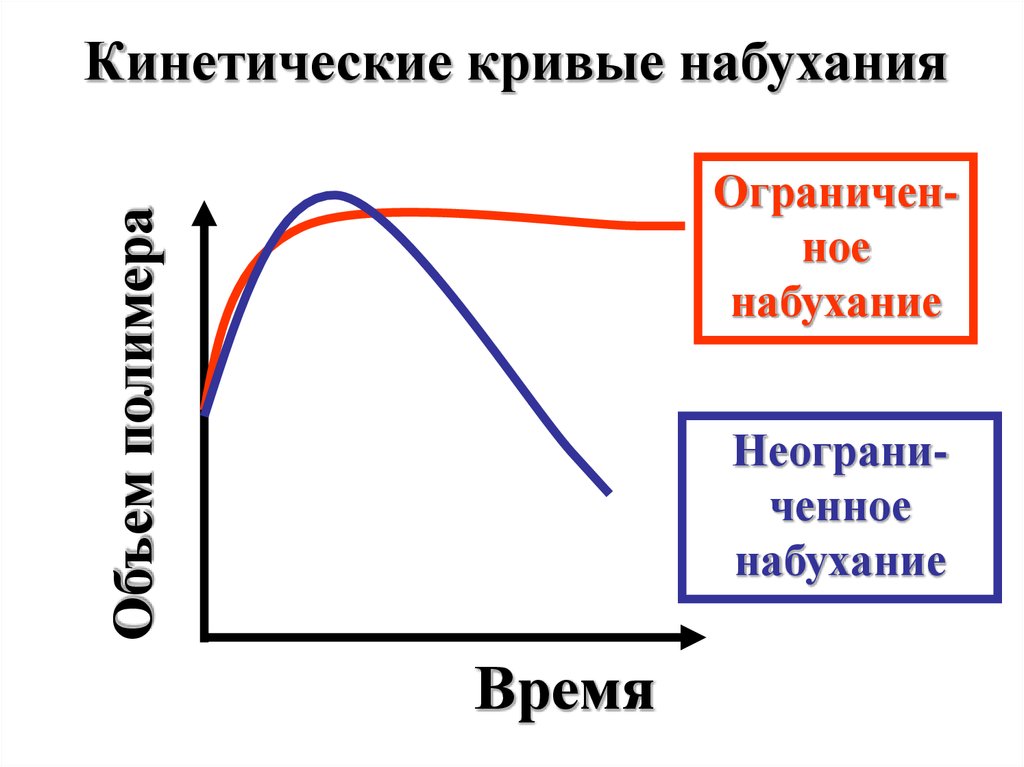
Ограниченное набухание(желатин в холодной воде)
приводит к образованию
геля. Гель –это состояние
вещества, являющееся
промежуточным между
твердым и жидким.
29.
Неограниченноенабухание (желатин
в горячей воде)
завершается
образованием
истинного раствора.
30.
Кинетические кривые набуханияОбъем полимера
Ограниченное
набухание
Неограниченное
набухание
Время
31.
На процесс набуханиявлияет:
1)Природа ВМС и
растворителя:
«Подобное растворяется
в подобном»
32.
2) Конфигурация цепиполимера; линейные и
разветвленные ВМС лучше
набухают, чем
пространственные и сшитые;
3) Кислотность среды
(у амфотерных
полиэлектролитов)
33.
4) Температура:при нагревании
увеличивается степень
набухания, так как
возрастает скорость
диффузии
низкомолекулярного
растворителя в полимер.
34.
В механизмефизиологических
процессов набухание
играет большую роль:
рост организма,
сокращение мышц,
тканевый обмен.
35.
К набуханиюспособны кожа,
ткани мозга,
стекловидное
тело глаза.
36.
Степень набухания меняетсяпри патологических
процессах: ожог, воспаление,
травма.
37.
Старениечеловека
сопровождается
уменьшением
способности
тканей организма
к набуханию.
38.
Растворы ВМС и коллоидныерастворы существенно
отличаются друг от друга,
однако существует и некоторая
общность их свойств,
обусловленная близкими
значениями длины молекул
полимера и диаметра
коллоидных частиц золей.
39.
РастворыВМС
Устойчивы, Не устойчивы,
образуются
образуются
самопроизволь несамопроизно
вольно
Золи
Гомогенные
Микрогетерогенные
40.
Концентрация10-15 %
Концентрация
менее 1%
Устойчивость Устойчивость
обусловлена
обусловлена
эффектом
наличием
сольватации
ДЭС
41.
Набухают и Не набухаютмогут
и не растрастворяться воряются
При боковом
Образуют
освещении да- четкий конус
ют размытый
Тиндаля
конус Тиндаля
42.
18.3 Полиэлектролиты –это ВМС, содержащие
ионогенные группы.
По характеру
ионогенных групп
полимеры делятся на три
вида.
43.
1.Полиэлектролитыкислотного типа
+
– СООН ⇄ – COO + H
– SO3Н ⇄ – SO3 + H+
растворимый крахмал,
гуммиарабик.
44.
2. Полиэлектролитыосновного типа
+
+
–NH2 + H ⇄ – NH3
45.
3. Амфотерныеполиэлектролиты
(полиамфолиты) – это
ВМС, содержащие и
кислотные, и основные
группы.
Важнейшие из них –
белки.
46.
Кислотно-основное равновесиев растворах белков
H2N – R – COOH
+ OH-
+H N – R – COO3
- H 2O
H2N – R – COO
Анионная
форма
+ H+
+H
3N
– R – COOH
Катионная
форма
47.
Особым состоянием белкаявляется его изоэлектрическое
состояние, в котором суммарный
заряд белковой молекулы равен
нулю. Упрощенно можно
считать, что белок существует в
виде биполярного иона:
+H
3
N – R – COO
48.
Изоэлектрическая точка(ИЭТ или pI)– это значение рН
раствора, при котором
полиамфолит находится в
изоэлектрическом состоянии.
Для большинства белков рI
изменяется в диапазоне 4,5-6,0.
49.
В ИЭТ белки имеютспецифические
свойства, что
объясняется особой
конфигурацией их
молекул.
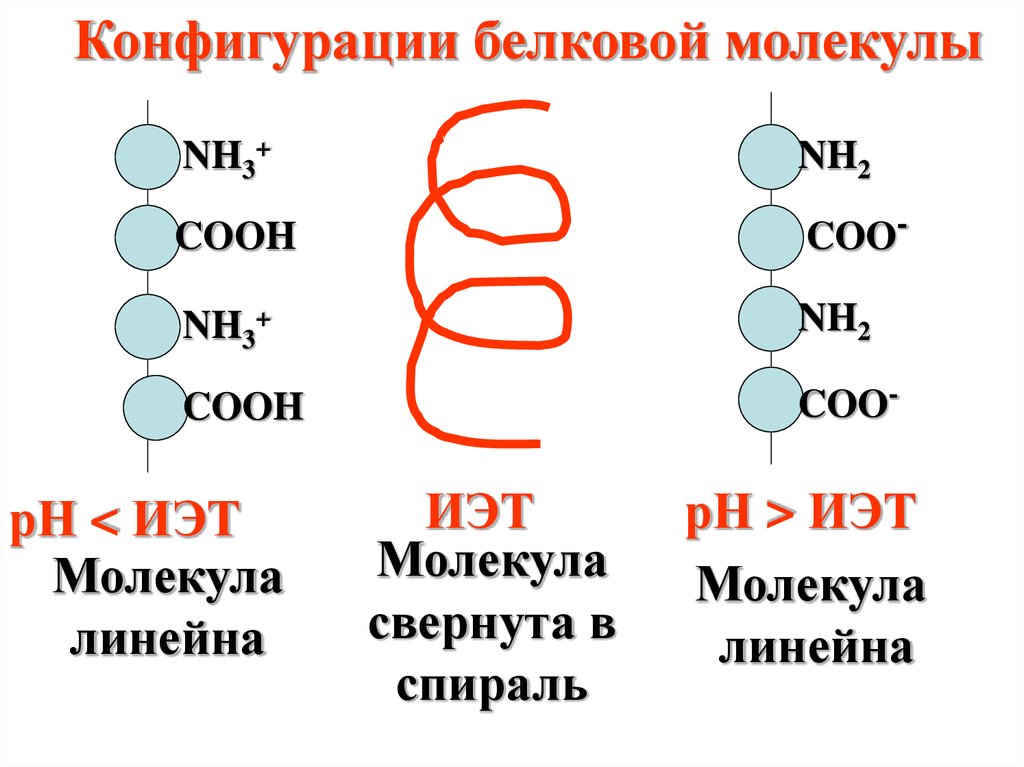
50.
Конфигурации белковой молекулыNH3+
NH2
COOH
COO-
NH3+
NH2
COOH
COO-
рН < ИЭТ
Молекула
линейна
ИЭТ
Молекула
свернута в
спираль
рН > ИЭТ
Молекула
линейна
51.
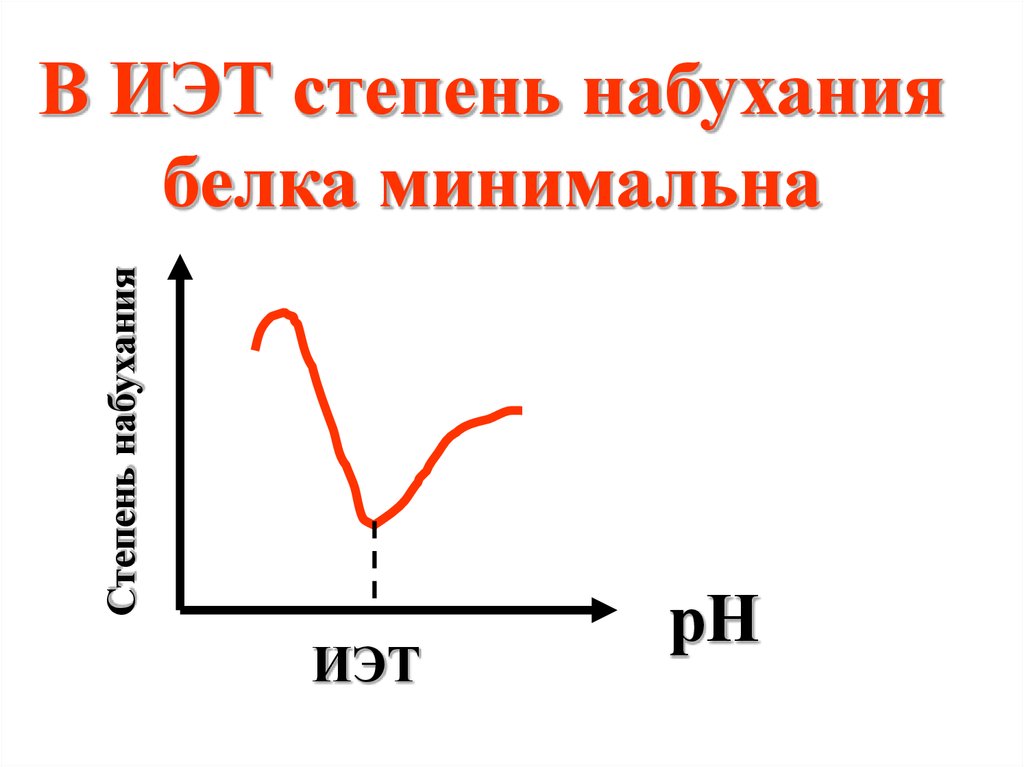
Методы экспериментальногоопределения ИЭТ белков
1) Путем измерения
степени набухания белков
в растворах с различной
кислотностью.
52.
Степень набуханияВ ИЭТ степень набухания
белка минимальна
ИЭТ
рН
53.
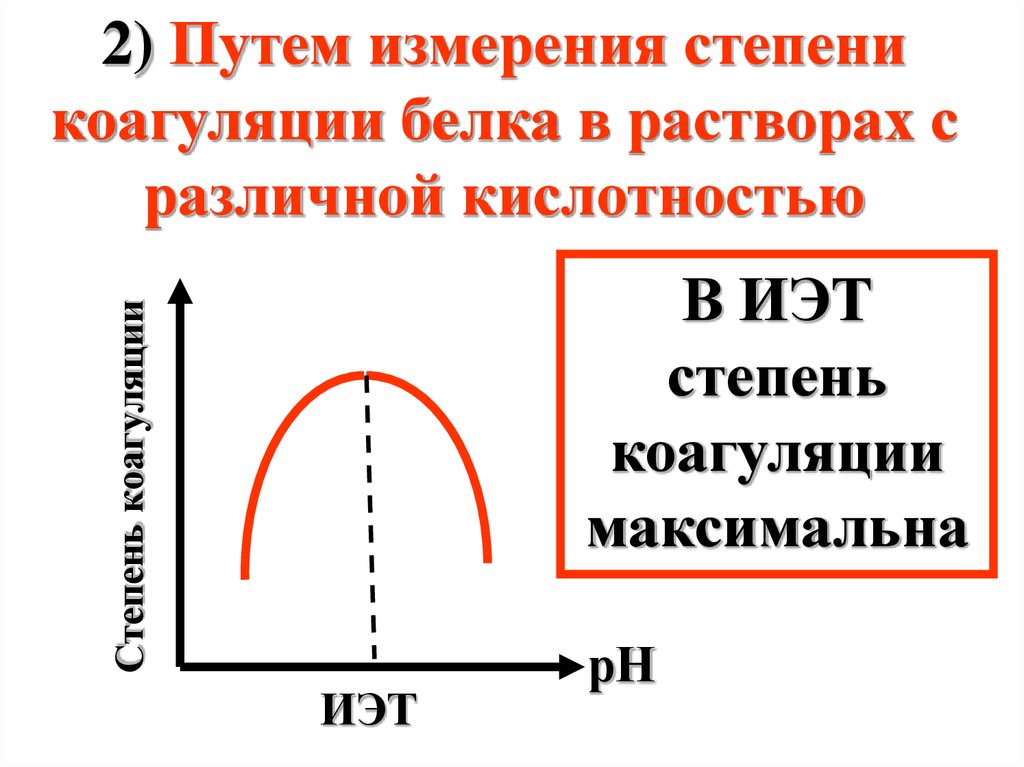
2) Путем измерения степеникоагуляции белка в растворах с
различной кислотностью
Степень коагуляции
В ИЭТ
степень
коагуляции
максимальна
ИЭТ
рН
54.
Важнейшими факторами,вызывающими коагуляцию
белка и других ВМС являются:
• добавление электролитов
(высаливание),
• добавление нерастворителей –
жидкостей, в которых полимер
практически не растворим.
55.
Коагулирующее действие какэлектролитов, так и
нерастворителей обусловлено их
десольватирующем действием;
они связывают молекулы
растворителя, уменьшая тем
самым плотность сольватной
оболочки вокруг молекул ВМС.
56.
3) Путем измеренияэлектрофоретической
подвижности белков (u) в
растворах с различной
кислотностью
В ИЭТ электрофоретическая
подвижность белков равна
нулю, так как их молекулы
электронейтральны.
57.
Кривая электрофоретическойподвижности белков и других
полиамфолитов
К катоду
u
мкм
мин
0
К аноду
ИЭТ
pH
58.
Электрофорезиспользуют не только
для определения ИЭТ,
но и для разделения
смесей белков на
фракции.
59.
18.4 Коллоиднаязащита
- это повышение порога
коагуляции
гидрофобных золей в
присутствии ВМС и
ПАВ.
60.
Механизм защитногодействия
Молекулы ВМС
адсорбируются на поверхности
частиц дисперсной фазы в
результате чего их поверхность
становится лиофильной и
покрывается защитной
сольватной оболочкой.
61.
Мерой защитного действияВМС является «золотое»
число - минимальная масса
(мг) сухого полимера,
необходимая для защиты 10
мл золя золота от
коагуляции при добавлении
1мл 10% раствора NaCl.
62.
Золотые числа некоторыхполимеров (мг)
желатин
гемоглобин
казеин
крахмал
0,008
0,05
0,01
25
63.
Измерение «золотого» числаспинномозговой жидкости
используется как важный
диагностический тест; оно
существенно отличается от
нормы при менингите и
некоторых других
заболеваниях.
64.
Кроме «золотых», дляколичественной оценки
защитного действия ВМС
используют «рубиновые»,
«серебряные»,
«железные» и другие
числа.
65.
Коллоидная защита играетважную роль в
жизнедеятельности организма.
Белки крови стабилизируют
дисперсии жиров, холестерина и
малорастворимых солей кальция,
предупреждая их выделение на
стенках кровеносных сосудов.
66.
При пониженнойзащитной функции
белков возникает
целый ряд
заболеваний: подагра,
атеросклероз, кальциноз,
образование почечных и
печеночных камней.
67.
Способность кровиудерживать в
растворенном состоянии
большое количество
газов (О2 и СО2)
также обусловлена
защитным действием
белков.
68.
В фармацевтическойпромышленности
защитные свойства ВМС
используются для
получения
концентрированных золей
серебра, ртути, золота и их
радиоактивных изотопов.
69.
Например, лекарственныйпрепарат колларгол – это
коллоидный раствор,
содержащий 70%
высокодисперсного
металлического серебра,
стабилизированного
гидролизатами белков.
70.
Благодаримза
внимание!!!




















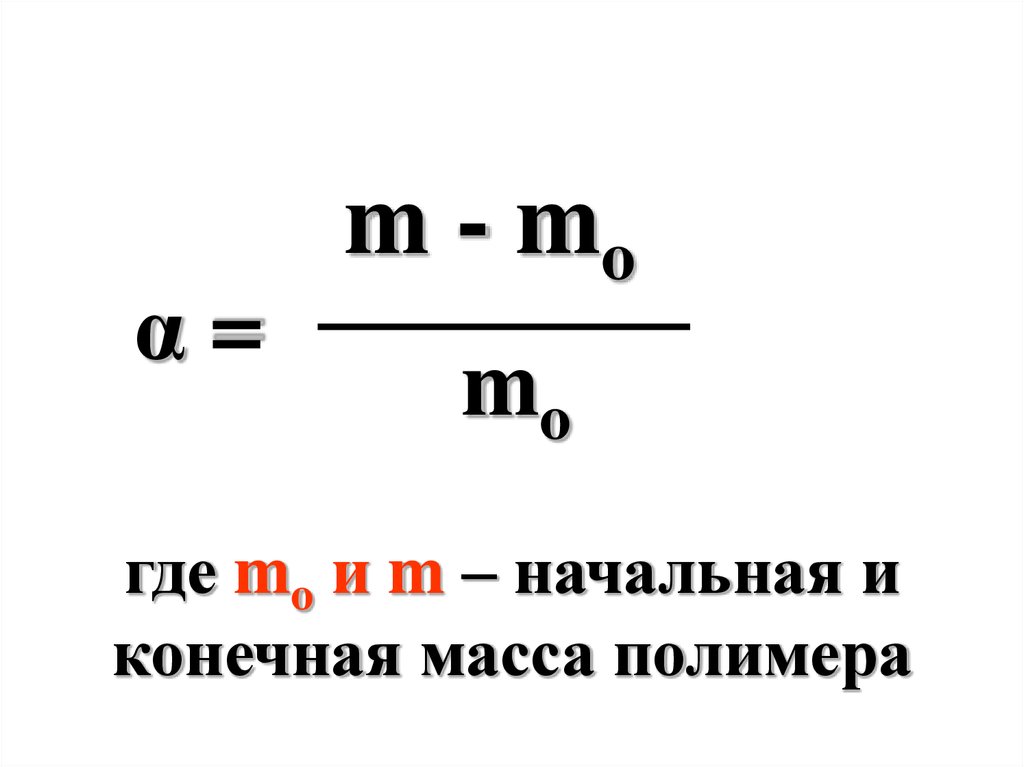







































 Химия
Химия








