Похожие презентации:
Регуляция экспрессии генов у про- и эукариот
1. Лекции № 7-8
Тема: Регуляция экспрессиигенов у про- и эукариот
2. План лекции:
1.2.
3.
Общие принципы и механизмы регуляции активности генов.
Регуляция активности генов у прокариот.
Регуляция активности генов у эукариот.
4. Уровни регуляции активности генов и их
характеристи
3. Регуляция активности прокариотических и эукариотических генов
Механизмы контроля синтеза продуктовгенов носят общее название генной
регуляции.
Продуктами генов (участков ДНК)
являются разные классы РНК: иРНК,
тРНК, рРНК, мРНК и др.
4. Регуляция активности прокариотических и эукариотических генов
Регуляция активностипрокариотических и эукариотических
генов осуществляется на трех уровнях:
Транскрипции,
Трансляции,
Посттрансляционном
уровне.
5. Прокариоты
Регулирующие системы активностигенов у прокариот и эукариот
различаются незначительно.
Прокариоты – это в основном
свободноживущие одноклеточные
организмы, растущие и непрерывно
делящиеся в подходящих условиях
среды при наличии питательных
веществ.
6. Регуляция активности генов у прокариот
Существует два вида транскрипционногоконтроля:
негативный
позитивный.
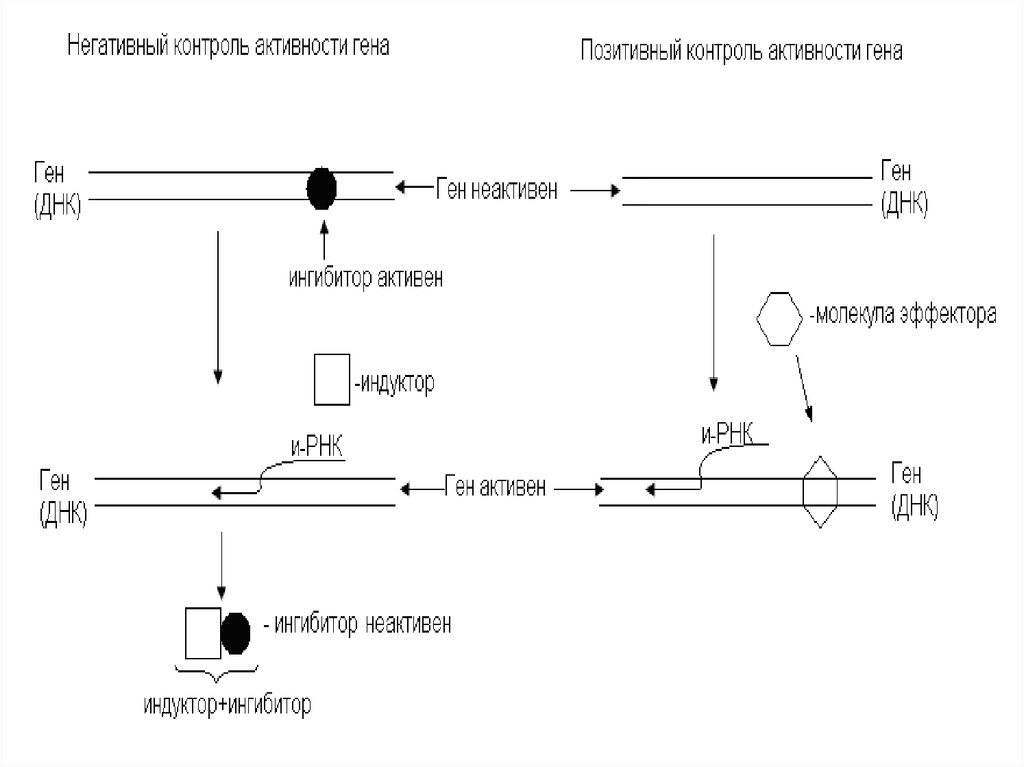
Негативный контроль активности гена основан на
присутствии в клетке специфических факторов
– ингибиторов, прекращающих транскрипцию
гена.
7. Позитивный контроль
В противоположность ингибиторам существуютиндукторы-факторы, способствующие началу
транскрипции.
Синтез фермента называемого индуцируемым,
происходит только тогда, когда в окружающей
клетку среде присутствует специфический
субстрат, называемый индуктором, на который
воздействует данный фермент.
8. Позитивный контроль активности гена
Позитивный контроль активности генаоснован на взаимодействии гена с
молекулами эффекторов (малые
молекулы, белки, сложные
молекулы).
Они:
активируют промотор,
начинают процесс транскрипции.
9.
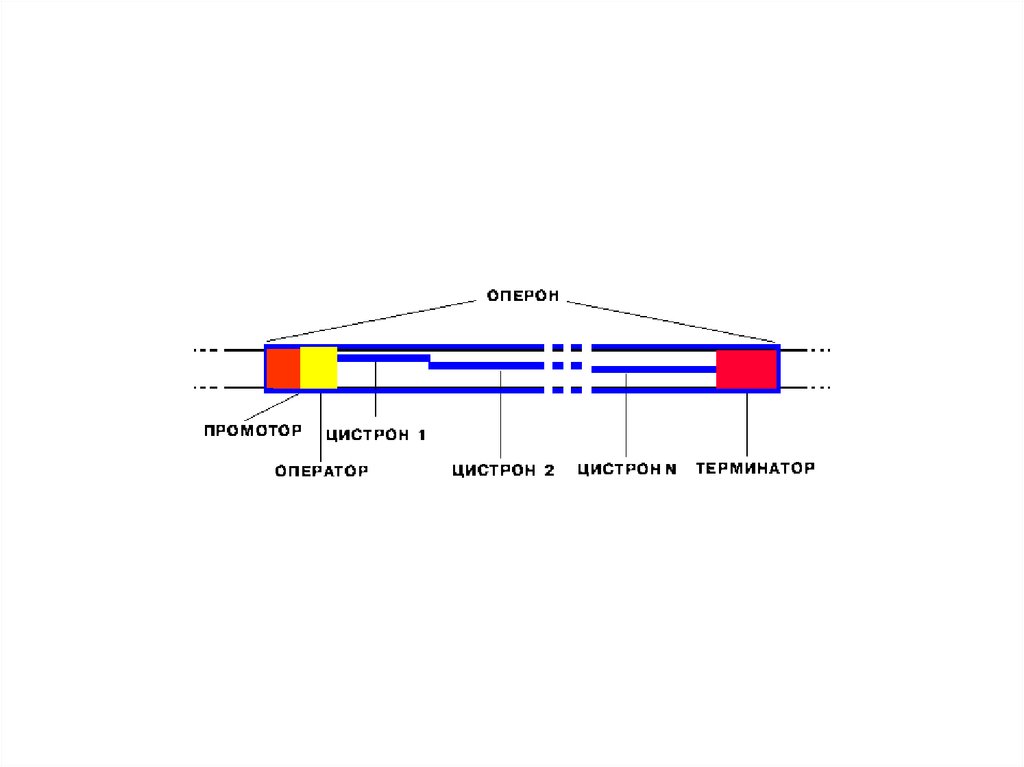
10. Лактозный оперон кишечной палочки
Оперон – это участок бактериальной ДНК,включающий следующие участки ДНК:
промотор (Р),
оператор (О),
структурные гены (в
данном случае
– Z, Y, А)
терминатор (Т).
11.
12.
13.
Организация и функционирование Lac – оперона по Жакобу и Моно14. Позитивный контроль активности гена
Многие бактериальные гены находятся подпозитивным контролем.
Примером позитивного контроля активности
генов является Lac-оперон Е. Соli.
Е. Соli содержит белок, называемый
катаболически активирующий белок (КАБ,
САР), продукт гена crp.
15.
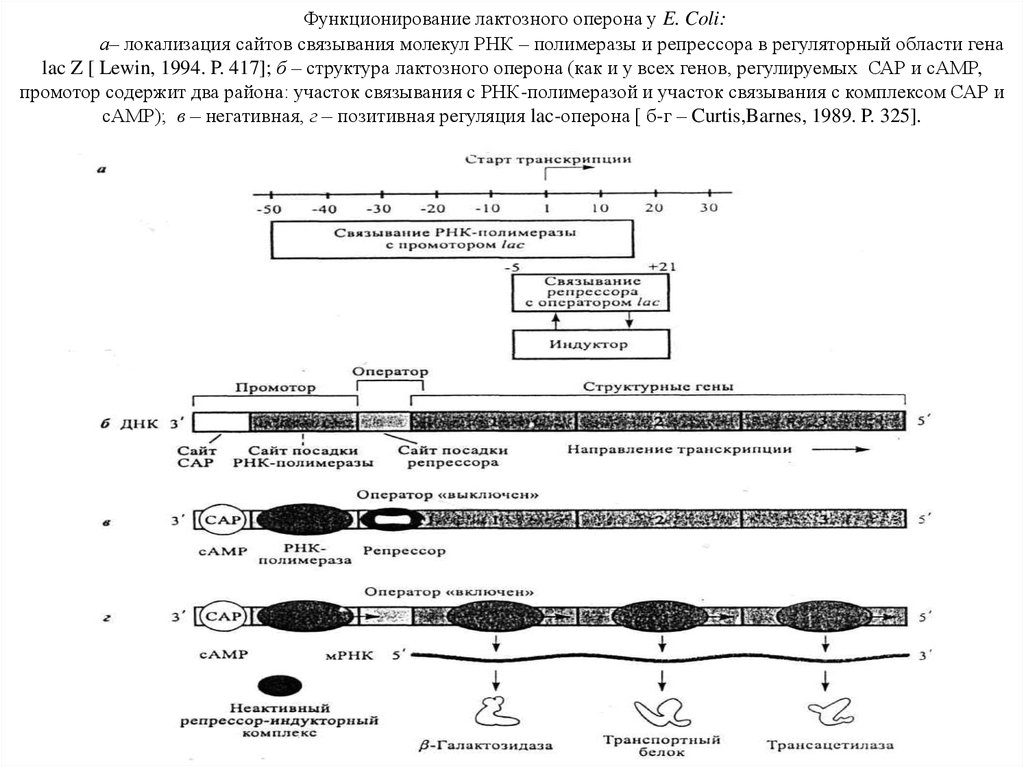
Функционирование лактозного оперона у E. Coli:а– локализация сайтов связывания молекул РНК – полимеразы и репрессора в регуляторный области гена
lac Z [ Lewin, 1994. P. 417]; б – структура лактозного оперона (как и у всех генов, регулируемых САР и сАМР,
промотор содержит два района: участок связывания с РНК-полимеразой и участок связывания с комплексом САР и
сАМР); в – негативная, г – позитивная регуляция lac-оперона [ б-г – Curtis,Barnes, 1989. P. 325].
16.
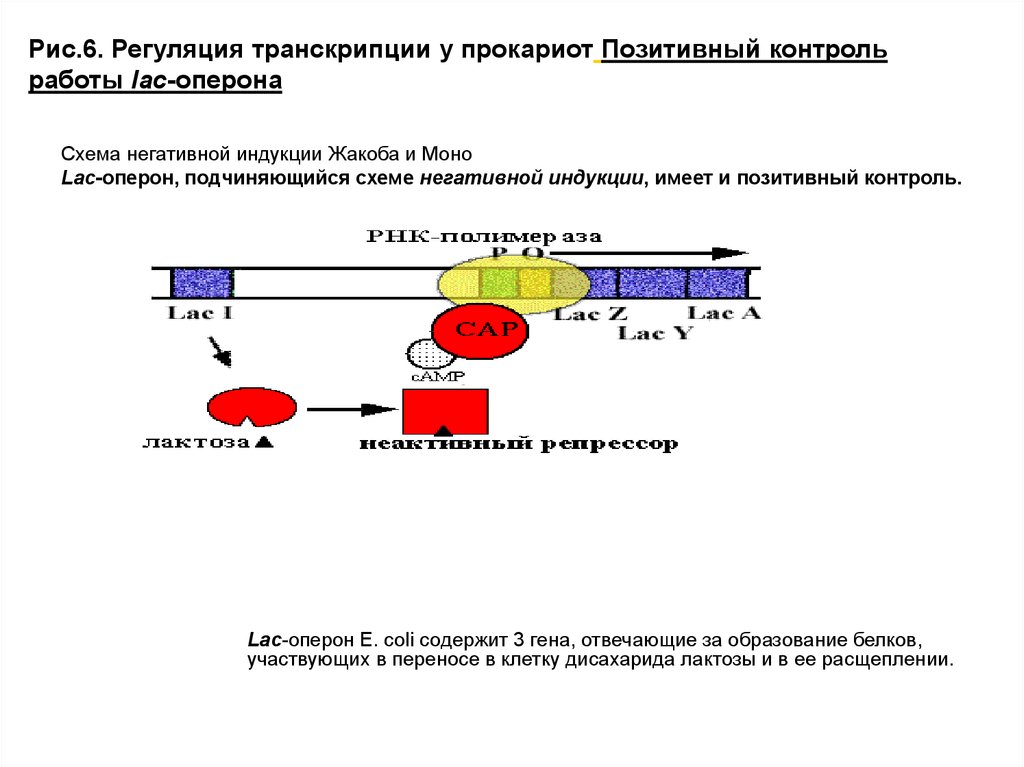
Рис.6. Регуляция транскрипции у прокариот Позитивный контрольработы lac-оперона
Схема негативной индукции Жакоба и Моно
Lac-оперон, подчиняющийся схеме негативной индукции, имеет и позитивный контроль.
Lac-оперон E. coli содержит 3 гена, отвечающие за образование белков,
участвующих в переносе в клетку дисахарида лактозы и в ее расщеплении.
17.
Триптофановый оперонрепрессибельных оперонов
—
пример
В триптофановом опероне, как и в
лактозном, тоже имеется двойной механизм
регуляции. Во-первых, как обычно, регулируется перемещение РНК-полимеразы по
оператору.
Вторым
же
(и
более
чувствительным)
объектом
регуляции
является не связывание РНК-полимеразы с
промотором, а окончание транскрипции на
аттенюаторе.
18.
Рассмотрим систему аттенуации напримере триптофанового оперона E.сoli.
Этот оперон регулируется по схеме
негативной
репрессии.
При недостатке в клетке триптофана
оперон
открыт.
При
увеличении
концентрации
триптофана
РНКполимераза не доходит даже до первого
цистрона.
19.
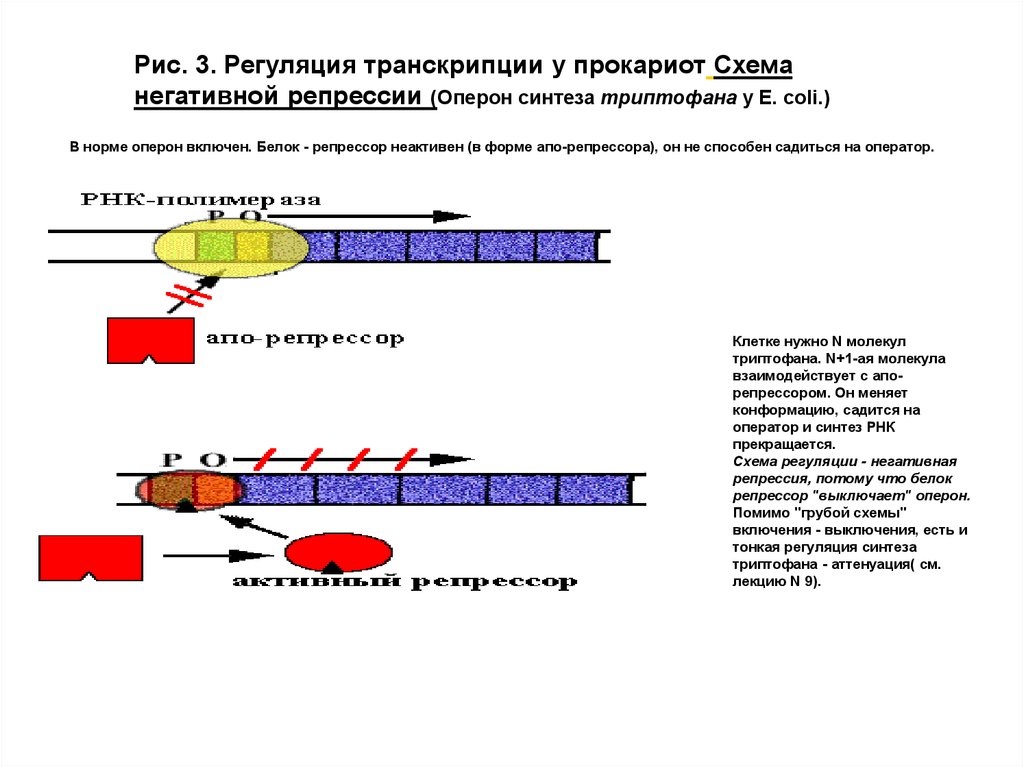
Рис. 3. Регуляция транскрипции у прокариот Схеманегативной репрессии (Оперон синтеза триптофана у E. сoli.)
В норме оперон включен. Белок - репрессор неактивен (в форме апо-репрессора), он не способен садиться на оператор.
Клетке нужно N молекул
триптофана. N+1-ая молекула
взаимодействует с апорепрессором. Он меняет
конформацию, садится на
оператор и синтез РНК
прекращается.
Схема регуляции - негативная
репрессия, потому что белок
репрессор "выключает" оперон.
Помимо "грубой схемы"
включения - выключения, есть и
тонкая регуляция синтеза
триптофана - аттенуация( см.
лекцию N 9).
20.
Напомним:аттенюатор
—
это
присутствующий в некоторых оперонах
участок ДНК между оператором и генами,
на котором при определенных условиях
прекращается транскрипция оперона.
Как
правило,
опероны,
имеющие
аттенюатор, являются репрессибельными и
контролируют синтез (анаболизм) того или
иного необходимого компонента —
например,
редкой
аминокислоты:
триптофана, гистидина, фенилаланина.
21.
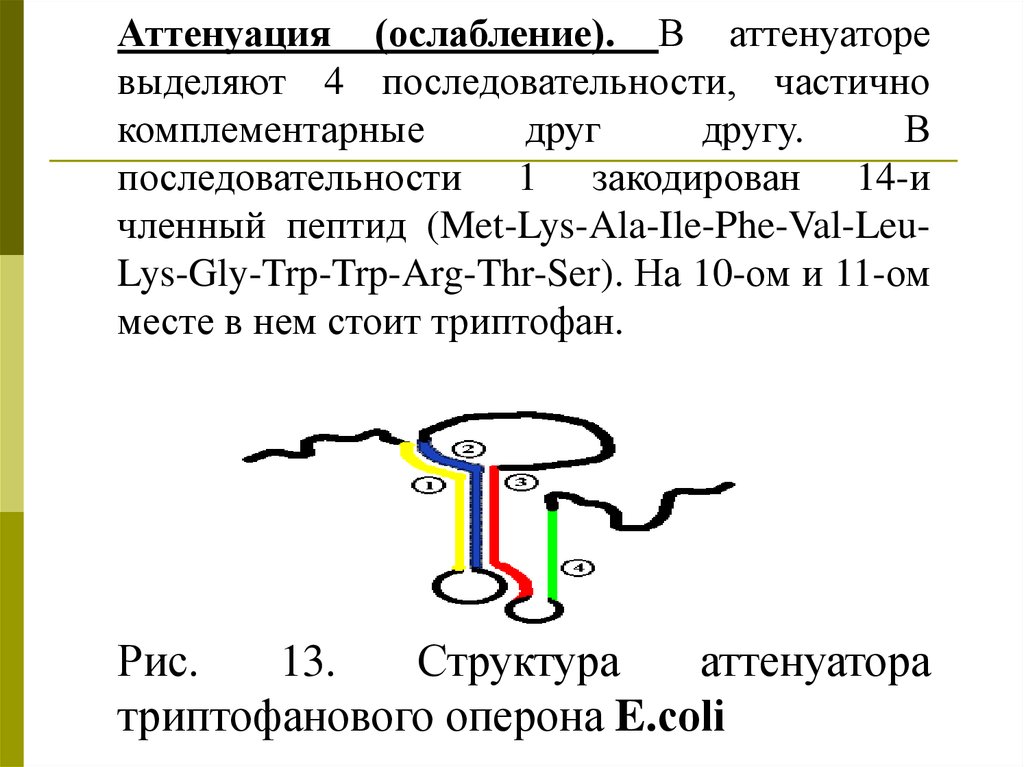
Аттенуация (ослабление). В аттенуаторевыделяют 4 последовательности, частично
комплементарные
друг
другу.
В
последовательности 1 закодирован 14-и
членный пептид (Met-Lys-Ala-Ile-Phe-Val-LeuLys-Gly-Trp-Trp-Arg-Thr-Ser). На 10-ом и 11-ом
месте в нем стоит триптофан.
Рис.
13.
Структура
аттенуатора
триптофанового оперона E.сoli
22.
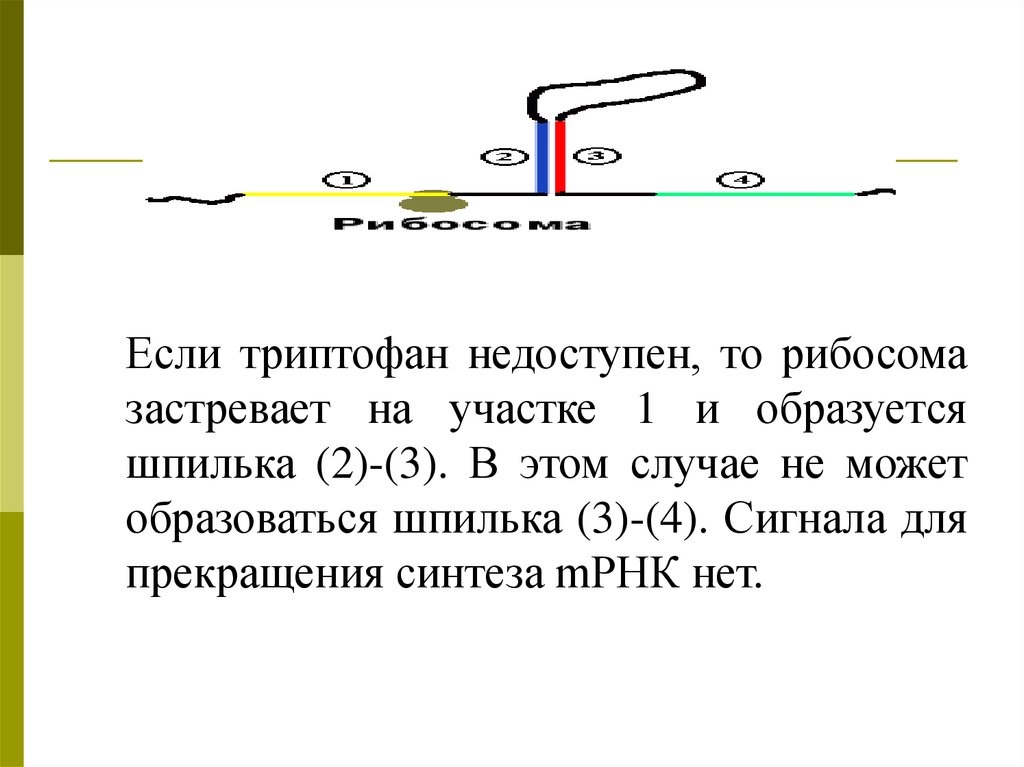
Если триптофан недоступен, то рибосомазастревает на участке 1 и образуется
шпилька (2)-(3). В этом случае не может
образоваться шпилька (3)-(4). Сигнала для
прекращения синтеза mРНК нет.
23.
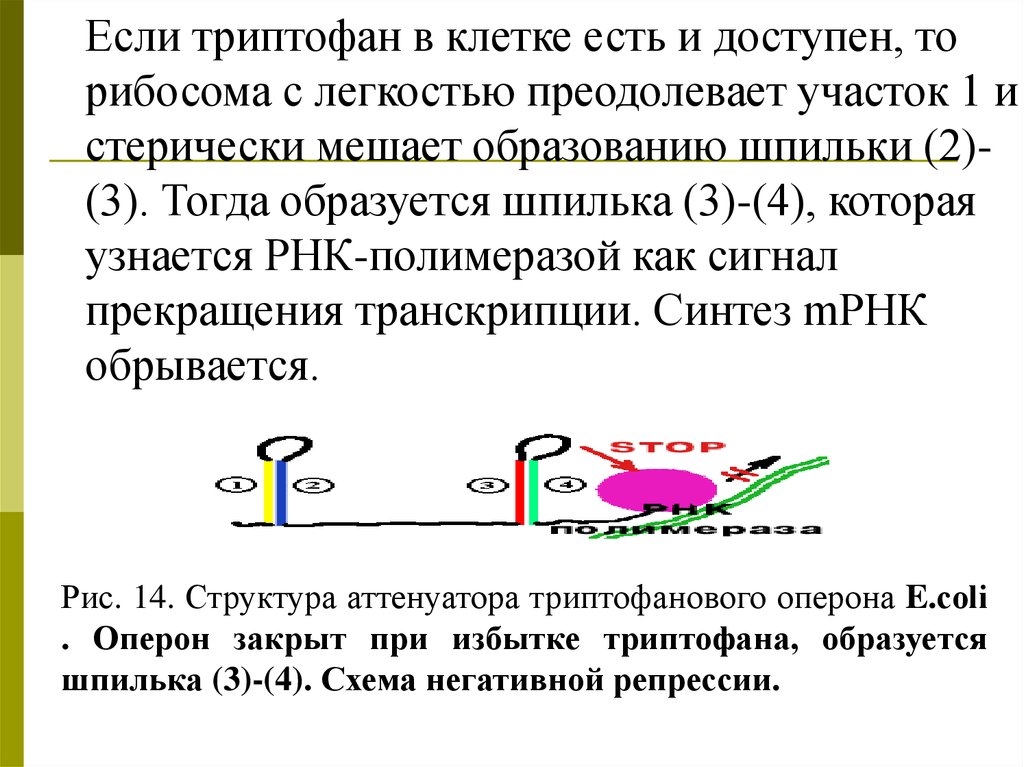
Если триптофан в клетке есть и доступен, торибосома с легкостью преодолевает участок 1 и
стерически мешает образованию шпильки (2)(3). Тогда образуется шпилька (3)-(4), которая
узнается РНК-полимеразой как сигнал
прекращения транскрипции. Синтез mРНК
обрывается.
Рис. 14. Структура аттенуатора триптофанового оперона E.сoli
. Оперон закрыт при избытке триптофана, образуется
шпилька (3)-(4). Схема негативной репрессии.
24.
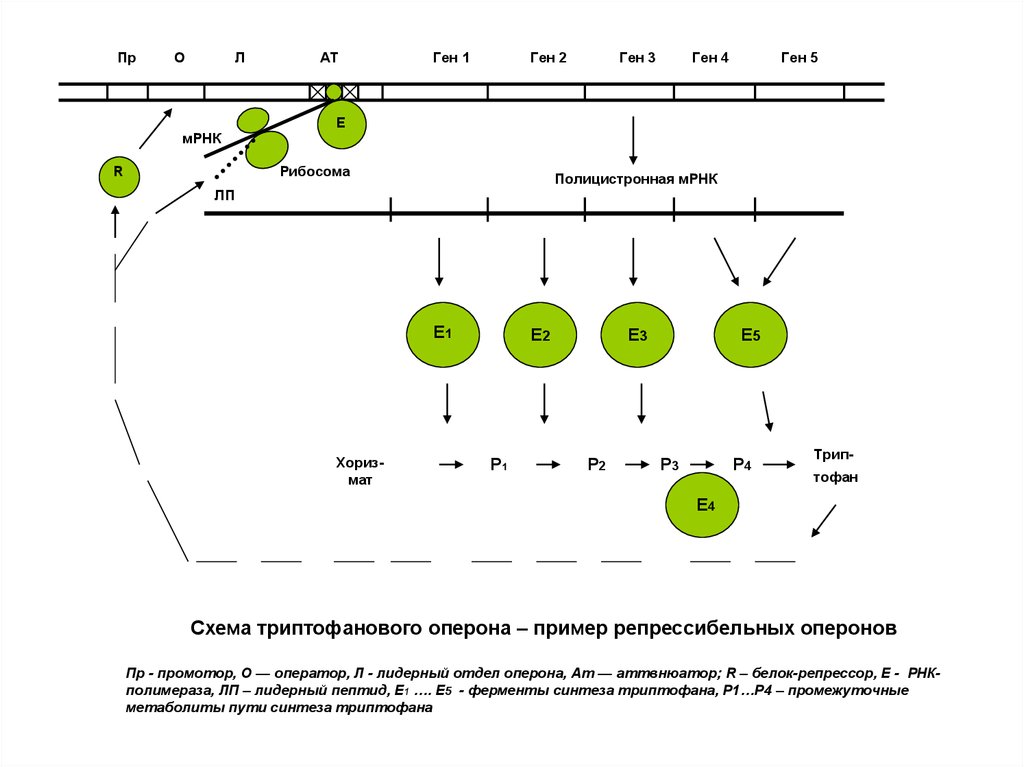
ПрО
Л
АТ
Ген 1
Ген 2
Ген 3
Ген 4
Ген 5
E
мРНК
Рибосома
R
Полицистронная мРНК
ЛП
E1
Хоризмат
E2
Р1
E3
Р2
E5
Р3
Р4
Трип-
тофан
Е4
Схема триптофанового оперона – пример репрессибельных оперонов
Пр - промотор, О — оператор, Л - лидерный отдел оперона, Ат — аттвнюатор; R – белок-репрессор, Е - РНКполимераза, ЛП – лидерный пептид, Е1 …. E5 - ферменты синтеза триптофана, Р1…Р4 – промежуточные
метаболиты пути синтеза триптофана
25.
Между оператором и первымцистроном есть протяженный
участок (162 п.н.), который
содержит последовательность
Шайна-Дальгарно.
Она
расположена ближе к цистрону,
все остальное же представляет
собой аттенуатор.
26.
В этом районе происходитпрекращение транскрипции и
отсоединение РНК-полимеразы
от ДНК. Это сделано для того,
чтобы
остановить
РНКполимеразу, которая уже в пути, в
том случае, если концентрация
триптофана в клетке к этому
моменту повысилась.
27.
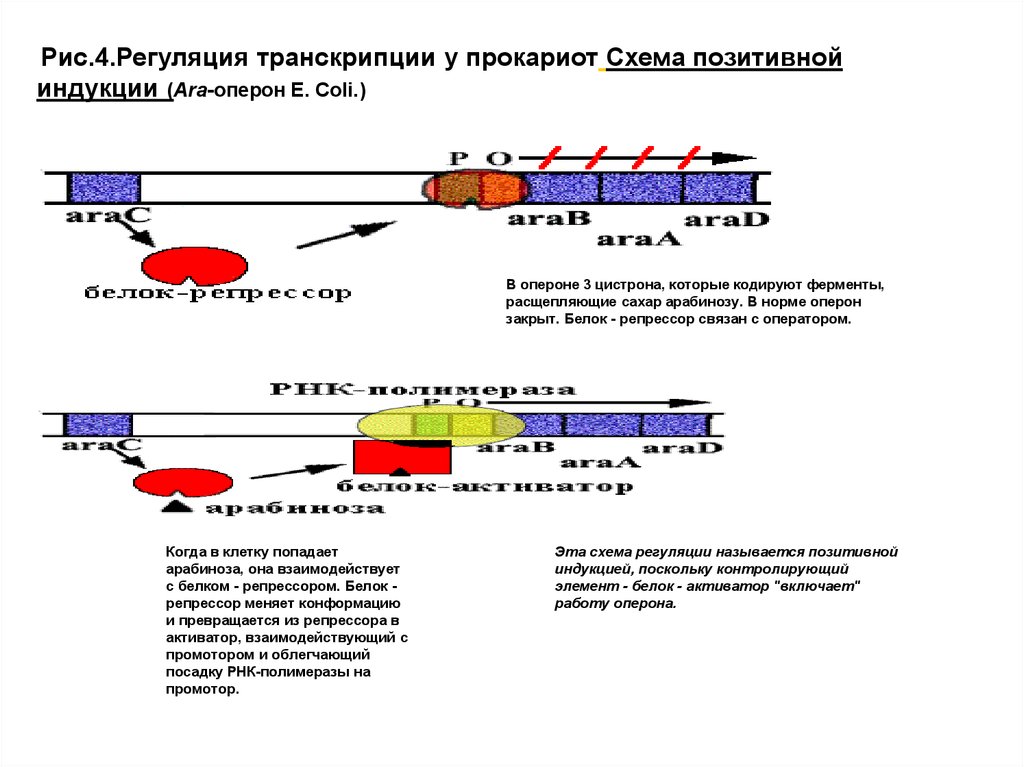
Рис.4.Регуляция транскрипции у прокариот Схема позитивнойиндукции (Аra-оперон E. Сoli.)
В опероне 3 цистрона, которые кодируют ферменты,
расщепляющие сахар арабинозу. В норме оперон
закрыт. Белок - репрессор связан с оператором.
Когда в клетку попадает
арабиноза, она взаимодействует
с белком - репрессором. Белок репрессор меняет конформацию
и превращается из репрессора в
активатор, взаимодействующий с
промотором и облегчающий
посадку РНК-полимеразы на
промотор.
Эта схема регуляции называется позитивной
индукцией, поскольку контролирующий
элемент - белок - активатор "включает"
работу оперона.
28.
Оперон для факторов инициации репликации,транскрипции и трансляции
Рис. 16.Оперон для факторов инициации репликации, транскрипции и трансляции
В этом опероне закодированы белки, имеющие
принципиальное значение для инициации транскрипции (σ фактор), инициации репликации (dna G - праймаза) и
инициации трансляции (белок S21). Каждый белок нужен в
разном количестве. S21 ~ 50000 копий, dnaG ~ 50, σ- фактор ~
5000. Между геном S21 и геном dnaG есть слабый терминатор
транскрипции. Ген dnaG имеет инициирующий кодон ГУГ (а не
АУГ), который гораздо хуже узнается рибосомой и реже, чем
АУГ инициирует трансляцию.
29.
В формировании рибосом участвуют 52различных белка, а значит 52 гена, их
кодирующих. В итоге,73 гена должны
работать координированно, чтобы не
было избытка белков или rРНК.
30.
Регуляция образования рибосомных РНК и белковрибосом E.сoli
Ежеминутно в E.сoli образуется около
500 рибосом. Имеется 7 оперонов, в
которых закодированы rРНК (всего 3
разных rРНК х 7оперонов = 21 ген).
Вначале образуется про-rРНК, которая
метилируется и процессируется (т.е.
"созревает").
Количество
rРНК
регулируется
количеством
рибосомных
оперонов,
скоростью их транскрипции и работой
ферментов метилаз и эндонуклеаз.
31.
Рис. 9. Регуляция образования рибосомных РНК и белков рибосом E.сoliИмеется 7 оперонов, в которых закодированы rРНК (всего 3 разных rРНК х 7оперонов = 21 ген).
Вначале образуется про-rРНК, которая метилируется и процессируется (т.е. "созревает").
Количество rРНК регулируется количеством рибосомных оперонов, скоростью их
транскрипции и работой ферментов метилаз и эндонуклеаз.
32.
Рис. 8.Регуляция на уровне транскрипции.Оперон S10 регулируется белком L4. РНК-полимераза синтезирует первую лидерную последовательность, длиной 140 нукл.
Если 23S rРНК не хватает (2), то белку L4 не с чем соединяться, и он взаимодействует с лидерной
последовательностью, придавая ей такую конформацию, которая не позволяет РНК-полимеразе продолжать
транскрипцию. В результате синтез mРНК обрывается на первом же лидере (2).
Регуляция на уровне транскрипции.
33.
Рис. 8. Регуляция на уровне трансляции.Имеется 7 разных оперонов, в которых закодированы рибосомные
белки. Регуляция каждого из них осуществляется отдельно.
Оперон регулируется белком S4.
Если в клетке имеется свободная 16S rРНК, то S4 связывается с ней (1).
Если же 16S rРНК не хватает, то он связывается с mРНК, считывающейся с данного оперона (2).
Причем связывается в районе лидера и тем самым мешает трансляции.
Таким образом, осуществляется регуляция на уровне трансляции.
34. Трансляционный контроль
У прокариотических геноврегуляция экспрессии генов на
уровне трансляции может быть
обусловлена генетически
обусловленной продолжительностью
жизни иРНК.
35. Посттрансляционной контроль
Активность генов может регулироваться послеокончания синтеза белков.
Подавление активности генов по принципу
обратной связи представляет собой
регуляторный механизм, он влияет не на
синтез фермента, а на его активность.
Конечный продукт биосинтетического пути
может свободно соединяться с первым
ферментом, который запускает данный
метаболический путь.
36.
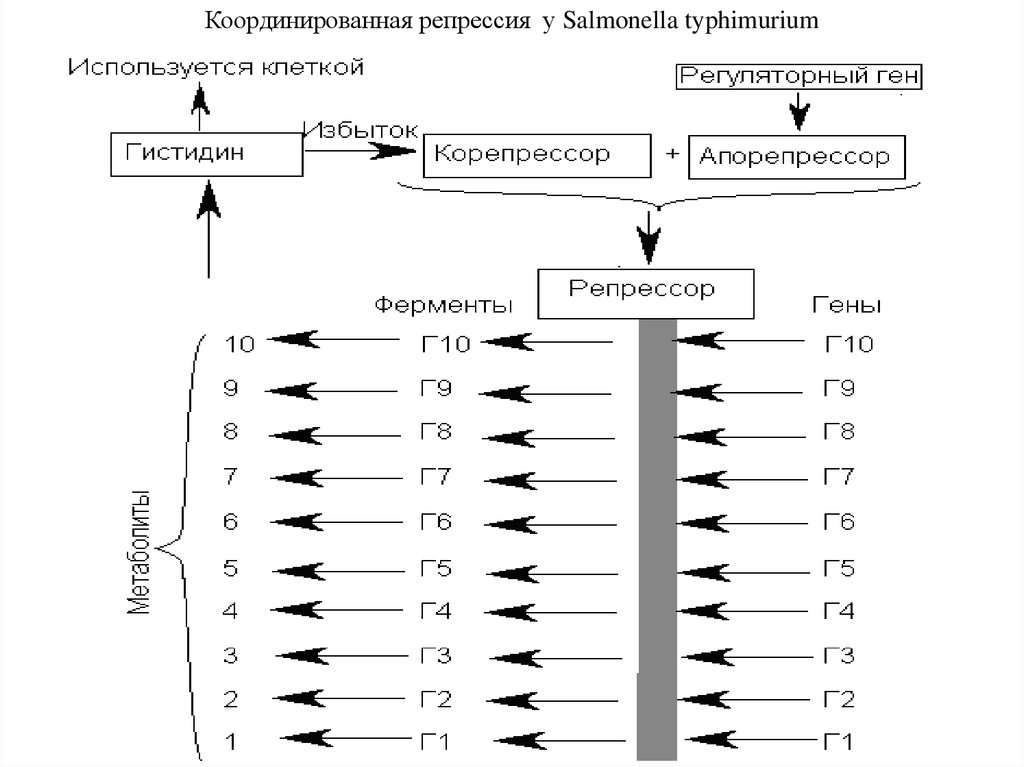
Координированная репрессия у Salmonella typhimurium37. ЭКСПРЕССИЯ ГЕНОВ У ЭУКАРИОТ
Особенности многих генов эукариот:наличие в их составе некодирующих
участков – интронов.
наряду с уникальными генами
(представленными в гаплоидном
геноме единичным числом копий)
встречаются многократно
повторяющиеся гены.
38. ГЕНЫ ОРГАНИЗМА
Все гены организма можно разделить надве большие группы:
конститутивные ,
индуцибельные.
39. Конститутивные гены
Конститутивные гены – это геныс постоянной экспрессией,
они постоянно включены,
то есть функционируют
на всех стадиях
онтогенеза и во
всех тканях.
40. Конститутивные гены
К конститутивным относятся гены,кодирующие
тРНК,
рРНК,
ДНК-полимеразы,
РНК-полимеразы,
белки-гистоны,
белки рибосом и т.д.
Это «гены домашнего хозяйства», без
которых клетки не могут существовать
41. Индуцибельные гены («гены роскоши»)
«Гены роскоши» –экспрессией.
Они могут:
1.
включаться,
2.
выключаться.
это гены с регулируемой
Обеспечивают устойчивость к
антибиотикам,
тяжелым металлам,
кодирующие специфические токсины,
гены конъюгации
обмена генетическим материалом с другими особями.
42.
43. Переключение генов у эукариот
У эукариот опероны отсутствуют, исистема управления активностью генов
более сложная.
У эукариот длина регуляторных
участков соизмерима с общей длиной
структурных генов.
У прокариот регуляторные участки
составляют примерно 5 % от всей ДНК.
44. Регуляция активности генов
Включение генов называется индукциейвыключение – репрессией.
Регуляцию активности генов производят
молекулярно-генетические системы
управления, в состав которых входят
различные эффекторы: индукторы и
репрессоры – вещества, осуществляющие
индукцию и репрессию.
45.
У многоклеточных организмовиндуцибельные гены, их называют
тканеспецифичными, потому что они
по-разному функционируют в
разных тканях на разных этапах
онтогенеза.
Регуляция активности генов
осуществляется на уровне:
1. транскрипции,
2. трансляции.
46.
Происходит еще много событий, но в конце их вядре происходит фосфорилирование факторов
транскрипции, относящихся к группе CREB факторов (c-AMP response element binding
protein). Фосфорилированный CREB связывается
со своей мишенью в ДНК. Эта мишень
называется CRE - это означает cAMP response
element.
47.
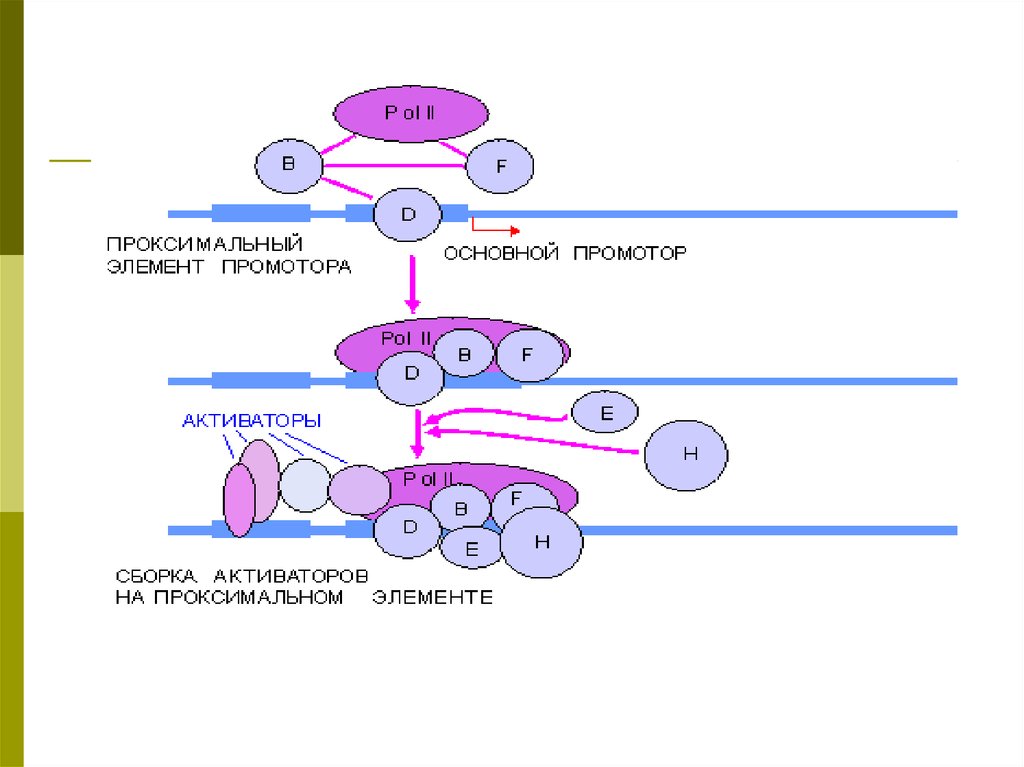
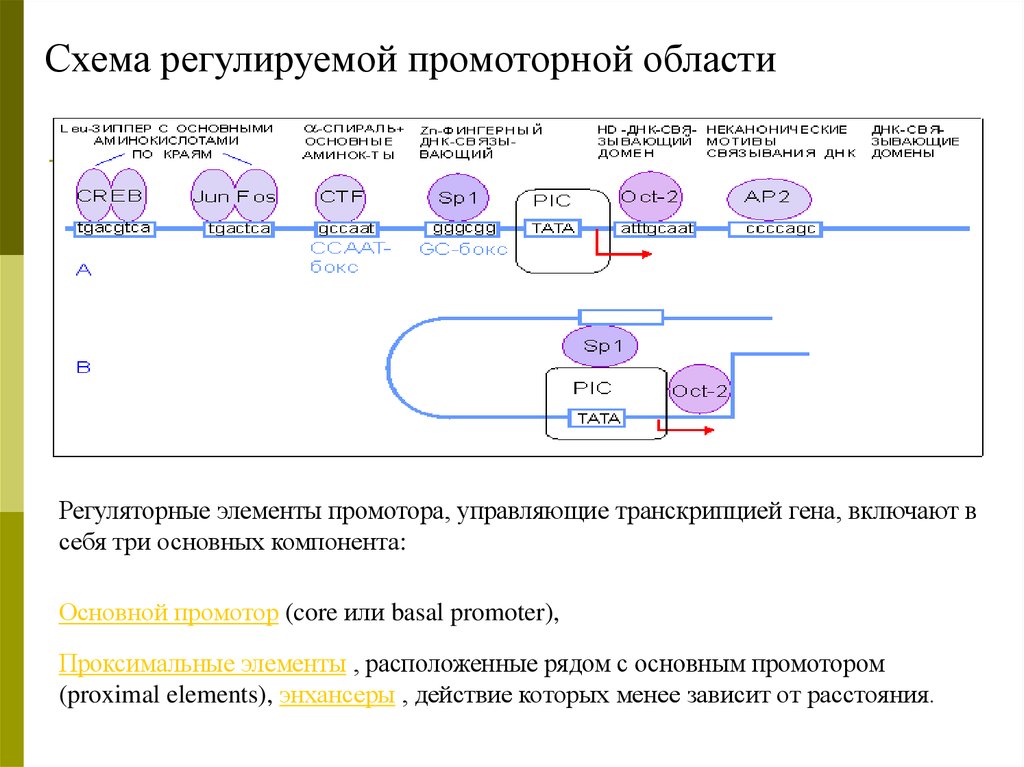
Схема регулируемой промоторной областиРегуляторные элементы промотора, управляющие транскрипцией гена, включают в
себя три основных компонента:
Основной промотор (core или basal promoter),
Проксимальные элементы , расположенные рядом с основным промотором
(proximal elements), энхансеры , действие которых менее зависит от расстояния.
48.
Но само по себе связывание CREB с ихмишенью недостаточно для активации этих
генов.
Чтобы
активация
произошла,
необходимо
чтобы
с
CREB
связался
коактиватор,
который
выполнит
роль
посредника между CREB и транскрипционной
машиной. Роль ко-активатора и выполняет
CREB-связывающий белок CBP (CREB-binding
protein) и его гомолог p300 . Эти белки не
взаимодействуют с ДНК, они взаимодействуют
с активаторами, в данном случае с CREB.
Связавшись,
они
взаимодействуют
с
транскрипционной машиной и стимулируют ее.
Способность к связыванию определяется
фосфорилированием CREB белка.
49.
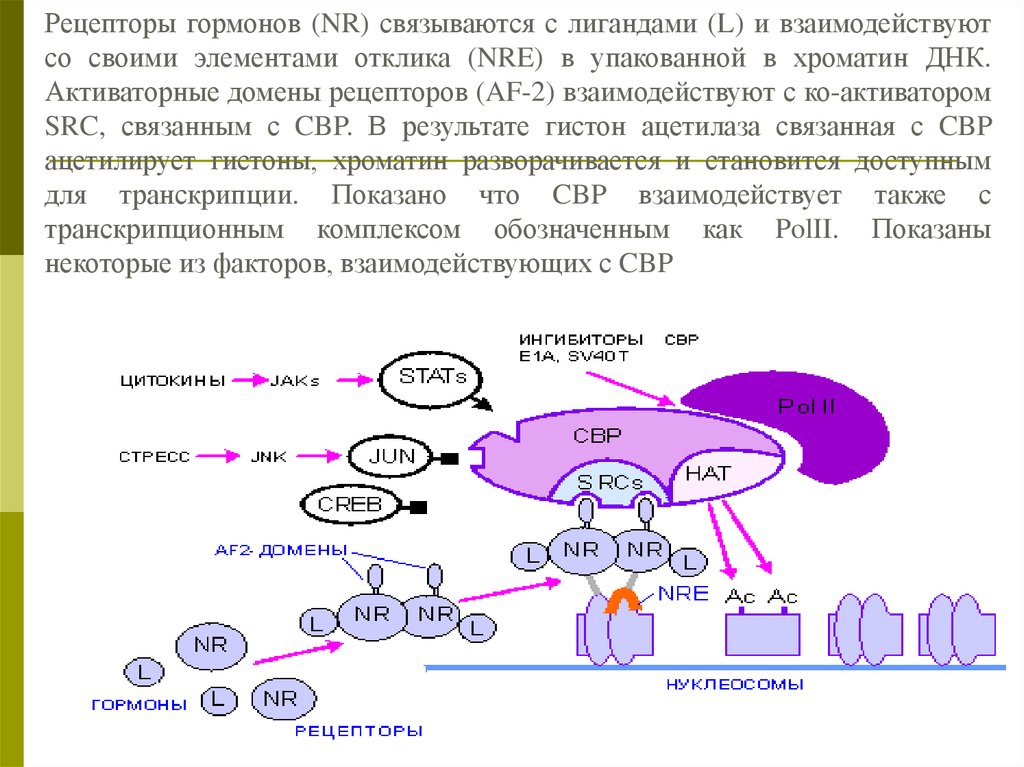
Рецепторы гормонов (NR) связываются с лигандами (L) и взаимодействуютсо своими элементами отклика (NRE) в упакованной в хроматин ДНК.
Активаторные домены рецепторов (AF-2) взаимодействуют с ко-активатором
SRC, связанным с CBP. В результате гистон ацетилаза связанная с CBP
ацетилирует гистоны, хроматин разворачивается и становится доступным
для транскрипции. Показано что CBP взаимодействует также с
транскрипционным комплексом обозначенным как PolII. Показаны
некоторые из факторов, взаимодействующих с CBP
50.
Интегрирующая роль p300/CBP.Рассмотрим
интеграцию на примере
семейства ко-активаторов транскрипции,
известных
под
названием
p300/CBP. p300 и CBP кодируются разными
генами [ Eckner ea 1996 ], но они очень
похожи друг на друга и поэтому часто,
когда говорят о их общих функциях, их
объединяют под общим именем p300/CBP.
Они экспрессируются если не во всех, то в
подавляющем большинстве клеток. Иными
словами их гены являются генами
домашнего хозяйства. Их функции очень
важны, поскольку они консервативны в
эволюции и очень похожие белки есть,
например, у нематоды Caenorhabditis
elegans и дрозофилы [ Shi ea 1998 ], хотя,
по-видимому, их нет в дрожжах.
51.
Таким образом, эти белки являютсяприобретением
многоклеточных
организмов, где они вовлекаются в
многочисленные процессы интеграции
сигналов, которыми обмениваются клетки в
процессах развития и дифференцировки.
Повреждение гена CBP приводит к
серьезным патологиям, например, синдрому
Rubinstein-Taybi . Этот синдром связан со
множественными дефектами в развитии.
52.
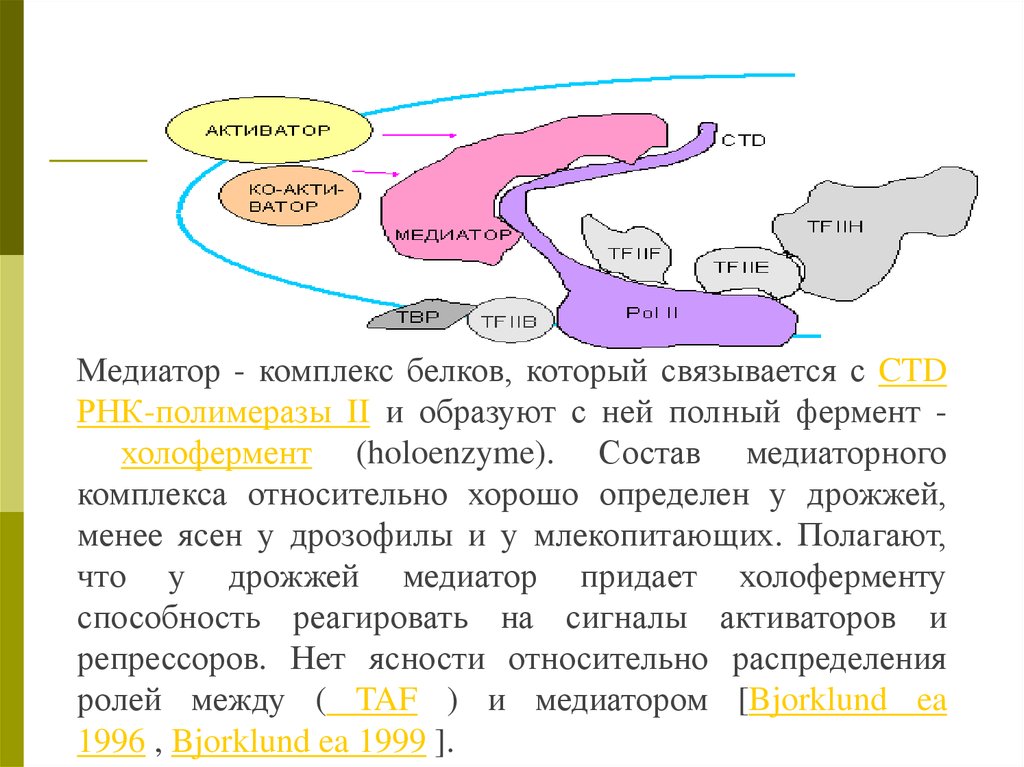
Медиатор - комплекс белков, который связывается с CTDРНК-полимеразы II и образуют с ней полный фермент холофермент (holoenzyme). Состав медиаторного
комплекса относительно хорошо определен у дрожжей,
менее ясен у дрозофилы и у млекопитающих. Полагают,
что у дрожжей медиатор придает холоферменту
способность реагировать на сигналы активаторов и
репрессоров. Нет ясности относительно распределения
ролей между ( TAF ) и медиатором [Bjorklund ea
1996 , Bjorklund ea 1999 ].
53. Переключение генов у эукариот
У многоклеточных эукариот в ходе онтогенеза изисходной клетки развивается целостный
организм.
На разных этапах онтогенеза в разных тканях с
разной интенсивностью экспрессируются разные
гены.
Активность генов у эукариот регулируется
разнообразными эффекторами, в т. ч.
гормонами.
54.
•Рис Стероидные гормоны: транслокация вклетку с рецептором
55. Переключение генов у эукариот
Выключение генов может быть обратимым инеобратимым.
У животных существует два типа дробления
зиготы:
недетерминированное (дифференцировка
клеток на поздних стадиях онтогенеза)
детерминированное (дифференцировка клеток
на самых ранних этапах дробления зиготы).
56. Переключение генов у эукариот
недетерминированное :можно пересадить ядро из клеток кишечного
эпителия головастика в яйцеклетку с убитым с
помощью ультрафиолетового облучения ядром.
Из такой синтезированной клетки разовьется
нормальная лягушка.
детерминированное:
клетки передней части бластодермы дрозофилы
способны формировать только структуры
передней части тела имаго, а клетки задней
части бластодермы – только структуры задней
части тела.
57.
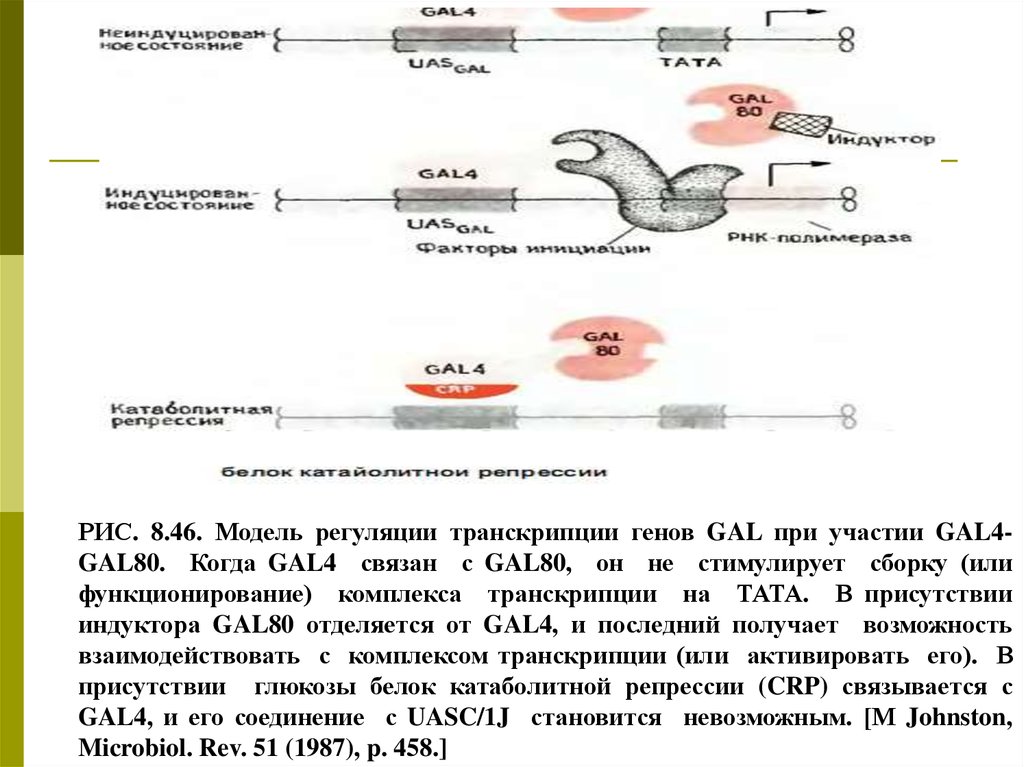
РИС. 8.46. Модель регуляции транскрипции генов GAL при участии GAL4GAL80. Когда GAL4 связан с GAL80, он не стимулирует сборку (илифункционирование) комплекса транскрипции на ТАТА. В присутствии
индуктора GAL80 отделяется от GAL4, и последний получает возможность
взаимодействовать с комплексом транскрипции (или активировать его). В
присутствии глюкозы белок катаболитной репрессии (CRP) связывается с
GAL4, и его соединение с UASC/1J становится невозможным. [М Johnston,
Microbiol. Rev. 51 (1987), p. 458.]
58. Литература:
1. Биология. Под ред. Ярыгина В.Н. М., 2001.2. Бочков Н.П. и др. Медицинская генетика. М., 1984.
3. Генетика. Под ред. Иванова В.И. М., 2006.
4. Заяц Р.Г. и др. Общая и медицинская генетика. Ростов-на-Дону,
2002.
5. Инге-Вечтомов С.Г. Генетика с основами селекции. М., 1989.
6. Кемп П., Армс К. Введение в биологию. М., 1988.
7. Медицинская биология и генетика. Под ред. проф. Куандыкова Е.У.
Алматы, 2004.
8. Фаллер Д. М., Шилдс Д. Молекулярная биология клетки. М., 2006.
9. Муминов Т.А., Куандыков Е.У. Основы молекулярной биологии
(курс лекций). Алматы, 2007.
10. Мушкамбаров Н.Н., Кузнецов С.Л. Молекулярная биология. М.,
2003.
11.Сингер М., Берг П. Гены и геномы. М. 1998.в 2-х томах.
59. Контрольные вопросы (обратная связь):
1. Что такое оперон?2. Уровни регуляции активности генов у
прокариот.
3. Механизмы регуляции активности генов у
прокариот.
4. Особенности регуляции активности генов у
эукариот.
5. Дифференциальная экспрессия генов и ее
значение в жизнедеятельности организмов.











































 Биология
Биология








