Похожие презентации:
Алюминий. Природные соединения алюминия
1. Алюминий
2. Алюминий (лат. Aluminium)
26,9815Был впервые получен датским
физиком Х.К. Эрстедом в 1825
г. Название этого элемента
происходит от латинского
алюмен, так в древности
назывались квасцы, которые
использовали для крашения
тканей. Латинское название,
вероятно, восходит к
греческому «халмэ» - рассол,
соляной раствор.
13
3
8
3s2 3p1
2
3. Алюминий (лат. Aluminium)
26,9815Порядковый номер.
Химический элемент
III группы главной
подгруппы 3-го
периода.
13
3
8
2
2
3s
1
3p
4. Алюминий (лат. Aluminium)
26,9815Атомная масса
элемента
13
3
8
2
2
3s
1
3p
5. Алюминий (лат. Aluminium)
1326,9815
3
8
2
2
3s
1
3p
Электронная
конфигурация элемента
+13Al 2е 8ē 3ē
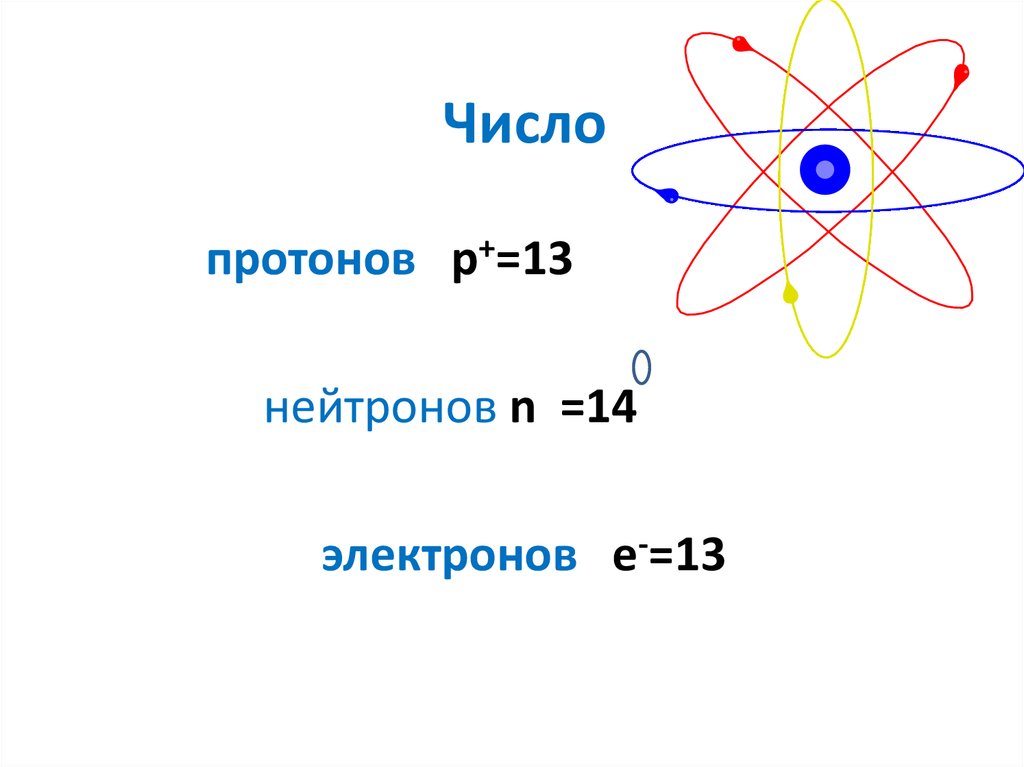
6. Число
протонов p+=13нейтронов n =14
электронов e-=13
7. ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ
АЛЮМОСИЛИКАТЫКОРУНД Al2O3 –
прозрачные кристаллы
8. Алюминевая руда
9. Алюминиевые руды (бокситы)
10. Бокситы
11. нефелин
12. Химические свойства алюминия
4Аl + 3O2 =
2Al + 3Br2 =
2Al + 3S =
2Al + 6H2O =
2Al + 6HCl =
Al +CuSO4 =
2Al + 2NaOH + 6H2O=
13. Химические свойства алюминия
4Аl + 3O2 = 2Al2O3
2Al + 3Br2 = 2AlBr3
2Al + 3S = Al2S3
2Al + 6H2O = 2Al(OH)3 + 3H2
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3CuSO4 =Al2 (SO4)3
2Al + 2NaOH + 6H2O=2Na[Al(OH)4]+3H2
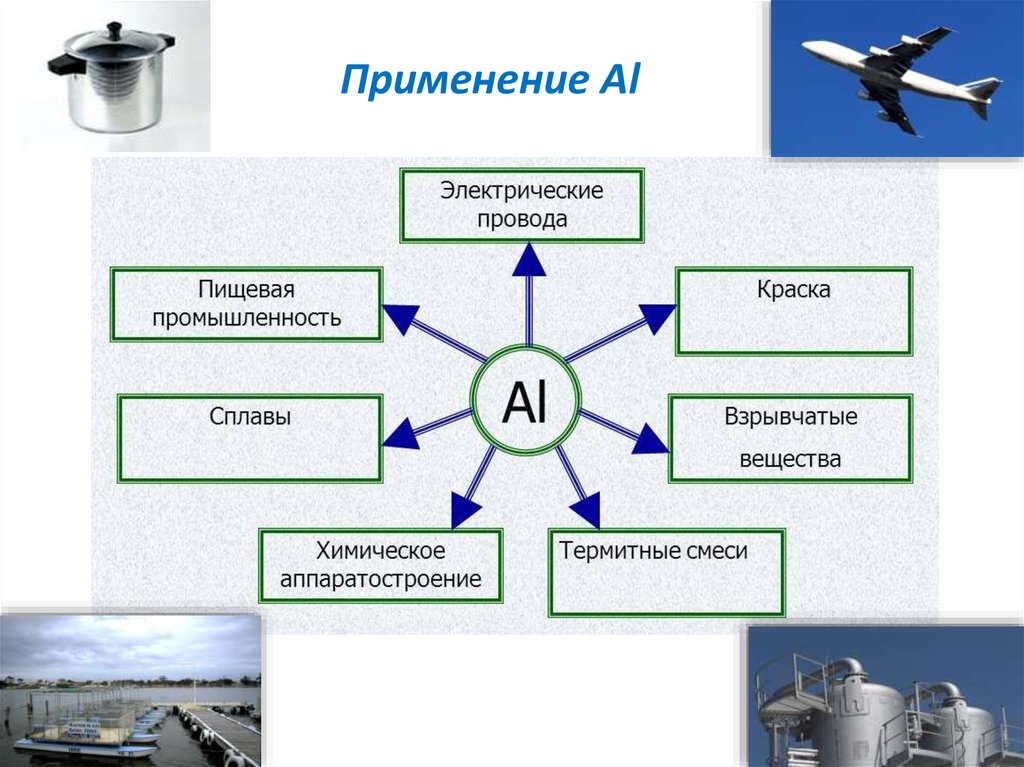
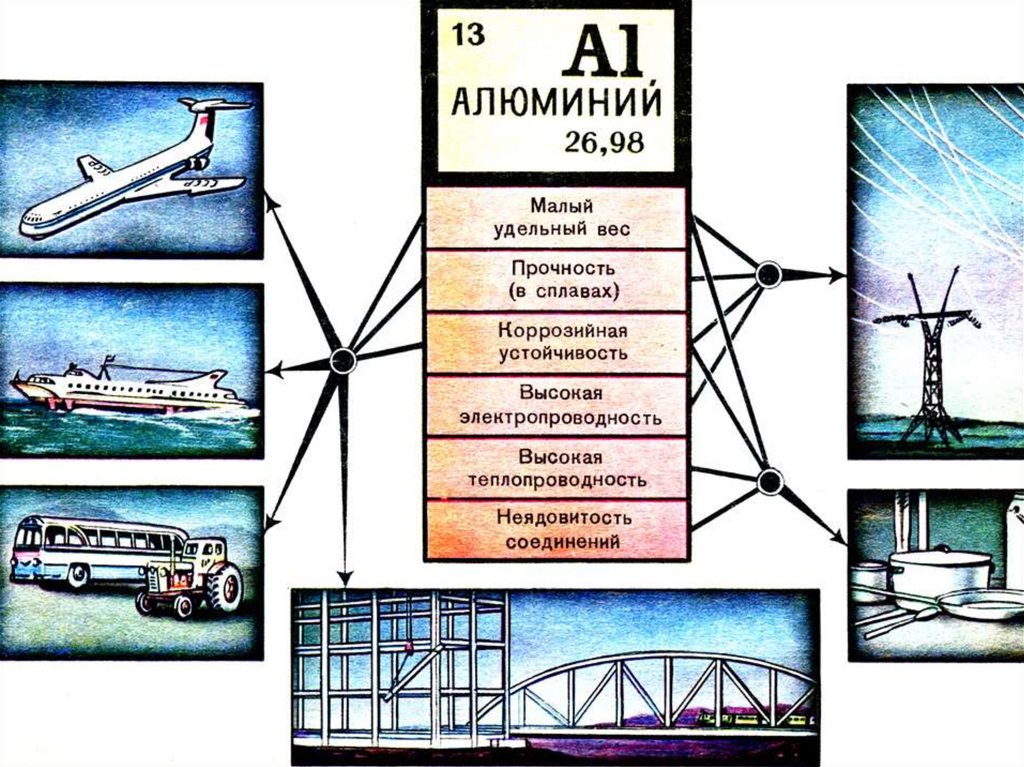
14. Применение Al
15.
16. Алюминий и его сплавы широко применяют как конструкционный материал
17. Домашнее задание
• П.14. с.67. упр 4. письменно.• Создать тест на А4 по теме «Алюминий» из
15 заданий с ответами














 Химия
Химия








