Похожие презентации:
Азотистая кислота
1. Азотистая кислота
Азотистая кислота HNO2имеет слабый характер.
Весьма неустойчива, может быть
только в разбавленных растворах:
2HNO2
NO + NO2 + H2O.
2. Атом азота в азотистой кислоте имеет промежуточную степень окисления +3
в связи с этим он может быть иокислителем, и проявлять
восстановительные свойства:
HNO2 + HI = I2 + NO + H2O,
HNO2 + H2O2 = HNO3 + H2O,
KNO2 + KMnO4 + H2SO4 = KNO3 +
K2SO4 + MnSO4 + H2O.
3.
Нагреваясь, раствор азотистойкислоты распадается с
выделением NO и
образованием азотной кислоты
Запишите уравнение
4. Соли азотистой кислоты называются нитритами
Нитриты гораздо более устойчивы, чем HNO2,все они токсичны. Представляют собой
кристаллические вещества, хорошо
растворимые в воде (труднее других - AgNО2)
Свойства .
1) Как и HNО2, нитриты обладают окислительновосстановительной двойственностью:
KNО2 + Н2О2 = KNО3 + Н2O
3KNО2 + 2КМпO4 + Н2O = 3KNО3 + 2MnО2↓ + 2КОН
2KNО2 + 2KI + 2H2SO4 = 2NO + I2 + 2K2SO4 + 2Н2O
2) Нитрит аммония разлагается при нагревании:
NH4NО2 = N2↑ + 2Н2O
5.
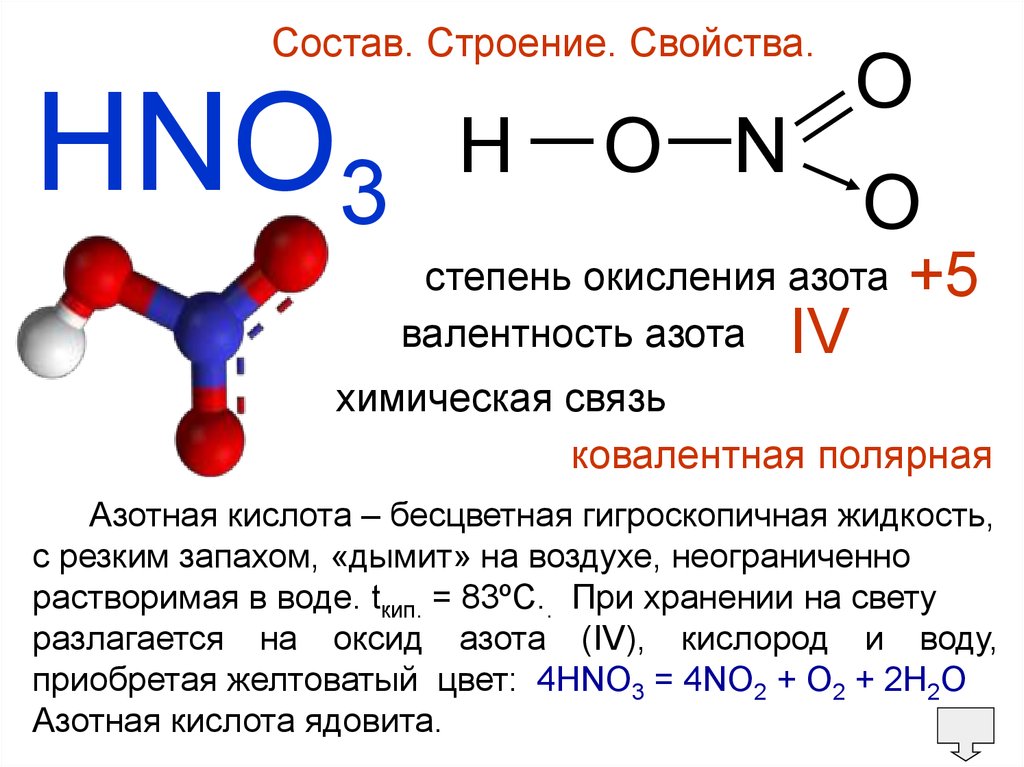
Состав. Строение. Свойства.HNO3
H — O —N
O
O
степень окисления азота
валентность азота IV
+5
химическая связь
ковалентная полярная
Азотная кислота – бесцветная гигроскопичная жидкость,
c резким запахом, «дымит» на воздухе, неограниченно
растворимая в воде. tкип. = 83ºC.. При хранении на свету
разлагается на оксид азота (IV), кислород и воду,
приобретая желтоватый цвет: 4HNO3 = 4NO2 + O2 + 2H2O
Азотная кислота ядовита.
6.
При разложении азотной кислотыкислород, поэтому скипидар вспыхивает.
выделяется
7.
Азотная кислота (HNO3)Классификация
Азотная кислота по:
наличию кислорода:
основности:
растворимости в воде:
кислородсодержащая
одноосновная
растворимая
летучести:
летучая
степени электролитической
диссоциации:
сильная
8.
Получение азотной кислоты в промышленностиNH3
NO
NO2
1. Контактное окисление аммиака до
оксида азота (II):
4NH3+ 5O2 = 4NO + 6H2O
2. Окисление оксида азота (II) в оксид
азота (IV):
2NO+O2 = 2NO2
3. Адсорбция (поглощение) оксида
азота (IV) водой при избытке кислорода
4NO2 + 2H2O + O2 = 4HNO3
HNO3
9.
В лаборатории азотную кислоту получают действиемконцентрированной серной кислоты на нитраты при
слабом нагревании.
Составьте уравнение реакции получения азотной кислоты.
NaNO3 + H2SO4 = NaHSO4 + HNO3
10.
Химические свойства азотной кислоты1. Типичные свойства кислот
2. Взаимодействие азотной кислоты с металлами
3. Взаимодействие азотной кислоты с неметаллами
11.
Химические свойства азотной кислотыАзотная кислота проявляет все типичные свойства
кислот.
Перечислите их:
Составьте уравнения реакций азотной кислоты:
1 с оксидом меди (II), оксидом алюминия;
2 c гидроксидом натрия, гидроксидом цинка;
3
c карбонатом аммония, силикатом натрия.
Дайте названия полученным веществам. Определите тип
реакции.
12.
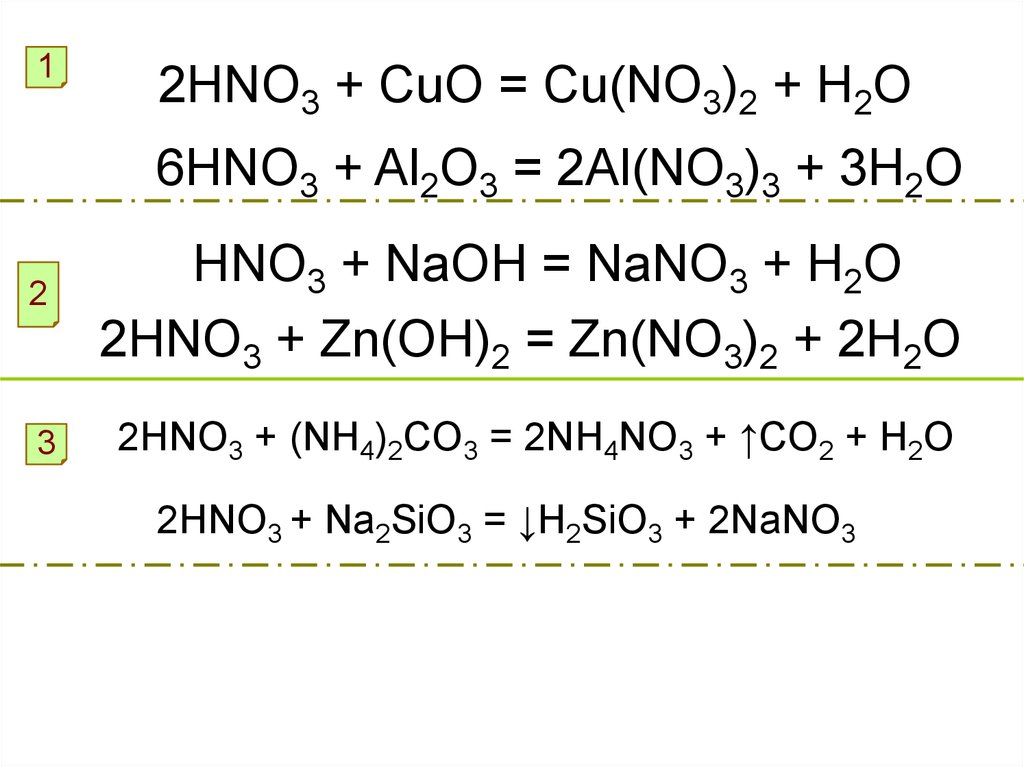
12HNO3 + CuO = Cu(NO3)2 + H2O
6HNO3 + Al2O3 = 2Al(NO3)3 + 3H2O
2
HNO3 + NaOH = NaNO3 + H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O
3
2HNO3 + (NH4)2CO3 = 2NH4NO3 + ↑CO2 + H2O
2HNO3 + Na2SiO3 = ↓H2SiO3 + 2NaNO3
13.
Взаимодействие азотной кислоты с металламиКак реагируют металлы с растворами кислот?
Металлы,
стоящие
в ряду активности
до кислоты
водорода,
вытесняют
Особенности
взаимодействия
азотной
с металлами:
его
изодин
кислот.
Металлы,
стоящие
после водорода
кислот его
1. Ни
металл
никогда
не выделяет
из азотнойизкислоты
не
вытесняют,
т.е. не взаимодействуют
с кислотами,
не
водород.
Выделяются
разнообразные соединения
азота:
растворяются
них. N2+1O, N20,
N+4O2, N+2вO,
N–3H3 (NH4NO3)
N–3H4+
N20
N2+1O
N+2O
N+4O2
концентрация кислоты
активность металлов
2. С азотной кислотой реагируют металлы, стоящие до и
после водорода в ряду активности.
3. Азотная кислота не взаимодействует с Au, Pt
4. Концентрированная азотная кислота пассивирует металлы:
Al, Fe, Be, Cr, Ni, Pb и другие (за счет образования плотной
оксидной пленки). При нагревании и при разбавлении азотной
кислоты данные металлы в ней растворяются.
14.
Найти закономерность при взаимодействииазотной кислоты с металлами:
15.
Единственная общая закономерность привзаимодействии азотной кислоты с металлами: чем
более разбавленная кислота и чем активнее металл,
тем глубже восстанавливается азот:
Увеличение
конц. кислоты
Увеличение
активности
металла
16.
Допишите схемы реакций:1)
HNO3(конц.) + Cu → Cu(NO3)2 + … + H2O
2)
HNO3(разб.) + Cu → Cu(NO3)2 + … + H2O
Рассмотрите превращения в свете ОВР
1) 4HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 + 2 N+4O2 + 2 H2O
окислитель
восстановитель
N+5 + 1e → N+4 1 2
Cu0 – 2e → Cu+2 2 1
восстановление
окисление
2) 8 HN+5O3(конц.) + 3 Cu0 = 3Cu+2(NO3)2 + 2 N+2O + 4 H2O
окислитель
восстановитель
N+5 + 3e → N+2 3 2
Cu0 – 2e → Cu+2 2 3
восстановление
окисление
17.
Взаимодействие азотной кислоты с неметалламиАзотная кислота как сильный окислитель
Окисляет неметаллы до соответствующих кислот.
Концентрированная (более 60%) азотная кислота восстанавливается до
NO2 , а если концентрация кислоты (15 – 20%), то до NO.
Расставьте в схемах коэффициенты методом электронного баланса.
4 HNO3 + С → СO2 + 2 H2O + 4 NO2
N+5 + 1e → N+4 1 4
С0 – 4e → С+4 4 1
HNO3 (за счет N+5) – окислитель, пр. восстановления
C – восстановитель, процесс окисления
5 HNO3 + P → H3PO4 + 5 NO2 + H2O
N+5 + 1e → N+4 1 5 HNO3 (за счет N+5) – окислитель, пр. восстановления
P – восстановитель, процесс окисления
P0 – 5e → P+5 5 1
5 HNO3 + 3 P + 2 H2O → 3 H3PO4 + 5 NO
N+5 + 3e → N+2 3 5 HNO3 (за счет N+5) – окислитель, пр. восстановления
P0 – 5e → P+5 5 3 P – восстановитель, процесс окисления
18.
Применение азотной кислоты1
Производство азотных и комплексных
удобрений.
2
Производство взрывчатых веществ
3
Производство красителей
4
Производство лекарств
5
Производство пленок,
нитролаков, нитроэмалей
6
Производство
искусственных волокон
7
Как компонент нитрующей
смеси, для траления
металлов в металлургии
19.
Соли азотной кислотыКак называются соли азотной кислоты?
нитраты
Нитраты K, Na, NH4+ называют селитрами
Составьте формулы перечисленных солей.
KNO3
NaNO3
NH4NO3
Нитраты – белые кристаллические
вещества. Сильные электролиты, в
растворах полностью диссоциируют
на ионы. Вступают в реакции обмена.
Каким способом можно определить нитрат-ион в растворе?
К соли (содержащей нитрат-ион) добавляют серную
кислоту и медь. Смесь слегка подогревают. Выделение
бурого газа (NO2) указывает на наличие нитрат-иона.
20.
Нитрат калия (калиевая селитра)Бесцветные кристаллы Значительно
менее гигроскопична по сравнению с
натриевой, поэтому широко применяется в пиротехнике как окислитель.
При нагревании выше 334,5ºС
плавится, выше этой температуры
разлагается с выделением кислорода.
Нитрат натрия
Применяется как удобрение; в
стекольной,
металлообрабатывающей промышленности; для получения
взрывчатых
веществ,
ракетного
топлива и пиротехнических смесей.
21.
Нитрат аммонияКристаллическое
вещество
белого
цвета. Температура плавления 169,6 °C,
при нагреве выше этой температуры
начинается постепенное
разложение
вещества, а при температуре 210°С
происходит полное разложение.
22.
При нагревании нитраты разлагаются тем полнее, чемправее в электрохимическом ряду напряжений стоит металл,
образующий соль.
Li K Ba Ca Na
Mg Al Mn Zn Cr Fe Co Sn Pb Cu
нитрит + О2
оксид металла + NO2 + O2
Ag Hg Au
Ме + NO2 + O2
Составьте уравнения реакций разложения нитрата
натрия, нитрата свинца, нитрата серебра.
2NaNO3 = 2NaNO2 + O2
2Pb(NO3)2= 2PbO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
23.
1. Степень окисления азота в азотной кислоте равна:А
А) +5;
Б) +4;
В) -3.
2. При взаимодействии с какими веществами азотная кислота проявляет
особые свойства, отличающие её от других кислот:
Б
А) основными оксидами; Б) металлами;
В) основаниями.
3. В окислительно-восстановительной реакции азотная кислота может
А
участвовать в качестве:
А) окислителя; Б) восстановителя; В) окислителя и восстановителя.
4. Какое из данных соединений азота называют чилийской селитрой:
А) нитрат калия;
Б) нитрат кальция;
В) нитрат натрия;
5. Запишите уравнение взаимодействия меди с концентрированной
азотной кислотой . Коэффициент перед формулой кислоты равен:
А) 2;
Б) 4;
В) 1.
6. Какое из перечисленных веществ не реагирует с разбавленной
азотной кислотой:
А) медь;
Б) гидроксид натрия;
В) бромид натрия.
7. Азотную кислоту получают в три стадии, окисляя атом азота по
следующей схеме:
А) N–3 →N+2 →N+4 → N+5
Б) N–3 →N0 →N+4 → N+5
В) N0 →N+2 →N+4 → N+5
В
Б
В
А




















 Химия
Химия








