Похожие презентации:
Биологиялық үрдістер термодинамикасы
1.
ДәріскерМедициналық биофизикамен
информатика кафедрасының
аға оқытушысы
Умирбекова
Замзагуль Климқызы
Page 1
2. Биологиялық үрдістер термодинамикасы
Page 23. Қарастырылатын сұрақтар
• Биологиялық жүйелерді оқып үйренудегітермодинамикалық әдістің маңызы мен
ерекшеліктері.
• Биологиядағы термодинамиканың бірінші
және екінші заңдарының қолданылуы.
• Биологиялық жүйелердің энтропиясы.
Page 3
4.
Термодинамика – материя қозғалысыныңжылулық формасының заңдылықтарын
және онымен байланысты болатын
физикалық құбылыстарды қарастыратын
физиканың бөлімі.
Термодинамиканың негізін қалаушы –
Никола Леонара Сади Карно.
Page 4
5. Термодинамиканың негізгі түсініктері
Термодинамикалық жүйе
Жүйенің күйі
Термодинамикалық үрдіс (процесс)
Ішкі энергия
Жұмыс.Жылу мөлшері
Page 5
6.
Термодинамикалық жүйе депбелгілі бір құбылыстағы
қасиеттері қарастырылатын
кез-келген дене немесе денелер
жиынтығы аталады.
Page 6
7.
Тұйық термодинамикалық жүйе – сыртқыортамен энергия және зат алмасуы
орындалмайтын жүйе.
Page 7
8.
Термодинамикалық жүйе:оқшауланған, жабық және ашық
болып келеді.
Жабық жүйе сыртқы ортамен
ешқандай зат алмасу да, энергия
алмасу да болмайды.
Ашық жүйе сыртқы ортамен зат
алмасу да, энергия алмасу да
бола алады.
Page 8
9. Жүйенің күйі
Жүйенің күйі -өлшенетін физикалықшамалар болып табылатын жүйе
параметрлерінің жиынтығымен
анықталады. Термодинамикалық жүйе
параметрелерінің негізгілері: көлем V,
температура T және қысым P.
Сыртқы ортамен немесе басқа денемен
әсерлескенде жүйенің күйін сипаттайтын
параметрлері өзгереді.
Жүйенің параметрлерінің өзара байланысын
сипаттайтын теңдеуді жүйе күйінің теңдеуі
деп атайды:
f(p, T, V) = 0
Page 9
10. Термодинамикалық үрдіс (процесс)
Жүйенің бір күйден екінші күйге өтуін(бір күйден екінші күйге өткенде бір
параметрдің мәні өзгерсе болғаны)
немесе параметрлердің біреуінің
өзгеруінен пайда болатын жүйе күйі
өзгерісін термодинамикалық үрдіс деп
атайды.
Page 10
11.
Термодинамикалық үрдістерциклді түрде жүреді.
Циклдік немесе дөңгелектік үрдіс
термодинамикадағы бірнеше
өзгерістен кейін жүйенің
бастапқы күйіне оралады.
Page 11
12.
Термодинамикалық тепе-теңдік –уақытқа қатысты
термодинамикалық
жүйенің күйі өзгермейтін
жағдай.
Page 12
13. Ішкі энергия
Макроденелерде механикалық энергияменқатар, өздерiнiң iштерiне тұйықталған
энергияға ие. Ол – iшкi энергия. Ол барлық
энергетикалық түрленулердiң балансына
кiредi.
Page 13
14.
Механикалық жұмыс жасамай-ақденелердi қыздырғанда, олардың iшкi
энергиясы ұлғаяды.
Iшкi энергияның механикалық энергияға
айналуының керi процесi
болатыны сөзсiз.
Page 14
15.
Жүйенің барлық бөлшектерініңкинетикалық және
потенциалдық энергияларының
қосындысын жүйенің ішкі
энергиясы (U) деп атайды, ол
жүйе сыртқы ортамен
(денелермен) әсерлескенде
өзгереді.
Page 15
16.
Жабық жүйе үшін: U = const(ΔU=0)
Ішкі энергия тек қана жүйенің
күйі арқылы анықталады, яғни
белгілі бір күйге тек қана бір
ғана ішкі энергияның шамасы
сәйкес келеді.
Page 16
17.
Егер дене бір күйден екіші бір күйгеөтсе, онда ішкі энергияның
өзгеруі:
ΔU = U2 – U1
бұл өзгерістің өту жолына
байланысты болмайды.
Page 17
18. Жұмыс. Жылу мөлшері
Термодинамикалық жүйенің күйінөзгертудің екі жолы бар:
жылу алмасу немесе жұмыс істеу.
Page 18
19.
Жұмыс классикалық механикадағысияқты анықталады, бiрақ ол
дененiң кинетикалық энергисының
өзгеруiне емес, оның iшкi
энергиясының өзгеруiне тең болады.
Page 19
20.
Мысалы, газдардың сығылуы кезiндепоршень өзiнiң механикалық
энергиясының бiр бөлiгiн газдарға
бергендiктен, молекулалардың
кинетикалық энергиясы ұлғаяды,
газ қызады.
Page 20
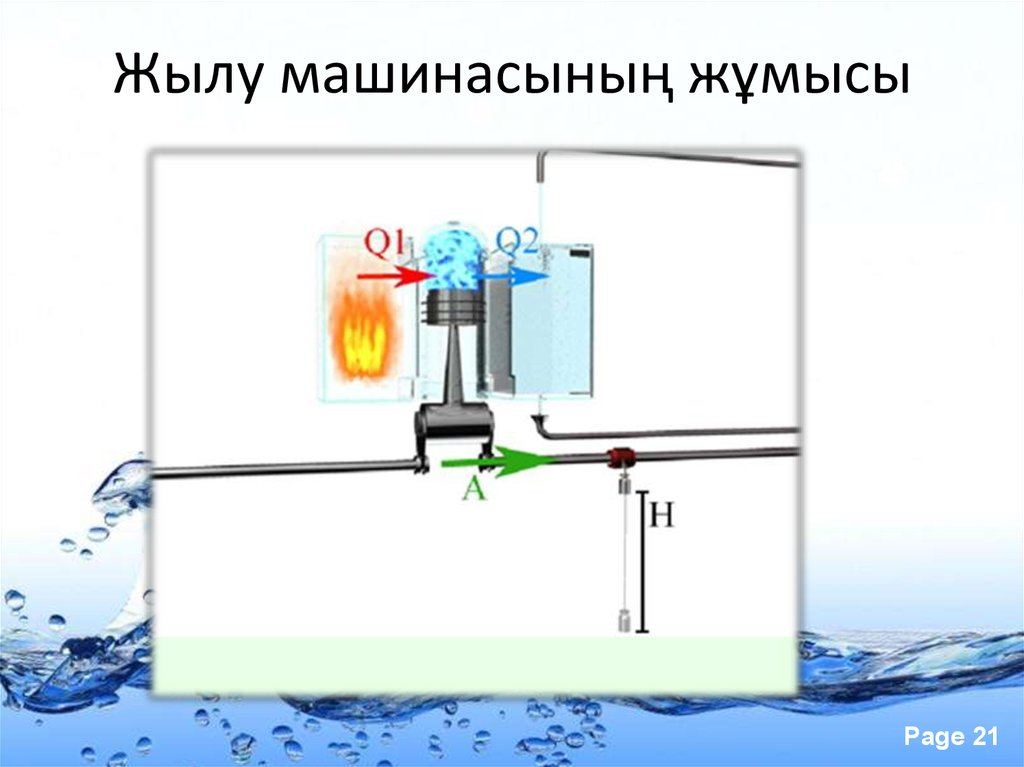
21. Жылу машинасының жұмысы
Page 2122.
Керiсiнше, егер газ ұлғайса, ондаалыстаған поршеньмен
соқтығысқаннан кейiн
молекулалардың жылдамдығы
азайып, газ суиды.
Газ ұлғайғандағы жұмыс
Page 22
23.
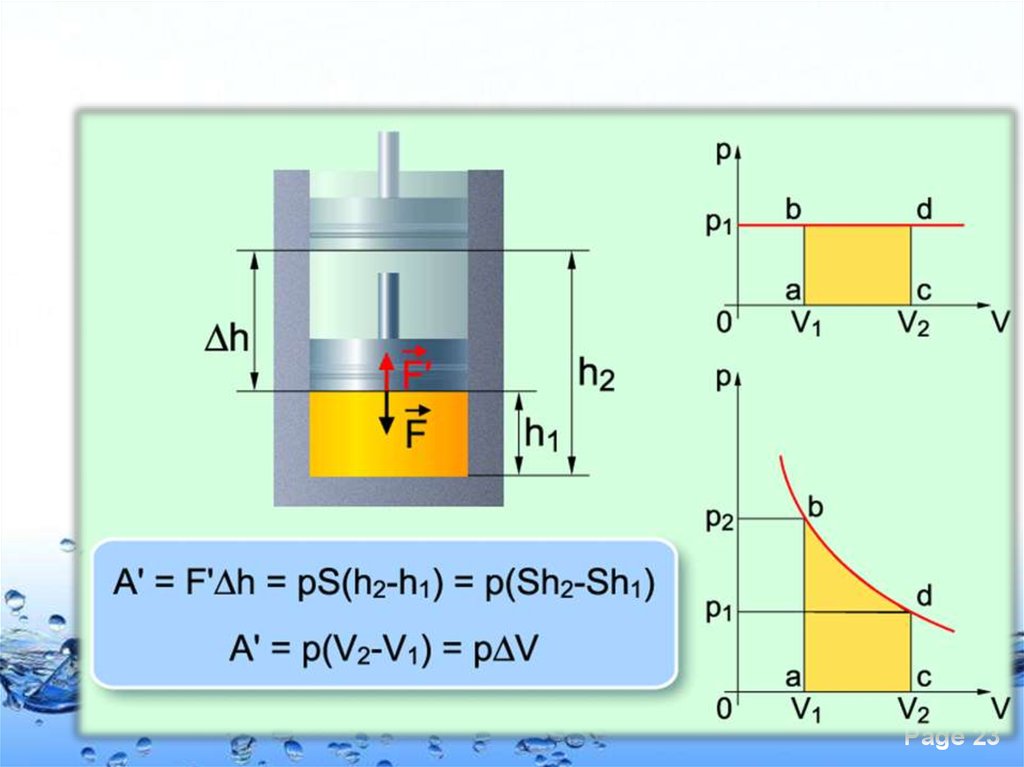
Page 2324.
Қозғалмалы ортаның көлемi өзгергендегiiстелген жұмыс мынаған тең болады
А′ = p·(V2-V1) = p·ΔV
Ұлғаю кезiнде (V2 > V1) газ оң жұмыс
жасайды: А′>0.
Сығылу кезiнде V2<V1, сондықтан оның
жұмысы терiс болады: А′<0.
Газ
ұлғайғандағы
жұмыс
Page 24
25.
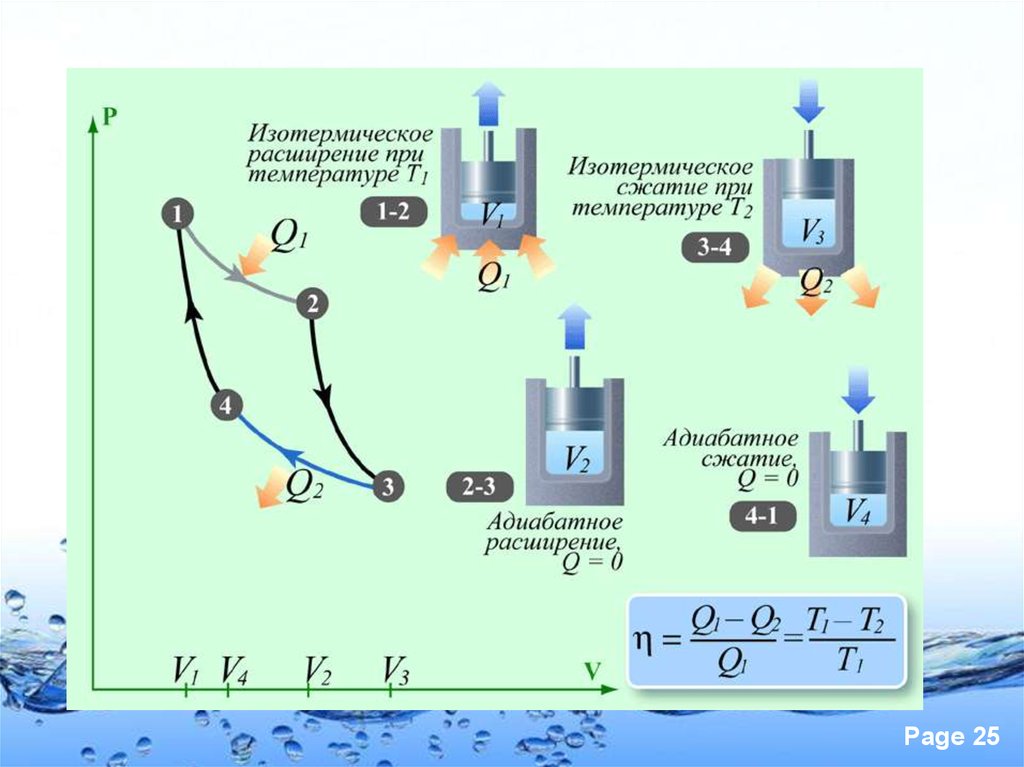
Page 2526.
Ағзада зат алмасуы энергиялардыңалмасу үрдістермен жүріп отырады:
өмір сүру негізінде жататын энергия
мен зат алмасуынан тұратын
бірлескен үрдіс.
Page 26
27.
Тірі ағза азық-түлік заттардыңхимиялық энергиясын жұмсап, осы
энергияны ағзада орындалатын
барлық жұмыстар энергияларының
бір түріне айналады және артық
болған жылу мөлшерін бөледі.
Page 27
28.
Жұмыс жасалынбай-ақ, бiр денеден екiншiденеге энергияның берiлу үдерісі жылу
алмасу немесе жылу берiлу деп аталады.
Жылу алмасу кезiндегi iшкi энергияның
өзгеруiнiң мөлшерлiк шамасын жылу
мөлшерi деп атайды.
Сәуле шығару
энергиясының берілуі
Page 28
29. Термодинамика негізгі заңдары: I және II бастамалары
Термодинамиканың негізі болыпэнергияның сақталу және айналу
заңы табылады:
Оқшауланған жүйенің толық
энергиясы осы жүйеде өтетін кез
келген үрдісте өзгеріссіз қалады.
Page 29
30.
Энергия пайда болмайды және жоғалмайды,ол тек бір түрден екінші түрге айналады.
Дене бір күйден екінші күйге өткенде
оның ішкі энергиясының өзгеруі денеге
жасалған жұмыс пен дененің қабылдаған
жылу мөлшерінің қосындысына тең
екенін білеміз.
Page 30
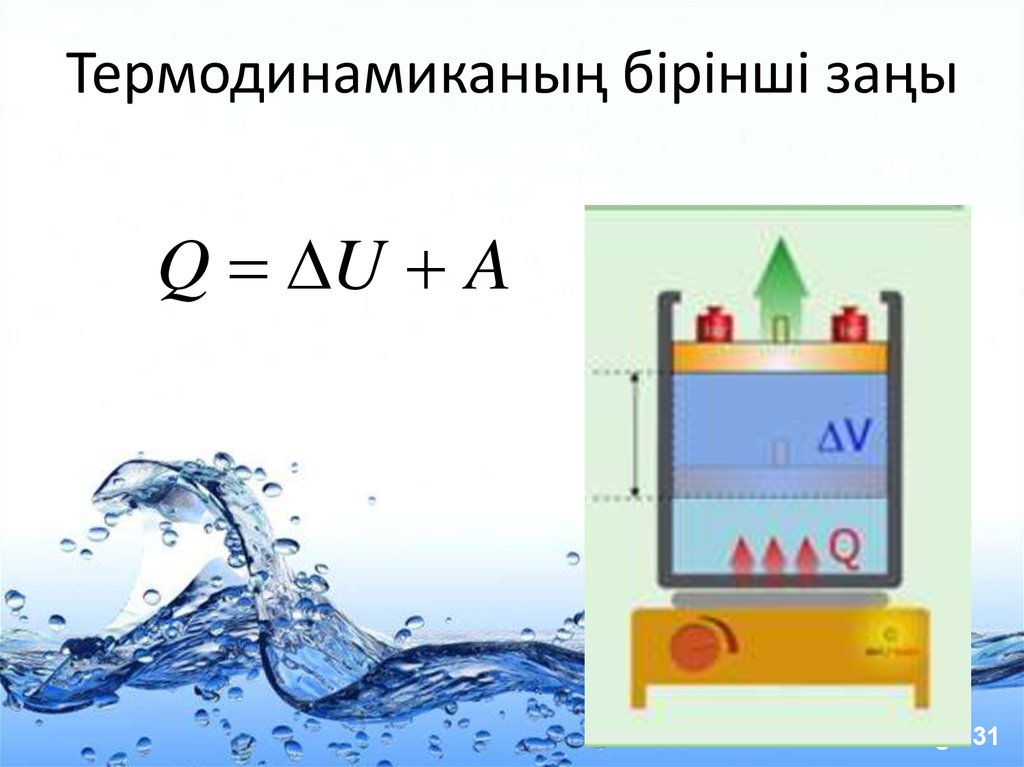
31. Термодинамиканың бірінші заңы
Q U APage 31
32.
Page 3233.
Жылу мөлшері мен жұмысты қандай дабір параметрдің бастапқы және соңғы
күйлеріндегі екі шаманың айырмасы
түрінде өрнектеуге болмайды, ал ішкі
энергия берілген күйде белгілі бір мәнге
ие болатындықтан, мына түрде
өрнектей аламыз:
U U 2 U1
Page 33
34.
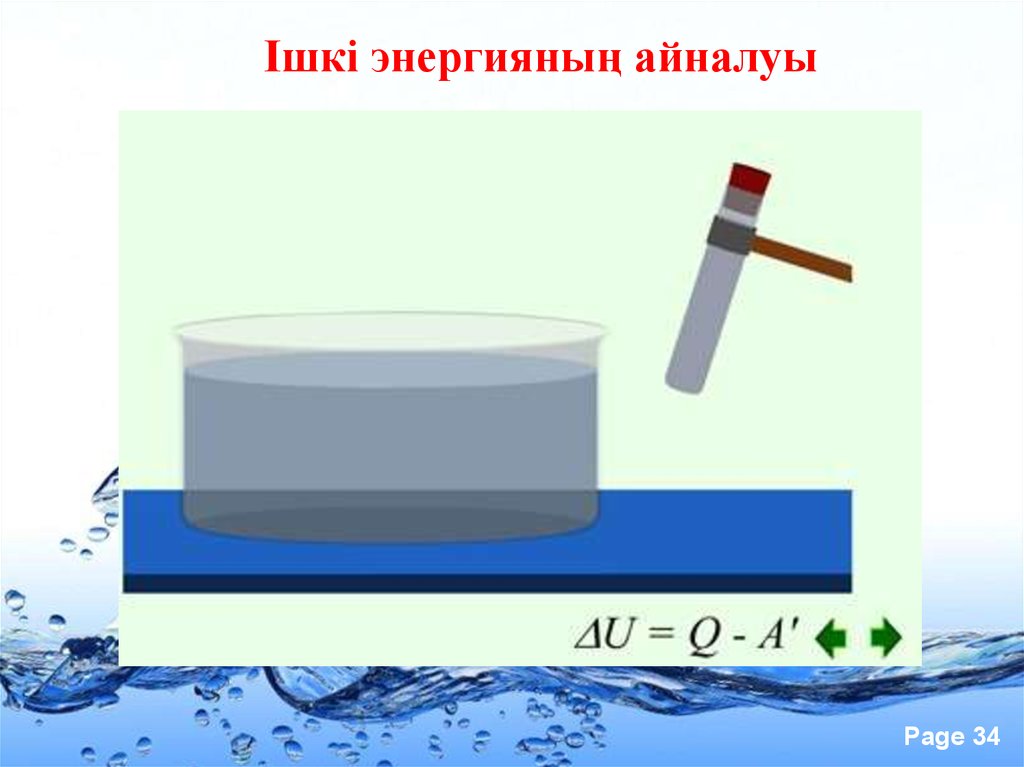
Ішкі энергияның айналуыPage 34
35. Жұмыс жасай отырып ішкі энергияны өзгерту
Сұйықтықтарды араластыруPage 35
36.
Егер ағза энергия көзі болып саналмаса,екіншіден ағзаға келіп түскен тамақтың
тотығуы нәтижесінде ағзаның жұмыс
істеуіне қажетті энергия бөлініп
шығатыны дәлелденсе, онда
термодинамиканың бірінші бастамасын
тірі ағзаға қолдануға болады екен.
Бұл мәселені дәлелдеу үшін сонау XVIII
ғасырдан бастап көптеген тәжірибелер
жүргізілді.
Page 36
37.
Ақыр соңында ағзаға келіп түскентамақтан пайда болатын
энергияның мөлшері жұмыс
істегенде кететін энергияның
ағза мөлшеріне тең екені
анықталды.
Page 37
38.
Page 3839.
Термодинамиканың екінші бастамасыбойынша
энергияның әр түрі жылуға айналады да, ал
кері бағытта жылудың энергияға айналуы
толық болмайды.
Page 39
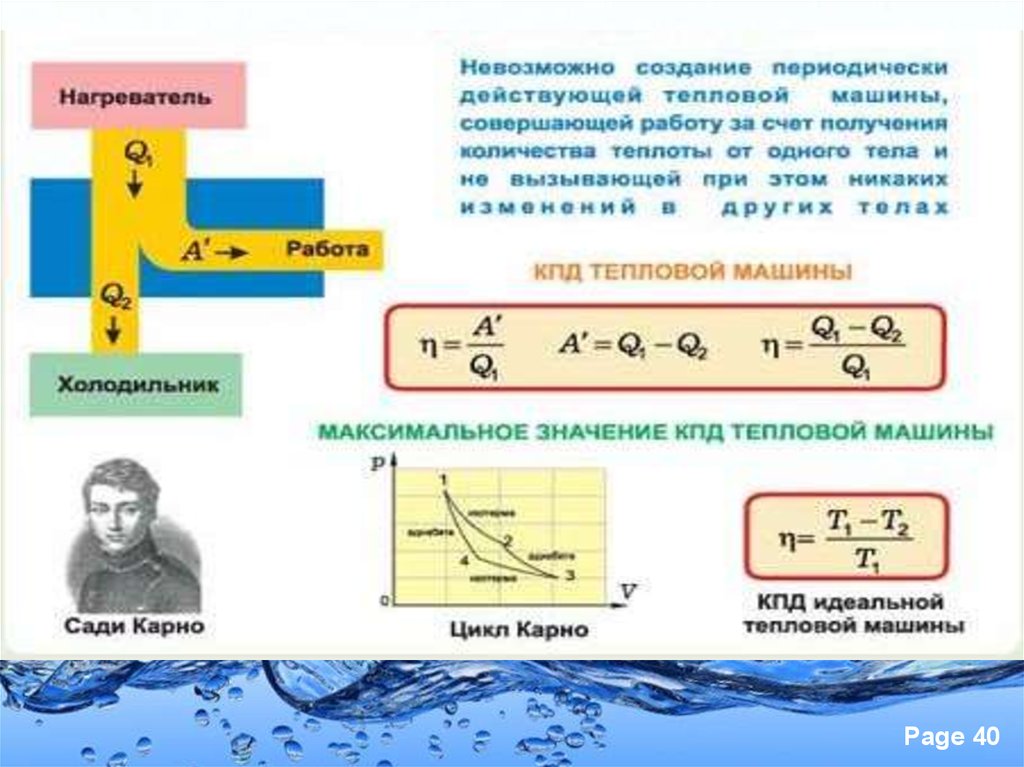
40.
Page 4041.
Тепе - теңдік күйі жүйенің максималдытұрақтылығымен сипатталады:
жүйеде болған кез келген өзгеріс тепе теңдікке келеді.
Ашық жүйелердегі өтетін үрдістер
қайтымсыз сипатта болады.
Page 41
42.
Бұл занды сипаттайтын бірнеше анықтамабар, олар біріне-бірі эквивалентті.
Соларға тоқталайық.
• Клаузиус анықтамасы. Жылу ешқашан да
суық денеден ыстық денеге берілмейді.
• Томсон-Планк анықтамасы:
Қыздырғышты суыту арқасында онан
алынган жылу мөлшерін түгелімен
жүмысқа айналдыру мүмкін емес.
Page 42
43.
Оствальд анықтамасы:Мәңгі двигательдің екінші
түрін жасау мүмкін емес.
Төрт тактылы іштен жану
қозғалтқышының моделі
Page 43
44.
Термодинамиканың екінші бастамасыныңбиологияда қолданылуы
Термодинамиканың бірінші
бастамасы өлі табиғатқа да, тірі
табиғатқа да қолданыла беретін
болса, термодинамиканың екінші
бастамасының тірі табиғатқа
бірден қолдануға болмайды.
Оның себебі тірі ағза жабық жүйе
емес ашық жүйеге жатады.
Page 44
45.
Жабық жүйеде өзінен-өзі жүретінүрдістер энтропияның өсуіне
ΔS >0, бос энергияның азаюына
әкеліп соқтыратын болса, ашық
жүйеде, яғни тірі ағзада тепетеңдік емес үрдістер пайда
болады.
Page 45
46.
Термодинамикалық тепетеңдіктің жоқ болуынақарамастан жүйенің ұзақ уақыт
бойына өзінің кейбір
физикалық және химиялық
қасиеттерін сақтап тұру
қасиеті стационар күй деп
аталады.
Page 46
47.
Стационарлық күйашық жүйеге тән болады.
Жүйе стационарлык күйге ие болу
үшін ол жүйеге сырттан зат және
энергия келіп түсуі керек те,
сонан кейін жүйеден сыртқа зат
пен энергия шығып отыруы
керек.
Page 47
48.
Тірі ағза ашық стационар күйдегітермодинамикалық жүйе
болғандықтан, оның күйінің
параметрлерінің уақытқа
байланысты тұрақтылық
сипаты да сақталады.
Page 48
49.
Бұл сипатты ағзаның стационаркүйі – гомеостаз деп атайды.
Сонымен қатар стационар күйде
барлық биохимиялық
түрленулер желісі жүріп
отырады.
Page 49
50.
Егер сыртқы ортаның өзгеруіне(айталық қысымның,
температураның) байланысты ағза
стационарлық күйде тұра алатын
болса, онда ағза осы ортаға үйренеді де
(адаптацияланады), өмір сүре береді.
Ал қоршаған ортаның өзгеруіне
байланысты ағза стационарлық
күйден ауытқып кететін болса, онда
ағза өмір сүруін тоқтатады.
Page 50
51.
Термодинамикалық үрдістердің бағыты, шегі,мүмкін болған ағымын жүйенің күйін
сипаттайтын шама — энтропия S болып
табылады. Ол жүйенің жылулық күйін
бейнелейді.
dQ
dS
T
Егер dQ=0 болса, онда dS=0 және
болғандықтан S=const.
T 0
Page 51
52.
Сонда энтропияның толық өзгерісі мынаформуламен анықталады:
dQ
S
const
T
мұндағы S- энтропия, T- абсолюттік
температура,
Q- жылу мөлшері.
Бұл формуладан энтропия жүйе күйінің
функциясы екендігін байқауға болады.
Page 52
53.
Ағза мен сыртқы орта арасындағы энтропияалмасуын сипаттайтын Пригожин формуласы:
dSi
dSe
dS
dt dtа ç dtорта
Page 53
54.
Ал термодинамиканың бірінші және екіншібастамаларын біріктірсек, онда мынаны
аламыз:
TdS U dA
Page 54
55.
Больцман физикалық және химиялық үрдістердежүйе күйінің ықтималдылығын энтропиямен
байланыстырып термодинамиканың екінші
бастамасын негіздеді. Больцман формуласы
бойынша энтропия мынаған тең:
S k ln w
• мұндағы
k - Больцман тұрақтысы,
термодинамикалық ықтималдылық.
w-
Page 55
56.
Ағзада градиентті (мысалы, заттыңпассивті тасымалы), градиентке қарсы
(заттың активті тасымалы) үрдістер де
жүріп отырады. Биологиялық
жүйелердің жұмыс жасау қабілеті
уақытқа байланысты азаймайды –
олардың өмір сүруі жылдарға созылады.
Классикалық термодинамика көзқарасы
бойынша
өмір – “керемет” күй.
Page 56
57.
Ағзада пайда болған әртүрлі градиенттерге(химиялық, электрлік, диффузиялық,
жылулық және т.б.) байланысты жүйенің
тепе - теңдігі бұзылып, заттың
диффузиялық ағыны, иондар,
электрондар және т.б. ағындар туады.
Ағындар тудыратын күштер жүйені,
яғни ағзаны термодинамикалық тепе теңдіктен ауытқытады.
Page 57
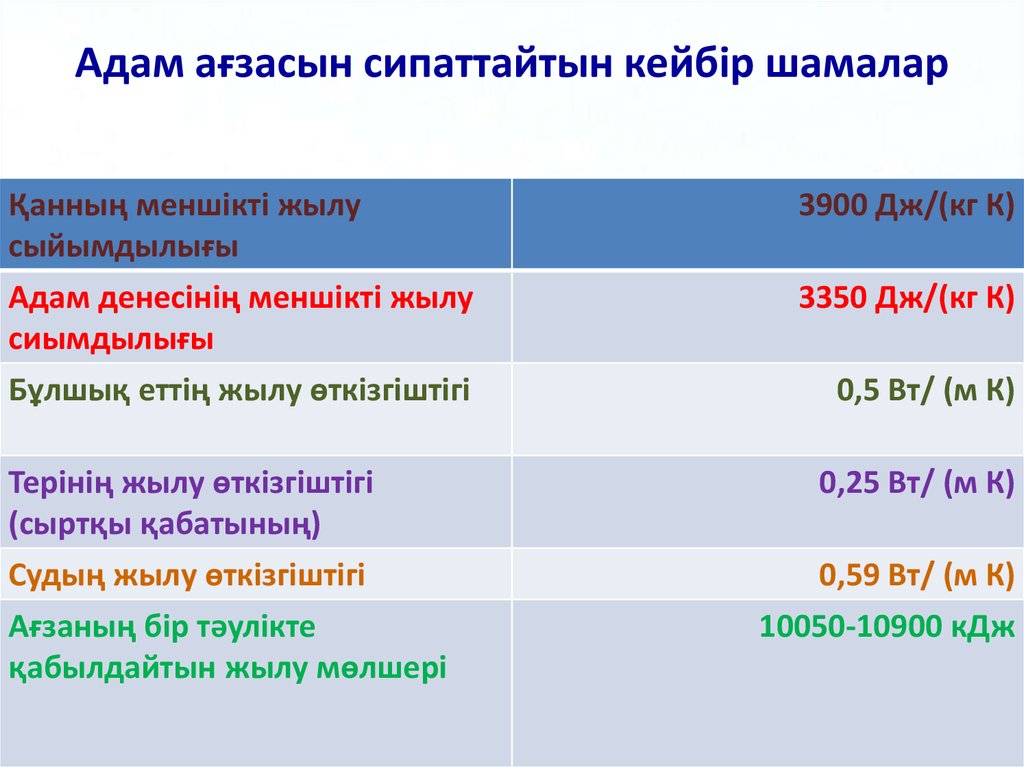
58. Адам ағзасын сипаттайтын кейбір шамалар
Қанның меншікті жылусыйымдылығы
Адам денесінің меншікті жылу
сиымдылығы
Бұлшық еттің жылу өткізгіштігі
Терінің жылу өткізгіштігі
(сыртқы қабатының)
Судың жылу өткізгіштігі
Ағзаның бір тәулікте
қабылдайтын жылу мөлшері
3900 Дж/(кг К)
3350 Дж/(кг К)
0,5 Вт/ (м К)
0,25 Вт/ (м К)
0,59 Вт/ (м К)
10050-10900 кДж
Page 58
59. Сыртқы ортаға бөлінетін жылу мөлшері
Жылу өткізгіштікжәне конвекция
2260 кДж
арқылы
Сәуле шығару
3390 кДж
арқылы (излучением)
Булану арқылы
1880 кДж
Жұмыс істеген кезде
2510-3350 кДж
Page 59
60. Адам ағзасының бір тәулікте жұмсайтын орташа энергиясы 3000 ккал. Берілген тағамдардан күндік рацион құрастырып көріңіз Кейбір
тағамдардың бөліп шығаратын меншікті жылумөлшері
Тағам
Меншіктік жылу мөлшері,
Дж/кг
Қара нан
Сиыр еті
Айран
Сүт
Балық
8880
7524
2700
2800
12900
Page 60
61. Бақылау сұрақтары
• Термодинамика нені зерттейді?• Биологиялық жүйелерді оқып үйренудегі
термодинамикалық әдістің маңызы мен
ерекшеліктері қандай?
• Биологиядағы термодинамиканың бірінші
және екінші заңдарының қолданылуы қандай?
• Биологиялық жүйелердің энтропиясының
ерекшеліктері.
Page 61






















































 Биология
Биология








