Похожие презентации:
Термодинамика. Законы термодинамики
1. Термодинамика
- это раздел физики, изучающийтепловые свойства макроскопических систем, не
обращаясь к строению тел,
составляющих систему.
2. Внутренняя энергия
определяется суммой кинетических энергийхаотического движения всех частиц тела
относительно центра масс тела (молекул,
атомов) и потенциальных энергий их
взаимодействия друг с другом.
U Еk Е p
3.
Потенциальная энергия – определяетсявзаимным расположением частиц
Кинетическая энергия частиц определяется
температурой тела.
Меняется только при изменении температуры
Если система молекул находится в тепловом
равновесии при температуре T, то средняя
кинетическая энергия равномерно распределена
между всеми степенями свободы и для каждой
kT
степени свободы молекулы она равна
2
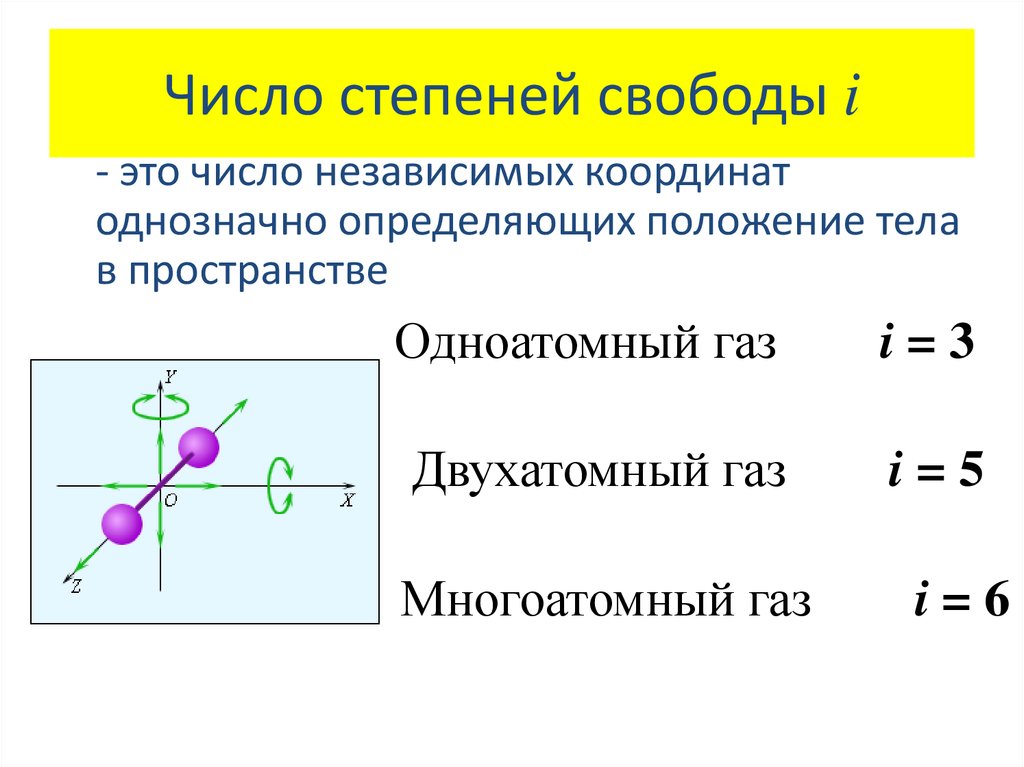
4. Число степеней свободы i
- это число независимых координатоднозначно определяющих положение тела
в пространстве
Одноатомный газ
i=3
Двухатомный газ
i=5
Многоатомный газ
i=6
5. Внутренняя энергия идеального газа
определяется только кинетической энергией движения молекулДля одноатомного идеального газа:
3
3
3
3
U N E К N kT vN A kT vRT pV
2
2
2
2
i
i
U vRT pV
2
2
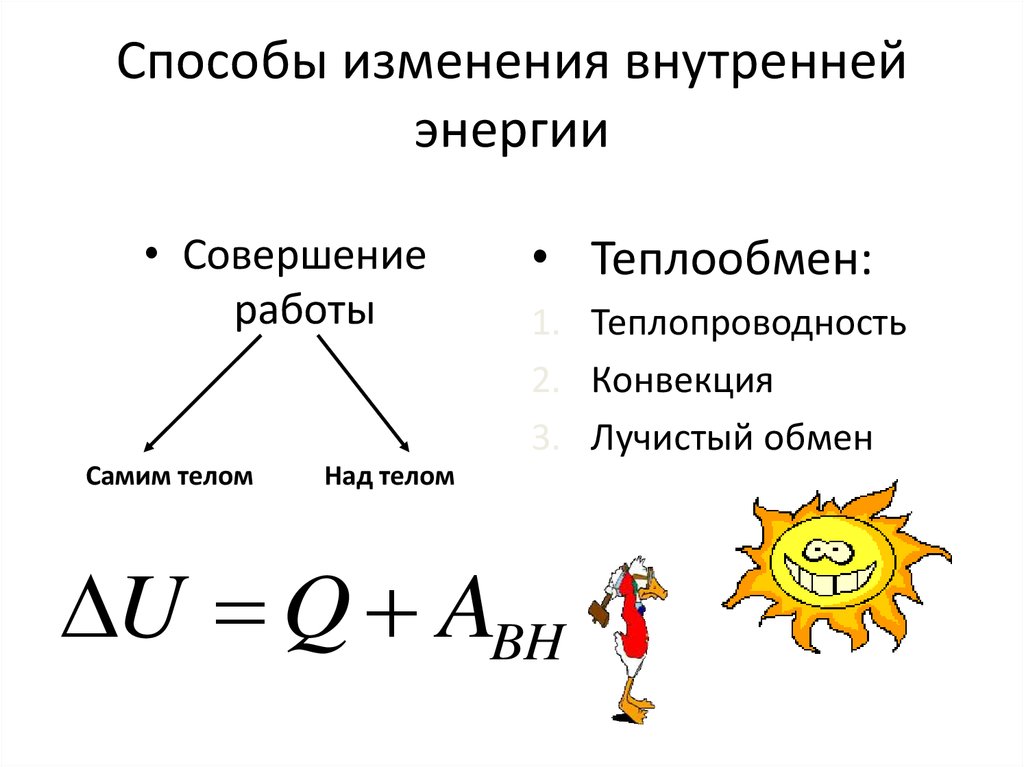
6. Способы изменения внутренней энергии
• Совершениеработы
Самим телом
• Теплообмен:
1. Теплопроводность
2. Конвекция
3. Лучистый обмен
Над телом
U Q ABH
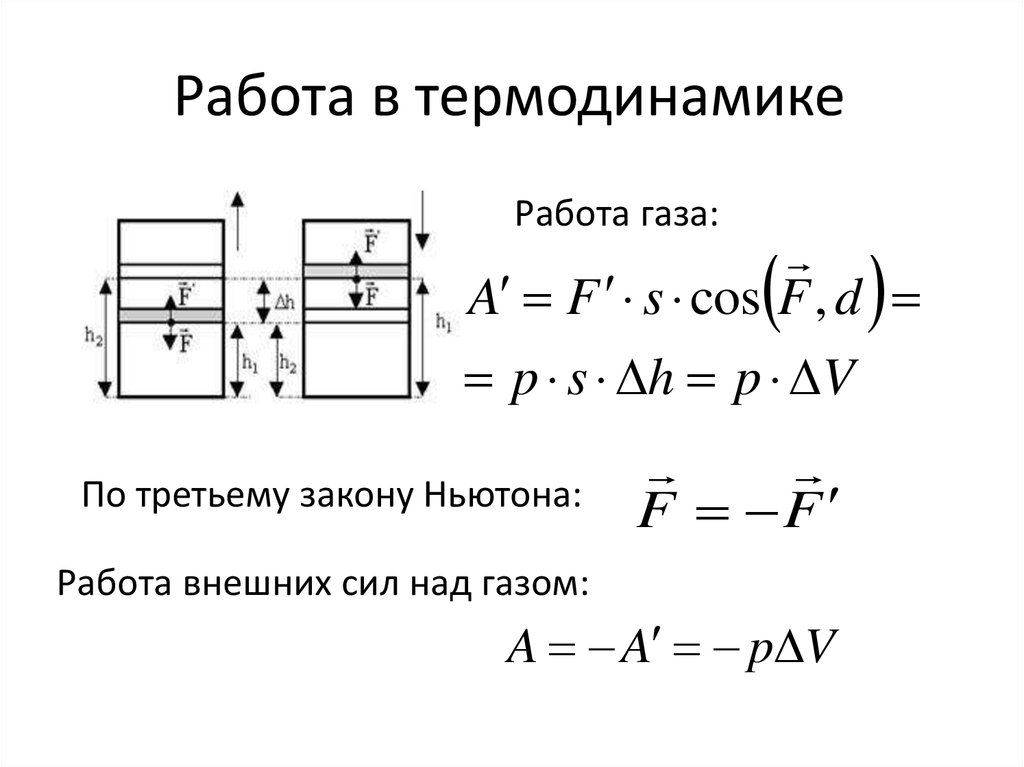
7. Работа в термодинамике
Работа газа:A F s cos F , d
p s h p V
По третьему закону Ньютона:
F F
Работа внешних сил над газом:
A A p V
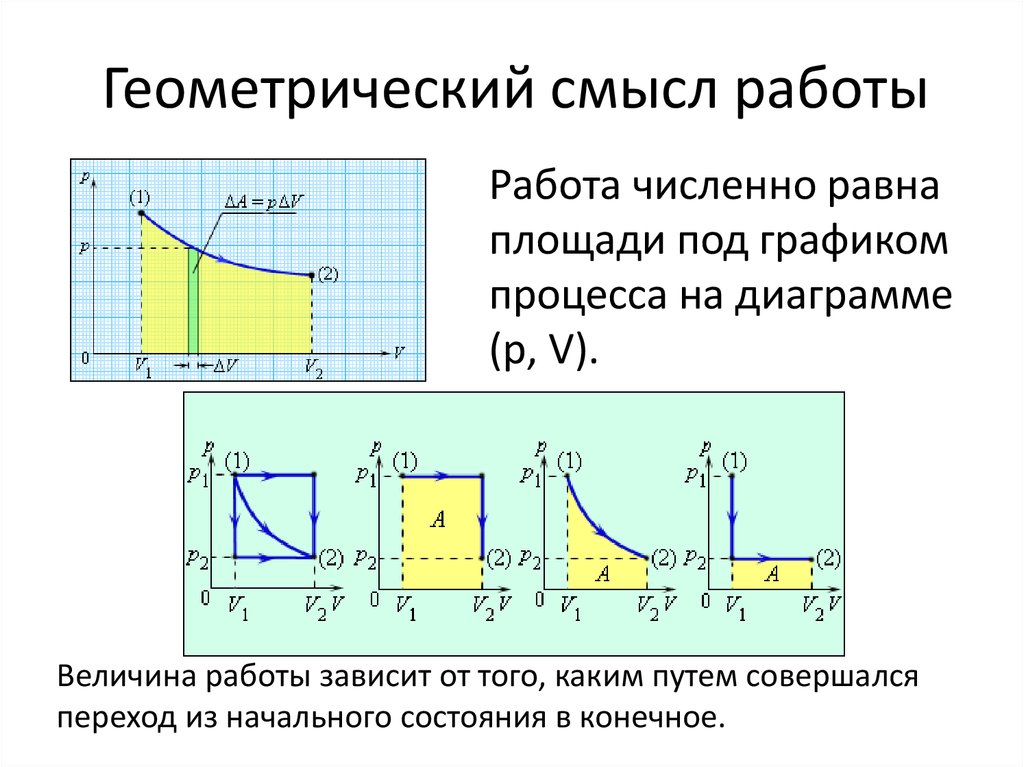
8. Геометрический смысл работы
Работа численно равнаплощади под графиком
процесса на диаграмме
(p, V).
Величина работы зависит от того, каким путем совершался
переход из начального состояния в конечное.
9. Работа газа при изобарном нагревании
рV2 vRT2A p V vR T
рV1 vRT1
V > 0, работу совершает газ
V < 0, работу совершают
внешние силы над газом
10. Первый закон термодинамики
Q U AПодводимая к системе теплота расходуется на совершение
газом работы и изменение его внутренней энергии
Q cm T C T Cmv T
•с - удельная теплоемкость вещества
•С – теплоемкость системы
•Сm – молярная теплоемкость вещества
11. Применение первого закона термодинамики к изобарному процессу
Q U A С p v Ti
А р V vR T
U vR T
2
i
i 2
Q vR T vR T
vR T
2
2
Q
i 2
Сp
R
v T
2
12. Применение первого закона термодинамики к изохорному процессу
V 0 A 0Q U
i
U vR T СV v T
2
i
Q
i
СV
R
Q vR T
v T 2
2
i 2
i
С р СV
R R R
2
2
13. Теорема Майера
i 2i
С р СV
R R R
2
2
Газовая постоянная численно равна работе
которую совершает 1 моль газа при
изобарном нагревании на 1 К
А vR T
14. Применение первого закона термодинамики к изотермическому процессу
Т 0 U 0Q А
Q
СТ
v T
V2
А vRT ln
V1
15. Адиабатный процесс
• протекает без теплообмена с окружающейсредой
Q 0 A U
i
i
А U vR T vR T1 Т 2
2
2
pV const
i 2
i











 Физика
Физика