Похожие презентации:
Коррозия металлов
1. Коррозия металлов
2.
23. Химическая коррозия
• Химическая коррозия – процессразрушения металла в результате
протекания гетерогенных реакций без
возникновения тока в системе.
• Газовая коррозия:
t
2 Fe 3SO2 3O2 Fe2 ( SO4 ) 3
• Жидкостная коррозия:
R1 S R2 Me MeS R1 R2
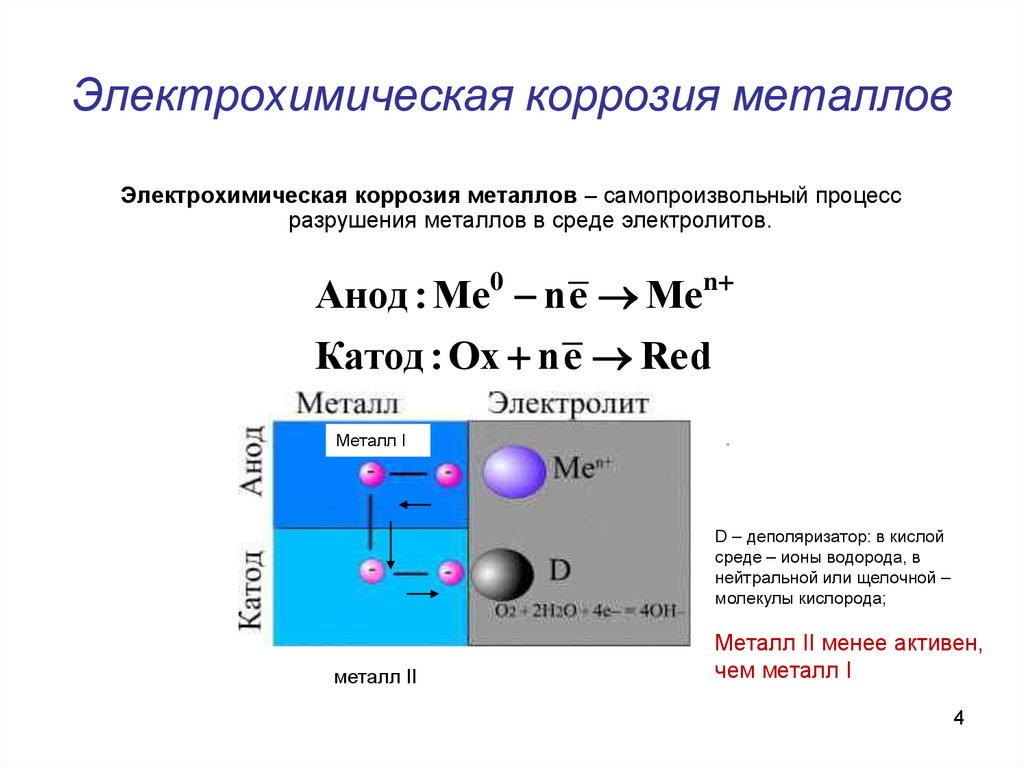
4. Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – самопроизвольный процессразрушения металлов в среде электролитов.
Анод : Me0 ne Men
Катод : Ох ne Red
Металл I
D – деполяризатор: в кислой
среде – ионы водорода, в
нейтральной или щелочной –
молекулы кислорода;
металл II
Металл II менее активен,
чем металл I
4
5. Катодные процессы при протекании коррозии по электрохимическому механизму
В щелочной и нейтральнойсредах:
В кислых средах:
2 H 2e H 2
Водородная деполяризация
(1)
O2 2 H 2O 4e 4OH
Кислородная деполяризация
(2)
6. Причины электрохимической коррозии
7. Контакт двух разных металлов (в кислой среде)
00
EFe
0
,
44
B
,
E
0,34B
2
/ Fe
Cu 2 / Cu
Fe2
Так как
Fe
е
Cu
0
0
EFe
E
,
2
/ Fe
Cu 2 / Cu
H
то контакт двух разных металлов
приводит к тому, что разрушаться
будет железо:
H2
pH<7
Рис. 12. Контакт двух
металлов: железо-медь,
в кислой среде
А( ) : Fe0 2e Fe 2
K ( ) : 2 H 2e H 2
0
Fe0 2H Fe2 H 2
8. Контакт двух разных металлов (щелочная и нейтральная среды)
Если контакт двух металлов происходит в указанных средах, то анодныйпроцесс будет таким же, как и в предыдущем случае, а на катоде
энергетически более выгодным становится восстановление кислорода:
А( ) : Fe0 2e Fe2
K ( ) : O2 2 H 2O 4e 4OH
Fe0 O2 2H 2O 2Fe2 4OH 2Fe(OH ) 2
Образующийся гидроксид железа (II) подвергается
последующему окислению:
4Fe(OH ) 2 O2 2H 2O 4Fe(OH )3
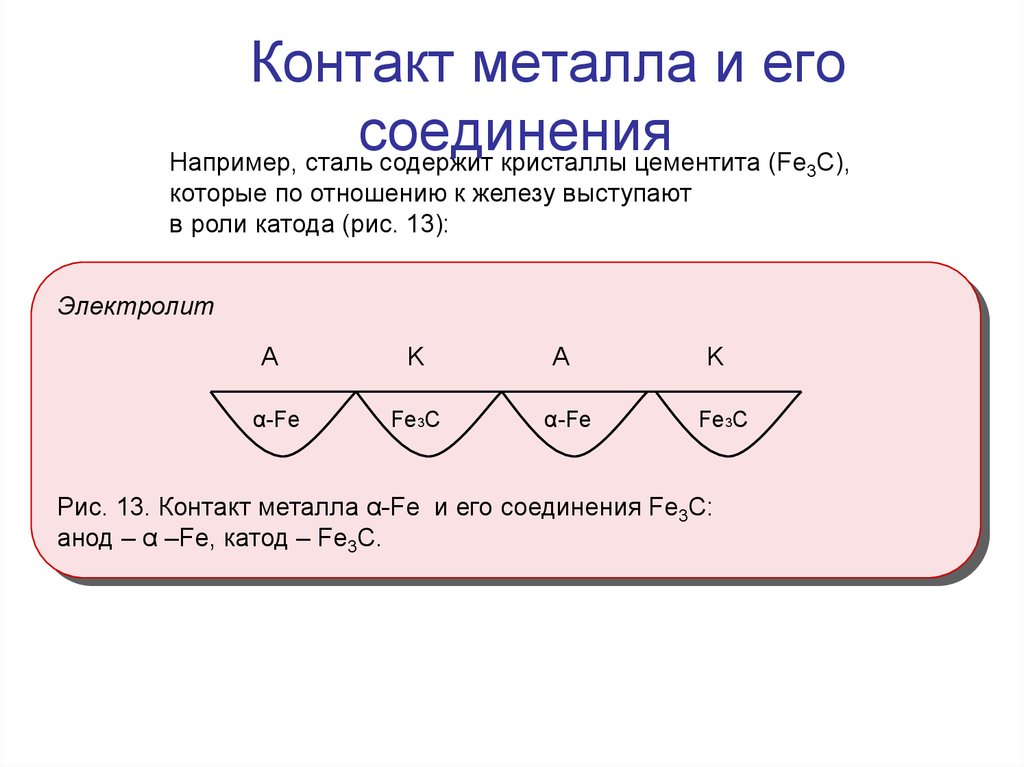
9. Контакт металла и его соединения
Например, сталь содержит кристаллы цементита (Fe C),3
которые по отношению к железу выступают
в роли катода (рис. 13):
Электролит
A
α-Fe
K
Fe3C
A
α-Fe
K
Fe3C
Рис. 13. Контакт металла α-Fe и его соединения Fe3C:
анод – α –Fe, катод – Fe3C.
10. Неодинаковый доступ воздуха (кислорода) к участкам поверхности металла (неравномерная аэрация)
Электродный потенциал окисленного участка выше, чем неокисленного.Окисленные участки выполняют функцию катода. Так, например, если
на стальной предмет нанести каплю воды, то корродировать будет
средняя, а не внешняя часть смоченного металла (рис. 14.). В середине
капли доступ воздуха к металлу затруднен, и этот участок выполняет
функцию анода. На участках с большим доступом кислорода
протекает катодный процесс.
O2
А( ) : Fe 2e Fe
0
O2
O2
H2O
Рис. 14. Неравномерный доступ
кислорода к участкам металла,
на поверхность нанесена капля воды
2
K ( ) : O2 2H 2O 4e 4OH
Fe O2 2H 2O 2Fe(OH ) 2
0
11. Коррозия под действием «блуждающих токов»
Вследствие плохого контакта рельсов на стыках и недостаточной изоляции их от земли, частьтока уходит в почву и находит пути с низким сопротивлением, например, подземные
газопроводы,водопроводные трубы. В зоне К вблизи рель- са восстанавливается кислород,
растворенный во влаге грунта. В результате соз- дается избыток ион ОН-:
О2 2Н 2О 4е 4ОН
Наличие этих ионов смещает равновесие, имеющееся на поверхности металла, из которого
сделано подземное сооружение, например, железная труба:
Fe 0 2e Fe 2
Связывание ионов железа гидроксид-ионами приводит к появлению в данном месте трубы
повышенной концентрации избыточных электронов. Эти электроны начинают перемещаться
вдоль трубы. Одновременно в зоне А происходит окислительный процесс. Металл рельса
разрушается. Т.о., в зоне К корродирует подземная труба, в зоне А – рельс.
11
12. Защита от коррозии
13. Защита от коррозии
Все методы защиты металлов от коррозии условноделят на следующие группы:
изоляция поверхности металла от окружающей среды;
электрохимическая защита;
применение конструкционных металлических материалов
с повышенной коррозионной стойкостью;
ингибиторы коррозии.
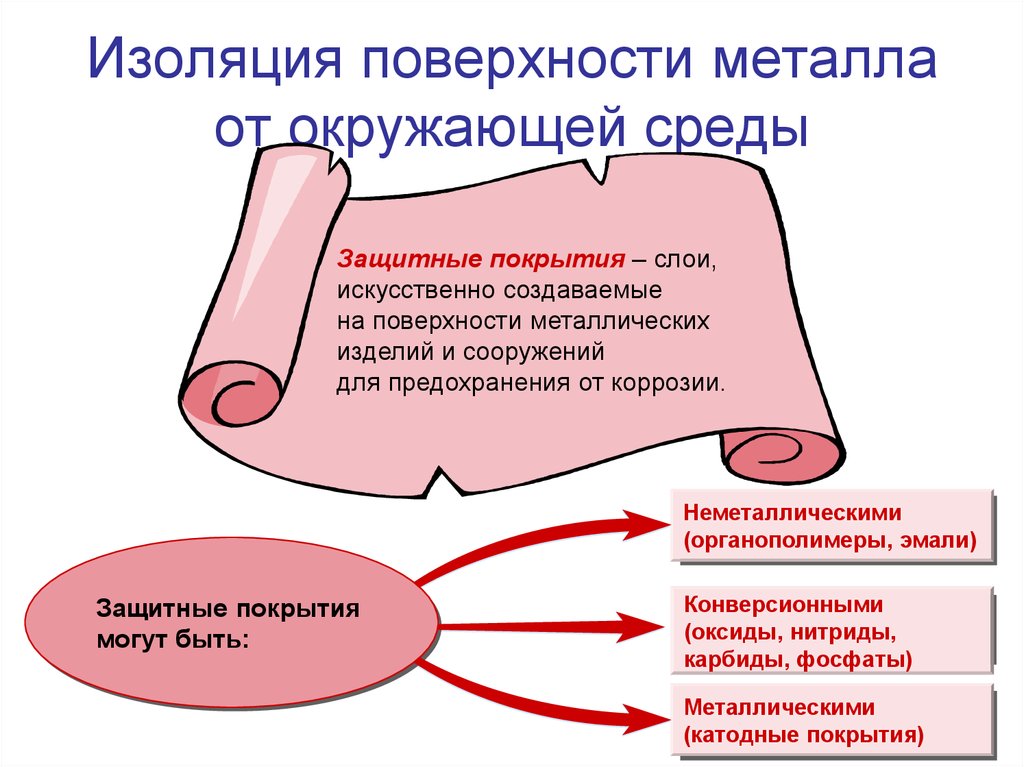
14. Изоляция поверхности металла от окружающей среды
Защитные покрытия – слои,искусственно создаваемые
на поверхности металлических
изделий и сооружений
для предохранения от коррозии.
Неметаллическими
(органополимеры, эмали)
Защитные покрытия
могут быть:
Конверсионными
(оксиды, нитриды,
карбиды, фосфаты)
Металлическими
(катодные покрытия)
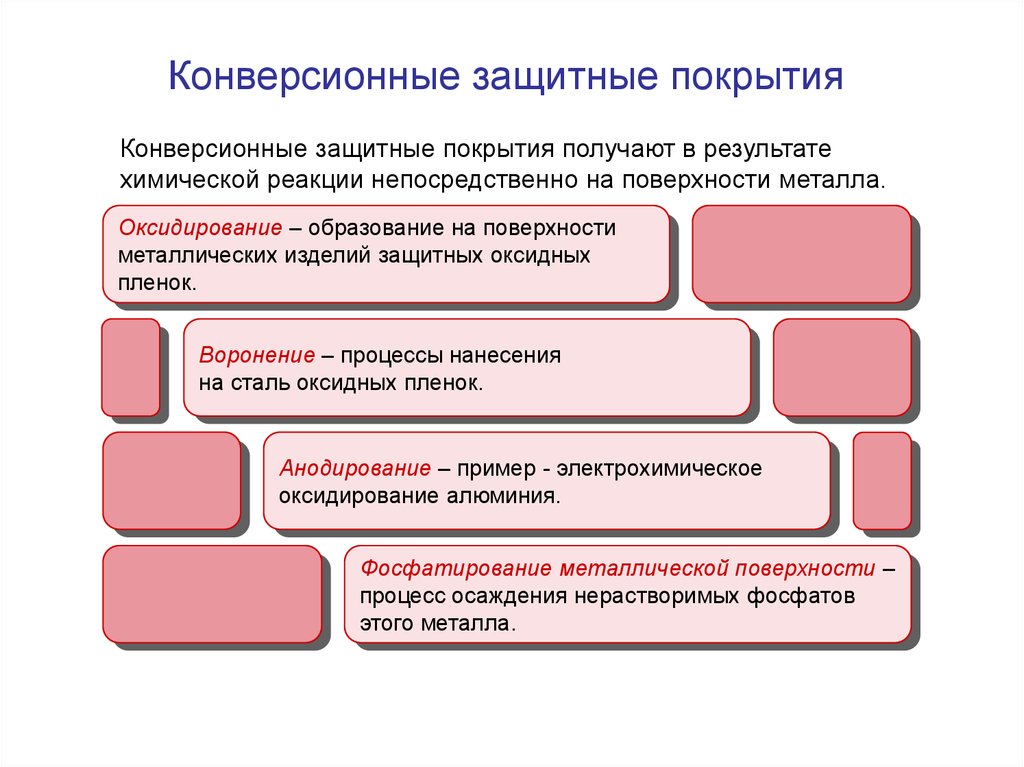
15. Конверсионные защитные покрытия
Конверсионные защитные покрытия получают в результатехимической реакции непосредственно на поверхности металла.
Оксидирование – образование на поверхности
металлических изделий защитных оксидных
пленок.
Воронение – процессы нанесения
на сталь оксидных пленок.
Анодирование – пример - электрохимическое
оксидирование алюминия.
Фосфатирование металлической поверхности –
процесс осаждения нерастворимых фосфатов
этого металла.
16. Металлические защитные покрытия. Катодные покрытия
Катодные защитные покрытия – это покрытия металлом,электродный потенциал которого в данных условиях положительнее
потенциала защищаемого металла, например, луженое железо.
При нарушении целостности катодного защитного покрытия
разрушается защищаемый металл. В случае луженого железа,
при нарушении целостности защитного покрытия разрушается железо, т. к.:
0
0
2
Sn / Sn
Fe2 / Fe
0,14 В, E
E
A : Fe 2e Fe
0
2
K : 2 H 2e H 2
2
Fe 2H Fe H 2
0
0,44 В
Fe2+
pH<7
ē
H+
H2
ē
Рис. 19. Схема повреждения
катодного защитного покрытия
в кислой среде
17. Электрохимическая защита. Анодные металлические покрытия
Анодные защитные покрытия – это покрытия металлом, электродныйпотенциал которого в данных условиях отрицательнее потенциала
защищаемого металла, например, оцинкованное железо. При нарушении
целостности анодного защитного покрытия разрушается металл
покрытия. В случае оцинкованного железа, при нарушении
целостности защитного покрытия разрушается цинк, т. к.:
0
0
EZn
0
,
76
В
,
E
0,44 В
2
/ Zn
Fe2 / Fe
A : Zn 2e Zn
0
2
K : 2 H 2e H 2
2
Zn 2H Zn H 2
0
H+
pH<7
ē
Zn2+
H2
ē
Рис. 18. Схема повреждения
анодного защитного покрытия
в кислой среде
18. Протекторная защита
анод - болееактивный ме
катод – менее
активный металл
Схема протекторной защиты
Анод (Ме-протектор):
Катод (Ме трубы) :
Ме 0 ne Me n
2Н 2е Н 20
( среда – кислая )
18
19.
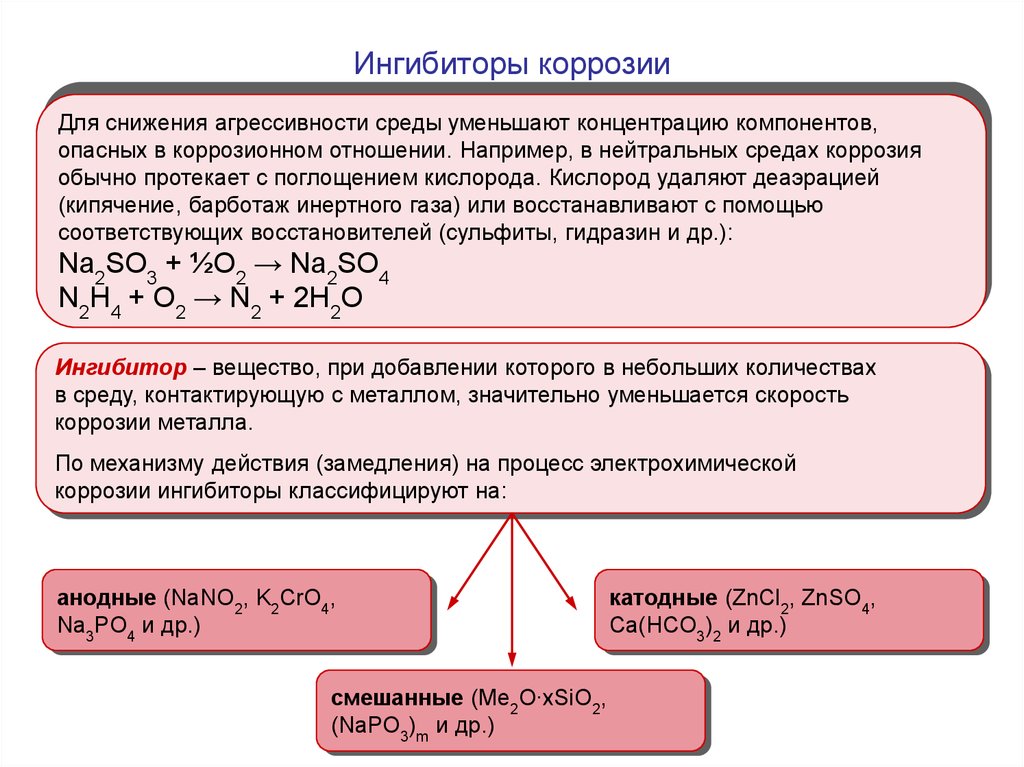
1920. Ингибиторы коррозии
Для снижения агрессивности среды уменьшают концентрацию компонентов,опасных в коррозионном отношении. Например, в нейтральных средах коррозия
обычно протекает с поглощением кислорода. Кислород удаляют деаэрацией
(кипячение, барботаж инертного газа) или восстанавливают с помощью
соответствующих восстановителей (сульфиты, гидразин и др.):
Na2SO3 + ½O2 → Na2SO4
N2H4 + O2 → N2 + 2H2O
Ингибитор – вещество, при добавлении которого в небольших количествах
в среду, контактирующую с металлом, значительно уменьшается скорость
коррозии металла.
По механизму действия (замедления) на процесс электрохимической
коррозии ингибиторы классифицируют на:
анодные (NaNO2, K2CrO4,
Na3PO4 и др.)
смешанные (Me2O∙xSiO2,
(NaPO3)m и др.)
катодные (ZnCl2, ZnSO4,
Ca(HCO3)2 и др.)















 Химия
Химия








