Похожие презентации:
Физиология мышц
1. ФИЗИОЛОГИЯ МЫШЦ
Физиологические свойства мышцОбмен веществ, раздражимость, возбудимость,
возбуждение, торможение.
проводимость; сократимость; эластичность;
пластичность.
Обеспечение позы тела человека, перемещение тела и его
частей в пространстве, движение крови по сосудам, дыхание,
образование тепла и др.
2. Классификация мышечных волокон
медленные фазическиеволокна окислительного типа (с высоким содержанием
миоглобина, много митохондрий, устойчивы к утомлению,
быстро восстанавливаются, "красные мышцы"); участвуют в
поддержании позы тела человека;
быстрые фазические
волокна окислительного типа (много митоходрий, устойчивы к
утомлению, участвуют в выполнении быстрых энергичных
движений, АТФ образуется путем окислительного
фосфорилирования);
3.
Классификация мышечных волоконбыстрые фазические
волокна с гликолитическим типом окисления (митохондрий мало,
осуществляют быстрые, сильные сокращения, но сравнительно,
быстро утомляются, миоглобин в них отсутствует - "белые
мышцы"; АТФ образуется за счет гликолиза;
тонические волокна
сокращение и расслабление медленное, эффективно работают
в изометрическом режиме, не подчиняются закону "все или
ничего"...;
4.
Типы мышечныхсокращений
Режимы мышечных
сокращений
- Изотоническое
- одиночное;
- изометрическое
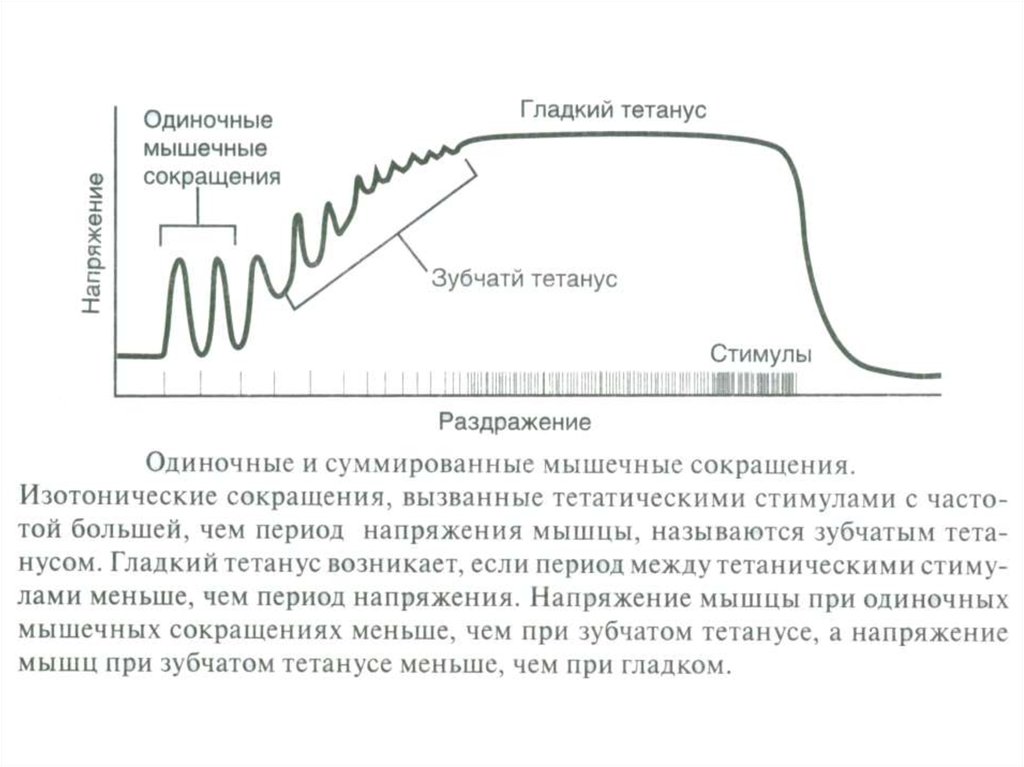
- Тетанус
(гладкий, зубчатый;).
- ауксометрическое
(смешанное,
промежуточное)
5.
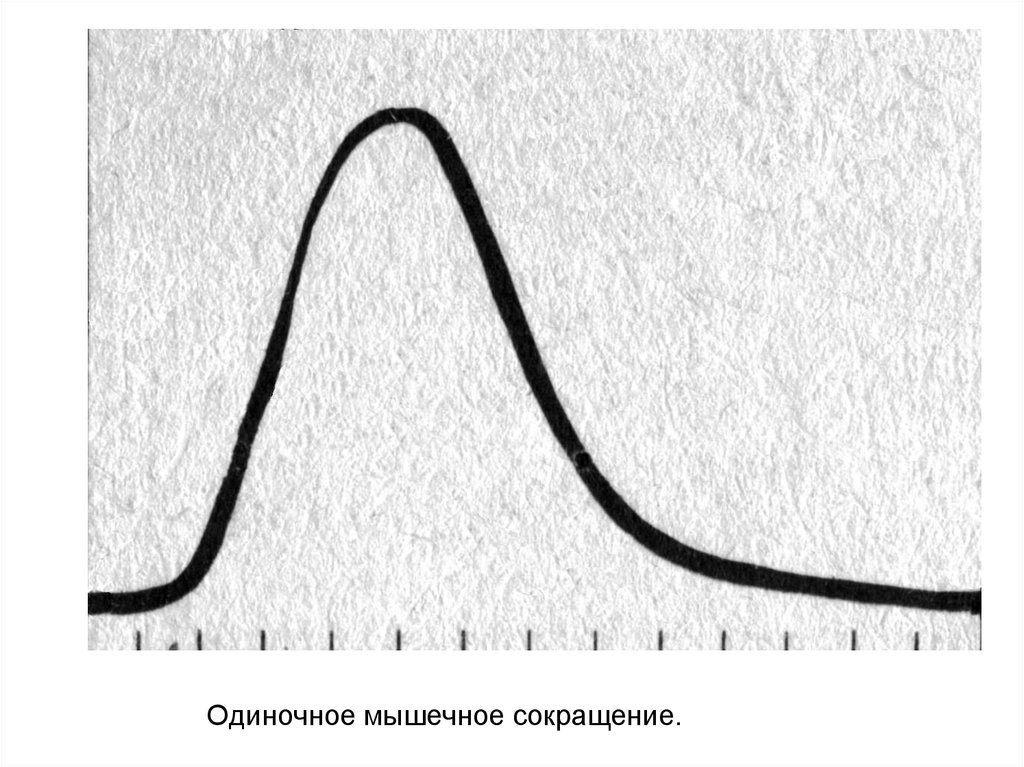
Одиночное мышечное сокращение.6.
7.
8. Моторная единица (двигательная, нейромоторная ) мотонейрон с группой иннервируемых им мышечных волокон. Мотонейронный пул –
группа мотонейронов, иннервирующихопределенную мышцу
Виды двигательных единиц
Медленные мало утомляемые (тонические) ДЕ
(красные волокна)
Быстрые (фазные) легко утомляемые ДЕ
(белые волокна)
Быстрые устойчивые к утомлению
В мышце имеются, как правило, все виды ДЕ, но в разных соотношениях.
9.
Функциональные особенностиМедленные мало утомляемые (тонические) ДЕ
(красные волокна)
- иннервируются небольшими и высоко возбудимыми альфа-мотонейронами
с низкой скоростью проведения возбуждения по аксону и частотой
импульсации 6—10 Гц;
- количество мышечных волокон в ДЕ сравнительно небольшое, они имеют
меньшее количество миофибрилл и развивают меньшую силу сокращения;
- волокна имеют низкую активность миозиновой АТФазы и низкую скорость
сокращения;
- имеют хорошее кровоснабжение, много митохондрий, миоглобина,
высокий аэробный обмен, поэтому обладают низкой утомляемостью.
Способны выполнять длительную маломощную работу;
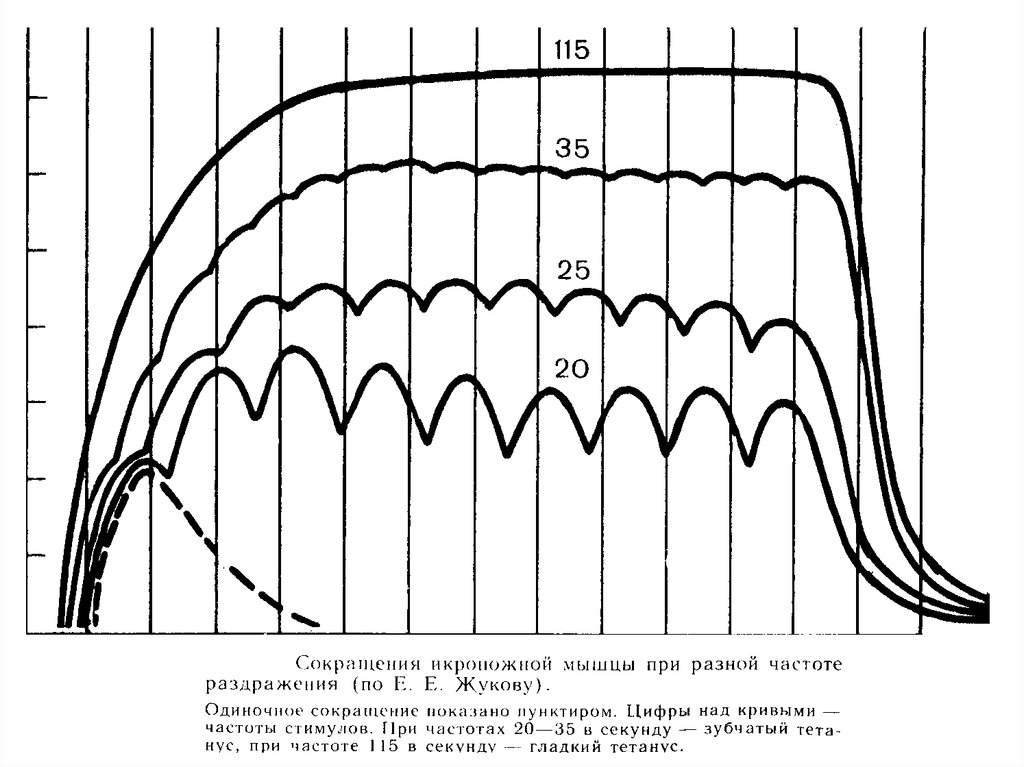
- дают гладкий тетанус при небольшой частоте разряда мотонейрона (около
16 Гц);
- в регуляции движения обеспечивают мышечный тонус и позу, а также
способность к длительной циклической работе — бегу, плаванию и др.
(например, у марафонцев их количество в мышцах ног достигает 85 %);
- длительность сокращения более 100 мс, не подчиняются закону «все или
ничего»
10.
Быстрые (фазные) легко утомляемые ДЕ(белые волокна)
- иннервируются крупными менее возбудимыми альфа-мотонейронами с
высокой скоростью проведения ПД по аксону и частотой импульсации
примерно 50 Гц;
- количество мышечных волокон в ДЕ сравнительно большое;
- содержат большое число миофибрилл и развивают большую силу
сокращения;
- имеют высокую активность миозиновой АТФазы и развивают высокую
скорость сокращения;
- имеют слаборазвитую капиллярную сеть, мало митохондрий, миоглобина,
но содержат много гликолитических ферментов, большой запас
креатинфосфата и гликогена, анаэробный тип энергообеспечения;
- способны развивать большую мощность, но быстро утомляются;
- дают гладкий тетанус при большей частоте разряда мотонейрона (около 30
Гц);
- в регуляции движения обеспечивают преимущественно фазический
компонент — перемещение организма и его частей в пространстве с большой
скоростью и мощностью (например, у спринтеров и прыгунов количество
быстрых ДЕ в мышцах ног достигает 90 %);
- длительность сокращения 10-30 мс; гладкий тетанус возникает при большей
частоте;
11.
Быстрые устойчивые к утомлению ДЕпо структурно-функциональным свойствам занимают
среднее положение между медленными и быстрыми ДЕ
(вероятно, используются в быстрых ритмических движениях:
ходьбе, беге).
12.
Абсолютная сила скелетных мышц (6—17 кг/см2)максимальная произвольная сила — 50 —80 % абсолютной
-
Факторы, определяющие силу сокращения мышцы
соотношение медленных и быстрых ДЕ (композиция мышцы);
- число активных ДЕ, их включение в соответствии с возбудимостью их
мотонейронов;
- режим работы активных ДЕ (одиночное сокращение, зубчатый и гладкий
тетанус);
- величина физиологического сечения мышцы (сумма поперечного сечения всех
ее волокон; в перистых мышцах она больше геометрического сечения);
-
длина мышцы и сила сокращения;
- сила сокращения мышцы (точнее саркомера) пропорциональна зоне
перекрытия актиновых и миозиновых нитей, т. е. количеству образующихся
актомиозиновых мостиков. Наибольшая сила развивается при длине мышцы в
состоянии покоя;
- при укорочении или удлинении мышцы на 50 % зона перекрытия нитей и сила
сокращения резко снижаются.
13. Оптимум и пессимум частоты и силы сокращения.
Вответ
на
ритмическое
раздражение
амплитуда
мышечного
сокращения
увеличивается
с
увеличением
частоты
раздражения до определенной величины
(оптимум). При дальнейшем увеличении
частоты стимуляции амплитуда мышечного
сокращения резко снижается и при какой-то
частоте,
несмотря
на
продолжающуюся
стимуляцию,
мышца
почти
полностью
расслабляется (пессимум).
14.
Теория мышечного сокращения и расслабления.Хаксли, Хью англ. биолог
Хаксли, Эндрю (1917-2012)
исследовал ультраструктуру
мышечной ткани; сформулировал
теорию, объясняющую мышечное
сокращение скольжением белковых
нитей (1954)
Лауреат Нобелевской премии,
создатель
теории
происхождения
потенциала действия (совместно
с
Ходжкиным и Экклсом),
теории мышечного сокращения (1954)
15.
16. Теория мышечного сокращения и расслабления.
Сократительные белки:Миозин - обладает длинной прямой цепью с двумя глобулярными
головками, каждая из которых содержит зону связывания с АТФ и
зону связывания с актином.
Актин – состоит из двух винтообразных тяжей полимеризованных
субъединиц (g-актин) с локусами, которые взаимодействуют с
головками молекул миозина для образования поперечных мостиков
с толстыми волоконами.
Тропомиозин - регуляторный белок фиброзного типа, расположенный
в желобке винтообразного тяжа актина, который препятствует
взаимодействию актина и миозина, когда мышца находится в покое.
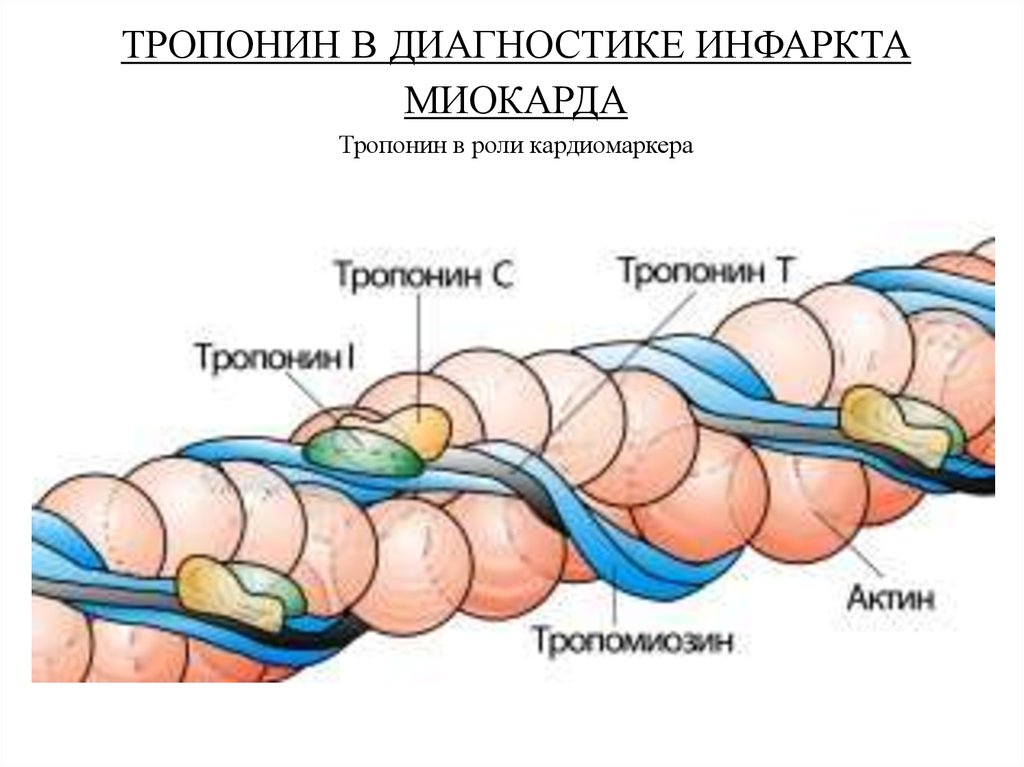
Тропонин - регуляторный белок, состоящий из трех субъединиц:
тропонина С (связывает ионы Са++ во время активации и
инициирует изменения конфигурации регуляторных белков);
тропонина Т (привязывает комплекс тропонина С и тропонина I к
тропомиозину); и тропонина I (участвует в ингибировании
взаимодействия актина и миозина в состоянии покоя).
17.
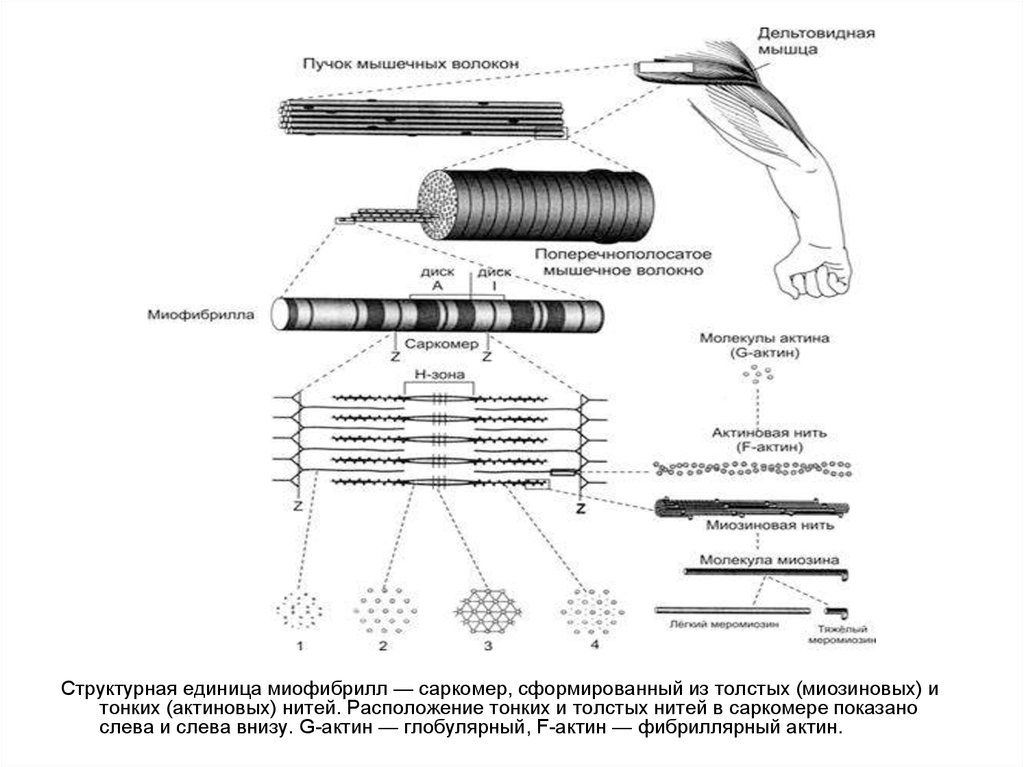
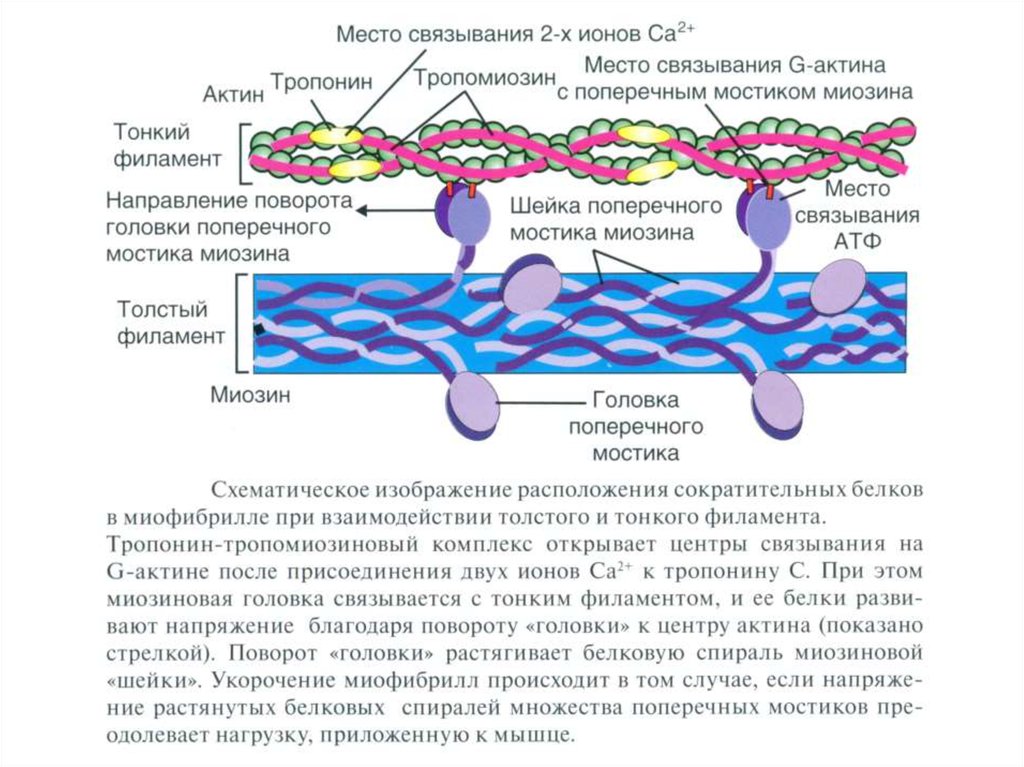
Структурная единица миофибрилл — саркомер, сформированный из толстых (миозиновых) итонких (актиновых) нитей. Расположение тонких и толстых нитей в саркомере показано
слева и слева внизу. G-актин — глобулярный, F-актин — фибриллярный актин.
18.
19.
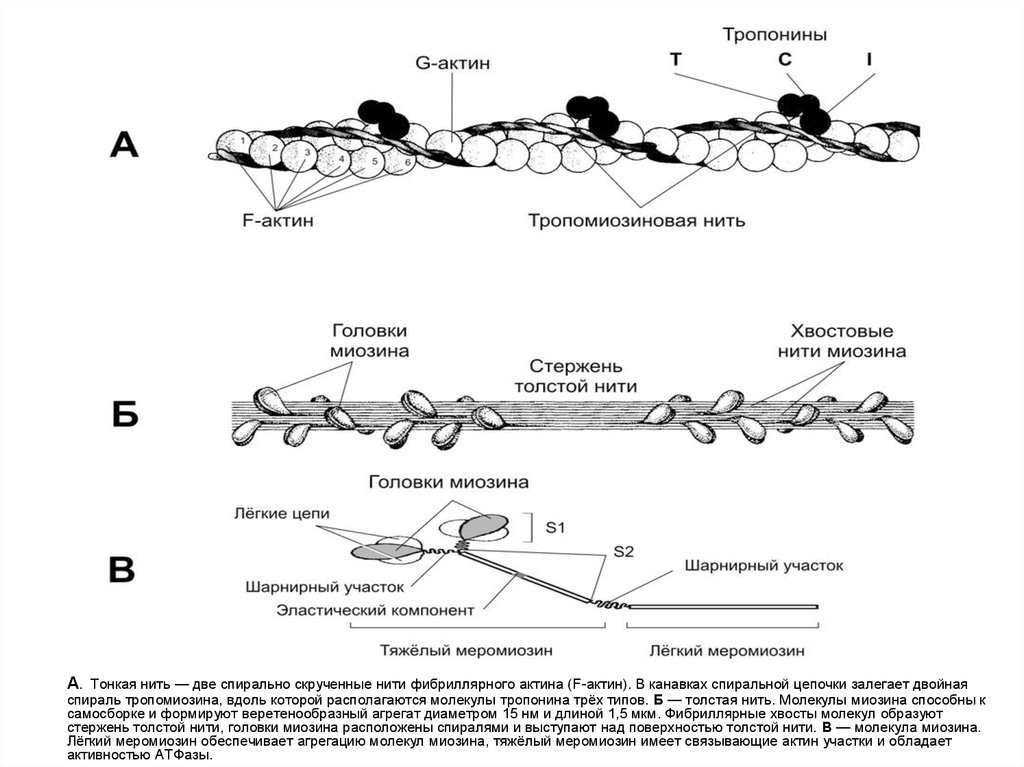
А. Тонкая нить — две спирально скрученные нити фибриллярного актина (F-актин). В канавках спиральной цепочки залегает двойнаяспираль тропомиозина, вдоль которой располагаются молекулы тропонина трёх типов. Б — толстая нить. Молекулы миозина способны к
самосборке и формируют веретенообразный агрегат диаметром 15 нм и длиной 1,5 мкм. Фибриллярные хвосты молекул образуют
стержень толстой нити, головки миозина расположены спиралями и выступают над поверхностью толстой нити. В — молекула миозина.
Лёгкий меромиозин обеспечивает агрегацию молекул миозина, тяжёлый меромиозин имеет связывающие актин участки и обладает
активностью АТФазы.
20.
Распространение потенциала действия по сарколемме мышечного волокна и выбросионов кальция из цистерн саркоплазматического ретикулума
21.
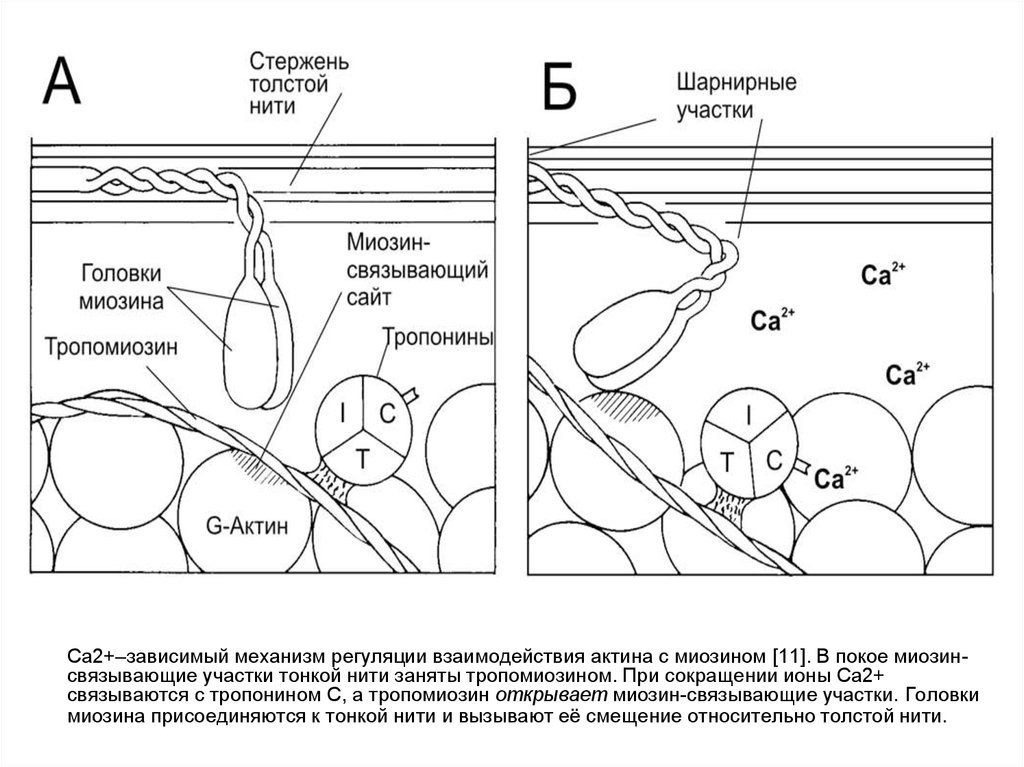
Ca2+–зависимый механизм регуляции взаимодействия актина с миозином [11]. В покое миозинсвязывающие участки тонкой нити заняты тропомиозином. При сокращении ионы Ca2+связываются с тропонином С, а тропомиозин открывает миозин-связывающие участки. Головки
миозина присоединяются к тонкой нити и вызывают её смещение относительно толстой нити.
22.
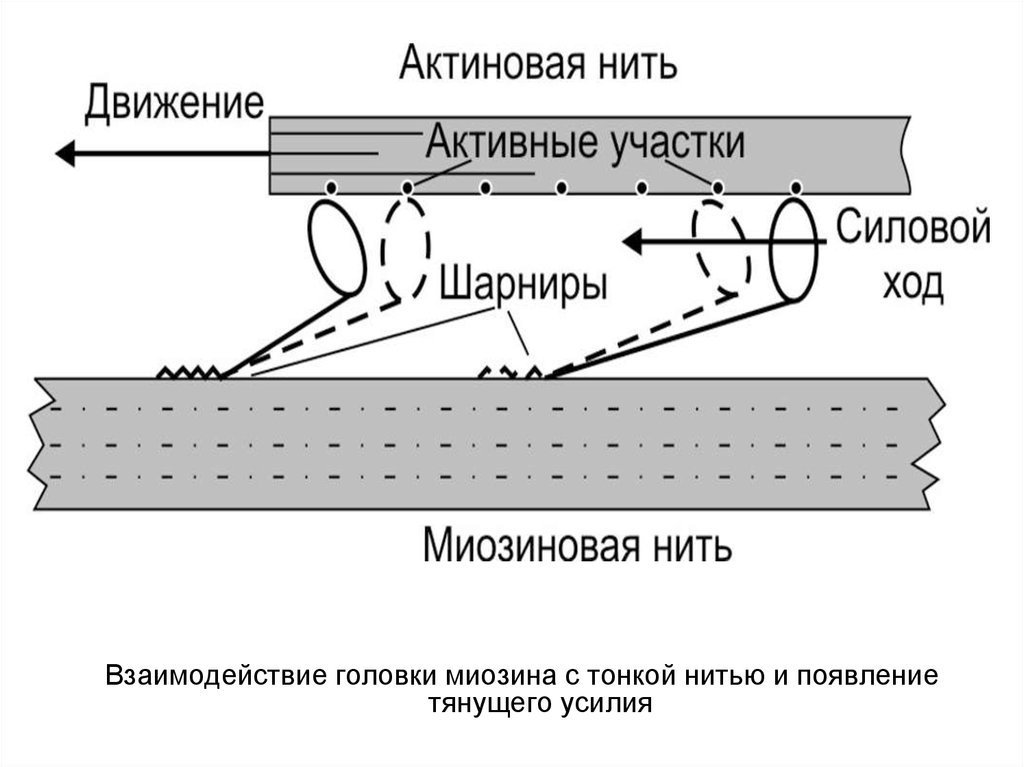
Взаимодействие головки миозина с тонкой нитью и появлениетянущего усилия
23.
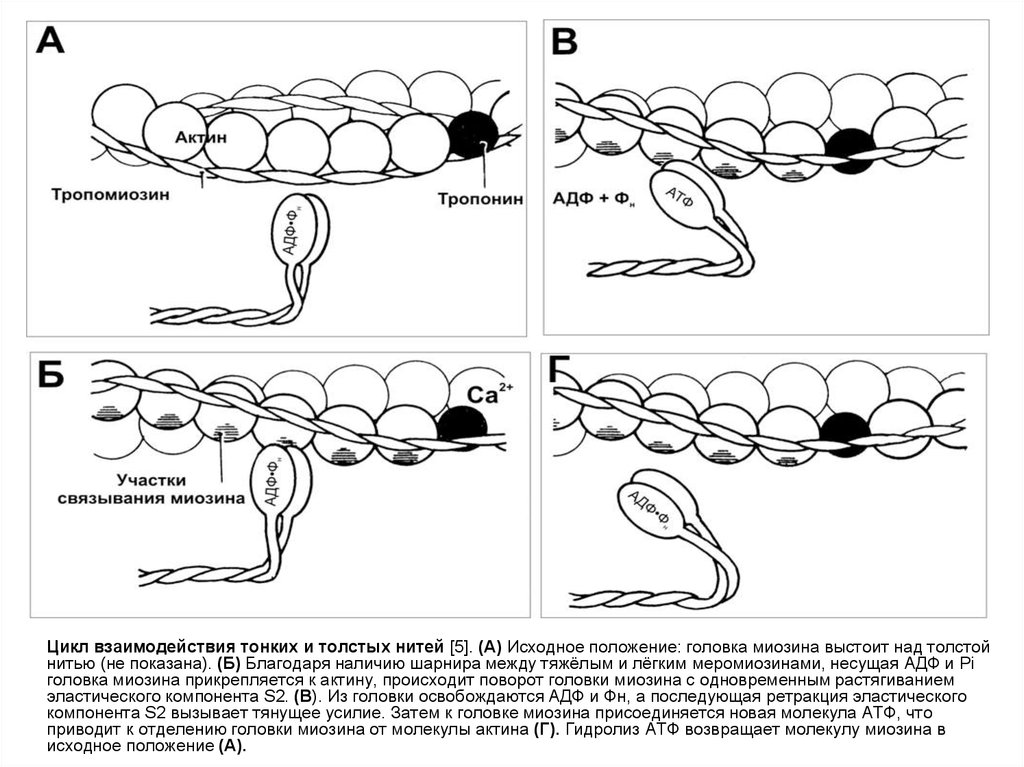
Цикл взаимодействия тонких и толстых нитей [5]. (А) Исходное положение: головка миозина выстоит над толстойнитью (не показана). (Б) Благодаря наличию шарнира между тяжёлым и лёгким меромиозинами, несущая АДФ и Pi
головка миозина прикрепляется к актину, происходит поворот головки миозина с одновременным растягиванием
эластического компонента S2. (В). Из головки освобождаются АДФ и Фн, а последующая ретракция эластического
компонента S2 вызывает тянущее усилие. Затем к головке миозина присоединяется новая молекула АТФ, что
приводит к отделению головки миозина от молекулы актина (Г). Гидролиз АТФ возвращает молекулу миозина в
исходное положение (А).
24.
25. Схема процесса сокращения - Потенциал действия (ПД) мембраны мышцы; - потенциал действия (ПД) Т – системы; - активация мембраны
саркоплазматического ретикулума;- выход ионов Са++ и повышение их концентрации до пороговой
величины;
- активация актомиозина (с распадом АТФ);
- снятие тропонин-тропомиозиновой блокады;
- образование «мостиков» и их конформационные изменения;
- движение нитей т.е. сокращение;
- прекращение действия нервного импульса;
- снижение концентрации ионов Са++;
- тропонин-тропомиозиновая блокада;
- распад «мостиков» ---расслабление мышцы.
26.
Энергетика мышечногосокращения
АТФ в мышце необходима для:
- сокращения (образование мостиков);
- расслабления (разрыва мостиков);
- работы Са-насоса;
работы
Nа-К-насоса
нарушенных
ионных
возбуждении).
(для
ликвидации
градиентов
при
27.
Три основных механизма ресинтеза АТФ- креатинфосфокиназный (КФ, фосфагенный; перенос фосфата
с креатинфосфата к АДФ; образуется до 3,6 моль АТФ в мин.);
самый мощный;
- гликолитический (окислительное фосфорилирование АДФ в
митохондриях; до 1,2 моль АТФ в мин.);
-
аэробное
окисление
(окислительный;
окислительное
фосфорилирование АДФ в митохондриях; при окислении глюкозы
АТФ образуется до 0,8 моль/мин, при окислении жиров до 0,4 моль
в мин.).
28.
29.
30.
31.
ТРОПОНИН В ДИАГНОСТИКЕ ИНФАРКТАМИОКАРДА
Тропонин в роли кардиомаркера





















 Биология
Биология