Похожие презентации:
Ионное произведение воды. Водородный показатель
1.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЛекция 9
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
2. Содержание
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСодержание
Электролитическая диссоциация воды
Ионное произведение воды
Водородный показатель (рН)
Определение рН водных растворов
Буферные растворы
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
3. Диссоциация воды
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАДиссоциация воды
Упрощенная запись уравнения диссоциации воды :
H2O
H+ + OH
Константа диссоциации воды
[H ][OH ]
K
1,8 10 16
[H2O]
при 298 К
При повышении температуры возрастают концентрации
ионов H+ и OH
T, K
([H ] [OH ]) 107
273
293
298
323
353
373
0,34 0,78 1,05 2,44 5,02 7,40
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
4. Ионное произведение воды Kw
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАИонное произведение воды Kw
[H ][OH ]
K
[H2O]
K w K[H2O]
K w [H ][OH ]
[H2O] CH
O
2
m 1000
55,56 моль
л
MV 18 1
K w 1,8 10 16 55,56 10 14
при Т=298 К
При повышении температуры Kw увеличивается
t,0C
25
50
70
100
Kw1014
1,0
5,5
15,8
55,0
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
5. Концентрации ионов H+ и OH−
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАКонцентрации ионов H+ и OH−
K w [H ][OH ]
[H ]
Kw
[OH ]
[OH- ]
Kw
[H ]
Расчет [H+] и [OH-] в 0,01 М растворе NaOH
NaOH = Na+ + OH[OH ] CNaOH 10- 2 моль / л
[H ]
Kw
[OH ]
10 14
10 2
10 12 моль/л
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
6. Водородный показатель рН
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВодородный показатель рН
pH = -lg [H+]
Расчет рН 0,01 М раствора соляной кислоты
HCl = H+ + Cl
[H ] CHCl 10 2 моль/л
pH lg10 2 2
Расчет рН 0,1 М раствора гидроксида калия
КОН = К+ + ОН-
[OH ] CKOH 10-1моль / л
[H ]
Kw
[OH ]
10 14
10 1
10 13 моль/л
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
pH lg10 13 13
7. Расчет рН 0,01 М раствора HBrO
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет рН 0,01 М раствора HBrO
HBrO - слабый электролит
HBrO
H+ + BrO−
[H ][BrO ]
K
2,2 10 9
[HBrO]
[H+] = [BrO−]
[HBrO] CHBrO
[H ]2
K
CHBrO
[H ] K CHBrO 2,2 10 9 0,01 4,7 10-5 моль / л
pH lg(4,7 10 5 ) 4,3
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
8. Расчет рН 0,01 М раствора аммиака
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет рН 0,01 М раствора аммиака
Гидрат аммиака NH3 H2O - слабый электролит
NH3 H2O
NH 4 OH
[NH 4 ][OH ]
K
1,8 10 5
[NH3 H2O]
[NH 4 ] [OH ]
[OH- ]2
K
CNH H O
3
2
[NH3 H2O] СNH3 H2O
[OH ] K CNH
3
H O
2
1,8 10 5 10 2 4,2 10 4 моль/л
pOH lg[OH ] lg(4,2 10 4 ) 3,4
рН=14 – 3,4 = 10,6
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
9. Количественные характеристики среды
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАКоличественные
характеристики среды
Нейтральная среда
7
14
[H ] [OH ] K W 10
10 моль/л
pH lg10
Кислая среда
7
[H ] [OH ]
7
lg[H ] lg10
Щелочная среда
7
lg[H ] lg10
7
7
[H ] 10 моль/л
lg[H ] 7
[H ] [OH ]
lg[H ] 7
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
pH 7
7
[H ] 10 моль/л
pH 7
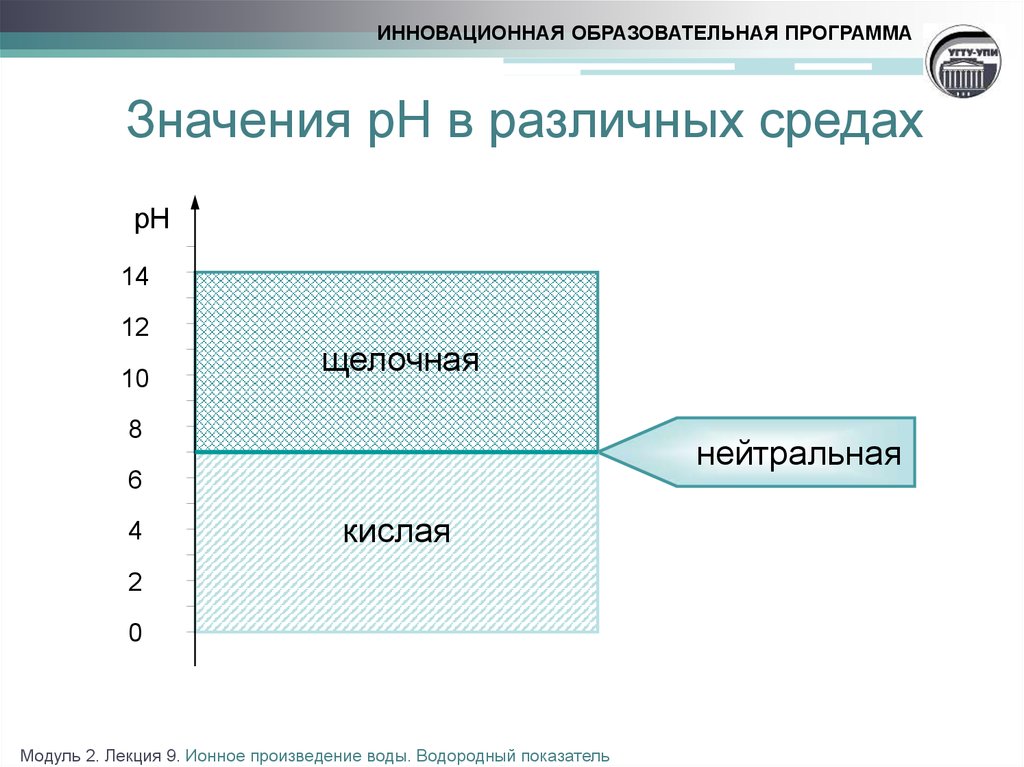
10. Значения рН в различных средах
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗначения рН в различных средах
pH
14
12
10
щелочная
8
нейтральная
6
4
кислая
2
0
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
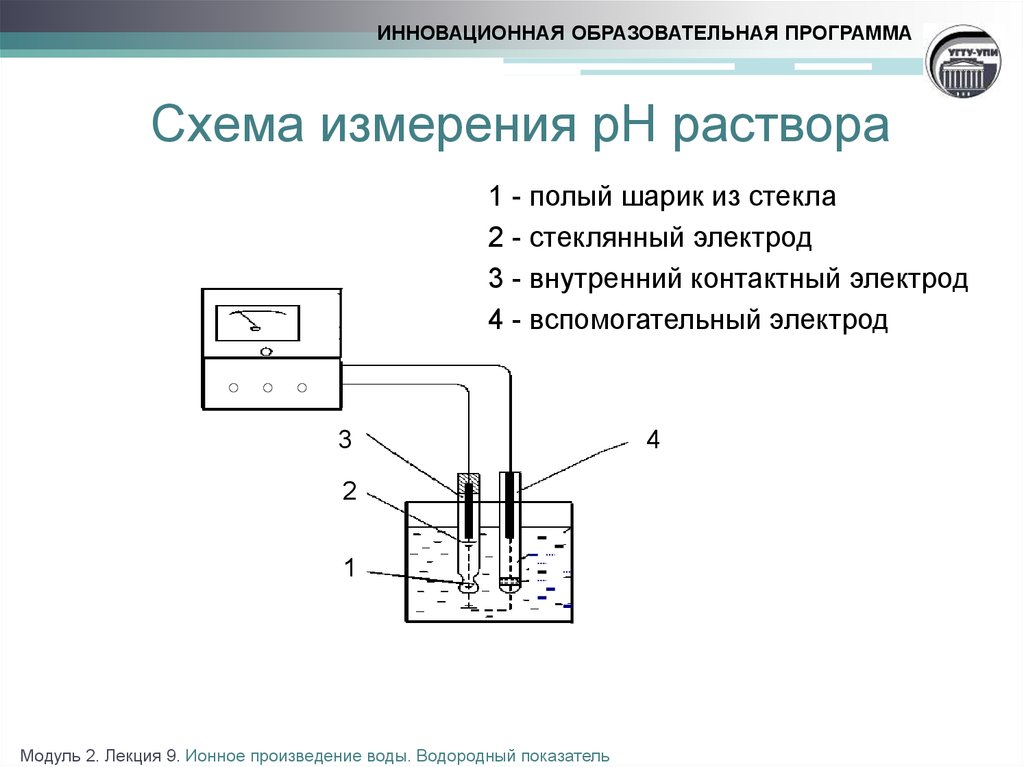
11. Схема измерения рН раствора
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСхема измерения рН раствора
1 - полый шарик из стекла
2 - стеклянный электрод
3 - внутренний контактный электрод
4 - вспомогательный электрод
3
2
1
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
4
12. Прибор для измерения рН
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАПрибор для измерения рН
рН-метр «ЭКСПЕРТ-рН»
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
13. Индикатор фенолфталеин
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАИндикатор фенолфталеин
H+
HInd
бесцветный
+
малиновый
в кислой среде
1
2
3
4
5
Ind
6
в щелочной среде
7
преобладает
молекулярная форма
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
8
9
10
11
преобладает
ионная форма
рН
14. Индикатор метиловый оранжевый
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАИндикатор метиловый оранжевый
HInd
H+ + Ind−
красный
желтый
в нейтральной и
щелочной среде
в кислой среде
1
2
3
4
5
6
7
преобладает
молекулярная форма
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
8
9
10
преобладает
ионная форма
рН
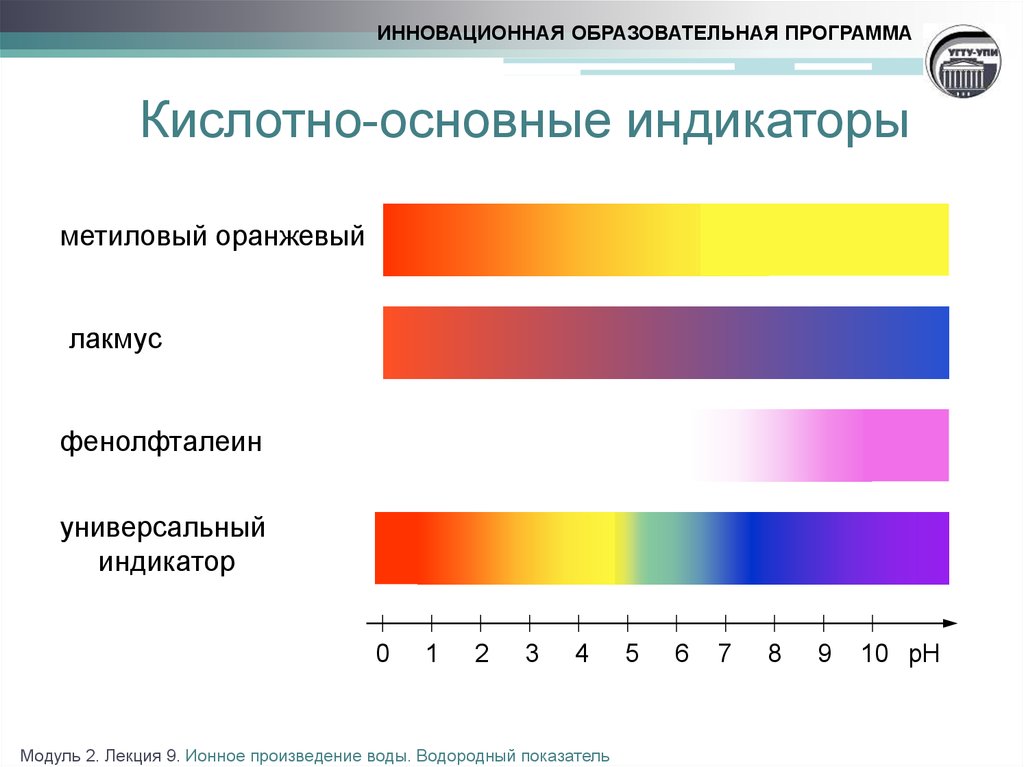
15. Кислотно-основные индикаторы
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАКислотно-основные индикаторы
метиловый оранжевый
лакмус
фенолфталеин
универсальный
индикатор
0
1
2
3
4
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
5
6
7
8
9
10 рН
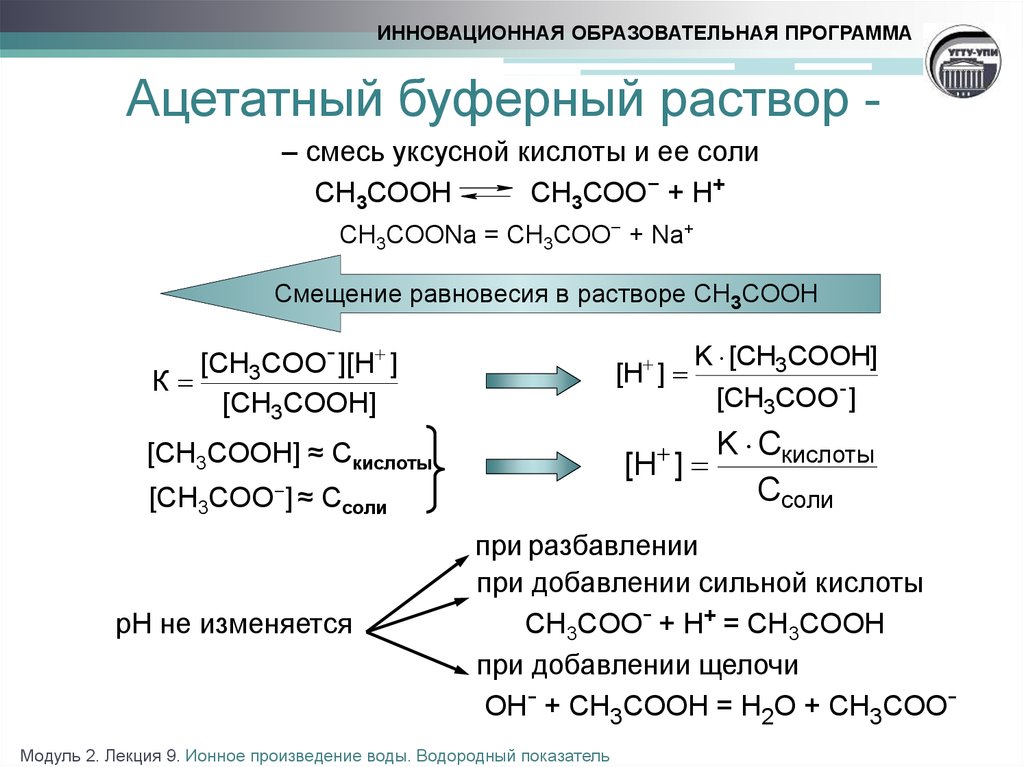
16. Ацетатный буферный раствор -
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММААцетатный буферный раствор – смесь уксусной кислоты и ее соли
СН3СООН
СН3СОО− + Н+
СН3СООNa = СН3СОО− + Na+
Смещение равновесия в растворе CH3COOH
[CH3COO- ][H ]
К
[CH3COOH]
[H ]
[CH3COO- ]
K Cкислоты
[H ]
Ссоли
[CH3COOH] ≈ Cкислоты
[CH3COO−] ≈ Ссоли
рН не изменяется
K [CH3COOH]
при разбавлении
при добавлении сильной кислоты
CH3COO- + H+ = CH3COOH
при добавлении щелочи
OH- + CH3COOH = H2O + CH3COO-
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
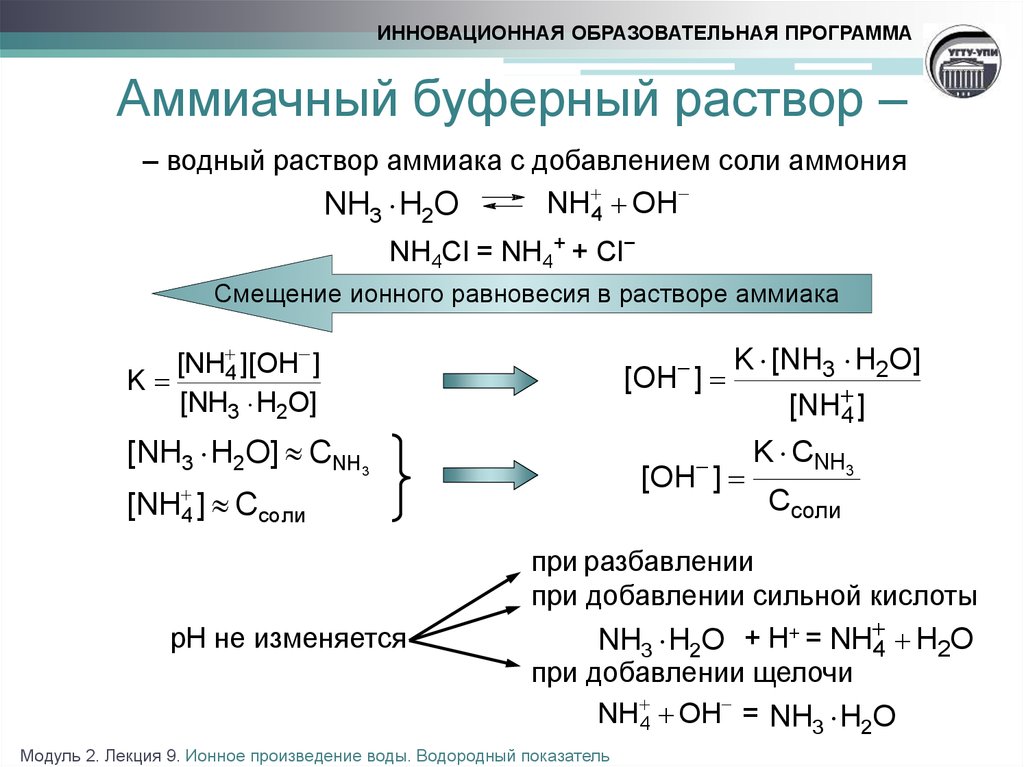
17. Аммиачный буферный раствор –
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММААммиачный буферный раствор –
– водный раствор аммиака с добавлением соли аммония
NH3 H2O
NH 4 OH
NН4Cl = NH4+ + Cl−
Смещение ионного равновесия в растворе аммиака
[NH 4 ][OH ]
K
[NH3 H2O]
[OH ]
[NH3 H2O] CNH3
[OH ]
[NH 4 ] Cсоли
pH не изменяется
K [NH3 H2O]
[NH 4 ]
K CNH3
Ссоли
при разбавлении
при добавлении сильной кислоты
NH3 H2O + H+ = NH 4 H2О
при добавлении щелочи
NH 4 OH = NH3 H2O
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
18. Заключение
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗаключение
Электропроводность чистой воды обусловлена ее
автопротолизом. Вода проявляет свойства слабого электролита
Для воды и разбавленных водных растворов значение ионного
произведения воды при данной температуре является
постоянной величиной
Водородный показатель рН является количественной
характеристикой кислотности или щелочности среды
Определение рН проводят с помощью приборов (рН-метров);
для приблизительной оценки рН используют кислотно-основные
индикаторы
Буферные растворы применяют для создания и сохранения
постоянства значений рН раствора в определенном диапазоне
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
19. Рекомендуемая литература
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Карапетьянц М.Х. Общая и неорганическая химия. - М.:
Химия, 2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк.,
2007
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы
неорганической химии. Под ред. Ю. Д. Третьякова. - М.:
Академия, 2004
Гаршин А.П. Неорганическая химия в схемах, рисунках,
таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш.
шк., 1994
Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель














 Химия
Химия








