Похожие презентации:
Спирты. Классификация
1. СПИРТЫ
12. Спирты
Спиртами называются производныеуглеводородов, в которых один или
несколько атомов водорода заменены на
гидроксильные группы.
2
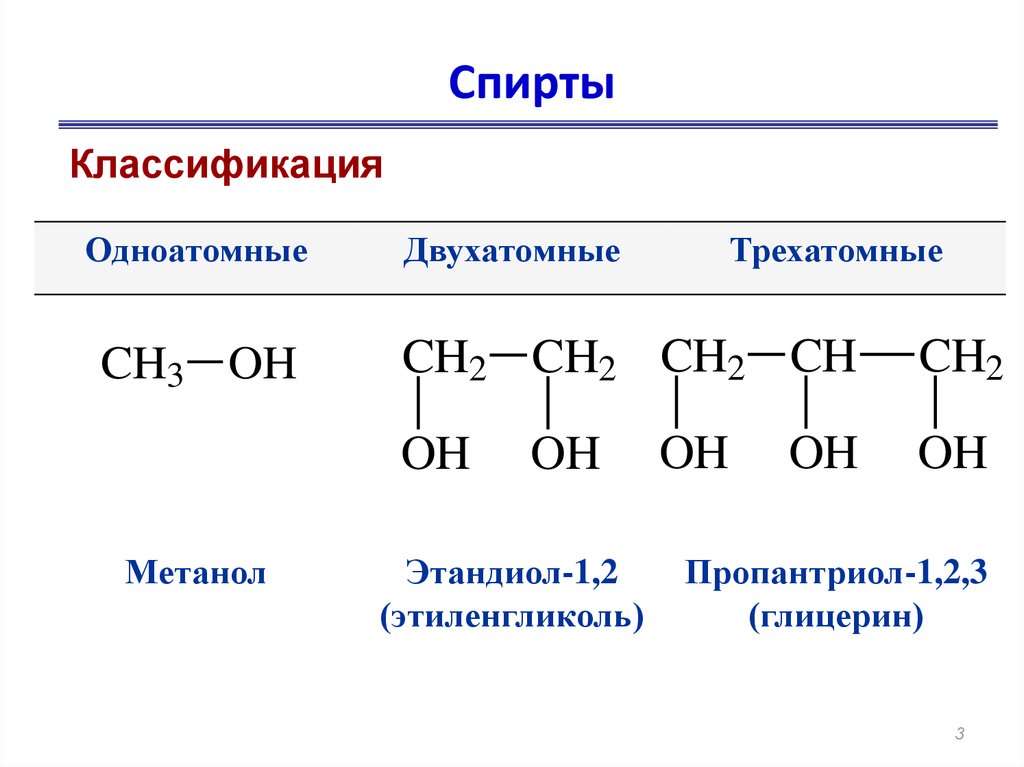
3. Спирты
КлассификацияОдноатомные
CH3 OH
Двухатомные
CH2 CH2 CH2 CH
OH
Метанол
Трехатомные
OH
Этандиол-1,2
(этиленгликоль)
OH
OH
CH2
OH
Пропантриол-1,2,3
(глицерин)
3
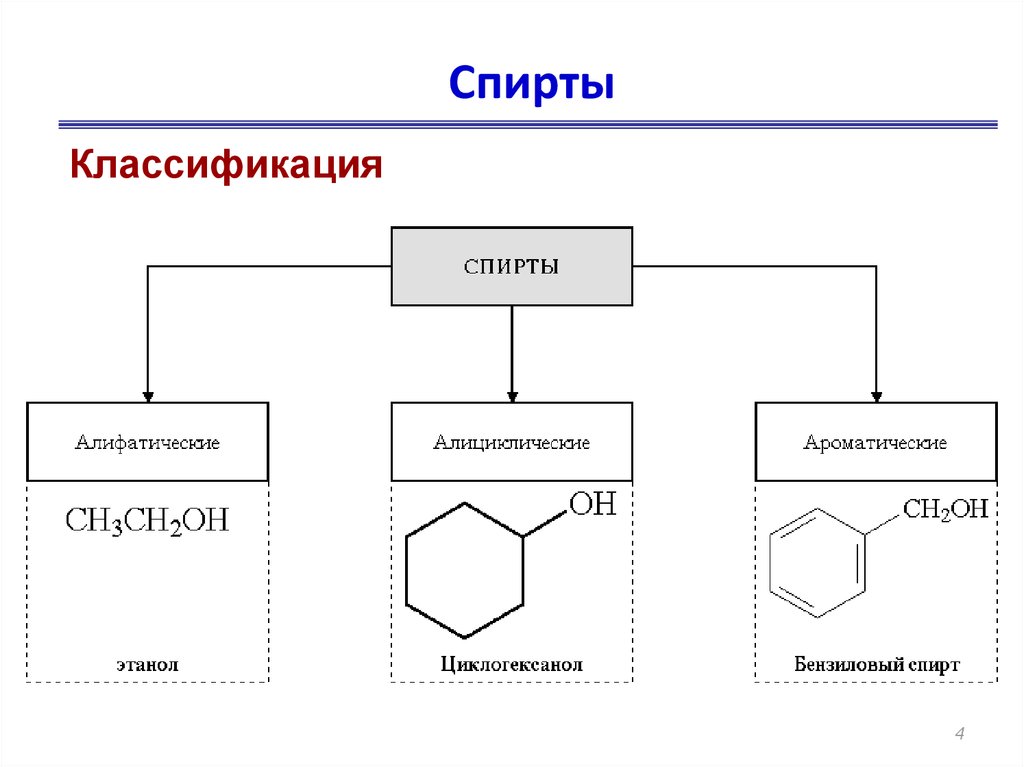
4. Спирты
Классификация4
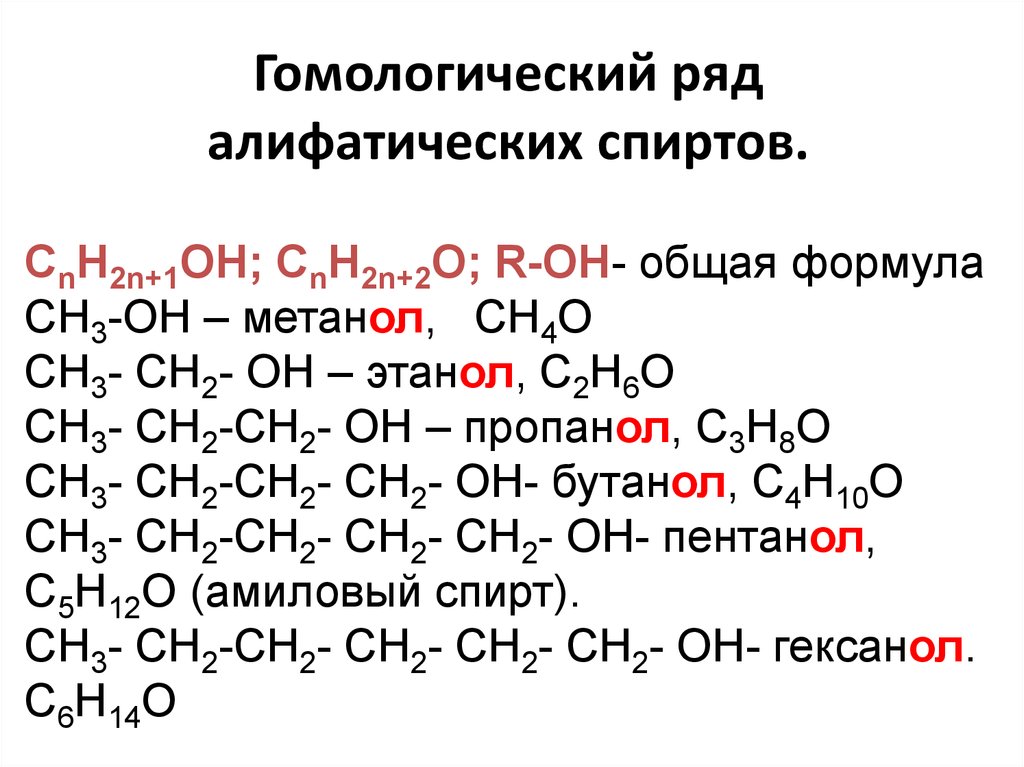
5. Гомологический ряд алифатических спиртов.
СnH2n+1OH; СnH2n+2O; R-OH- общая формулаCH3-OH – метанол, СH4O
СH3- CH2- OH – этанол, С2H6O
СH3- CH2-СH2- OH – пропанол, С3H8O
СH3- CH2-СH2- СH2- OH- бутанол, С4H10O
СH3- CH2-СH2- СH2- СH2- OH- пентанол,
С5H12O (амиловый спирт).
СH3- CH2-СH2- СH2- СH2- СH2- OH- гексанол.
С6H14O
6.
ПервичныеСН3-ОН
метанол
(метиловый спирт)
СН3-СН2-ОН
этанол
СН3-СН2- СН2-ОН
пропанол-1
( этиловый спирт)
СН3-СН2- СН2-CН2-OH
бутанол-1
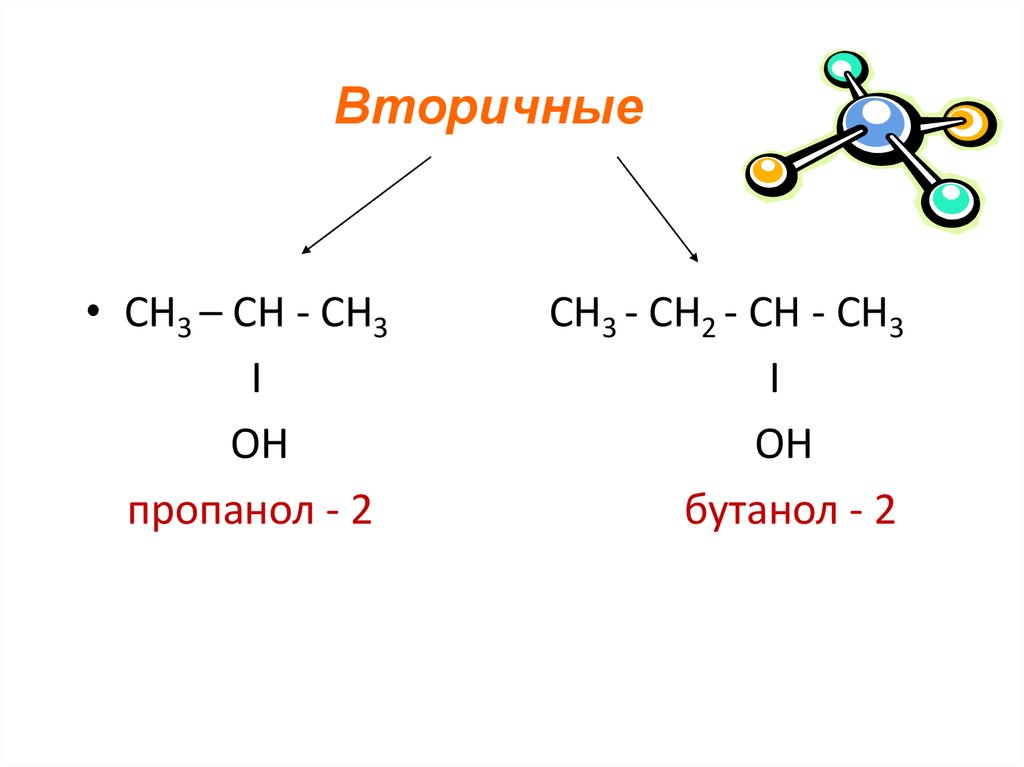
7.
Вторичные• СН3 – СН - СН3
I
OH
пропанол - 2
СН3 - СН2 - CH - СН3
I
OH
бутанол - 2
8.
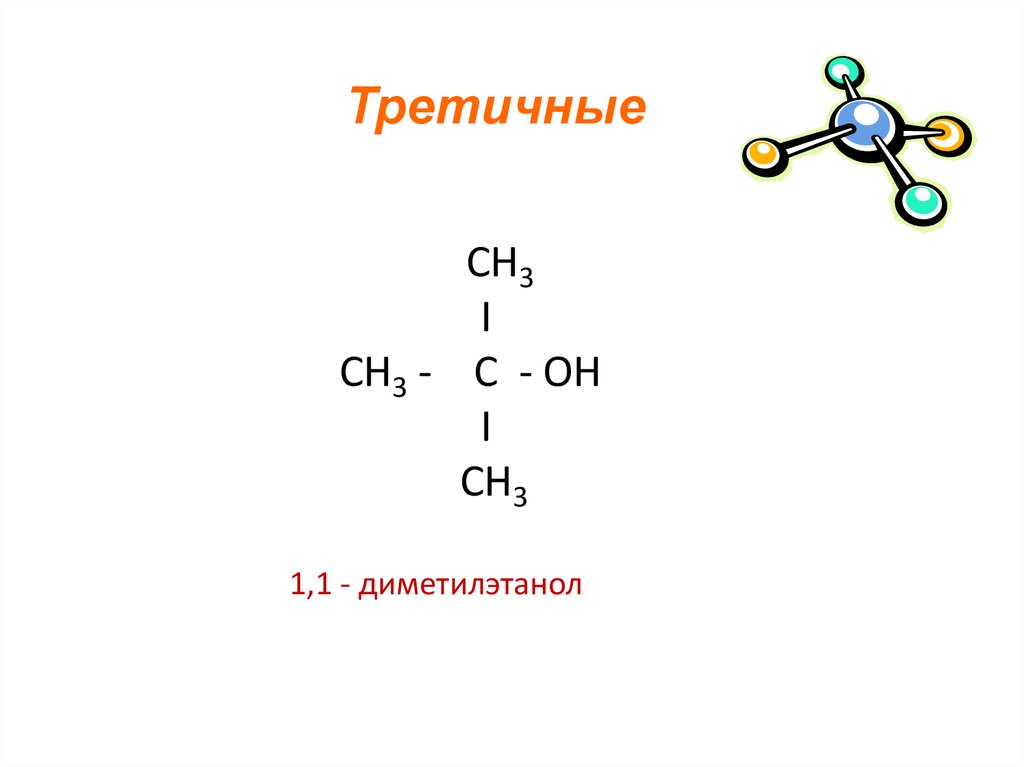
ТретичныеСН3
I
СН3 - C - OН
I
СН3
1,1 - диметилэтанол
9.
910.
1011. Ядовитость спиртов.
• Метиловый спирт – сильный яд!Несколько граммов его, попав в организм
человека, вызывает слепоту, а большее
количество приводит к смерти. Поэтому
метиловый спирт, используемый для
технических нужд, объязательно должен
носить название метанол – яд.
• https://www.youtube.com/watch?v=6FkdU5fF
MoU
• Время 8.10-12.00
12.
• Этиловый спирт(этанол) – бесцветнаяжидкость с характерным запахом.
• Спирт, содержащий 4-5% воды, называют
ректификатом, а только доли процента –
абсолютным спиртом.
Этиловый спирт,
получаемый брожением сахаристых веществ (в
присутствии ферментов, например, дрожжей)
называют пищевым или винным спиртом.
Спирт, получаемый из глюкозы, которую
получают гидролизом целлюлозы, называют
гидролизным.
12
13. Спирты
ЭтанолСпирты
Физические свойства
CH3CH2OH
J Bump
13
14. Физические свойства спиртов
Алканолы являются бесцветными жидкостями или кристаллическимивеществами с характерным запахом. Первые члены гомологического
ряда имеют приятный запах, для бутанолов и пентанолов запах
становится неприятным и раздражающим. Высшие алканолы имеют
приятный ароматный запах.
15.
• Спирты от С1 до С12 по агрегатномусостоянию – жидкости, высшие
спирты – твердые вещества.
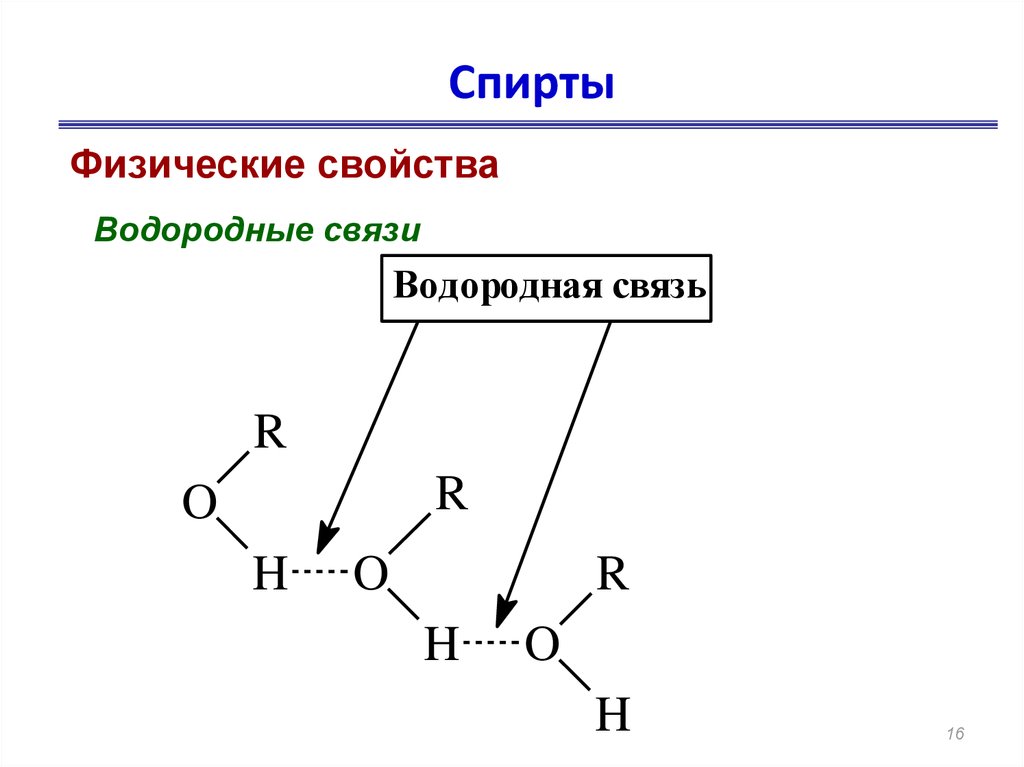
• В отличие от углеводородов спиртов
нет в газообразном состоянии. Это
связано с образованием водородных
связей.
• Спирты
–
растворители.
С
увеличением
относительной
молекулярной массы растворимость
спиртов
уменьшается.
Твердые
спирты в воде не растворимы.
• Температура кипения спиртов выше
чем у углеводородов.
16. Спирты
Физические свойстваВодородные связи
Водородная связь
R
R
O
H
O
R
H
O
H
16
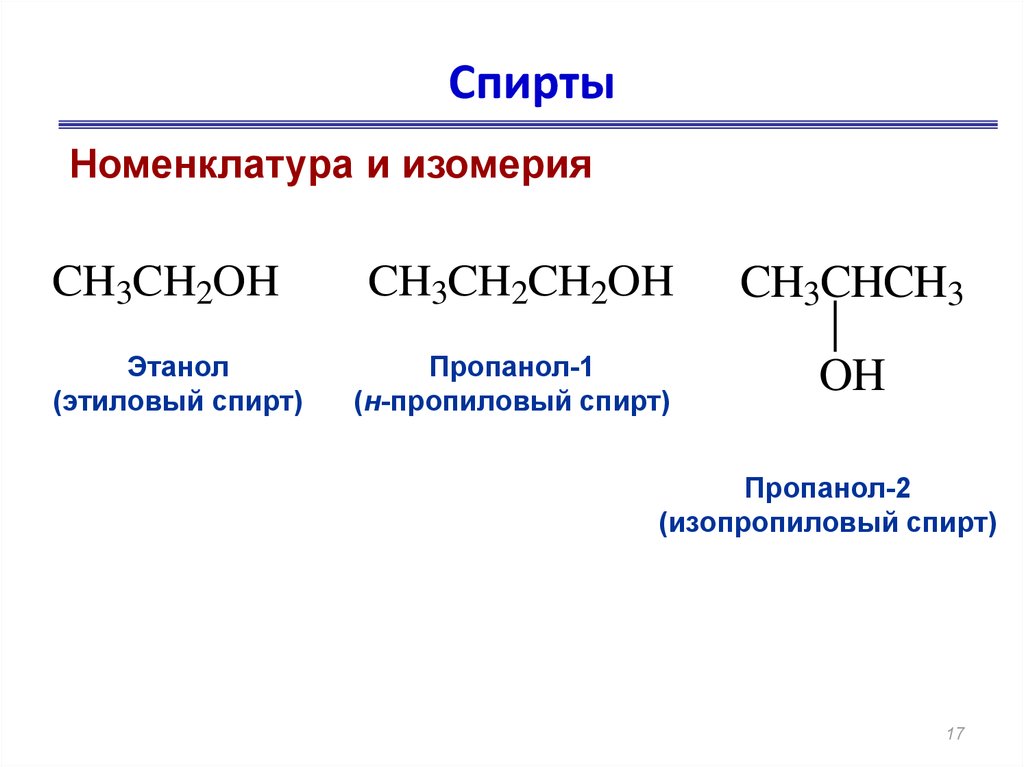
17. Спирты
Номенклатура и изомерияCH3CH2OH
Этанол
(этиловый спирт)
CH3CH2CH2OH
Пропанол-1
(н-пропиловый спирт)
CH3CHCH3
OH
Пропанол-2
(изопропиловый спирт)
17
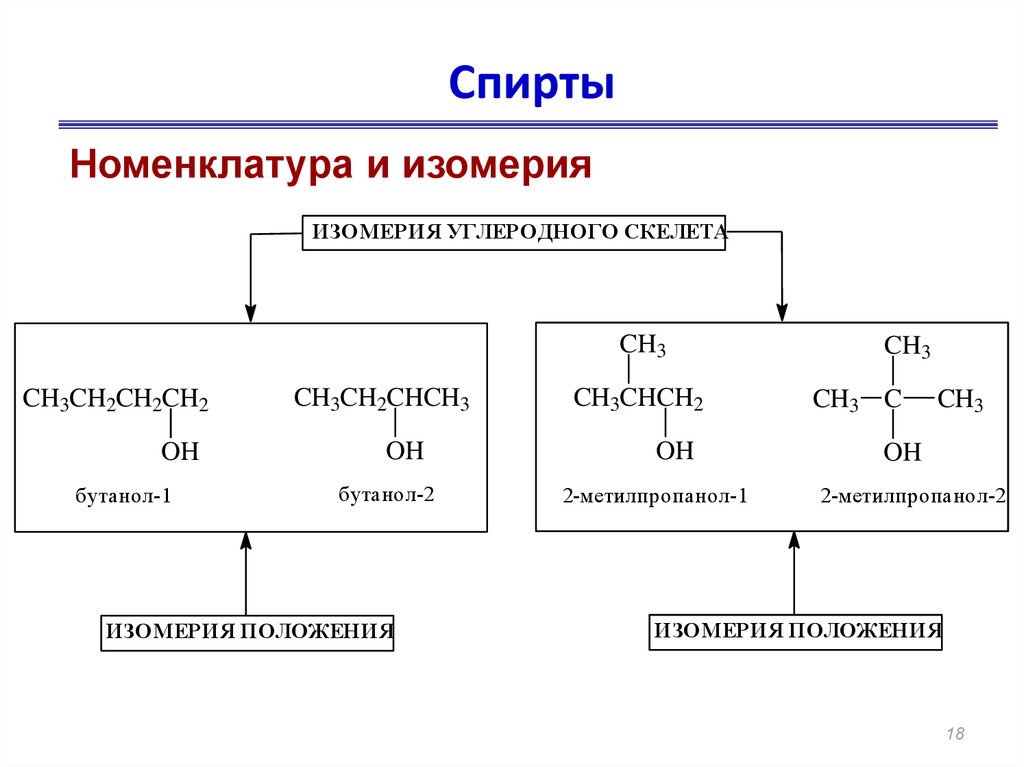
18. Спирты
Номенклатура и изомерияИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА
CH3
CH3CH2CH2CH2
OH
бутанол-1
CH3CH2CHCH3
OH
бутанол-2
ИЗОМЕРИЯ ПОЛОЖЕНИЯ
CH3CHCH2
OH
2-метилпропанол-1
CH3
CH3 C
CH3
OH
2-метилпропанол-2
ИЗОМЕРИЯ ПОЛОЖЕНИЯ
18
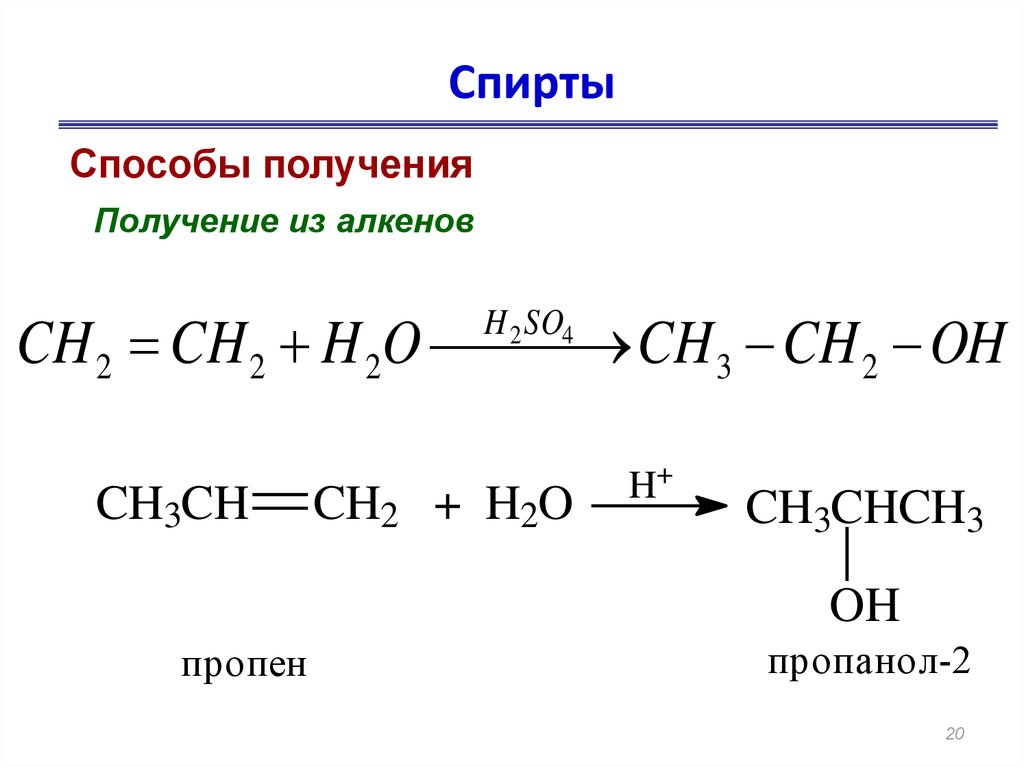
19. Способы получения
Ферментативный синтез этанола.•Этанол получают при брожении сахаров,
вызываемом ферментами:
С6 Н12О6
2С2 Н 5ОН 2СО2
дрожжи
19
20. Спирты
Способы полученияПолучение из алкенов
CH 2 CH 2 H 2O CH 3 CH 2 OH
H 2 SO4
CH3CH
CH2 + H2O
H+
CH3CHCH3
OH
пропен
пропанол-2
20
21. Метанол и этанол
Смесь метана с водяным паромпропускают над катализатором.
СН4 Н 2О CO 3H 2 синтез - газ
Ni ,900o C , p
Cr2O3 , ZnO, p
СO 2 H 2
CH 3OH метанол
o
400 C
22. Производство метанола
• https://www.youtube.com/watch?v=YXcShunkPps
• https://www.youtube.com/watch?v=7wDhHg
7u1IU
22
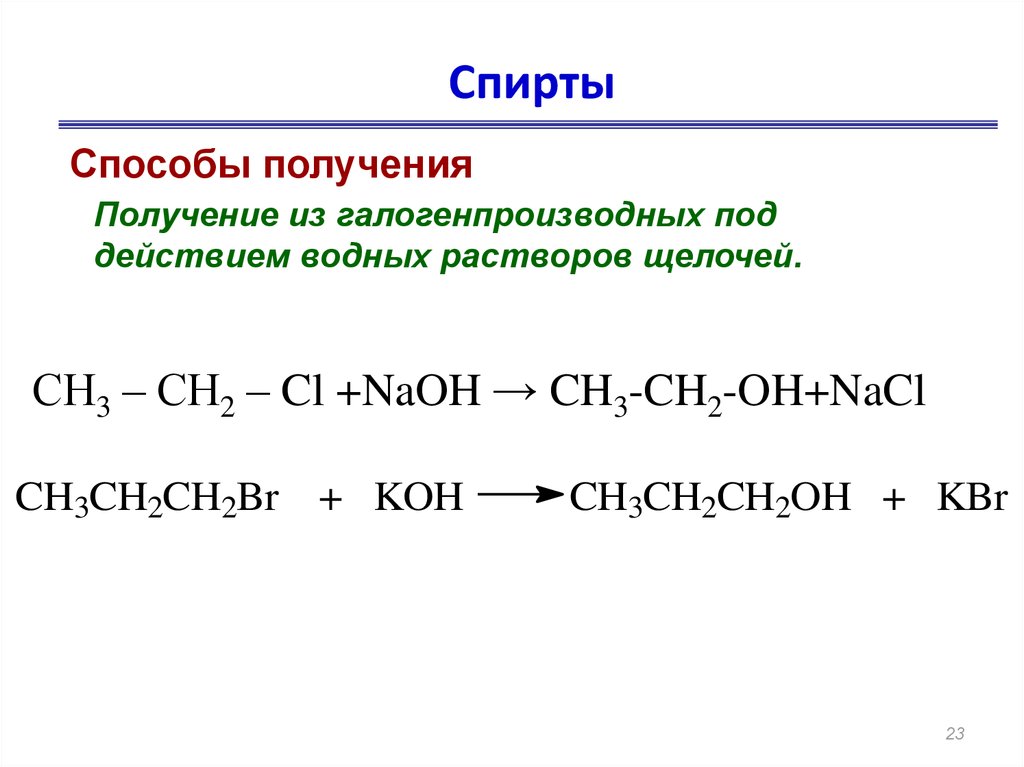
23. Спирты
Способы полученияПолучение из галогенпроизводных под
действием водных растворов щелочей.
СН3 – СН2 – Cl +NaOH → CH3-CH2-OH+NaCl
CH3CH2CH2Br + KOH
CH3CH2CH2OH + KBr
23
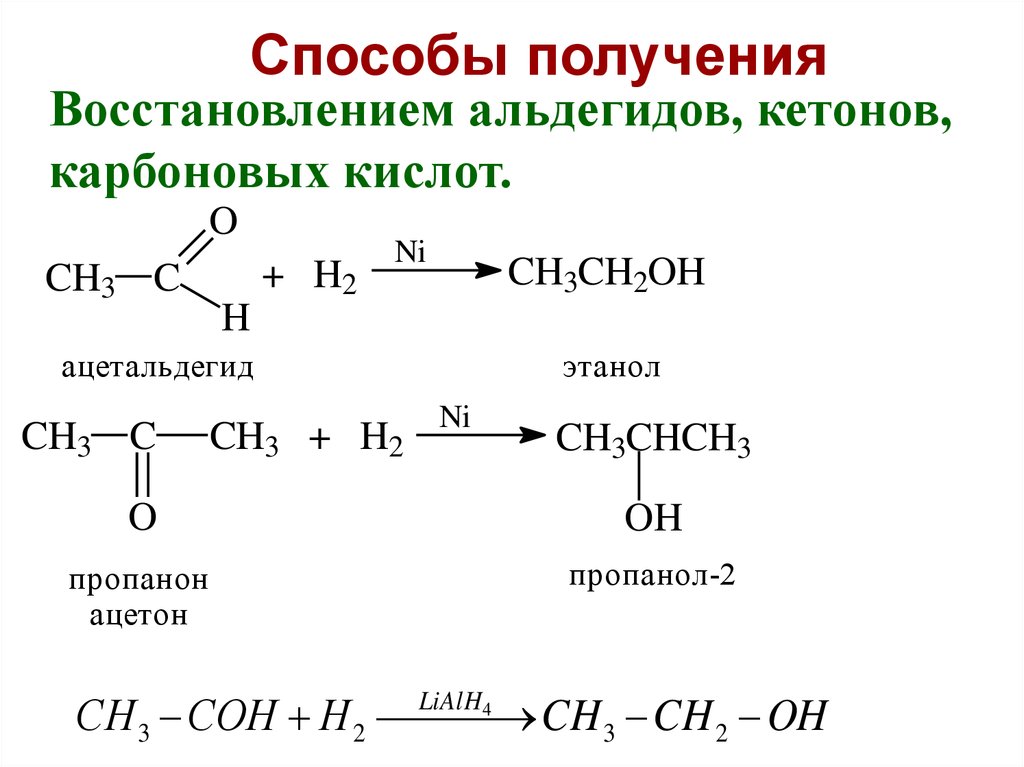
24.
Способы полученияВосстановлением альдегидов, кетонов,
карбоновых кислот.
O
CH3 C
+ H2
Ni
CH3CH2OH
H
ацетальдегид
CH3 C
CH3 + H2
этанол
Ni
CH3CHCH3
O
OH
пропанон
ацетон
пропанол-2
СН 3 СОН Н 2 CH 3 CH 2 OH
LiAlH4
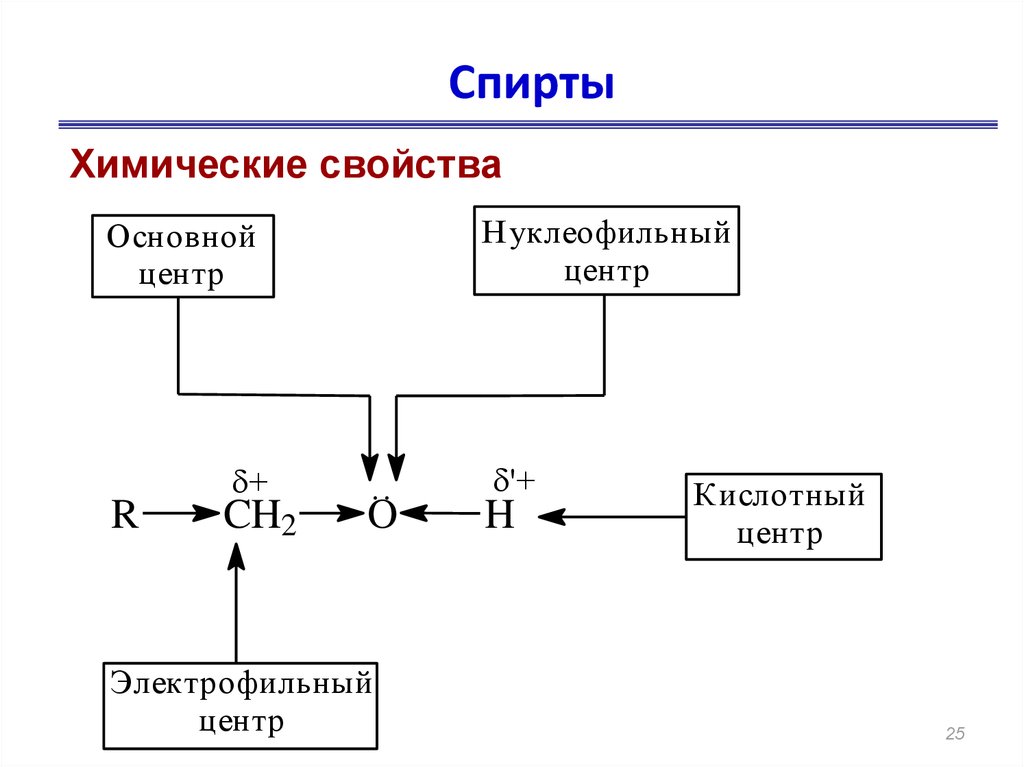
25. Спирты
Химические свойстваНуклеофильный
центр
Основной
центр
R
+
CH2
..
O
Электрофильный
центр
'+
H
Кислотный
центр
25
26. Строение молекулы спиртов
• CH3-CH2 → O←H• H-O-H
• Атом кислорода наиболее электроотрицателен по
сравнению с углеродом и водородом, поэтому связи
C-O и O-H ковалентные полярные. Более полярна
связь в гидроксильной группе. При химических
реакциях она может гетеролитически разрываться с
отщеплением катиона водорода.
• Легкость разрыва связи кислород-водород в
гидроксидах зависит от природы и степени
окисления атома, связанного с группой OH.
Невысокая Э.О. углерода и положительный
индуктивный
эффект
этильной
группы
приводят к тому , что спирты проявляют очень
слабые кислотные свойства
27.
• Общая характеристика: соединенияреакционноспособны
благодаря
наличию двух ковалентных связей
• O-H; C-O.
• Можно выделить следующие типы
реакции: с разрывом связи
• O-H и C-O.
28.
• Реакции замещения водородафункциональной группы
• Реакции замещения функциональной
группы
• Внутримолекулярная дегидратация
• Реакции окисления
• Реакции этерификации
29. Реакции замещения водорода функциональной группы
Одноатомные спирты реагируют с активными металлами(Na, K, Mg, Al и др), образуя соли - алкоголяты (алкоксиды):
2CH3CH2OH + 2Na
этанол
2CH3CH2ONa + H2
этоксид натрия
• С увеличением углеводородного радикала, скорость этой
реакции замедляется. В присутствии воды алкаголяты
подвергаются гидролизу.
CH3OK + H2O
метоксид
натрия
CH3OH + KOH
метанол
29
30. Реакции замещения функциональной группы
Замещение гидроксила ОН на галоген происходит вреакции спиртов с галогеноводородами в присутствии
катализатора – сильной минеральной кислоты
(например, конц. H2SO4).
(H+)
C2H5OH + HBr C2H5Br + H2O
этилбромид
Механизм реакции – нуклеофильное замещение (SN).
Нуклеофил – бромид-анион Br– – замещает группу ОН–.
Реакционная способность ROH возрастает в ряду:
CH3 OH < первичные < вторичные < третичные.
31.
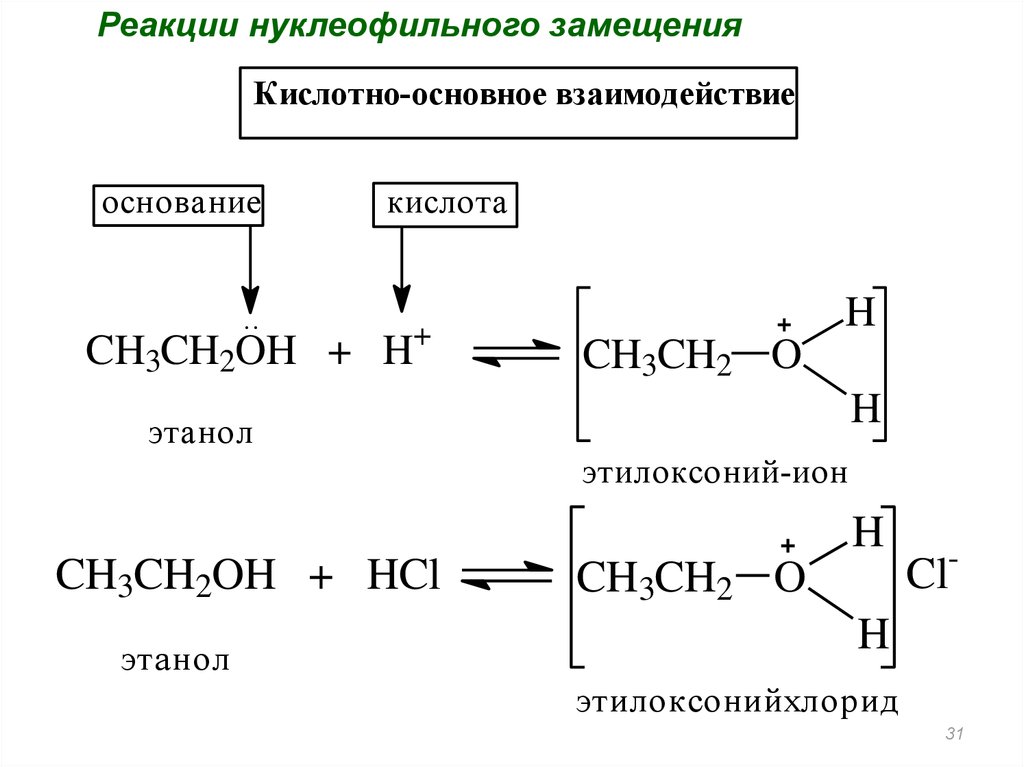
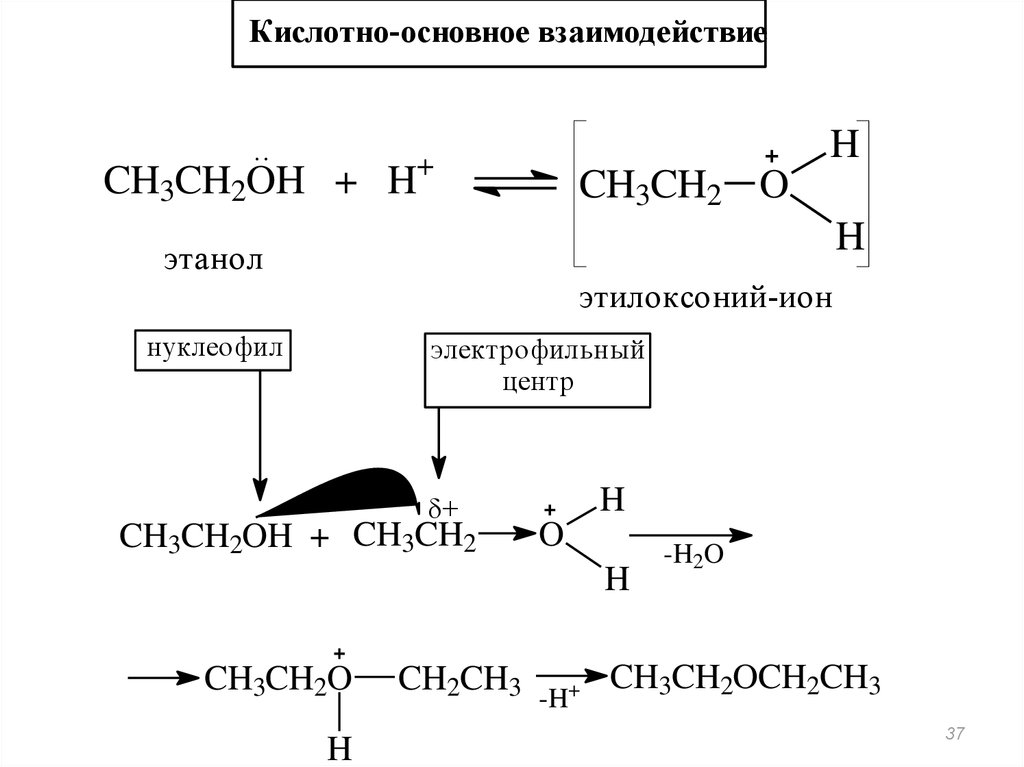
Реакции нуклеофильного замещенияКислотно-основное взаимодействие
основание
..
кислота
+
CH3CH2OH + H
H
CH3CH2 O
H
этанол
этилоксоний-ион
H
CH3CH2OH + HCl
этанол
-
Cl
CH3CH2 O
H
этилоксонийхлорид
31
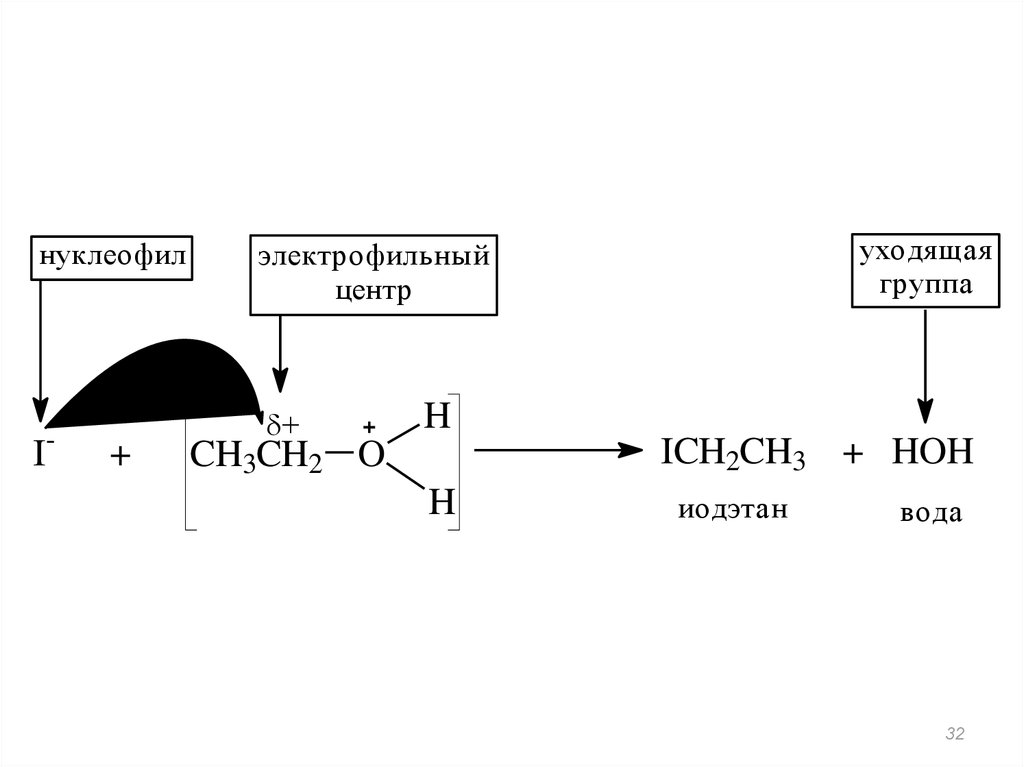
32.
нуклеофил-
I
+
уходящая
группа
электрофильный
центр
+
H
ICH2CH3 + HOH
CH3CH2 O
H
иодэтан
вода
32
33. Реакции нуклеофильного замещения
Взаимодействие с галогенидами фосфора.C2H5OH + PCl5→ C2H5Cl + POCl3 + HCl
хлорокись фосфора
3C2H5OH + PBr3→3C2H5Br +H3PO3
C2H5OH + SOCl2 → C2H5Cl + SO2 + HCl
тионил хлорид
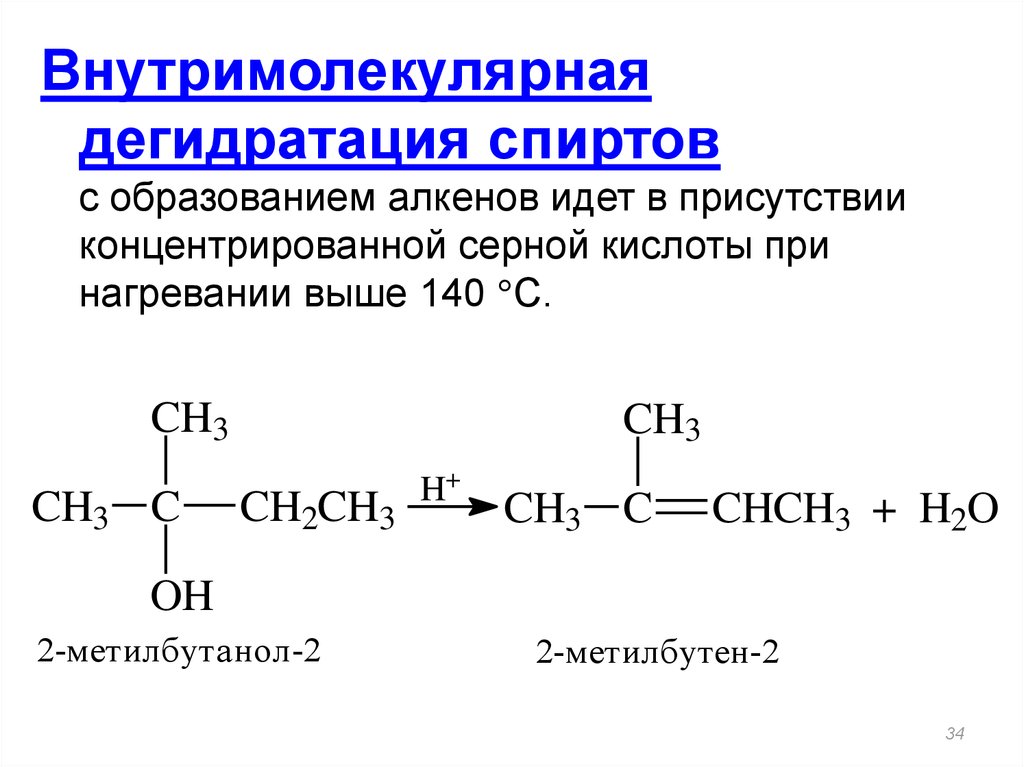
34. Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при
нагревании выше 140 С.CH3
CH3 C
CH3
CH2CH3
H+
CH3 C
CHCH3 + H2O
OH
2-метилбутанол-2
2-метилбутен-2
34
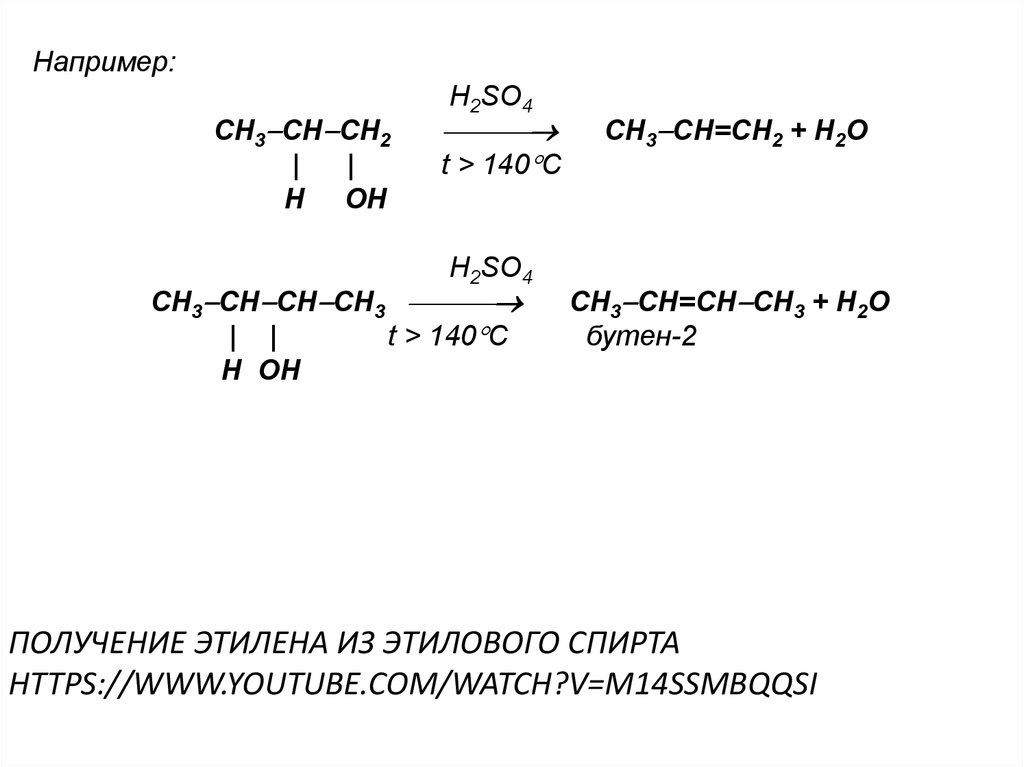
35. Получение этилена из этилового спирта https://www.youtube.com/watch?v=m14SsmBqQSI
Например:CH3 CH CH2
|
|
H OH
H2SO4
t > 140 C
H2SO4
CH3 CH CH CH3
| |
t > 140 C
H OH
CH3 CH=CH2 + H2O
CH3 CH=CH CH3 + H2O
бутен-2
ПОЛУЧЕНИЕ ЭТИЛЕНА ИЗ ЭТИЛОВОГО СПИРТА
HTTPS://WWW.YOUTUBE.COM/WATCH?V=M14SSMBQQSI
36.
Межмолекулярная дегидратация собразованием простых эфиров (при
нагревании ниже 140 С):
C2H5OH + HOC2H5 C2H5-O-C2H5 + H2O
37.
Кислотно-основное взаимодействиеH
..
CH3CH2OH + H+
CH3CH2 O
H
этанол
этилоксоний-ион
нуклеофил
электрофильный
центр
+
CH3CH2OH + CH3CH2
H
O
H
CH3CH2O
H
CH2CH3
+
-H
-H2O
CH3CH2OCH2CH3
37
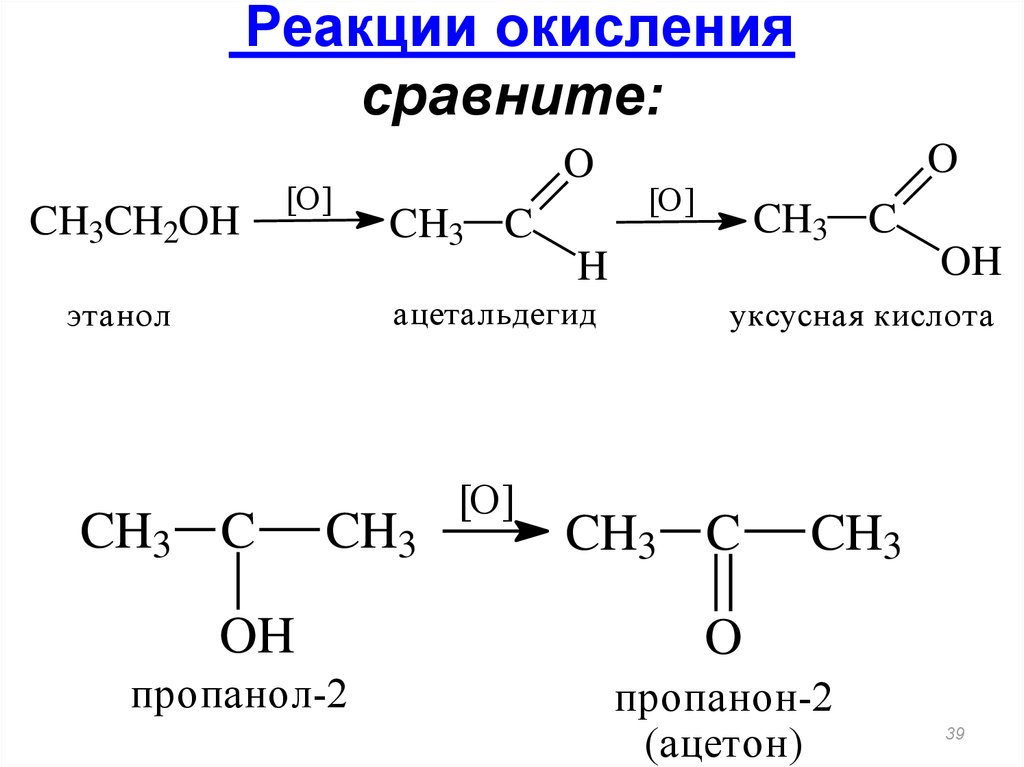
38. Реакции окисления
При действии окислителей (KMnO4, K2Cr2O7+H2SO4)Первичные спирты при окислении образуют альдегиды, которые
затем легко окисляются до карбоновых кислот:
[O]
[O]
R–СН2–OH R–СН=O R–СOOH
-H2O
альдегид
карбоновая кислота
Например, окисление этилового спирта K2Cr2O7 / H2SO4 :
3C2H5OH + 2K2Cr2O7 + 8H2SO4 3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 +
11H2O
При окислении вторичных спиртов образуются кетоны:
[O]
R CH R' R C R'
|
-H2O
||
OH
O
39. Реакции окисления сравните:
CH3CH2OH[O]
O
CH3 C
CH3 C
CH3
OH
пропанол-2
[O]
[O]
CH3 C
H
ацетальдегид
этанол
O
OH
уксусная кислота
CH3 C
CH3
O
пропанон-2
(ацетон)
39
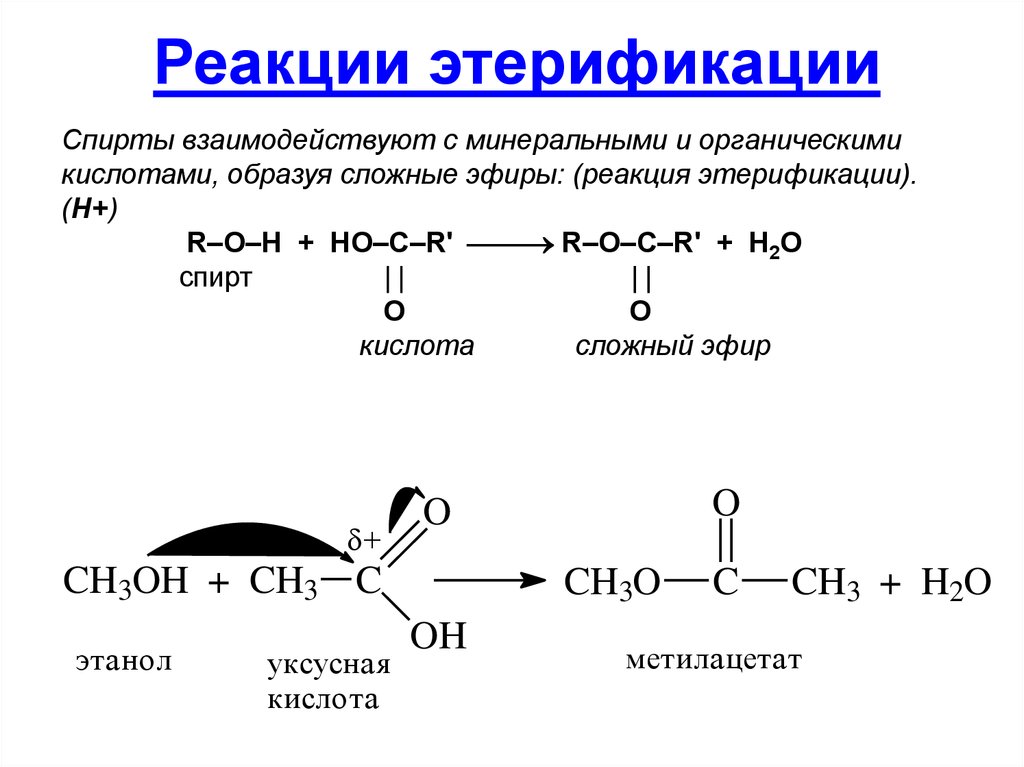
40. Реакции этерификации
Спирты взаимодействуют с минеральными и органическимикислотами, образуя сложные эфиры: (реакция этерификации).
(H+)
R–O–H + HO–C–R' R–O–C–R' + H2O
спирт
O
O
кислота
сложный эфир
+
CH3OH + CH3 C
этанол
уксусная
кислота
O
O
CH3O
OH
C
CH3 + H2O
метилацетат
41.
Метанол CH3OH-производство
формальдегида, муравьиной
кислоты;
- растворитель.
Этанол С2Н5ОН (этиловый
спирт)
- производство ацетальдегида,
уксусной кислоты, бутадиена,
простых и сложных эфиров;
- растворитель для красителей,
лекарственных и парфюмерных
средств;
- производство ликеро-водочных
изделий;
- дезинфицирующее средство в
медицине;
- горючее для двигателей,
добавка к моторным топливам.
42. Применение метанола
• https://www.youtube.com/watch?v=wG4FLlrmw7g
42
























 Химия
Химия








