Похожие презентации:
Дисперсная система
1. ГПОУ ЯО Ростовский колледж отраслевых технологий
*Презентация на тему:
<Дисперсная система>
Выполнила студентка очной формы обучения
Старостина Милена
Группа: ПР-21
Проверила преподаватель:
Сарайкова Елена Владимировна
2018 год
2.
3. Дисперсная система-это………
*Дисперсная система-это………* это система, образованная из двух или более фаз (тел), которые совершенно
или практически не смешиваются и не реагируют друг с другом химически.
Первое из веществ (дисперсная фаза) мелко распределено во втором
(дисперсионная среда). Если фаз несколько, их можно отделить друг от друга
физическим способом (центрифугировать, сепарировать и т. д.).
* Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным
системам относят также случай твёрдой дисперсной среды, в которой находится
дисперсная фаза.
4.
5.
6. Дисперсные системы и их квалификация….
*Дисперсные системы и ихквалификация….
* Дисперсионные системы можно разделить по размеру частиц дисперсионной фазы.
Если размер частиц составляет меньше одного нм – это молекулярно - ионные
системы, от одного до ста нм - коллоидные, и более ста нм - грубодисперсные.
Группу молекулярно дисперсных систем представляют растворы. Это однородные
системы, которые состоят из двух или более веществ и являются однофазными. К
ним относятся газ, твердое вещество или растворы. В свою очередь эти системы
можно разделить на подгруппы:
- Молекулярные. Когда органические вещества, такие как глюкоза, соединяются
с неэлектролитами. Такие растворы назвали истинными для того, чтобы можно
было отличать от коллоидных. К ним относятся растворы глюкозы, сахарозы,
спиртовые и другие.
- Молекулярно-ионные. В случае взаимодействия между собой слабых
электролитов. В эту группу входят кислотные растворы, азотистые,
сероводородные и другие.
* - Ионные. Соединение сильных электролитов. Яркие представители - это
растворы щелочей, солей и некоторых кислот.
7. Коллоидные системы…
*Коллоидные системы…* Коллоидные системы - это микрогетерогенные системы, в которых размеры
коллоидных частиц варьируют от 100 до 1 нм. Они длительное время могут не
выпадать в осадок за счет сольватной ионной оболочки и электрического
заряда. При распределении в среде коллоидные растворы заполняют
равномерно весь объем и делятся на золи и гели, которые в свою очередь
представляют собой осадки в виде студня. К ним относятся раствор альбумина,
желатина, коллоидные растворы серебра. Холодец, суфле, пудинги - это яркие
примеры коллоидной систем, встречающихся в повседневной жизни.
8.
9.
10.
11. Грубодисперсные системы…
** Непрозрачные системы или взвеси, в которых мелкие ингредиенты частицы
видны невооруженным глазом. В процессе отстаивания дисперсная фаза
легко отделяется от дисперсной среды. Они подразделяются на суспензии,
эмульсии, аэрозоли. Системы, в которых в жидкой дисперсионной среде
размещаются твердое вещество с более крупными частицами, называются
суспензиями. К ним относятся водные растворы крахмала и глины. В
отличие от суспензий, эмульсии получаются в результате смешивания двух
жидкостей, в которых одна капельками распределяется в другой. Примером
эмульсии является смесь масла с водой, капельки жира в молоке. Если
мелкие твердые или жидкие частицы распределяется в газе - это аэрозоли.
По сути аэрозоль - это суспензия в газе. Одним из представителей аэрозоля
на основе жидкости является туман - это большое количество мелких
водяных капелек, взвешенных в воздухе. Твердотельный аэрозоль – дым
или пыль - множественное скопление мелких твердых частиц также
взвешенных в воздухе.
12.
13.
14.
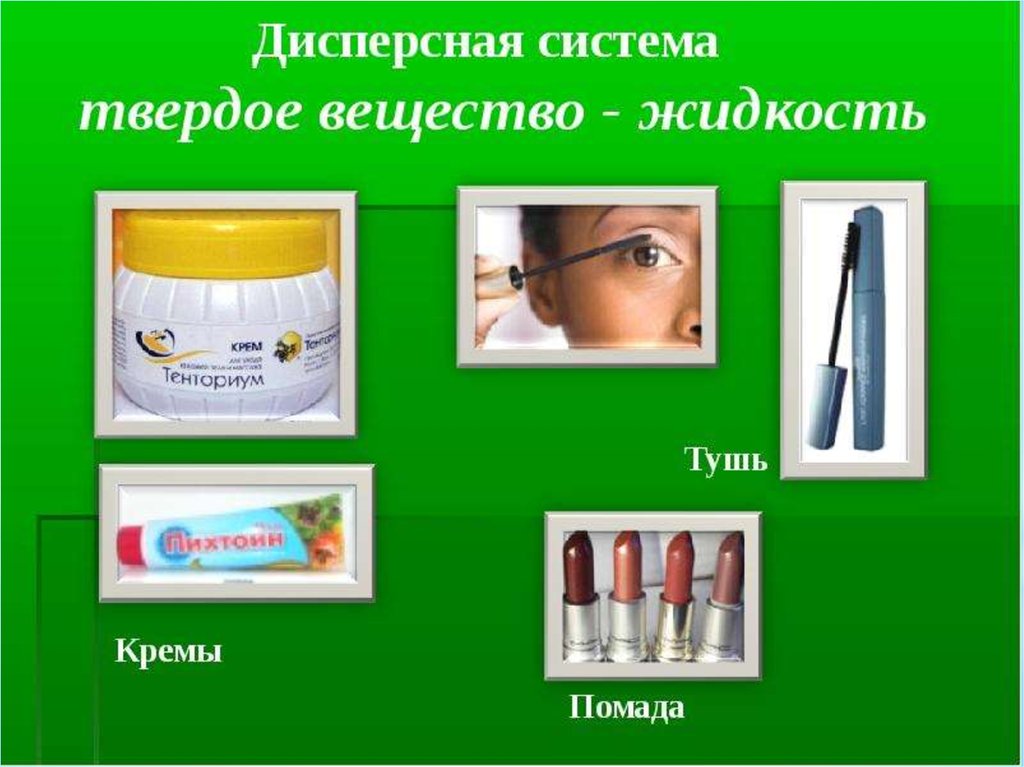
15. Дисперсные системы….
*Дисперсные системы….* Дисперсные системы могут быть свободнодисперсными
и связнодисперсными в зависимости от отсутствия или наличия взаимодействия
между частицами дисперсной фазы. К свободнодисперсным системам относятся
аэрозоли, разбавленные суспензии и эмульсии. Они текучи, в этих системах
частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном
тепловом движении, свободно перемещаются под действием силы тяжести.
Связнодисперсные системы − твердообразны; они возникают при контакте
частиц дисперсной фазы, приводящем к образованию структуры в виде каркаса
или сетки. Такая структура ограничивает текучесть дисперсной системы и
придает ей способность сохранять форму. Порошки, концентрированные
эмульсии и суспензии (пасты), пены, гели – примеры связнодисперсных систем.
Сплошную массу вещества могут пронизывать поры и капилляры, образующие
капиллярно-дисперсные системы (кожа, картон, ткани, древесина).
16.
* Дисперсные системы, в соответствии с их промежуточным положением междумиром молекул и крупных тел, могут быть получены двумя путями: методами
диспергирования, т. е. измельчения крупных тел, и методами конденсации
молекулярно- или ионнорастворенных веществ.
* Под взаимодействием фаз дисперсных систем подразумевают процессы
сольватации (гидратации в случае водных систем), т. е. образование
сольватных (гидратных) оболочек из молекул дисперсионной среды вокруг
частиц дисперсной фазы. Соответственно, по интенсивности взаимодействия
между веществами дисперсной фазы и дисперсионной среды (только для
систем с жидкой дисперсионной средой), по предложению Г. Фрейндлиха
различают следующие дисперсные системы:
* − Лиофильные (гидрофильные, если ДС – вода): мицеллярные растворы ПАВ,
критические эмульсии, водные растворы некоторых природных ВМС, например,
белков (желатина, яичного белка), полисахаридов (крахмала). Для них
характерно сильное взаимодействие частиц ДФ с молекулами ДС. В
предельном случае наблюдается полное растворение. Лиофильные дисперсные
системы образуются самопроизвольно вследствие процесса сольватации.
Термодинамически агрегативно устойчивы.
* − Лиофобные (гидрофобные, если ДС – вода): эмульсии, суспензии, золи. Для
них характерно слабое взаимодействие частиц ДФ с молекулами ДС.
Самопроизвольно не образуются, для их образования необходимо затратить
работу. Термодинамически агрегативно неустойчивы (т. е. имеют тенденцию к
самопроизвольной агрегации частиц дисперсной фазы), их относительная
устойчивость (так называемая метастабильность) обусловлена
кинетическими факторами (т. е. низкой скоростью агрегации).
17. Взвеси- это…..
*18. Устойчивость дисперсных систем.
** Устойчивость дисперсных систем характеризуется постоянством дисперсности (распределения
частиц по размерам) и концентрации дисперсной фазы (числом частиц в единице объема). Наиб.
сложна в теоретич. аспекте и важна в практич.отношении проблема устойчивости аэрозолей и
жидких лиофобных Д. с. Различают седиминтационную устойчивость и устойчивость к
коагуляции (агрегатную устойчивость). Седиментационно устойчивы коллоидные системы с
газовой и жидкой дисперсионной средой, в к-рых броуновское движение частиц препятствует
оседанию; грубодисперсные системы с одинаковой плотностью составляющих их фаз; системы,
скоростью седиментации в к-рых можно пренебречь из-за высокой вязкости среды. В
агрегативно устойчивых Д. с. непосредств. контакты между частицами не возникают, частицы
сохраняют свою индивидуальность. При нарушении агрегативной устойчивости Д. с. частицы,
сближаясь в процессе броуновского движения, соединяются необратимо или скорость агрегации
становится значительно больше скорости дезагрегации. Между твердыми частицами возникают
непосредственные точечные ("атомные") контакты, к-рые затем могут превратиться в фазовые
(когезионные) контакты, а соприкосновение капель и пузырьков сопровождается их
коалесценцией и быстрым сокращением суммарной площади межфазной пов-сти. Для таких
систем потеря агрегативной устойчивости означает также потерю седимeнтационной
устойчивости. В агрегативно устойчивых системах дисперсный состав может изменяться
вследствие изотермич. перегонки - мол. переноса в-ва дисперсной фазы от мелких частиц к
более крупным. Этот процесс обусловлен зависимостью давления насыщенного пара (или
концентрации насыщенного р-ра) от кривизны пов-сти раздела фаз (см. Капиллярные явления).
Агрегативная устойчивость и длительное существование лиофобных Д. с. с сохранением их св-в
обеспечивается стабилизацией. Для высокодисперсных систем с жидкой дисперсионной средой
используют введение в-в - стабилизаторов (электролитов, ПАВ, полимеров). В теории
устойчивости Дерягина-Ландау-Фервея-Овербека (теории ДЛФО) осн. роль отводится ионноэлектростатич. фактору стабилизации.
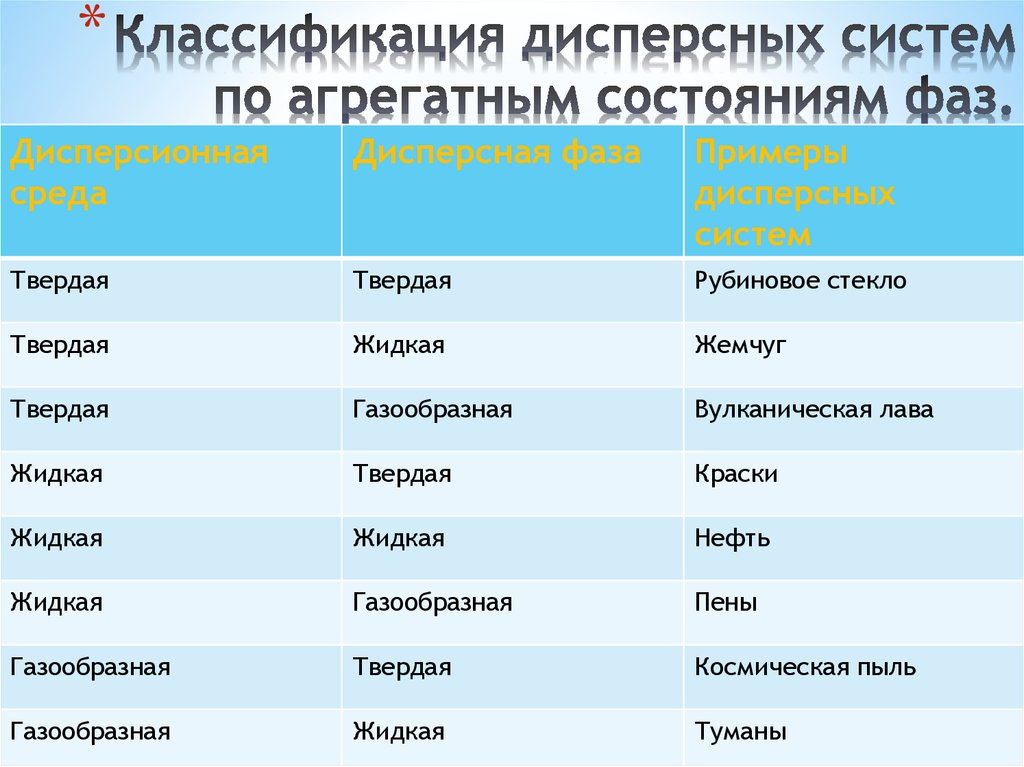
19. Классификация дисперсных систем по агрегатным состояниям фаз.
*Дисперсионная
среда
Дисперсная фаза
Примеры
дисперсных
систем
Твердая
Твердая
Рубиновое стекло
Твердая
Жидкая
Жемчуг
Твердая
Газообразная
Вулканическая лава
Жидкая
Твердая
Краски
Жидкая
Жидкая
Нефть
Жидкая
Газообразная
Пены
Газообразная
Твердая
Космическая пыль
Газообразная
Жидкая
Туманы
20.
21.
22.
23. Коллоидные системы…
** Коллоидные системы необычайно лабильны, т.е. неустойчивы. Для многих из
них достаточно прибавления ничтожного количества электролита, чтобы вызвать
выпадение осадка. Причина столь легкого изменения состояния коллоидных
систем связана с непостоянством степени их дисперсности. Различают два вида
устойчивости любой раздробленной системы - кинетическую и агрегатную
24. Дисперсные системы( по агрегатному состоянию среды и дисперсной фазы)
дисперсионнаясреда
жидкость
твердая
дисперсная фаза
дисперсная
система
примеры
газ
пены
газированная вода
взбитые сливки
жидкость
эмульсии
молоко,
маргарин
крем
твердое
вещество
супсензии
краски
паста
газ
твердые пены
губка
пенопласт
хлеб
жидкость
твердые эмульсии
жемчуг
природные
материалы
Твердое
твердые золи
золото в стекле
горные породы
25.
26.
27.
28.
29. ВЫВОД
** В природе и практической жизни человека встречаются не
отдельные вещества, а их системы. Важнейшими из них являются
дисперсные системы-гетерогенные системы в которых одно
вещество равномерно распределенно в виде частиц внутри
другого вещества.
30.
31. Спасибо за внимания!!!!
*В призентации были использованы ресурсы интернета и учебники химии….





























 Химия
Химия