Похожие презентации:
Рекомбинантные антитела для диагностики и терапии
1.
2.
3.
4.
5.
АНТИТЕЛО - БЕЛОК СЫВОРОТКИ КРОВИ, ВЫРАБАТЫВАЮЩИЙСЯ ВОТВЕТ НА ВВЕДЕНИЕ АНТИГЕНА, КОМПЛЕМЕНТАРНЫЙ «СВОЕМУ»
АНТИГЕНУ И СПОСОБНЫЙ СПЕЦИФИЧЕСКИ С НИМ СВЯЗЫВАТЬСЯ.
АНТИГЕН – ЛЮБАЯ СУБСТАНЦИЯ, КОТОРАЯ СПОСОБНА
СВЯЗЫВАТЬСЯ С АНТИТЕЛАМИ.
6.
АНТИГЕННАЯ ДЕТЕРМИНАНТА (ЭПИТОП) – ФРАГМЕНТСТРУКТУРЫ АНТИГЕНА, С КОТОРЫМ СВЯЗЫВАЕТСЯ АНТИТЕЛО.
ГАПТЕН - НИЗКОМОЛЕКУЛЯРНОЕ СОЕДИНЕНИЕ, НЕ ОБЛАДАЮЩЕЕ
АНТИГЕНЫИМИ СВОЙСТВАМИ, НО ВЫЗЫВАЮЩЕЕ ВЫРАБОТКУ
АНТИТЕЛ ПРИ КОНЪЮГАЦИИ С БЕЛКАМИ .
7.
8.
9.
ОБЩАЯ СХЕМА СТРОЕНИЯ lgG1ВАРИАБЕЛЬНАЯ ОБЛАСТЬ
VL
CL
ТЯЖЕЛАЯ ЦЕПЬ ( 450 ОСТАТКОВ )
VH
CH1
CH2
АНТИГЕНСВЯЗЫВАЮЩИЕ
ЦЕНТРЫ
ШАРНИРНАЯ
ОБЛАСТЬ
ЛЕГКАЯ ЦЕПЬ ( 212 ОСТАТКОВ )
CH3
10.
АНТИГЕН-СВЯЗЫВАЮЩИЙ ЦЕНТРVH
VL
Fab
CL
ЛЕГКАЯ ЦЕПЬ
( 212 ОСТАТКОВ )
CH1
ШАРНИРНАЯ
ОБЛАСТЬ
ТЯЖЕЛАЯ ЦЕПЬ
( 450 ОСТАТКОВ )
CH2
Fc
CH3
11.
12.
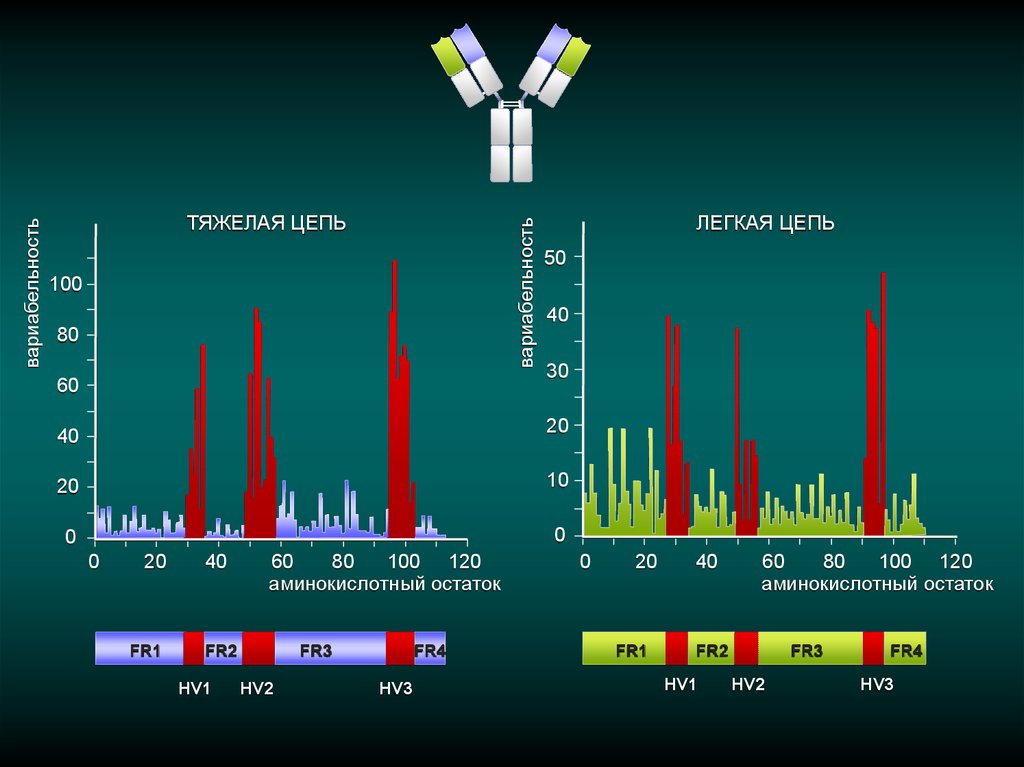
вариабельностьвариабельность
ТЯЖЕЛАЯ ЦЕПЬ
100
80
60
ЛЕГКАЯ ЦЕПЬ
50
40
30
20
40
20
10
0
0
0
20
FR1
40
60
80
100 120
аминокислотный остаток
FR2
HV1
FR3
HV2
FR4
HV3
0
20
FR1
40
60
80
100 120
аминокислотный остаток
FR2
HV1
FR3
HV2
FR4
HV3
13.
ИММУНОГЛОБУЛИНlgG1 lgG2 lgG3
lgG4
lgM
lgA1
lgA2
lgD
lgE
a1
a2
d
e
g1
g2
g3
g4
m
Молекулярная масса (kД)
146
146
165
146
970
160
160
184
188
Содержание в сыворотке
крови(мг/мл)
9
3
1
0.5
1.5
3.0
0.5
0.03
5x10 -5
Время полужизни в кровотоке
(дни)
21
20
7
21
10
6
6
3
2
Активация классического
пути комплемента
++
+
+++
-
+++
-
-
-
-
-
-
-
-
-
+
-
-
-
+++
+
++
- +
-
-
-
-
-
Связывание с макрофагами
+
-
+
-
-
+
+
-
+
Связывание с тучными
клетками и базофилами
+
-
+
-
-
+
+
-
+++
Тяжелая цепь
Активация альтернативного
пути комплемента
Перенос через плаценту
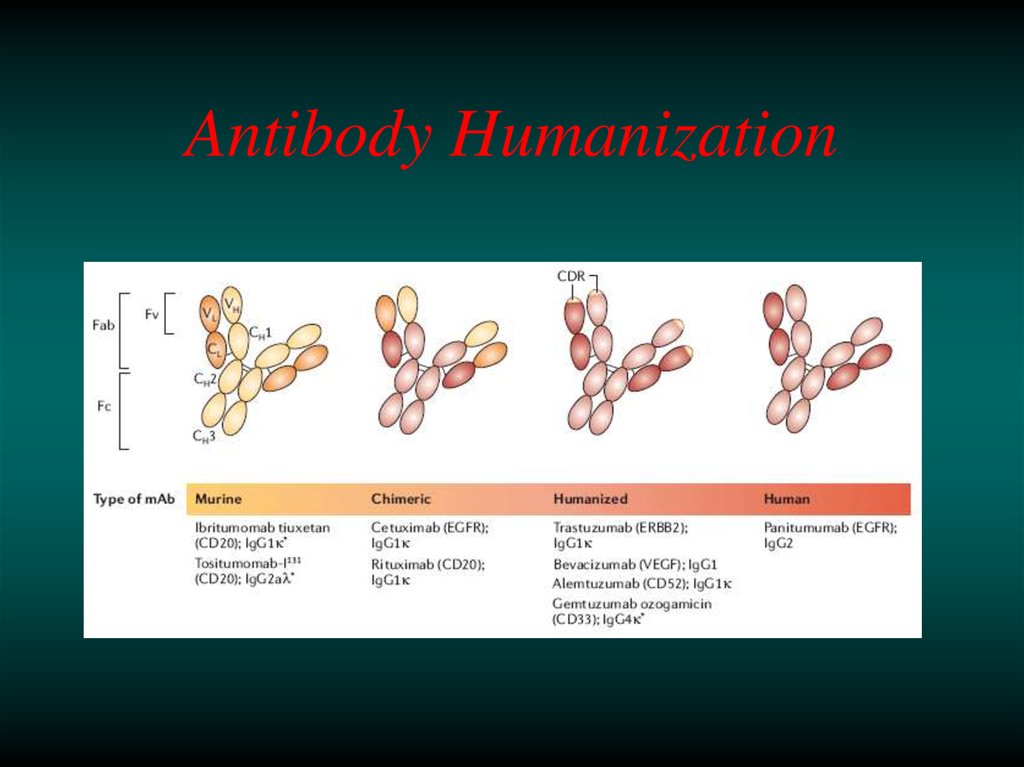
14.
15.
16.
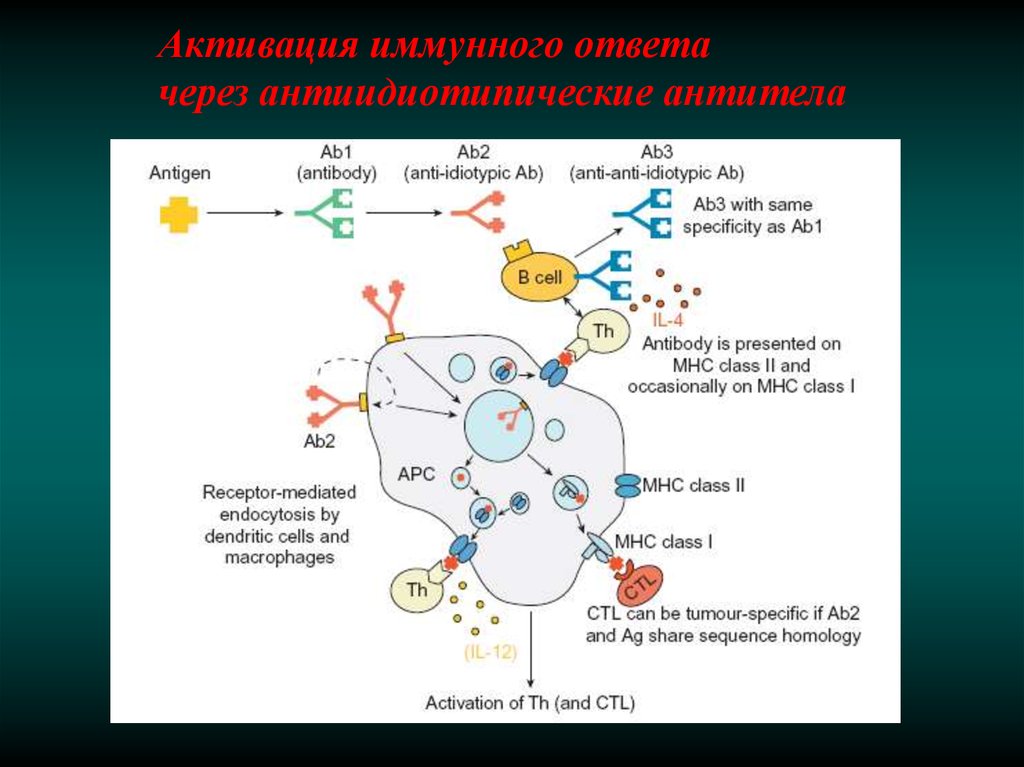
Активация иммунного ответачерез антиидиотипические антитела
17.
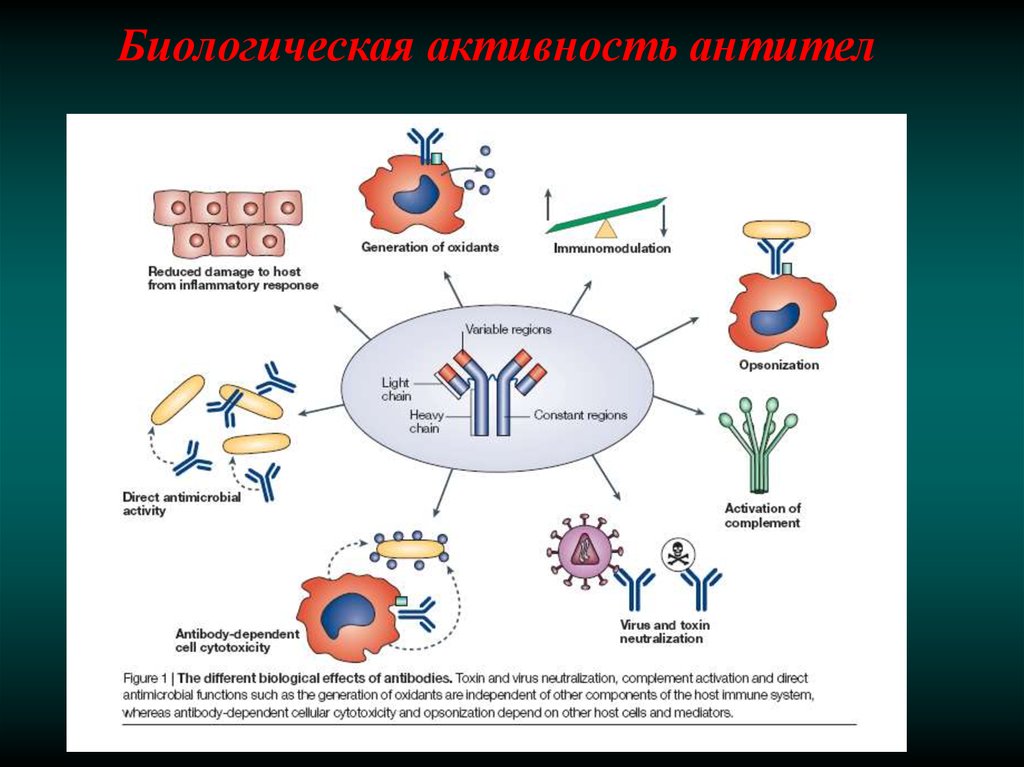
Биологическая активность антител18.
19.
20.
21.
22.
23.
24.
Строение бактериофага М137 nm×880
25.
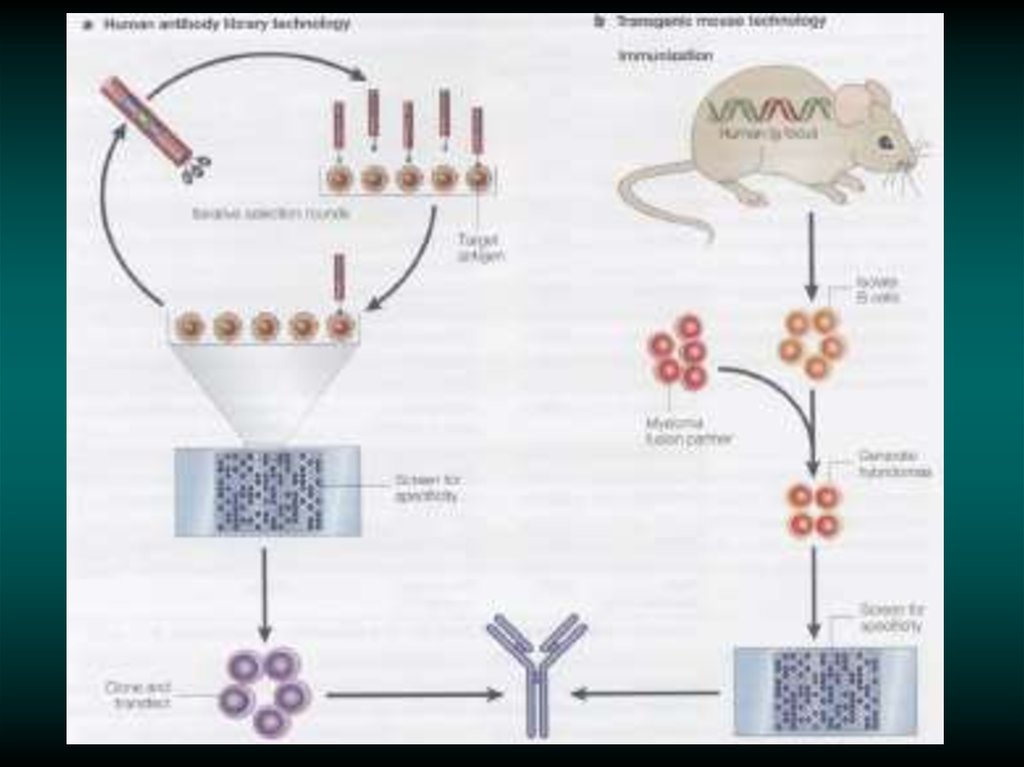
Immunizedrepertoire
Unimmunized
repertoire
Synthetic
repertoire
Amplify V-genes by PCR
Clone for display as scFv or Fab
fragments in phagemid
repeat
3-5 times
Rescue phagemid library
with helper phage
Affinity select on antigen
Elute bound phagemids
Infect TG1 cells (sup)
for phage display
Infect HB2152 (non-sup)
for soluble expression
Rescue individual
clones with helper phage
Induce expression of
individual clones
ELISA with
phage antibodies
ELISA with
soluble fragments
26. Construction of miniantibody library.
B-lymphocytesС / FOR
mRNA isolation from immune
volunteers
Сm/g FOR
cDNA synthesis
Amplification of DNA fragment corresponding to variable
part of light and heavy chain of Immunoglobulin
27. Construction of miniantibody library.
PCR amplification of DNA correspondingVH and VL Ig
VH
Vl
DNA
markers
Gene assemble and stepwise cloning
VH
VH
V
V
scFv( ) scFv( )
Vl
800 bp
380 bp
350 bp
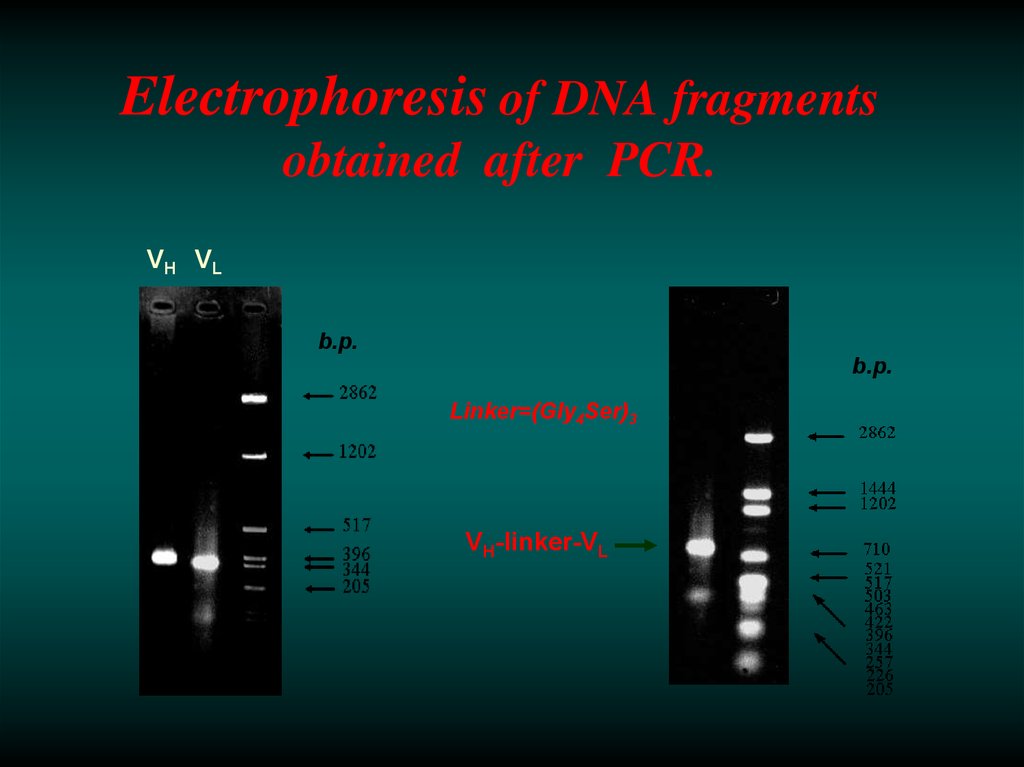
28. Electrophoresis of DNA fragments obtained after PCR.
VH VLb.p.
b.p.
Linker=(Gly4Ser)3
VH-linker-VL
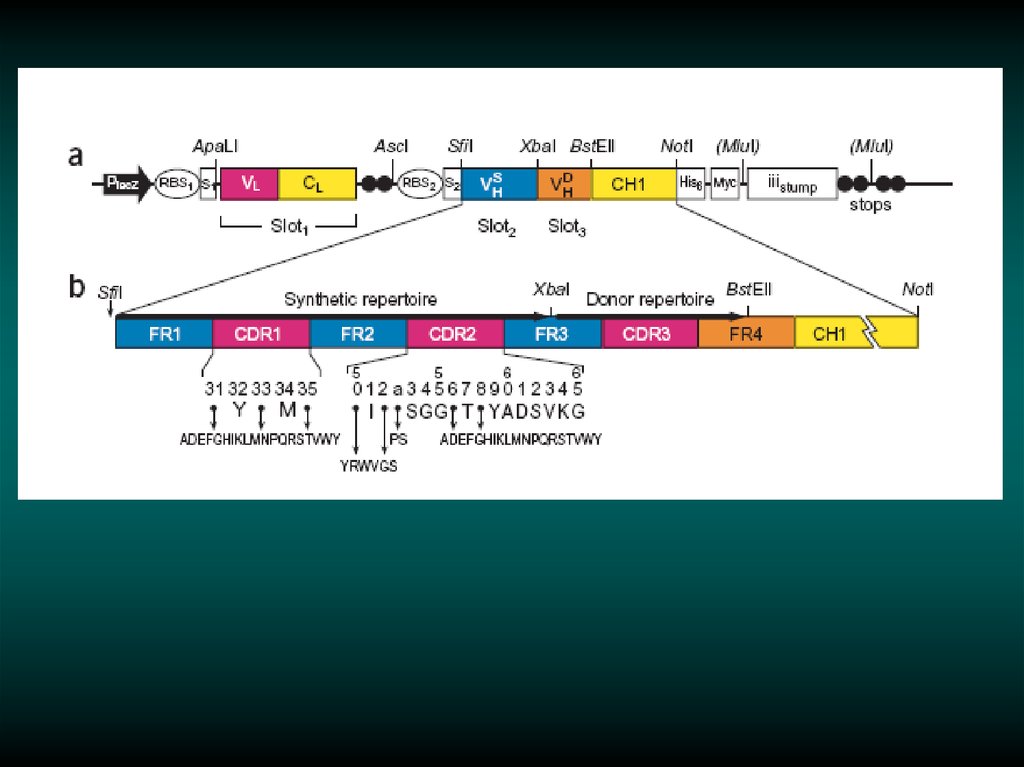
29. Cloning scFv DNA into a Phagemid Vector.
30.
31.
Основы фагового дисплеяAmber Stop Codon
Sfi1
pelB
P lacZ
Not1
myc
PIII
ColE1 ori
pHEN1
4519 bp
r
AP
M13 ori
32. Selection Strategies for Obtaining Specific Phage Ligand.
ImmobilizedAntigen
+
scFv Library
Elution
Affinity Clones
Amplification
33.
34.
Скрининг клонов-продуцентов scFv E.coli к белковым антигенамЧашка Петри с колониями E.coli .
Перенос колоний E.coli на нитроцеллюлозный
фильтр
Инкубация фильтров с сорбированными
колониями на питательной среде с IPTG(1 мМ) в
течение 2-3 часов при 30 0С
Лизис колоний E.coli в парах хлороформа
Совмещение фильтра с лизированными
колониями Е.coli с фильтром с сорбированным
ботулиническим антигеном А (100 нг/мл)
35.
Analysis~ 103 clones
trxA-scFv expressed E.coli
Analysis
~ 102 clones
Positive signal
Negative signal
ELISA
Colony lift screen
Preparative protein expression, purification
and analysis (sequence, Kd, specifity )
36.
Selection of antibody libraryRestriction of total ScFv
gene from pHEN2
Recloning
in expression vector
37.
Клонирование генов scFv в экспрессионный векторрТ7
rbs
trx
A
S
His
Tag Tag
Nco1
scFv
myc
Not1
His
Tag
term
Т7
38. Insertion of c-myc and LNKB-2 epitop tags
Sfi INot I
amber
pHEN1
myc
Sfi I
Not I Not I
amber
myc IL-2 - tag
pHEN1
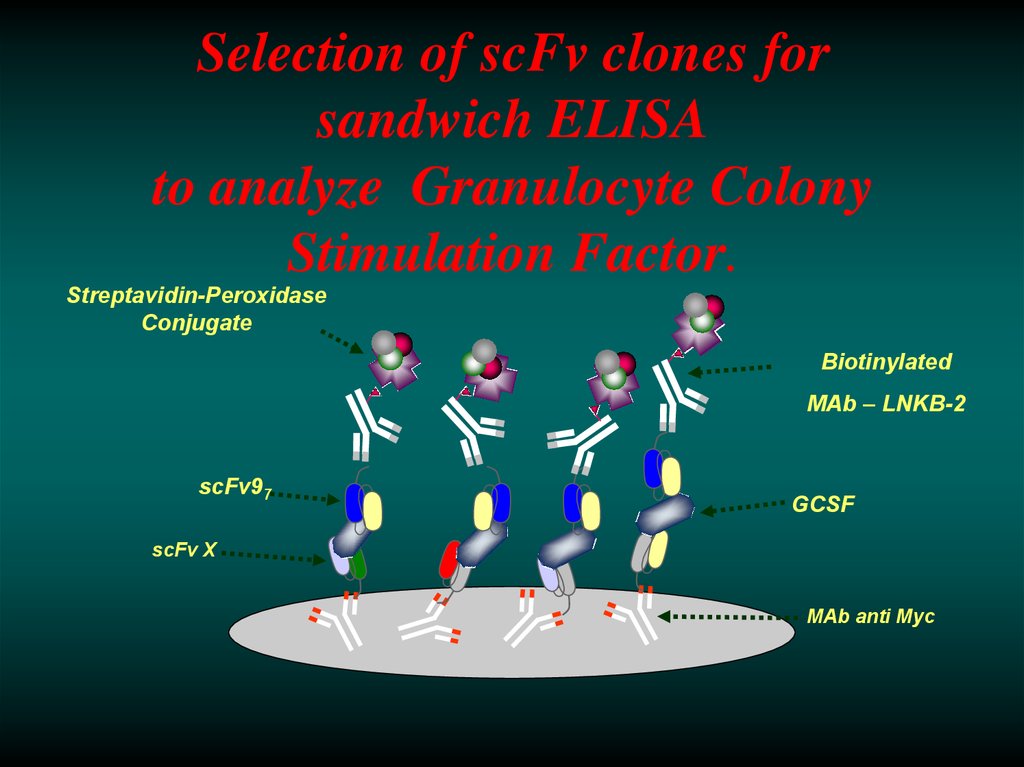
39. Selection of scFv clones for sandwich ELISA to analyze Granulocyte Colony Stimulation Factor.
Streptavidin-PeroxidaseConjugate
Biotinylated
MAb – LNKB-2
scFv97
GCSF
scFv X
MAb anti Myc
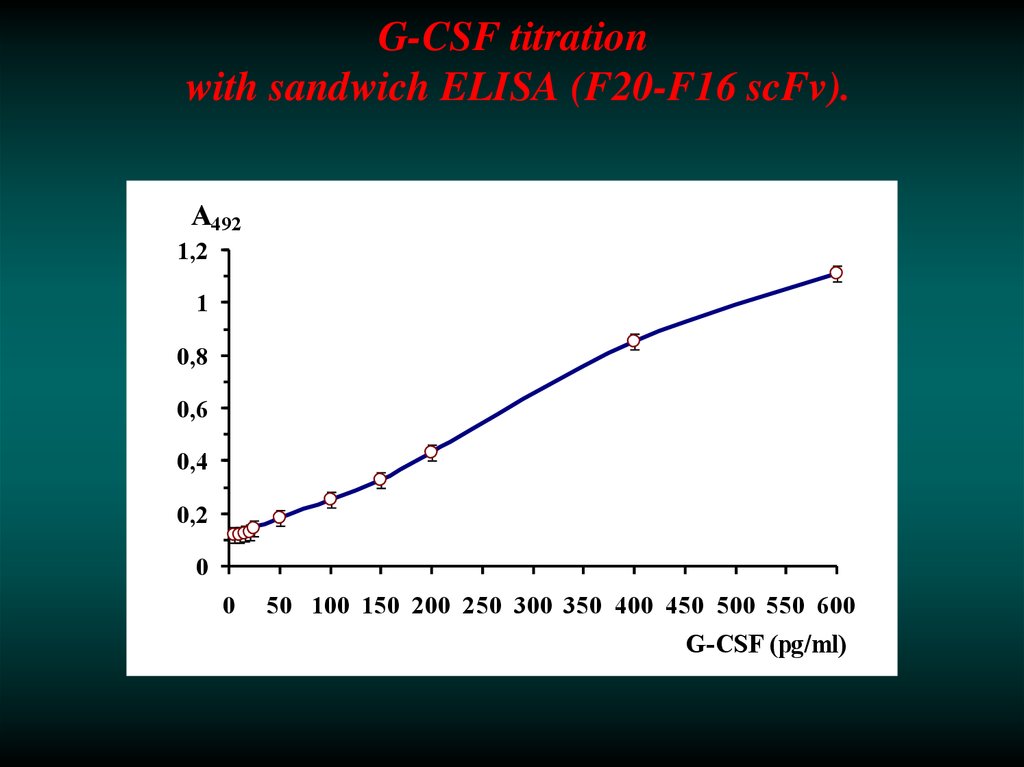
40. G-CSF titration with sandwich ELISA (F20-F16 scFv).
А4921,2
1
0,8
0,6
0,4
0,2
0
0
50 100 150 200 250 300 350 400 450 500 550 600
G-CSF (pg/ml)
41.
Оптимизация условий очистки и ренатурации scFvИнкубация культуры E.coli Origami
pRAREв условиях индукции при
интенсивной аэрации при 30 0С
Очистка белка металл-хелатной
хроматографией на Ni-NTA агарозе
в денатурирующих условиях
0,4
0,35
А 340 нм
Экстракция внутреклеточного белка
в денатурирующих условиях
(8 М мочевина,рН8)
0,45
scFv 5
scFv 19
0,3
scFv 20
0,25
scFv 21
scFv 31
0,2
0,15
scFv 35
0,1
0,05
0
8M urea
Снятие целевого белка:
- понижением рН реакционной среды
- имидазолом
- EDTA
Рефолдинг scFv при понижении
концентрации денатурирующего агента
с использованием рефолдинг-буфера
Рефолдинг на колонке
1М urea
PBS
Буфер
Рис. 1 Рефолдинг scFv c постепенным понижением
концентрации денатурирующего агента
42.
Оценка чистоты препарата после ренатурации и концентрирования scFv1
2
3
4
M
94.6 kDa
1- Тотальный клеточный
экстракт E.coli (10 мкг) до
очиски на Ni-NTA агарозе
66.2 kDa
2 - Очищенные,
сконцентрированные scFv
21(15мкг)
45.0 kDa
3 - Очищенные,
сконцентрированные scFv
31(15 мкг)
4 -Очищенные,
31.0 kDa
14.4 kDa
сконцентрированные scFv 5
(15мкг)
M - белковый маркер
“Хеликон”
Рис. 4. Электрофоретический анализ белковых препаратов на
разных стадиях очистки в денатурирующих условиях SDS
PAGE(10%)
43.
Оценка чистоты препарата после ренатурации и концентрирования scFv1
2
3
M
94,6 kDa
66.2 kda
1 - Очищенные,
сконцентрированные scFv
21(15мкг)
45.0 kDa
2 - Очищенные,
сконцентрированные scFv
31(15 мкг)
31.0 kDa
3 -Очищенные,
14.4 kDa
Рис.5. Иммуно-блот - анализ выделенных
scFv.
Детекция белка с помощью мышиных
моноклональных антител
MAb anti-myc и Streptavidin-Alkaline
Phosphatase конъюгата
сконцентрированные scFv 5
(15мкг)
M - белковый маркер
“Хеликон”
44.
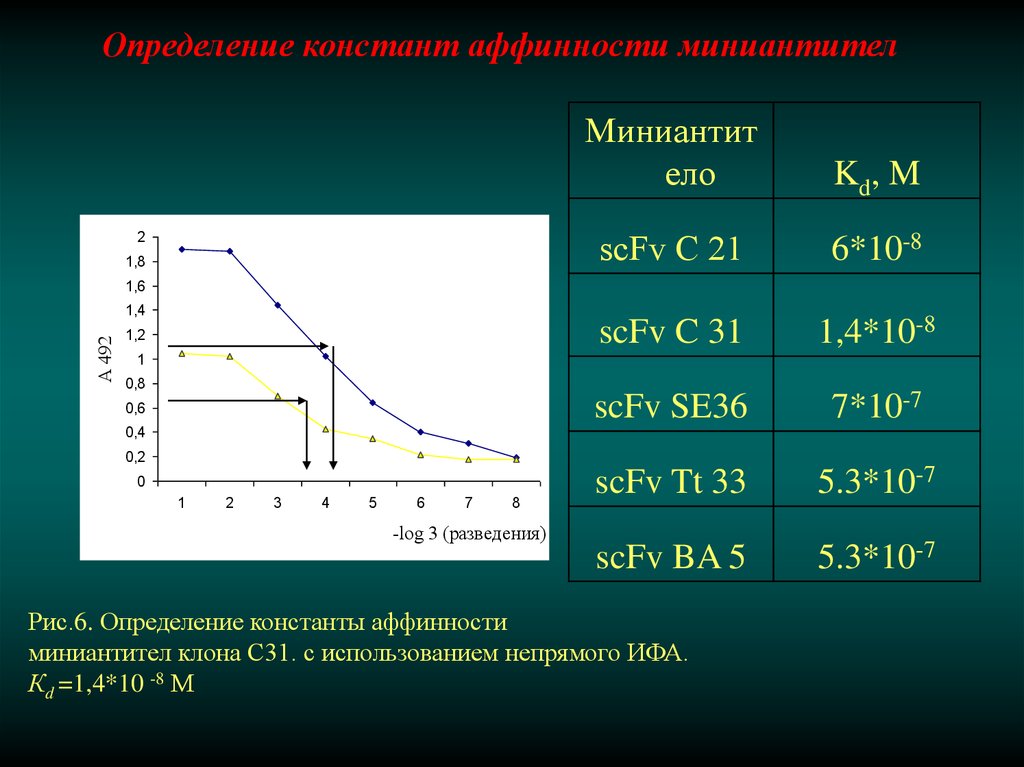
Определение констант аффинности миниантител2
1,8
Миниантит
ело
Kd, M
scFv С 21
6*10-8
scFv C 31
1,4*10-8
scFv SE36
7*10-7
scFv Tt 33
5.3*10-7
scFv BA 5
5.3*10-7
1,6
А 492
1,4
1,2
1
0,8
0,6
0,4
0,2
0
1
2
3
4
5
6
7
8
-log 3 (разведения)
Рис.6. Определение константы аффинности
миниантител клона С31. с использованием непрямого ИФА.
Кd =1,4*10 -8 М
45.
Изменение аффинности рекомбинантных антител46.
47.
Стратегия улучшения антигенсвязывающих параметровантител
48.
49.
50.
51.
52.
53.
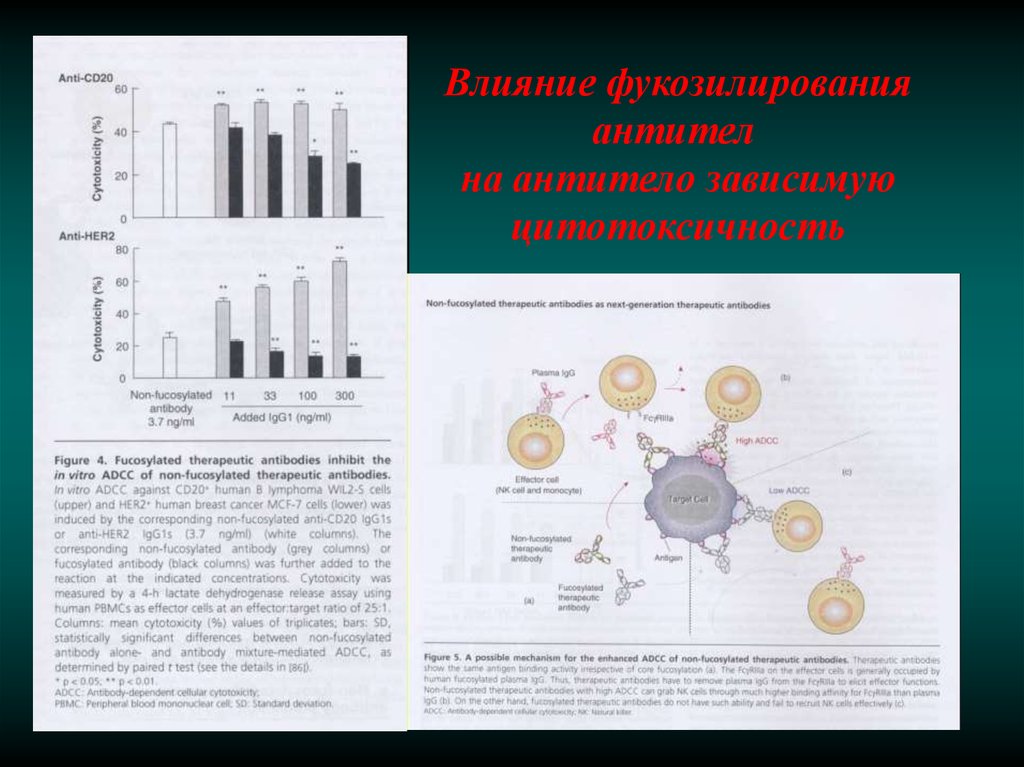
Влияние фукозилированияантител
на антитело зависимую
цитотоксичность
54.
Гликозилирование белковв диком и рекомбинантном штаммах
Pichia Pastories
55.
Гликозилирование рекомбинантных белков56.
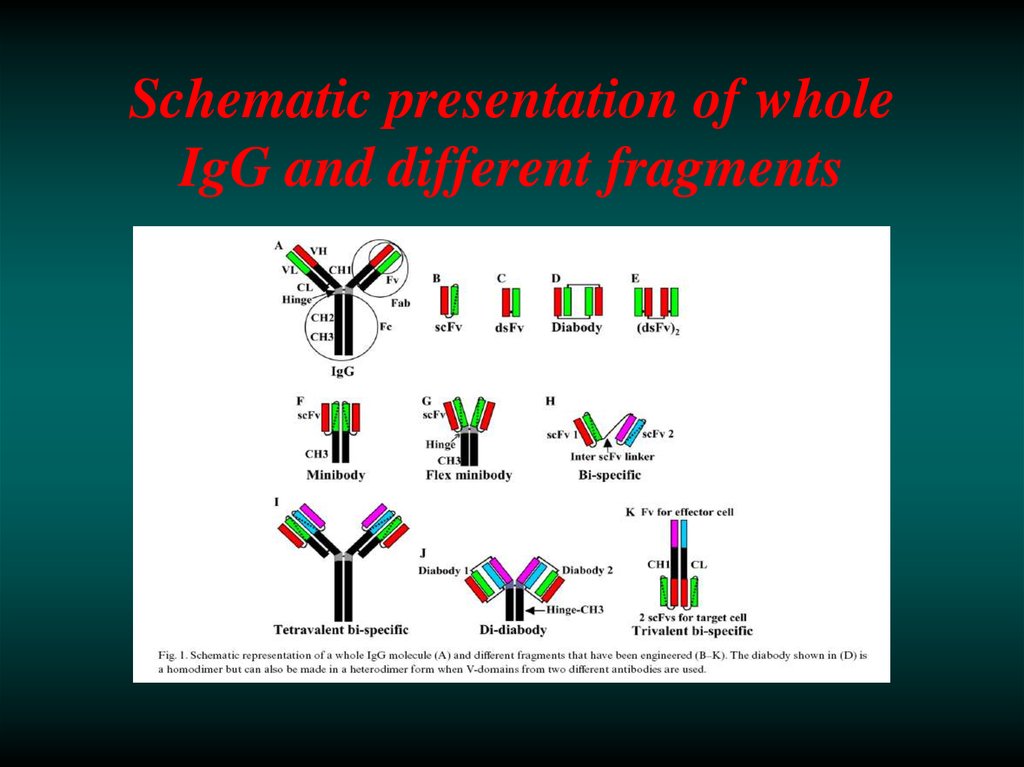
Schematic presentation of wholeIgG and different fragments
57.
58.
59.
60.
61.
62.
Binding Site BarrierHypothesis
Anti –erbB2 scFv
Affinity from 10-7 to 10-9
Activity in cellular test not
incriesed
Binding activity from 2 to 400 nM
Diabody and tumor targeting
better for 2 nM
Anti mesothelin SS antibody
(scFv) 0,8 nM 10 fold active that 11
nM,
But another mutant with 0,2 nM
affinity have low activity that 0,8
nM
63.
64.
65.
Антитела активаторы клеток иммунной системыкак инструменты в онкоиммунологии
66.
Молекулярные мишени дляактиваторных – супрессорных антител
67.
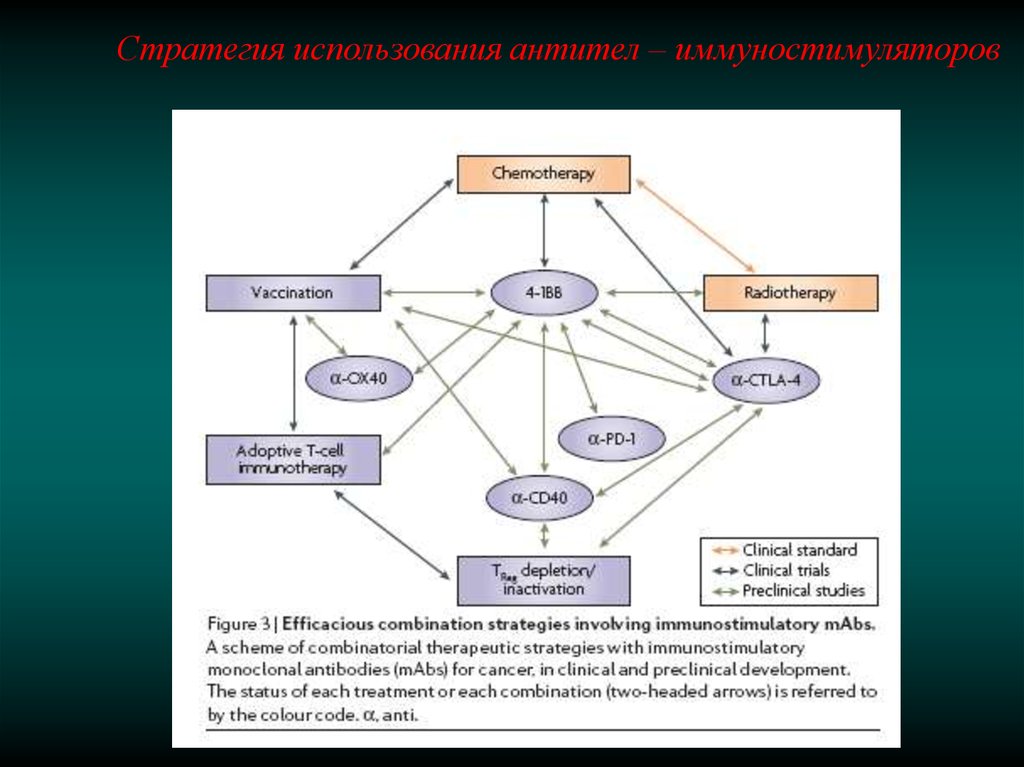
Стратегия использования антител – иммуностимуляторов68.
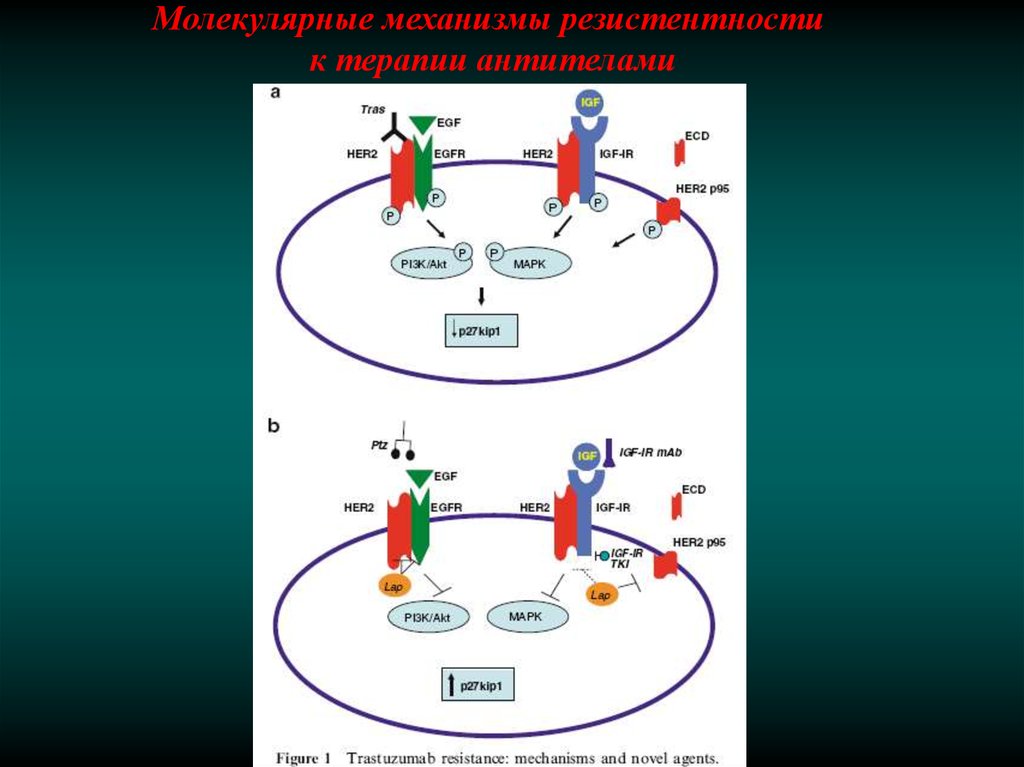
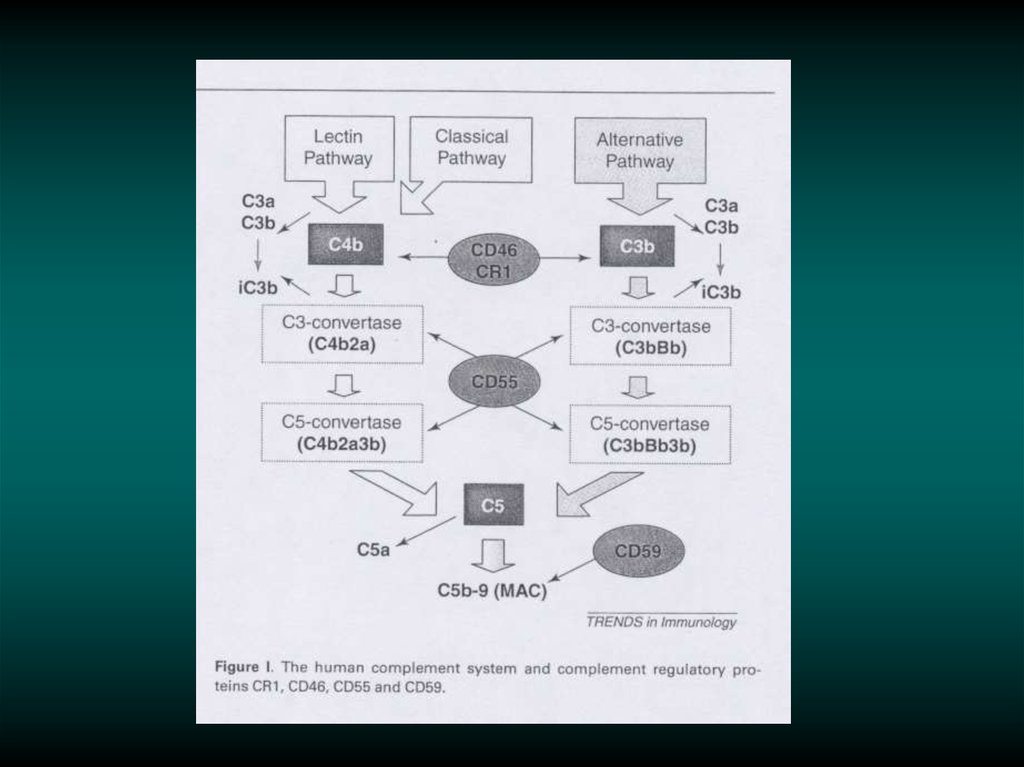
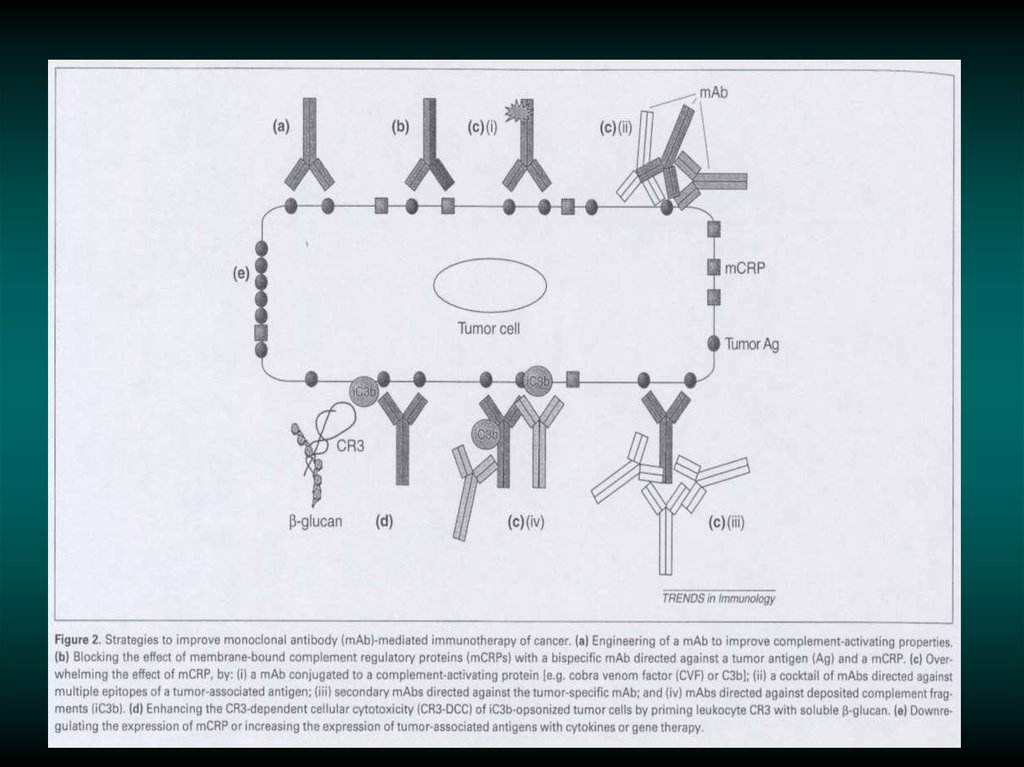
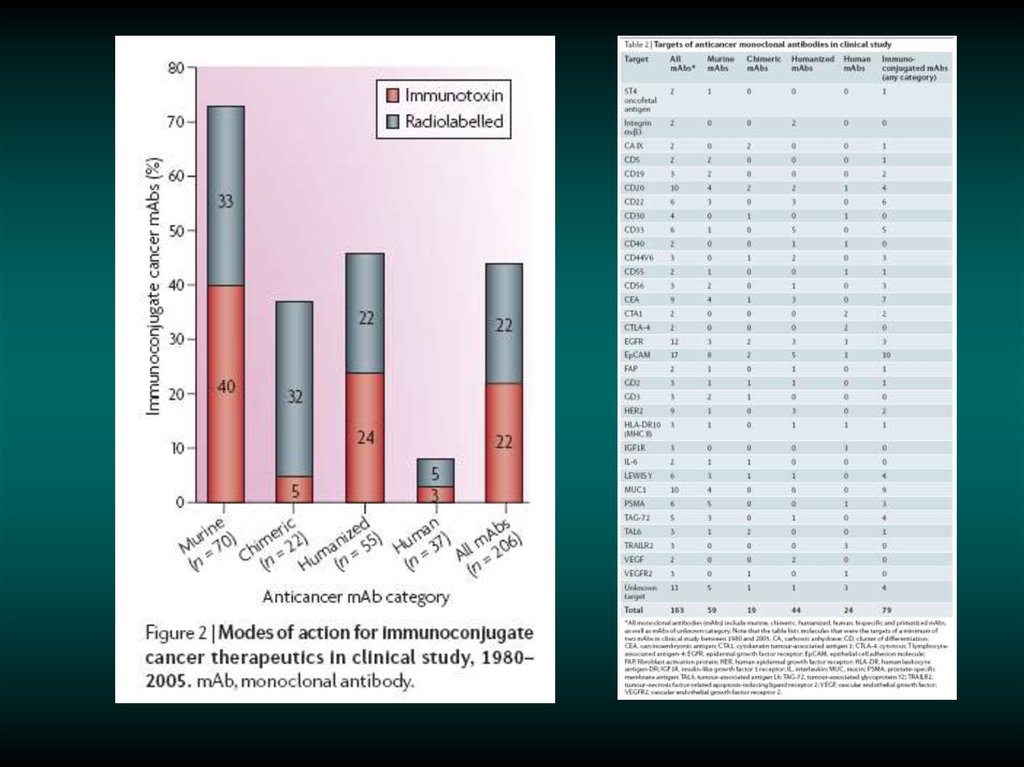
Молекулярные механизмы резистентностик терапии антителами



























































 Биология
Биология








