Похожие презентации:
Ферменты. Общие свойства ферментов
1. Ферменты
1. Явление катализа2. Общие свойства ферментов
3. Структура ферментов
4. Активность ферментов
5. Кофакторы и коферменты
6. Механизм действия ферментов
7. Классификация и номенклатура
ферментов.
2. Катализ
Возможность протекания хим.реакций обусловлена разницейсвободной энергии исх. веществ и продуктов. Самопроизвольное
течение реакции возможно, если суммарная энергия (∆G) исходных
веществ выше, чем продуктов (реакция экзергоническая). Реакция
невозможна, если ∆G ниже (реакция эндергоническая).
Скорость
экзергонической
реакции
зависит
от
«энергетического барьера», который нужно преодолеть веществом. У
реакционно способных молекул энергии достаточно для преодоления
барьера.
Энергетическая активация – дополнительное количество
энергии, необходимое молекулам веществ для преодоления
энергетического барьера.
Катализ
–
ускорение
хим.реакций
веществами
участвующих в процессе, но не расходующихся. Катализаторы
– вещества ускоряющие химические реакции.
Ферменты снижают энергию активации (Еа) (понижают
энергетический барьер) процесса, воздействуя на хим. связи
реагируемых веществ. В результате возрастает доля активированных
молекул, возрастает скорость реакции.
3. Ферменты = Энзимы
Fermentum – закваска; enzyme – в дрожжах.Ферменты – катализаторы белковой природы.
Катализ – ускорение хим.реакций веществами участвующих в
процессе, но не расходующихся.
Не каждое столкновение молекул сопровождается их
взаимодействием, а только в том случае, если достаточно много
энергии для преодоления «энергетического барьера». Энергия
активации - дополнительно энергия необходима для
преодоления «энергетического барьера» (нагрев, облучение,
давление, катализатор).
Нагрев, облучение – повышает энергию молекул. Катализатор не
повышает энергию молекул, а снижает энергетический барьер,
действуя на субстраты, расшатывая хим.связи и образуя
промежуточные продукты с низким энергетическим уровнем.
Происходит внутримолекулярная перестройка молекул
субстрата.
4. Ферменты
1) простые белки2) сложные белки (холоферменты)
апофермент
(протеин)
кофермент
(простетическая
группа)
3) рибозимы
5. Молекулярная масса
РИБОНУКЛЕАЗА ……………....………………..……………………..13700ТРИПСИН ………………………………………………………………23800
ГЕКСОКИНАЗА ……………………...………………….……………..45000
АЛЬДОЛАЗА ………………………………………………...………..142000
УРЕАЗА ………………………………………………………………..480000
ПИРУВАТДЕГИДРОГЕНАЗА ………………………………...……4500000
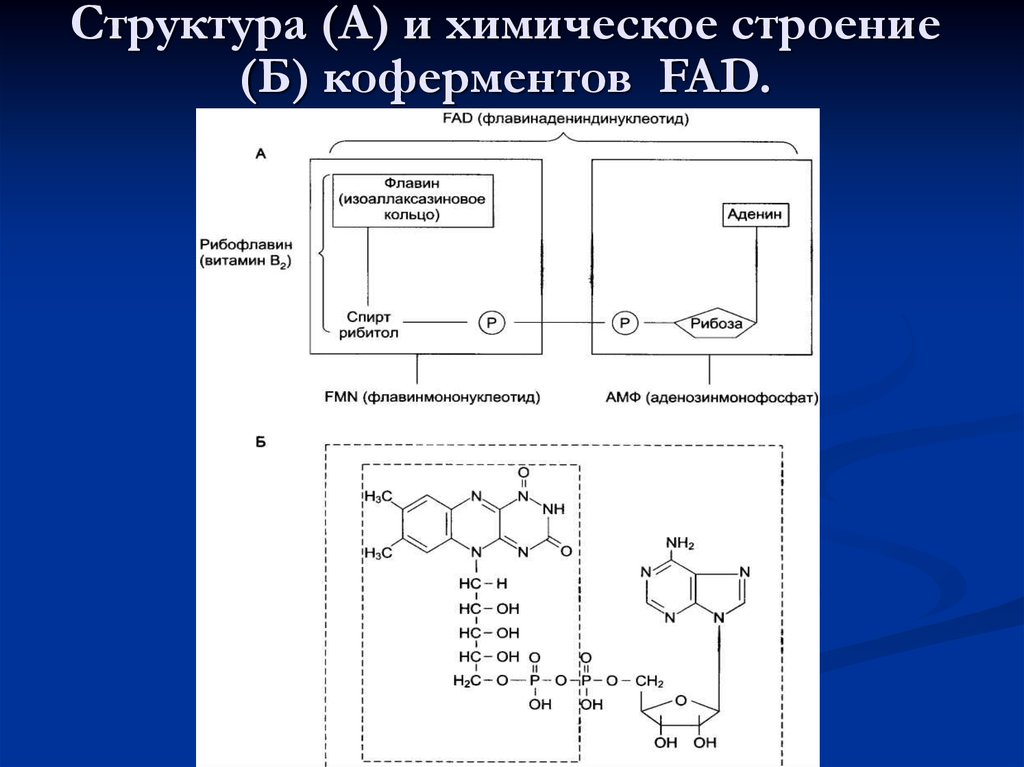
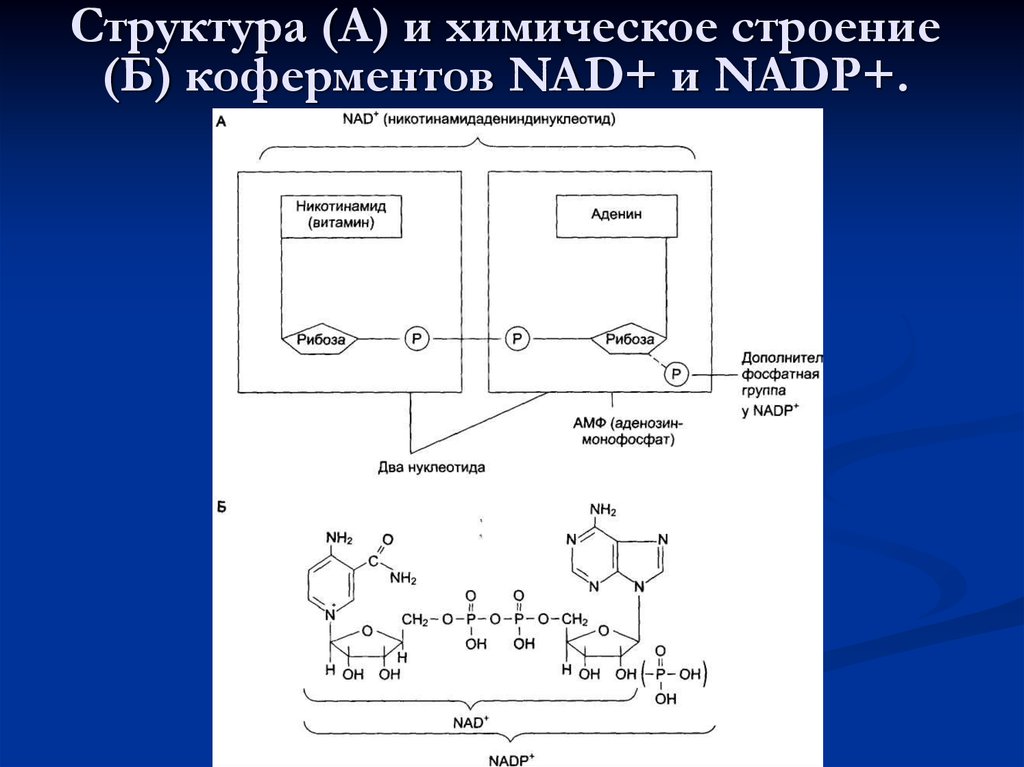
6. Кофакторы и коферменты
1. Небелковые части нуклеотидного типа.2. Нуклеотид три- и дифосфаты ( АТФ, ТТФ, УТФ, ГТФ).
3. Витаминные коферменты.
4. Металлы (Zn2+, Cu2+, Fe2+, Mo2+ и др.).
5. Пептидные коферменты (глутатион).
7. К коферментам относят следующие соединения:
производные витаминов;гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, N0- синтазы и
являющиеся простетической группой ферментов;
нуклеотиды — доноры и акцепторы остатка фосфорной
кислоты;
убихинон, или кофермент Q, участвующий в переносе
электронов и протонов в ЦПЭ;
фосфоаденозилфосфосульфат, участвующий в переносе
сульфата;
S-аденозилметионин (SАМ) — донор метильной группы;
глутатион, участвующий в окислительновосстановительных реакциях.
8. Аминокислоты, образующие каталитические центры
Серин – ОНТреонин – ОН
Тирозин – ОН
Цистеин – SH
Лизин – NH2
Аргинин – HN – C – NH2
||
NH
Гистидин - имидазол
9.
ВитаминКофермент Ферменты
В1
ТПФ
В2
ФАД, ФМН
В3
HS - КоА
В5
НАД, НАДФ
В6
ФП
В12
Н
Декарбоксилазы αкетокислот
Аэробные
дегидрогеназы
Ацилтрансферазы
Анаэробные
дегидрогеназы
Аминотрансфераз
ы
Метилтрансферазы
Карбоксилазы
(лигазы)
10. Роль металлов в присоединении субстрата в активном центре фермента.
Ионы металла выполняют функцию стабилизаторовмолекулы субстрата, активного центра фермента и
конформации белковой молекулы фермента, а именно
третичной и четвертичной структур.
11. Организация ферментов
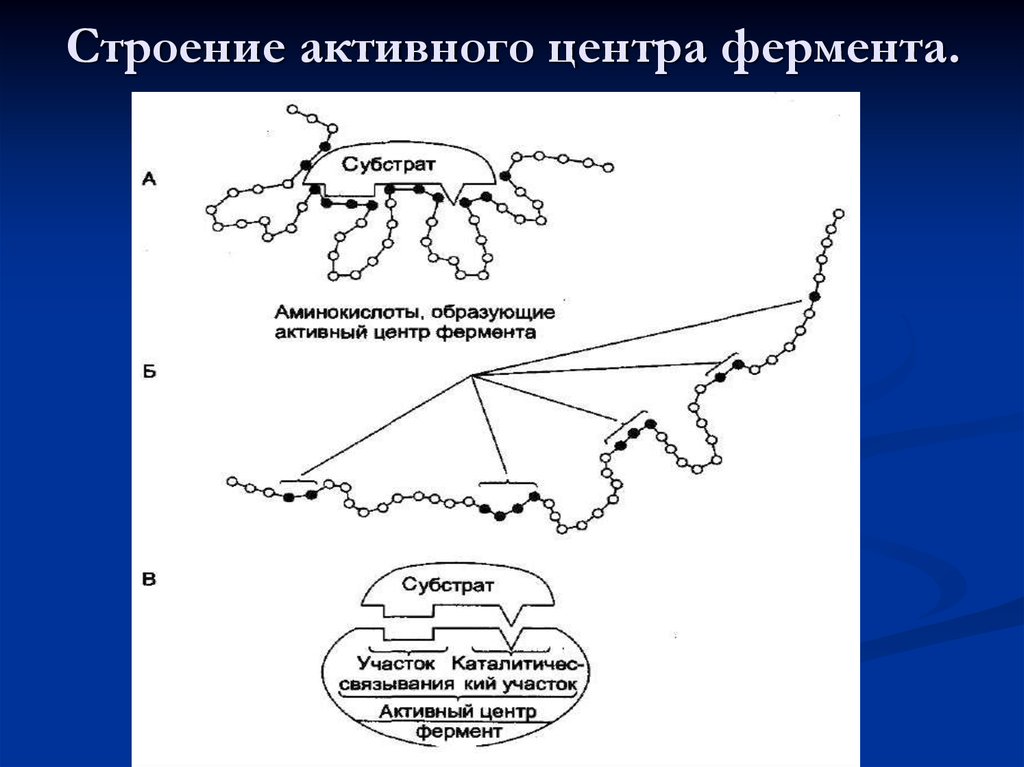
1. Активный центрКонтактный участок
Каталитический участок
2. Регуляторный (аллостерический) центр.
12. Функциональная значимость отдельных участков активного центра фермента
Активный центр ферментаУчасток связывания
Обеспечивает
субстратную специфичность
(выбор субстрата)
-абсолютная субстратная
специфичность
-групповая субстратная
специфичность
- стереоспецифичность
Каталитический участок
Обеспечивает выбор пути
химического превращения
данного субстрата
Специфичность пути
превращения
13. Строение активного центра фермента.
14. Сходство и отличия между биологическими и небиологическими катализаторами
Сходства1. Ускоряют только энергетически
возможные реакции.
2. Не изменяют направление
реакции.
3. Не изменяют равновесие
обратной реакции.
4. Не входят в состав продуктов.
5. Не расходуются в процессе
катализа.
Отличия
1. Скорость катализа много выше.
2. Специфичность действия.
3. Функционируют только в
физиологических условиях.
4. Активность ферментов
регулируется.
5. Побочных продуктов нет.
6. Взаимосвязь и взаимодействие с
другими ферментами.
7. Скорость хим.реакции
пропорциональна количеству
ферментов.
15. Общие свойства ферментов
1. Очень высокая эффективность.2. Очень высокая специфичность.
3. Регулируемость, это позволяет контролировать
метаболизм.
4. Работают в мягких условиях (t, р, рН). Чувствительны к
изменению этих факторов.
5. Нет побочных продуктов и процессов.
6.Сохраняют активность в изолированном виде.
7. Кооперативность, взаимосвязанность и
запрограмированность действия.
16.
АКТИВНОСТЬ ФЕРМЕНТОВАктивность ферментов определяют косвенно:
1.
по количеству образующегося продукта (Р),
2.
по количеству потребляемого субстрата (S).
Международная единица активности фермента Е –
количество фермента, превращающее 1 мкмольS / мин в
стандартных условиях в расчете на 1 г ткани.
Удельная активность – количество Е / мг белка.
17. Активность ферментов.
Для оценки количества молекул фермента средидругих белков данной ткани определяют удельную
активность фермента, численно равную количеству
превращенного субстрата (мкмоль), делённому на
массу (мг) белка в этой ткани в единицу времени
(мин):
18.
Каталитическая эффективность.Большинство катализируемых ферментами реакций
высокоэффективны, они протекают в 10 —10¹ раз
быстрее, чем не катализируемые реакции.
Каждая молекула фермента способна за секунду
трансформировать от 100 до 1000 молекул субстрата в
продукт.
Количество молекул субстрата, превращенных в продукт с
помощью одной молекулы фермента за 1 с, называют
числом оборотов фермента, или молярной
активностью.
19. Специфичность.
Специфичность — наиболее важное свойствоферментов, определяющее биологическую
значимость этих молекул. Различают субстратную
и каталитическую специфичности фермента,
определяемые строением активного центра.
20. Субстратная специфичность ферментов
В основе лежит строгое соответствие размеров и структурысубстратов активному центру.
1. Абсолютная специфичность – действие только на один
субстрат (уреаза взаимодействует только с мочевиной).
2. Разновидность – стехиометрическая (оптическая)
специфичность – действие только на определенные
стереоизомеры. Фумараза действует только на фумаровую
кислоту.
3. Относительная (групповая) – действие на группу веществ
имеющих один тип связи. Амилаза – на крахмал, гликоген,
декстрины, пепсин – на разные белки.
21. Каталитическая специфичность
Биологическая функция фермента, как и любого белка,обусловлена наличием в его структуре активного
центра. Лиганд, взаимодействующий с активным
центром фермента, называют субстратом. В активном
центре фермента есть аминокислотные остатки,
функциональные группы которых обеспечивают
связывание субстрата, и аминокислотные остатки,
функциональные группы которых осуществляют
химическое превращение субстрата. Условно эти
группы обозначают как участок связывания субстрата и
каталитический участок, однако не всегда эти участки
имеют чёткое пространственное разделение и иногда
могут «перекрываться».
22. Полиферментные системы
1. Каждая клетка имеет специфичный состав ферментов.2. Некоторые ферменты содержатся во всех клетках, другие в
немногих.
3. Работа каждого фермента, обычно, не индивидуальна, а
связана с другими ферментами из которых формируется
полиферментные системы – конвейеры.
4. Субстрат проходит длинную цепь реакции многих
ферментов Р1→S2→Р2→S3
5. Некоторые ферменты системы связаны с органеллами,
биомембранной или цитоскелетом.
6. Некоторые ферменты одной цепи метаболизма
объединяются в мультиферментные комплексы с
определенной функцией.
23.
Ферментные ансамбли или мультиферменты – комплексферментов, катализирующих последовательные реакции
при превращении одного вещества.
24. Энергетические изменения ПРИ ХИМИЧЕСКИХ РЕАКЦИЯХ.
Любые химические реакции протекают,подчиняясь двум основным законам
термодинамики: закону сохранения энергии и
закону энтропии. Согласно этим законам, общая
энергия химической системы и её окружения
остаётся постоянной, при этом химическая система
стремится к снижению упорядоченности
(увеличению энтропии).
25. Изменение свободной энергии при разложении угольной кислоты.
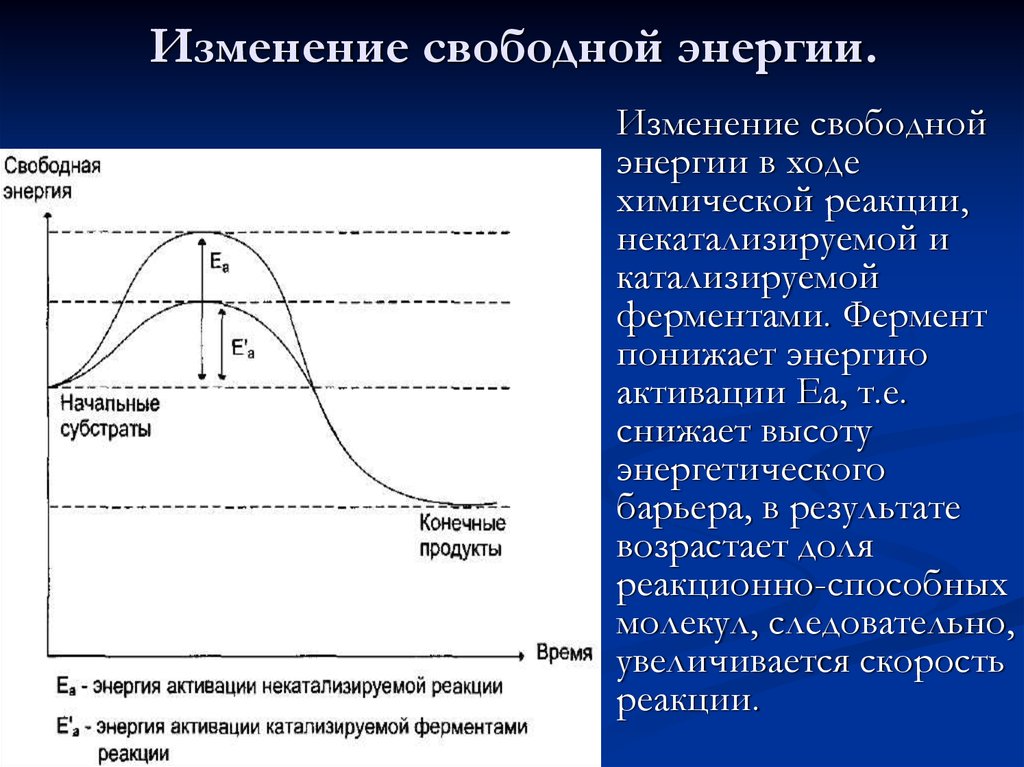
26. Изменение свободной энергии.
Изменение свободнойэнергии в ходе
химической реакции,
некатализируемой и
катализируемой
ферментами. Фермент
понижает энергию
активации Еа, т.е.
снижает высоту
энергетического
барьера, в результате
возрастает доля
реакционно-способных
молекул, следовательно,
увеличивается скорость
реакции.
27. Механизм ферментативного катализа.
В механизме ферментативного катализа решающеезначение имеет образование нестойких
промежуточных соединений — ферментсубстратный комплексов - ES, подвергающихся
превращению в нестабильный переходной
комплекс - ЕР, который почти мгновенно
распадается на свободный фермент и продукт
реакции.
28. Эффект деформации.
Активный центр фермента также способствуетдестабилизации межатомных связей в молекуле
субстрата, что облегчает протекание химической
реакции и образование продуктов. Это свойство
активного центра называют эффектом
деформации субстрата .
29. Последовательность действия ферментов
В участке связывания субстрат при помощинековалентных связей взаимодействует
(связывается) с ферментом, формируя ферментсубстратный комплекс.
В каталитическом участке субстрат претерпевает
химическое превращение в продукт, который затем
высвобождается из активного центра фермента.
30. Механизм действия ферментов
1. Стадия: диффузия, связывание S ферментом Е иобразование фермент – субстратного комплекса - ES.
Индуцированное соответствие S активному центру.
ЭА измеряется незначительно. Очень быстрый процесс.
2. Стадия: образование активированного ES*. Резкое
снижение ЭА. Взаимодействие Е и S. Дестабилизация
химических связей в S.
3. Стадия: образование продуктов и их выход.
31. Образование фермент-субстратного комплекса.
Схематично процесс катализа можно представитьследующим уравнением:
где Е — фермент (энзим), 3 — субстрат, Р —
продукт. Данные обозначения общеприняты и
происходят от английских слов enzyme, substrat,
produkt.
32. Мультисубстратные реакции:
Большинство ферментов катализирует реакции, вкоторых участвует более чем один субстрат. В
случае если кофермент не является простетической
группой, его также можно рассматривать как ещё
один субстрат. Следовательно, участников
ферментативной реакции может быть несколько:
непосредственно фермент, несколько
субстратов и кофермент.
33. Механизм упорядоченного взаимодействия субстрата с активным центром фермента:
Первым в активный центр фермента присоединяетсясубстрат А, облегчая присоединение субстрата В. После
химической модификации также наблюдают
определенный порядок высвобождения продуктов
реакции.
34. Этапы ферментативного катализа.
I - этап сближения и ориентации субстрата относительноактивного центра фермента; II - образование ферментсубстратного комплекса (ES) в результате
индуцированного соответствия; III - деформация
субстрата и образование нестабильного комплекса
фермент-продукт (ЕР); IV - распад комплекса (ЕР) с
высвобождением продуктов реакции из активного центра
фермента и освобождением фермента.
35. Молекулярные механизмы ферментативного катализа
1. Эффект ориентации реагентов снижает энтропию и энергиюактивации, ускоряет реакцию в тысячи раз.
2. Эффект «деформации» субстрата – «растягивается» хим.связь,
снижается энергия её разрыва (снижается энергия активации).
3. Кислотно-основной катализ. В активном центре имеются
функциональные группы аминокислотных остатков с
кислотными и основными группами.
Фермент является и акцептором и донором протонов и электронов.
Происходит перераспределение электронной плотности на
участке субстрата. Это облегчает перестройку и разрыв связей.
4. Ковалентный катализ – образование ковалентных связей с
субстратами.
36. Снижение энергетического барьера происходит за счет:
1. Повышения вероятности столкновения субстратов.2. Строгая ориентация взаимодействия молекул в активном
центре.
3. Максимальное сближение субстратов.
4. Действие на определённые атомы субстрата атомами
активного центра.
5. Смещение электронов и протонов, что повышает
реакционоспособность атомов.
37. Ферментативная кинетика
Раздел биохимии, который изучает ферментативнуюактивность в зависимости от условий протекания реакций.
В частности, в зависимости от количества субстратов,
продуктов и других метаболитов. В зависимости от
температуры, давления, кислотности среды и наличия
ингибиторов.
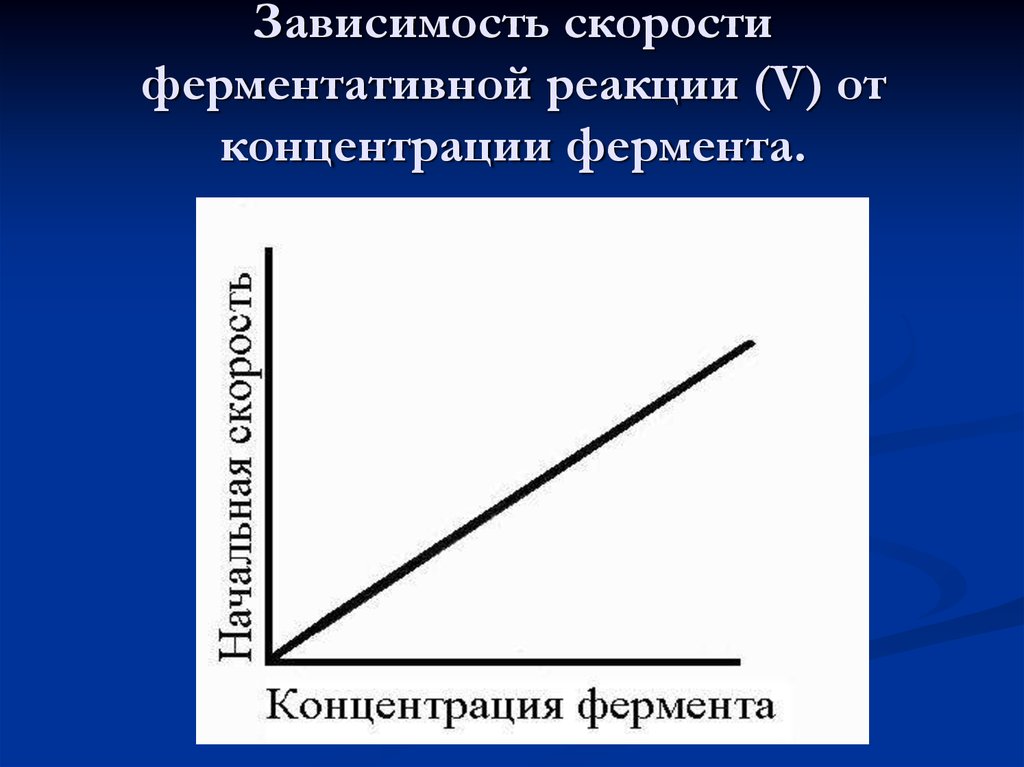
38. Зависимость скорости ферментативной реакции (V) от концентрации фермента.
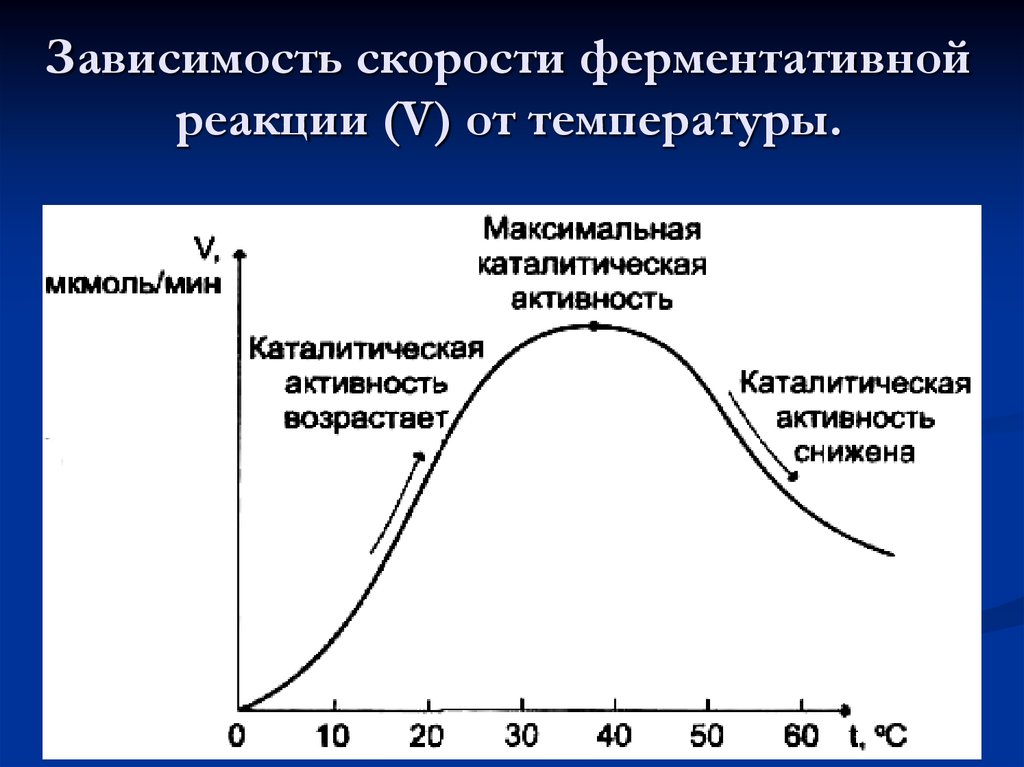
39. Зависимость скорости ферментативной реакции (V) от температуры.
40. Зависимость скорости ферментативной реакции (V) от рН среды.
41. Оптимальные значения рН для некоторых ферментов.
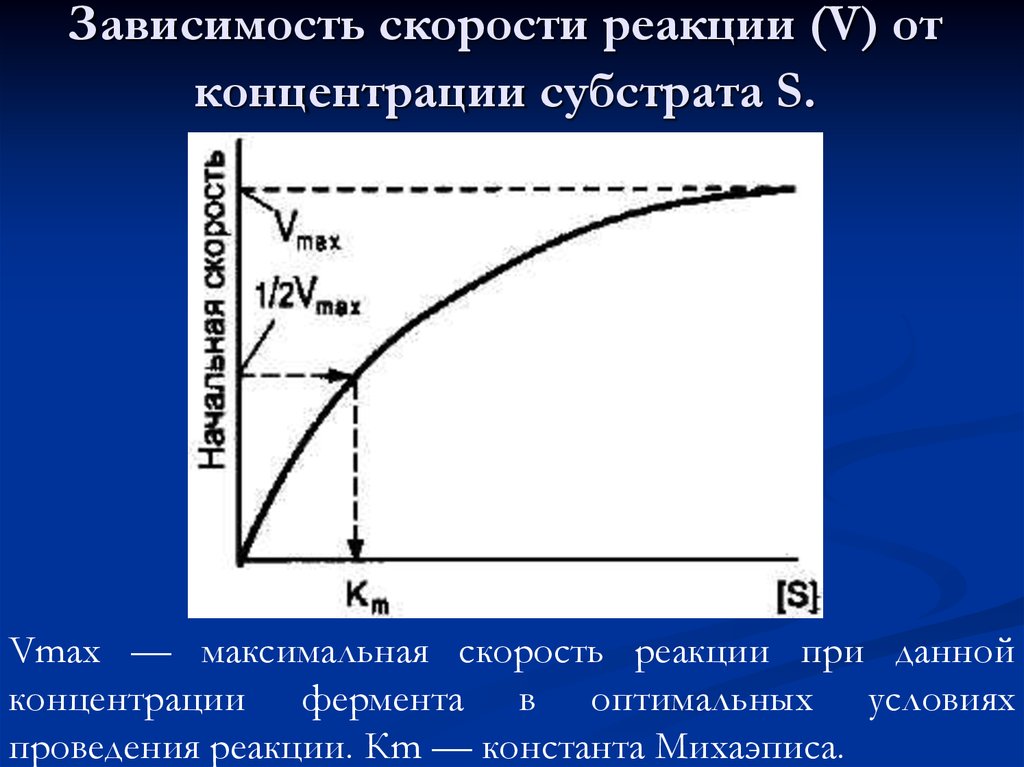
42. Зависимость скорости реакции (V) от концентрации субстрата S.
Vmax — максимальная скорость реакции при даннойконцентрации фермента в оптимальных условиях
проведения реакции. Кm — константа Михаэписа.
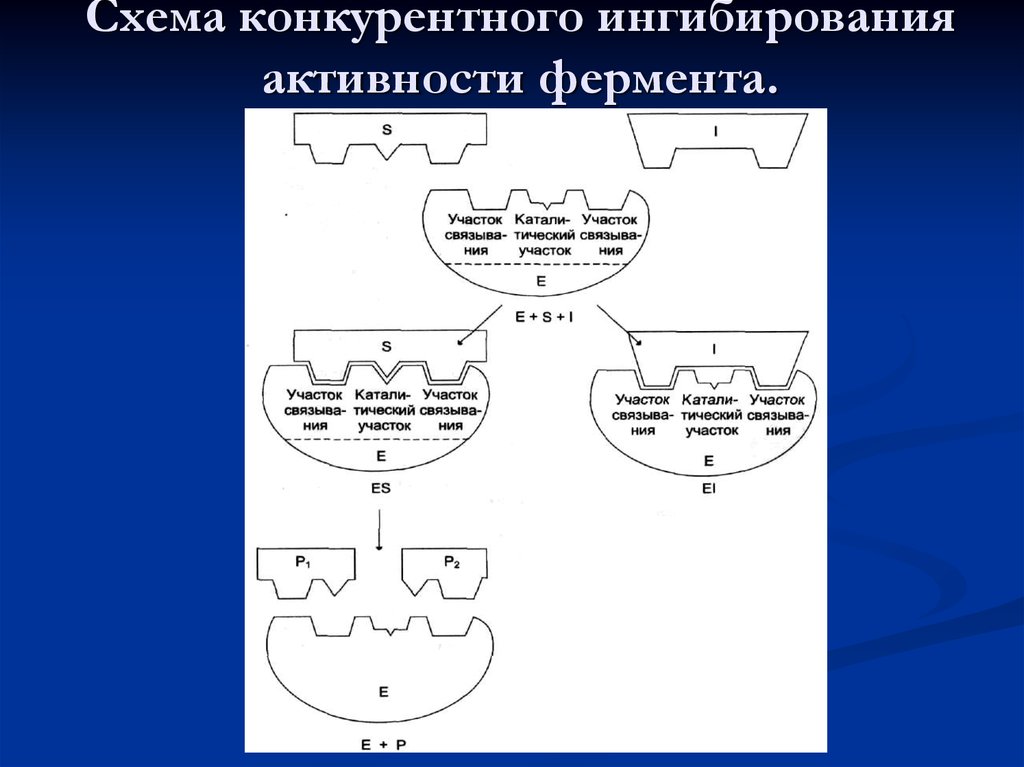
43. Схема конкурентного ингибирования активности фермента.
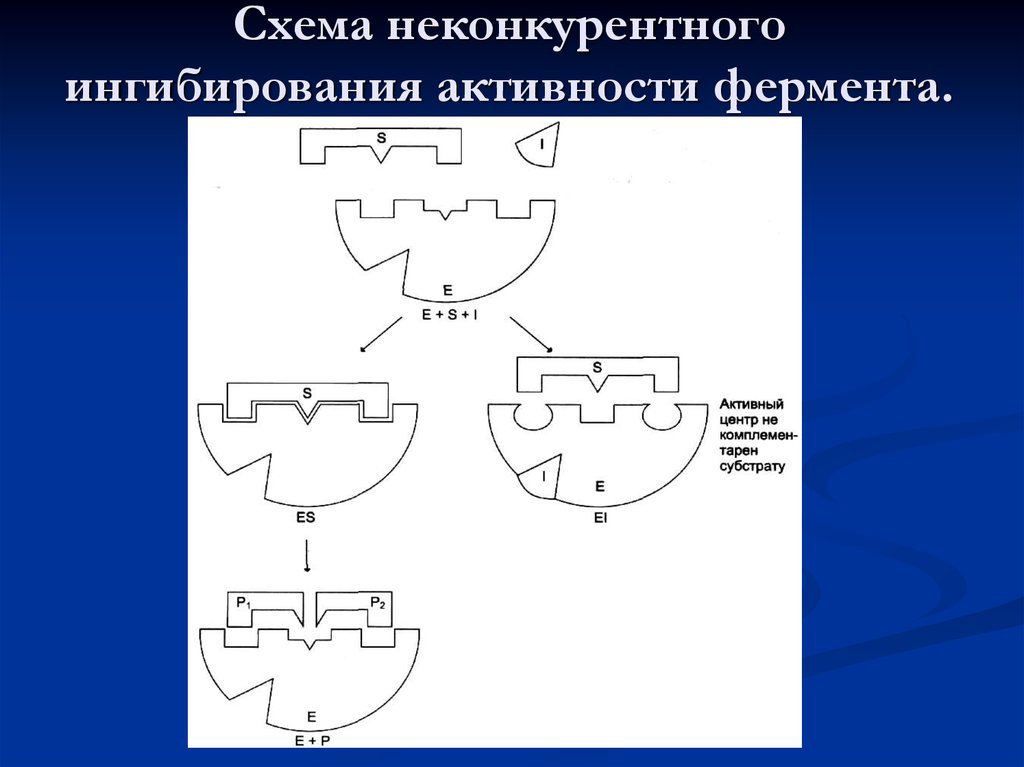
44. Схема неконкурентного ингибирования активности фермента.
45. Механизм действия ионов ртути как необратимого ингибитора.
Ионы ртути в малых концентрациях блокируютсульфгидрильные группы активного центра, что приводит к
снижению скорости ферментативной реакции.
46. Основные способы регуляции активности ферментов:
аллостерическая регуляция;регуляция с помощью белок-белковых
взаимодействий;
регуляция путём фосфорилирования/дефосфорилирования молекулы фермента;
регуляция частичным (ограниченным)
протеолизом.
47. Схема положительной и отрицательной регуляции катаболизма глюкозы.
Молекула АТФ участвует вретроингибировании
аллостерических ферментов
фосфо-фруктокиназы
и
пируваткиназы. Фруктозо1,6-бисфосфат — активатор
метаболического
пути
распада глюкозы. Плюсами
отмечена
активация,
минусами— ингибирование
ферментов.
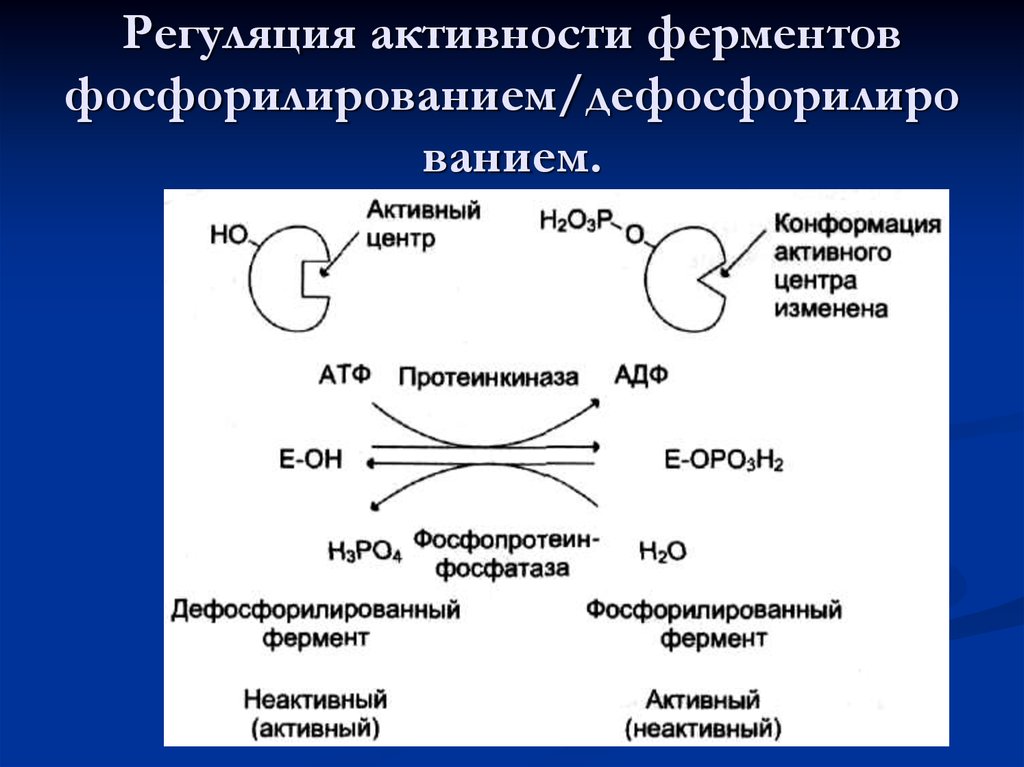
48. Регуляция активности ферментов фосфорилированием/дефосфорилированием.
Регуляция активности ферментовфосфорилированием/дефосфорилиро
ванием.
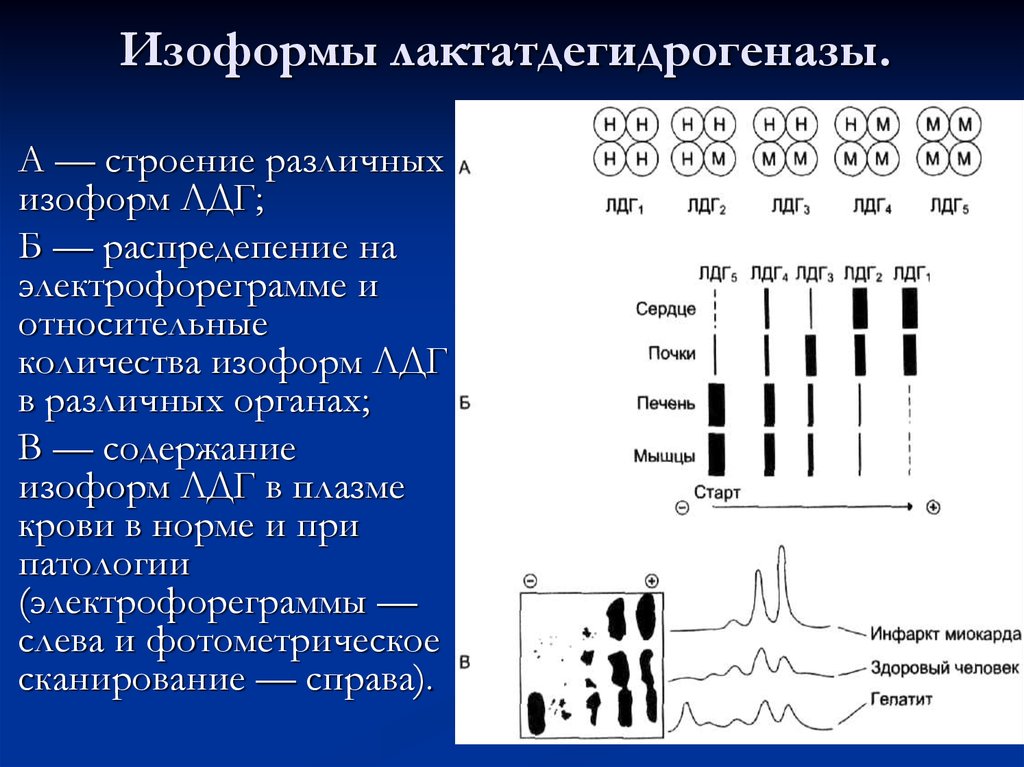
49. Изоформы лактатдегидрогеназы.
А — строение различныхизоформ ЛДГ;
Б — распредепение на
электрофореграмме и
относительные
количества изоформ ЛДГ
в различных органах;
В — содержание
изоформ ЛДГ в плазме
крови в норме и при
патологии
(электрофореграммы —
слева и фотометрическое
сканирование — справа).
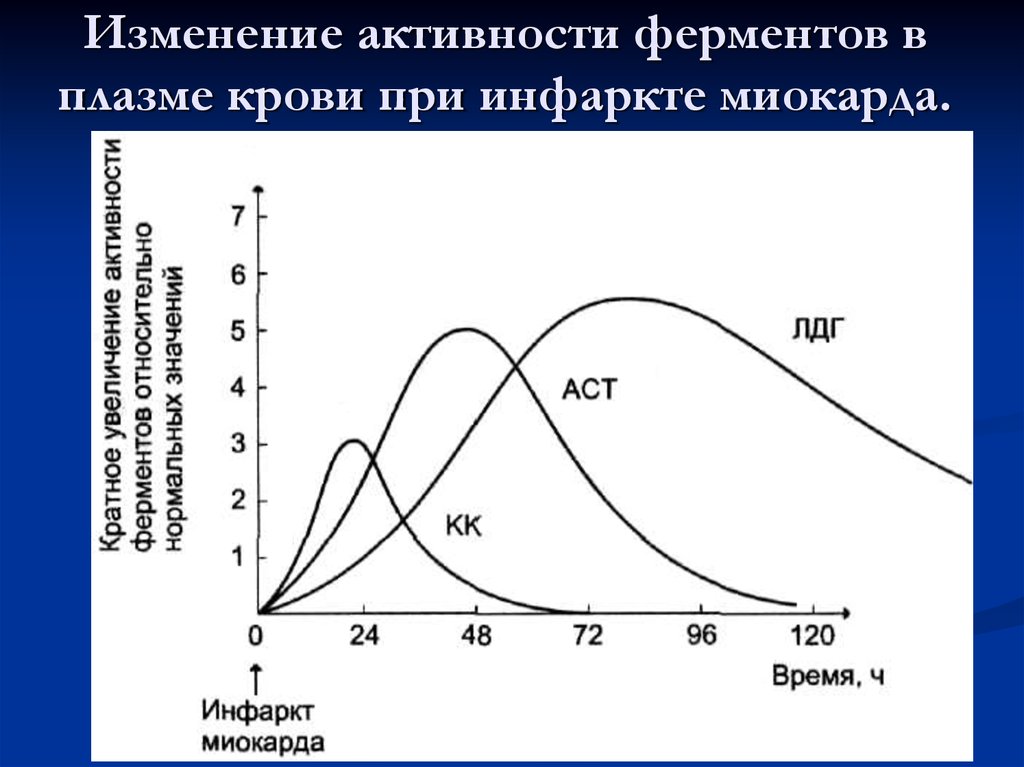
50. Изменение активности ферментов в плазме крови при инфаркте миокарда.
51.
Лабильность ферментовКаталитическая эффективность фермента, как и любой
белковой молекулы, зависит от его конформации, и в
частности от конформации активного центра.
Для ферментов характерна конформационная
лабильность — способность к небольшим изменениям
нативной конформации вследствие разрыва слабых
связей. Поэтому воздействие денатурирующих агентов,
способных изменять конформацию молекулы фермента,
приводит к изменению конформации активного центра и
снижению способности присоединять субстрат. В
результате этого уменьшается каталитическая
эффективность фермента.
52. Возможные пути преобразования глюкозы-6-фосфата.
53. Классификация и номенклатура ферментов.
Известно 6 классов ферментов:1. Оксидоредуктазы
2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Лигазы
Каждый фермент имеет 2 названия. Первое —
короткое, так называемое рабочее, удобное для
повседневного использования. Второе (более
полное) — систематическое, применяемое для
однозначной идентификации фермента.
54. 1. Оксидоредуктазы.
Катализируютразличные
окислительновосстановительные реакции с участием 2 субстратов
(перенос е ־или атомов водорода с одного субстрата
на другой).
Систематическое
наименование
ферментов
составляют по формуле «донор: акцептор —
оксидоредуктаза», рабочее — субстрат-подкласс
оксидоредуктаз.
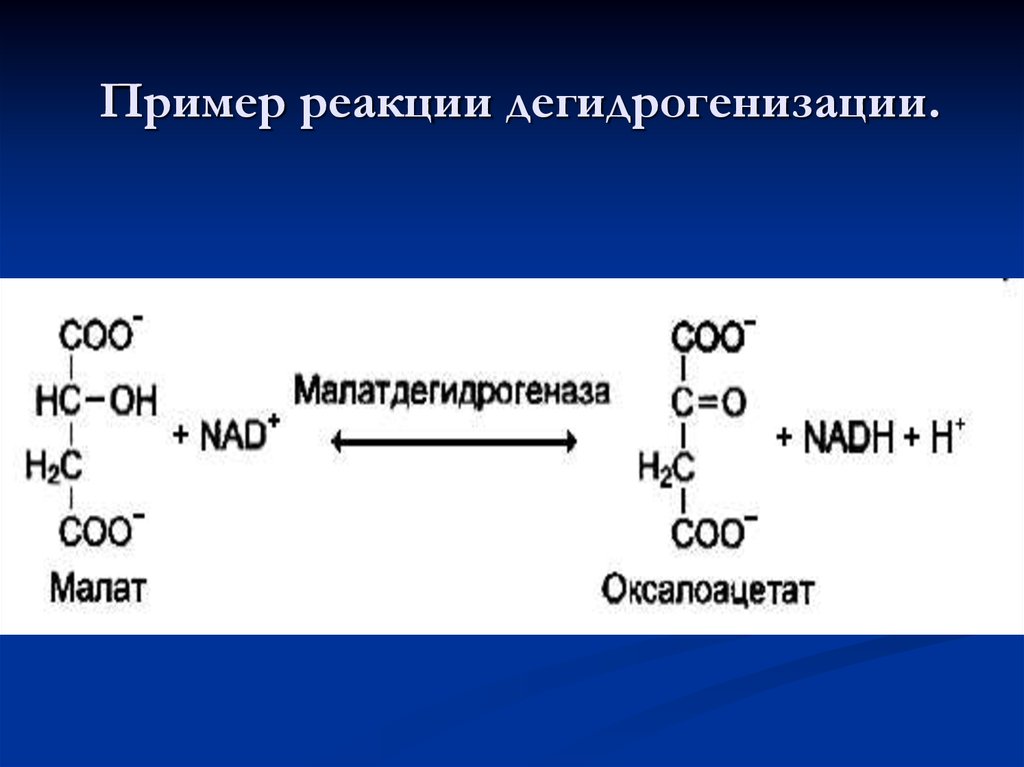
55. Дегидрогеназы.
В этот подкласс входят ферменты, катализирующиереакции дегидрирования (отщепления водорода). В
качестве акцепторов электронов используются
коферменты NAD+, NADP, FAD, FMN. Все
ферменты этой группы обладают высокой
субстратной специфичностью.
56. Пример реакции дегидрогенизации.
57. Оксидазы.
Акцептором электрона служит молекулярныйкислород. Пример реакции, катализируемой
цитохромоксидазой:
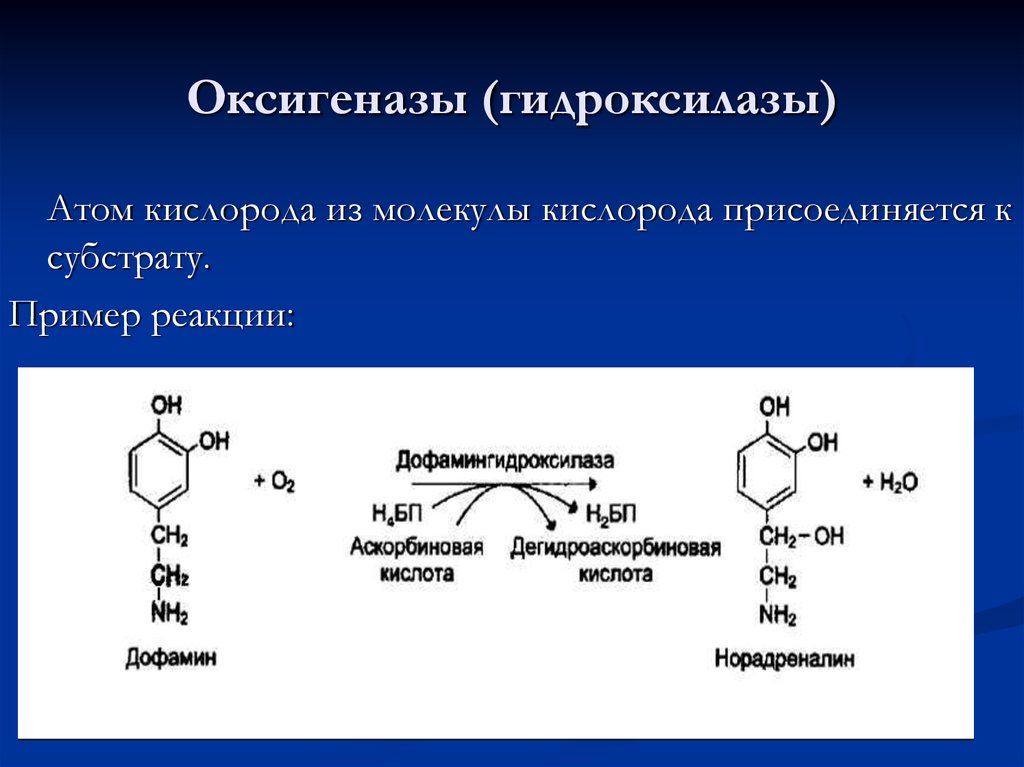
58. Оксигеназы (гидроксилазы)
Атом кислорода из молекулы кислорода присоединяется ксубстрату.
Пример реакции:
59. 2. Трансферазы.
Катализируют перенос функциональных групп от одногосоединения к другому. Подразделяют в зависимости от
переносимой группы.
Название этих ферментов составляют по формуле
«донор: акцептор транспортируемая группа-трансфераза».
К классу трансфераз относят аминотрансферазы,
ацилтрансферазы, метилтрансферазы,
гликозилтрансферазы, киназы (фосфотрансферазы).
60. Примеры реакций с участием трансфераз.
61. 3. Гидролазы
Катализируют реакции гидролиза (расщепленияковалентной связи с присоединением молекулы воды по
месту разрыва). Подразделяют в зависимости от
расщепляемой связи.
Наименование ферментов составляют по формуле
«субстрат—гидролаза» или прямым присоединением к
названию субстрата суффикса «аза», например протеаза,
липаза, фосфолипаза, рибонуклеаза.
Для отдельных классов гидролаз применимы специальные
термины, характеризующие гидролиз определённой
химической связи: эстеразы, фосфатазы и др.
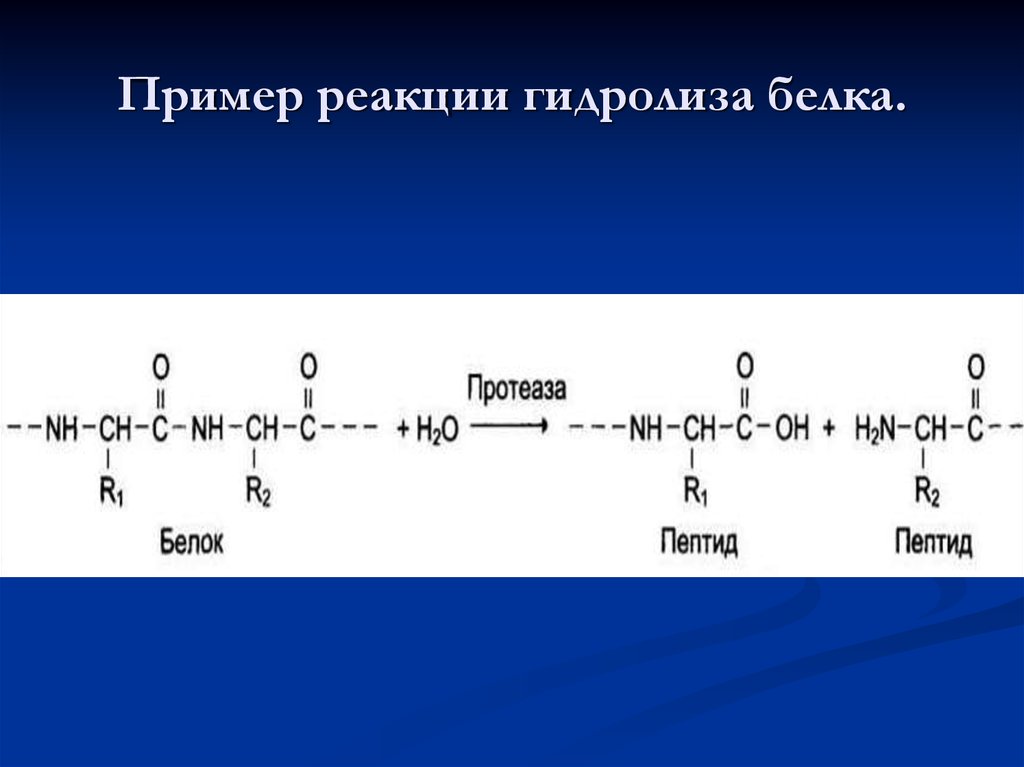
62. Пример реакции гидролиза белка.
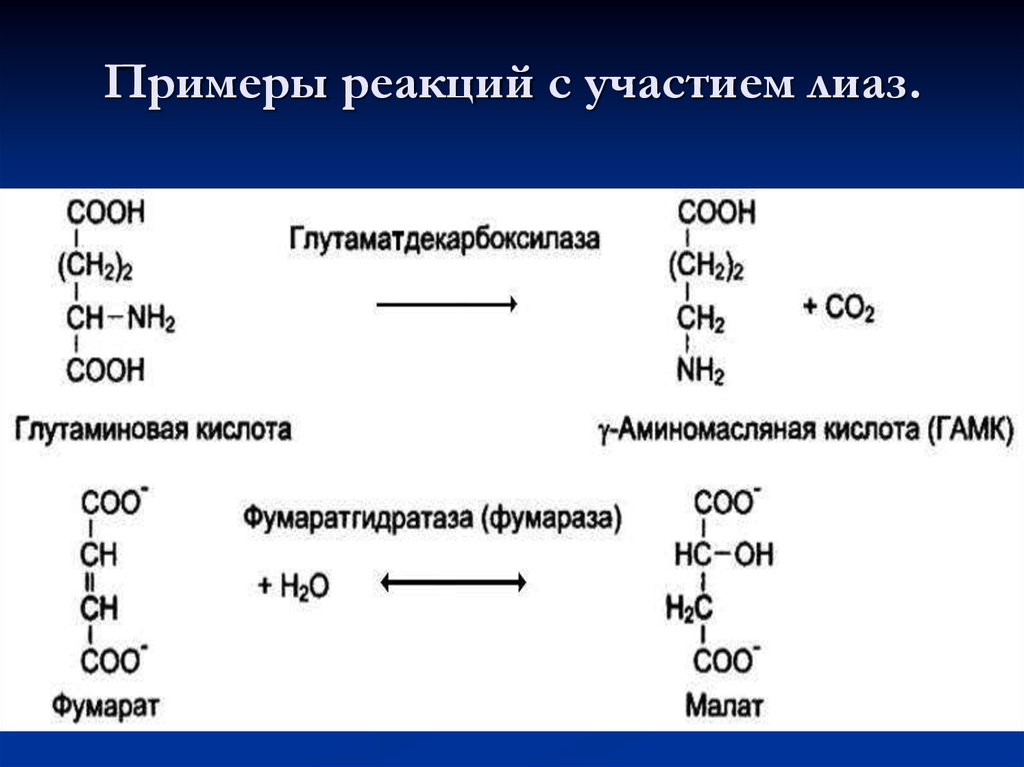
63. 4. Лиазы
К лиазам относят ферменты, отщепляющие от субстратовнегидролитическим путём определённую группу (при
этом могут отщепляться СО2, Н2О, NH2, SH2 и др.) или
присоединяющие чаще всего молекулу воды по двойной
связи.
64. Примеры реакций с участием лиаз.
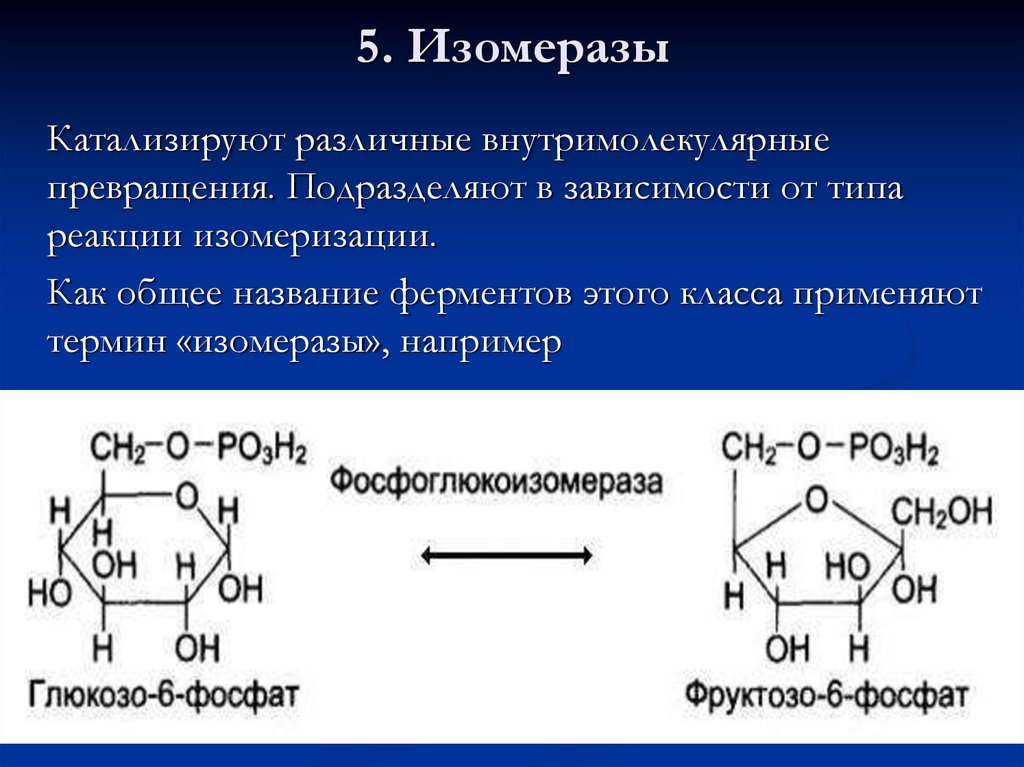
65. 5. Изомеразы
Катализируют различные внутримолекулярныепревращения. Подразделяют в зависимости от типа
реакции изомеризации.
Как общее название ферментов этого класса применяют
термин «изомеразы», например
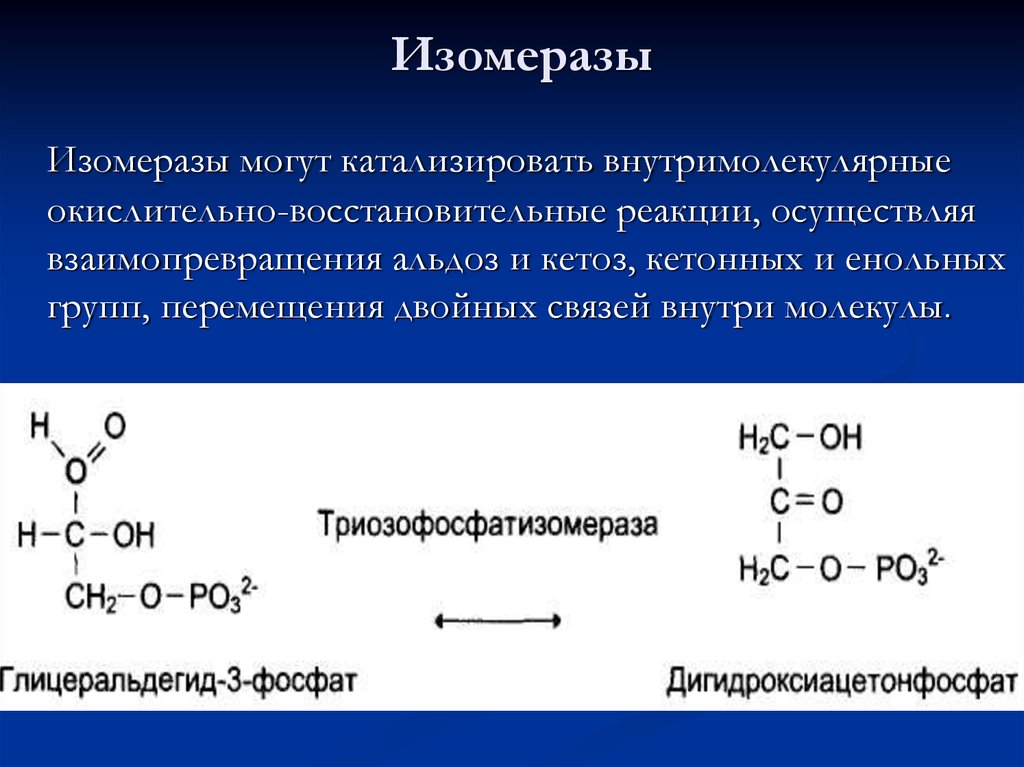
66. Изомеразы
Изомеразы могут катализировать внутримолекулярныеокислительно-восстановительные реакции, осуществляя
взаимопревращения альдоз и кетоз, кетонных и енольных
групп, перемещения двойных связей внутри молекулы.
67. Мутазы
Когда изомеризация состоит во внутримолекулярномпереносе группы, фермент называют «мутазой», например
68. 6. Лигазы (синтетазы)
Катализируют реакции присоединения друг к другу двухмолекул с образованием ковалентной связи.
69. Лигазы
Этот процесс сопряжён с разрывом фосфоэфирнойсвязи в молекуле АТФ (или других
нуклеозидтрифосфатов) или с разрывом
макроэргических связей других соединений. В первом
случае (при использовании энергии гидролиза АТФ)
такие ферменты называют лигазами, или синтетазами.
70. Механизм функционирования лигаз.
В случае, когда источником энергии служит любое другоемакроэргическое соединение (не АТФ), ферменты
называют синтазами.
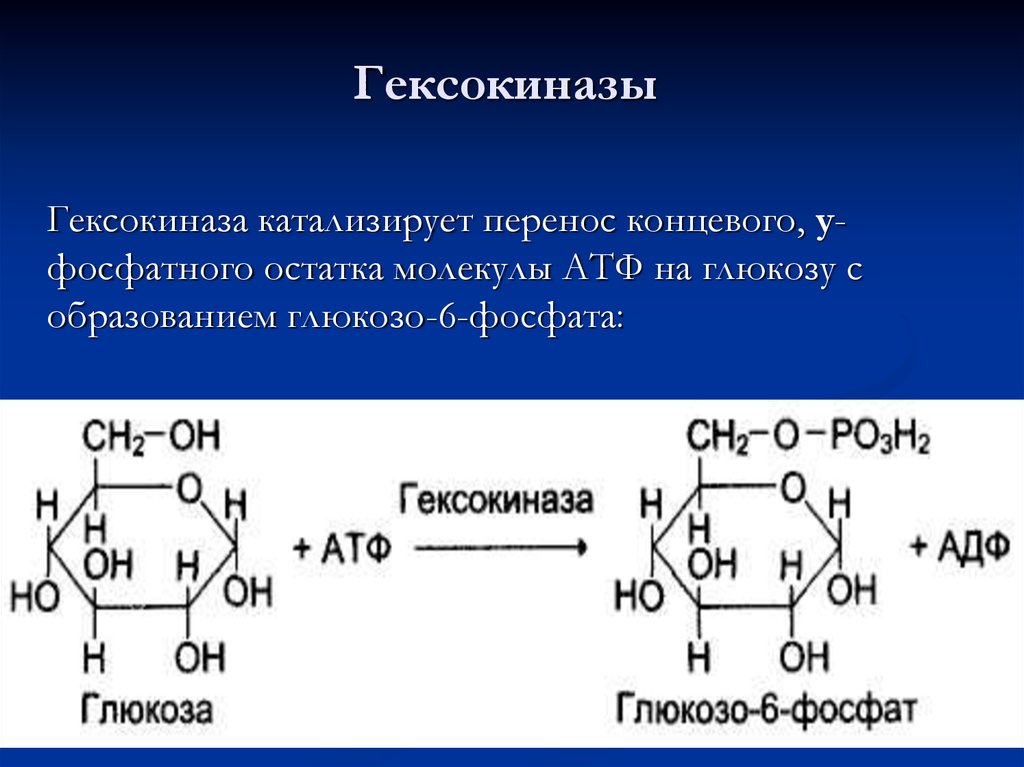
71. Гексокиназы
Гексокиназа катализирует перенос концевого, уфосфатного остатка молекулы АТФ на глюкозу собразованием глюкозо-6-фосфата:
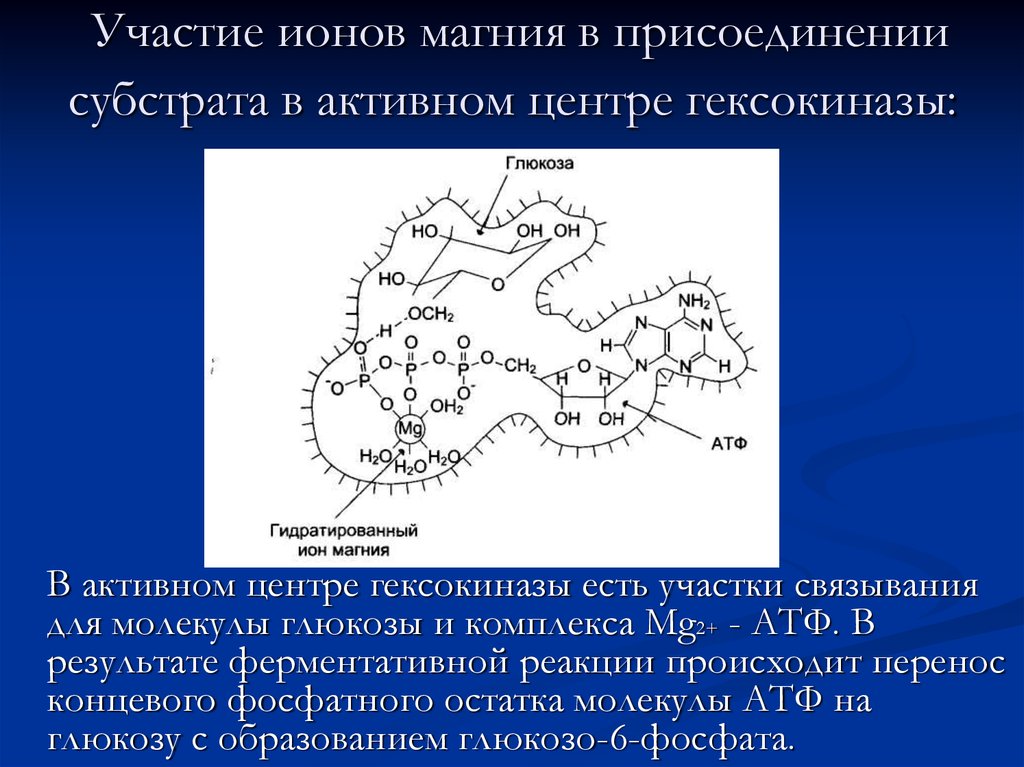
72. Участие ионов магния в присоединении субстрата в активном центре гексокиназы:
В активном центре гексокиназы есть участки связываниядля молекулы глюкозы и комплекса Мg2+ - АТФ. В
результате ферментативной реакции происходит перенос
концевого фосфатного остатка молекулы АТФ на
глюкозу с образованием глюкозо-6-фосфата.
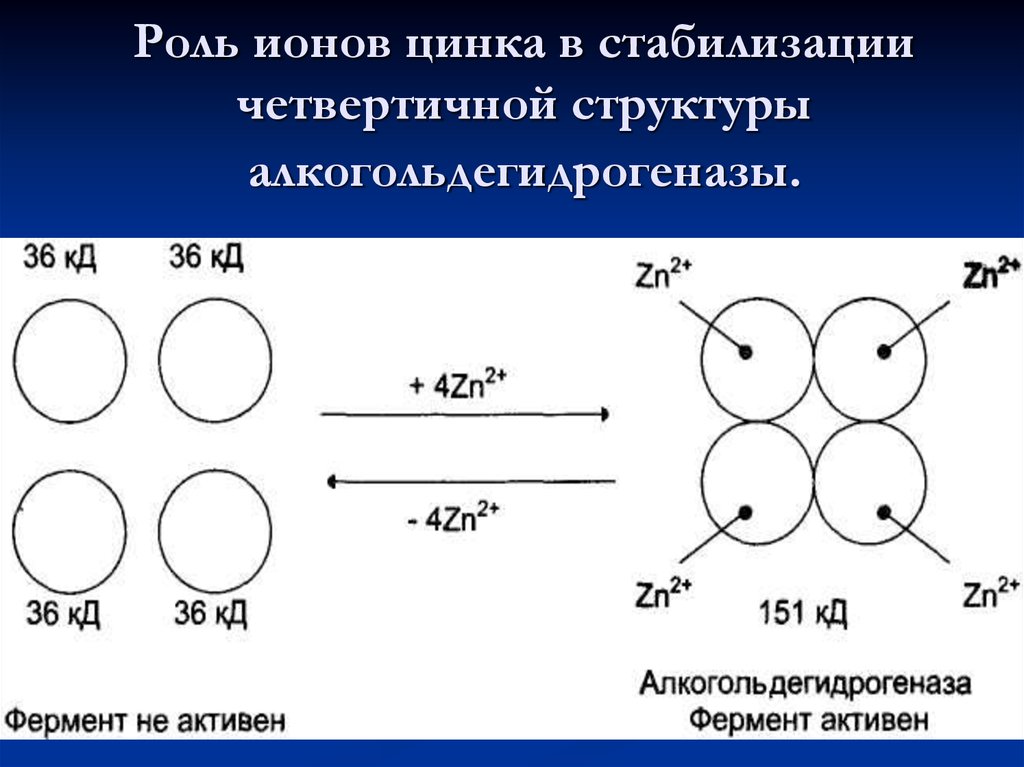
73. Роль ионов цинка в стабилизации четвертичной структуры алкогольдегидрогеназы.
74. Участие металлов в окислительно-восстановительных реакциях:
Участие металлов в окислительновосстановительных реакциях:Ионы металлов с переменной
валентностью могут также
участвовать в переносе
электронов. Например, в
цитохромах (гемсодержащих
белках) ион железа способен
присоединять и отдавать
один электрон. Благодаря
этому свойству цитохромы
участвуют в окислительновосстановительных реакциях.
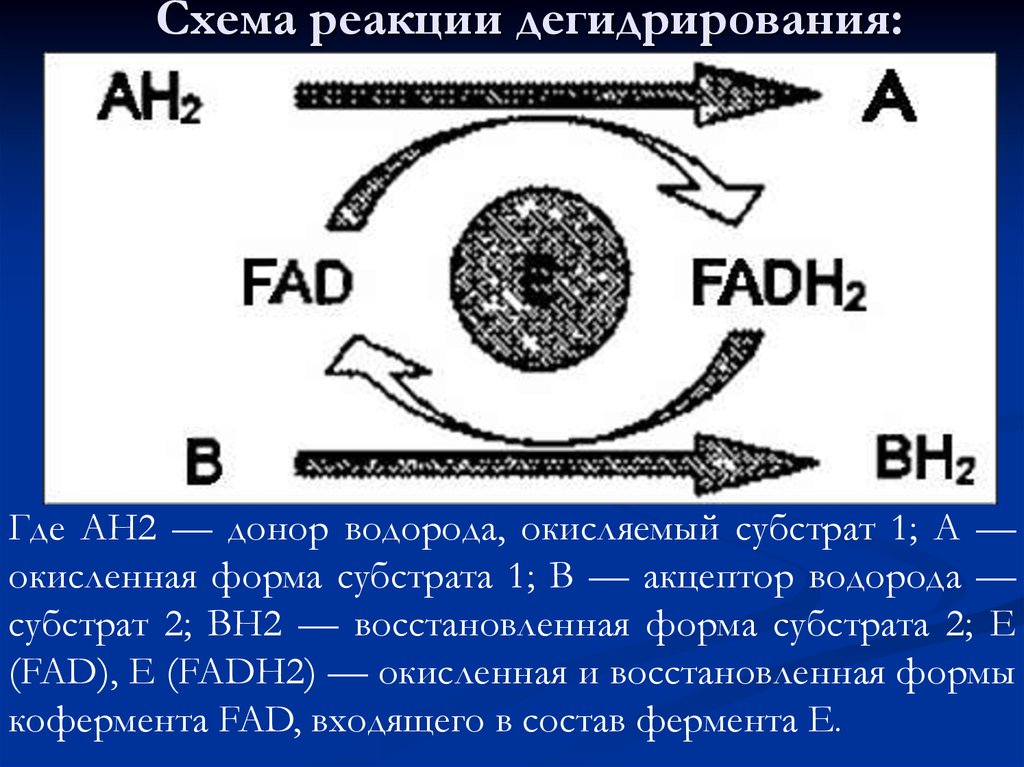
75. Схема реакции дегидрирования:
Где АН2 — донор водорода, окисляемый субстрат 1; А —окисленная форма субстрата 1; В — акцептор водорода —
субстрат 2; ВН2 — восстановленная форма субстрата 2; Е
(FAD), Е (FADH2) — окисленная и восстановленная формы
кофермента FAD, входящего в состав фермента Е.























































 Биология
Биология








