Похожие презентации:
Основные задачи, решаемые с помощью различных методов пробоподготовки
1.
ОСНОВНЫЕ ЗАДАЧИ, РЕШАЕМЫЕ С ПОМОЩЬЮРАЗЛИЧНЫХ МЕТОДОВ ПРОБОПОДГОТОВКИ
• перевод аналитов в фазу, адекватную выбранному методу
анализа
• увеличение концентрации аналитов – снижение их пределов
обнаружения
• устранение мешающего влияния различных факторов
1
2.
ОСНОВНЫЕ МЕТОДЫ ПРОБОПОДГОТОВКИ ИПРЕДКОНЕЦНТРИРОВАНИЯ В КАПИЛЛЯРНОЙ
ГАЗОВОЙ ХРОМАТОГРАФИИ
1. Жидкостная экстракция
2. Газовая экстракция
3. Жидкостная абсорбция
4. Твердофазная экстракция (сорбция)
2
3.
ЖИДКОСТНАЯ ЭКСТРАКЦИЯ4.
ДОСТОИНСТВА ЖИДКОСТНОЙ ЭКСТРАКЦИИ1.
2.
3.
4.
Простота.
Универсальность
Экспрессность
Высокая степень изученности.
ТИПЫ ЭКСТРАКЦИОННЫХ СИСТЕМ
1. Физическое распределение
2. Реакционная экстракция
Выделяют собственно экстрагент и разбавитель
ТРЕБОВАНИЯ К ЭКСТРАГЕНТУ
1. Необходимая селективность
2. Достаточно высокие коэффициенты распределения KD
3
5.
ТРЕБОВАНИЯ К ОРГАНИЧЕСКОЙ ФАЗЕ1.
2.
3.
4.
4
Низкая вязкость.
Минимальная растворимость в воде.
Низкая летучесть.
Плотность должна сильно отличаться от плотности воды.
ФИЗИЧЕСКОЕ РАСПРЕДЕЛЕНИЕ
K Di
S i ,орг
S i ,в од
K Di
1
Si ,вод
S – растворимость, моль/л
Коэффициент селективности = KDi/KDj
K Di S j ,вод
K Dj S i ,вод
6.
1.2.
3.
5.
ВЛИЯЮЩИЕ ФАКТОРЫ
Природа экстрагируемого соединения
Природа экстрагента
Температура 4. рН водной фазы
Концентрация и природа примесей в водной фазе
5
СИСИТЕМА ИЗООКТАН - ВОДА
Соединения
КD
Соединения
Алканы С1 – С8
104 – 105
Сложные эфиры С3 – С7
Алкены С2 – С8
103 – 104
Альдегиды С2 – С6
КD
10 – 200
4 – 20
Алкилбензолы С6 – С8 103 – 5.103 Кетоны С3 – С6
0,9 – 80
102 – 3.103 Спирты С1 – С6
0,01 – 5
Хлоралканы С1 – С3
Простые эфиры
С2 – С8
20 – 102
Карбоновые кислоты
С1 – С6
10-3 – 0,5
7.
ЭКСТРАКЦИЯ ИЗОМЕРОВЭкстрагируемое
вещество
н-Бутанол
втор-Бутанол
трет-Бутанол
о- Хлоранилин
м- Хлоранилин
п-Хлоранилин
КD в зависимости от экстрагента
Бензол
н-Октанол
0,8
7,6
0,55
4,5
0,26
2,3
120
80
85
76
83
67
РАСЧЕТ КОЭФФИЦИЕНТОВ РАСПРЕДЕЛЕНИЯ
n
lg K D lg K Dg
g 1
6
8.
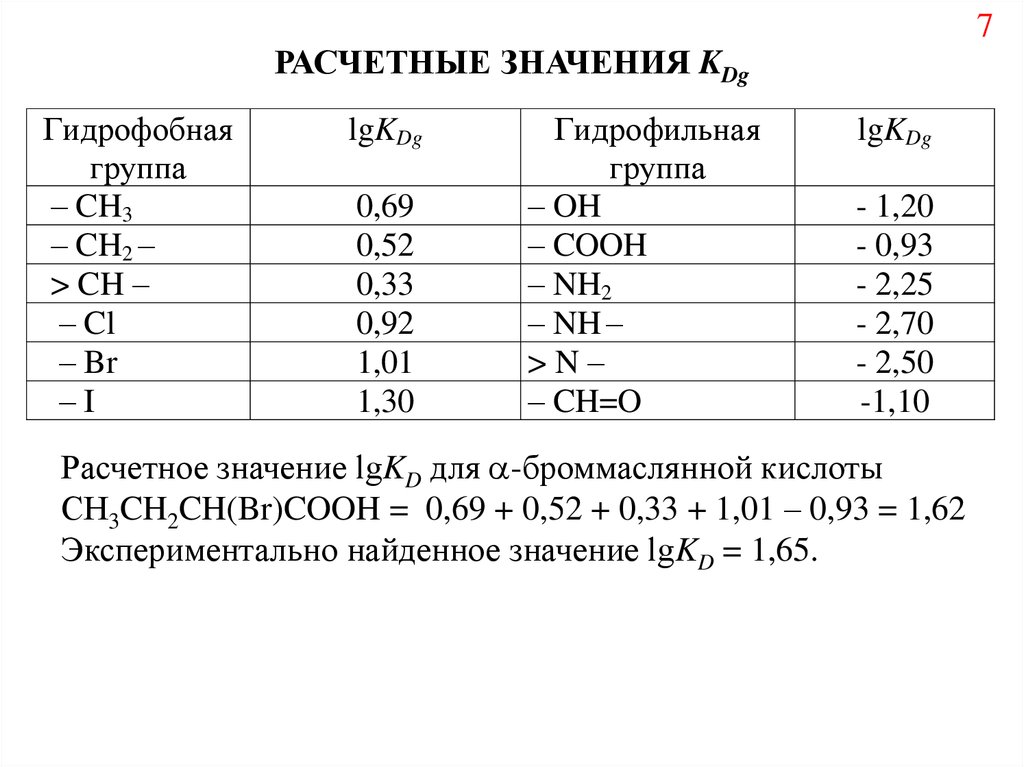
7РАСЧЕТНЫЕ ЗНАЧЕНИЯ KDg
Гидрофобная
группа
– CH3
– CH2 –
> CH –
– Cl
– Br
–I
lgKDg
0,69
0,52
0,33
0,92
1,01
1,30
Гидрофильная
группа
– OH
– COOH
– NH2
– NH –
>N–
– CH=O
lgKDg
- 1,20
- 0,93
- 2,25
- 2,70
- 2,50
-1,10
Расчетное значение lgKD для -броммаслянной кислоты
СH3CH2CH(Br)COOH = 0,69 + 0,52 + 0,33 + 1,01 – 0,93 = 1,62
Экспериментально найденное значение lgKD = 1,65.
9.
8КОЭФФЦИЕНТЫ РАСПРЕДЕЛЕНИЯ РАЗЛИЧНЫХ
ВЕЩЕСТВ МЕЖДУ ОРГАНИЧЕСКОЙ И ВОДНОЙ ФАЗАМИ
Вещество
н-Октан
Бензол
Толуол
о-Ксилол
Хлорбензол
Диэтил. эфир
Этилацетат
Бутилацетат
Ацетон
Этанол
Бутанол-1
Фенол
Растворимость
в воде, моль/л
0,00031
0,010
0,0051
0,0019
0,0048
1,0
0,98
0,043
1,05
0,92
КD
Гептан Циклогексан Хлороформ
120000
--166
500
-560
1320
1000
2450
-1410
840
---6,52
26,0
0,14
2,59
63,1
46,8
55,0
1120
0,10
0,58
-0,008
0,008
0,14
0,2
0,13
2,82
0,28
0,22
1,5
Октанол
150000
135
490
1410
-26,0
5,37
66,1
1,75
0,48
7,6
31,3
10.
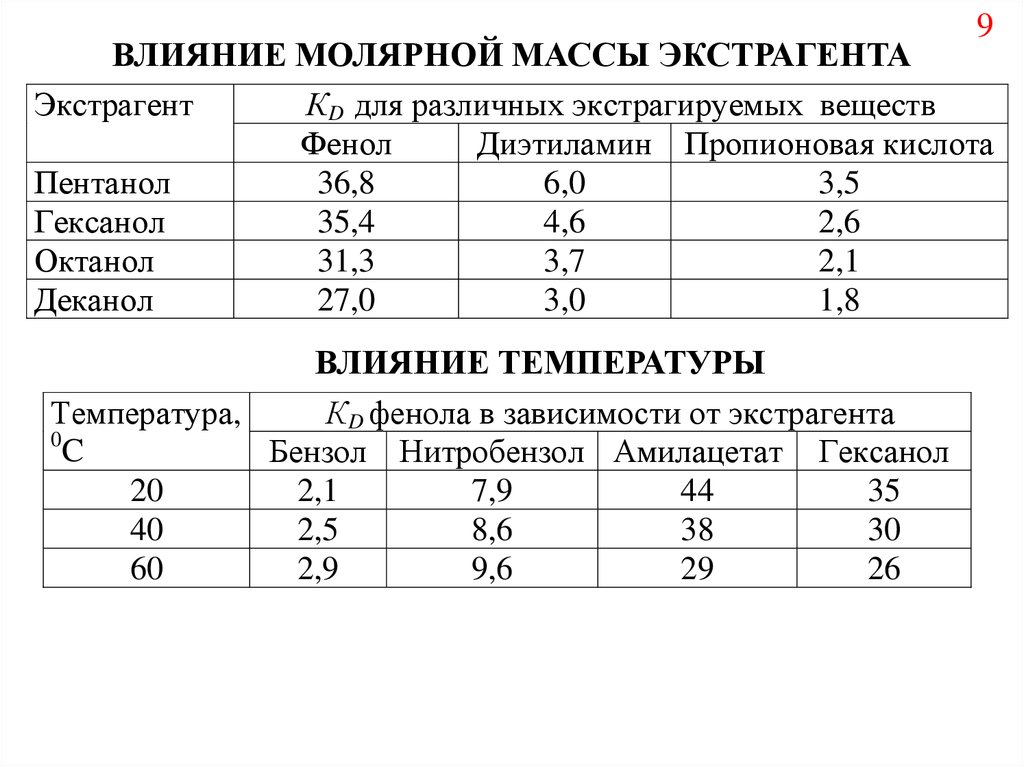
9ВЛИЯНИЕ МОЛЯРНОЙ МАССЫ ЭКСТРАГЕНТА
Экстрагент
КD для различных экстрагируемых веществ
Фенол
Диэтиламин Пропионовая кислота
Пентанол
36,8
6,0
3,5
Гексанол
35,4
4,6
2,6
Октанол
31,3
3,7
2,1
Деканол
27,0
3,0
1,8
ВЛИЯНИЕ ТЕМПЕРАТУРЫ
Температура,
КD фенола в зависимости от экстрагента
0
C
Бензол Нитробензол Амилацетат Гексанол
20
2,1
7,9
44
35
40
2,5
8,6
38
30
60
2,9
9,6
29
26
11.
ВЛИЯНИЕ рН ВОДНОЙ ФАЗЫ (KD = 10)10
12.
11ВЛИЯНИЕ ПРИМЕСЕЙ В ВОДНОЙ ФАЗЕ
lg(KD/KD0) = kc Уравнение Сеченова
KD0 – коэффициент распределения в отсутствии примесного
компонента в водной фазе; с – концентрация этого компонента в
водной фазе, моль/л; k – коэффициент высаливания (k > 0)
всаливания (k < 0)
Высаливающий эффект
Li+ > Na+ > K+ > Rb+ >Cs+ F- > Cl- > Br- > I-
Высаливание 2-нафтиламина. Экстрагент - гексан
Соль
k
KF
KCl
NaCl
LiCl
NaBr Na2SO4
0,230 0,124
0,174
0,206
0,137
0,112
NaI
NaNO3
0,079
0,099
13.
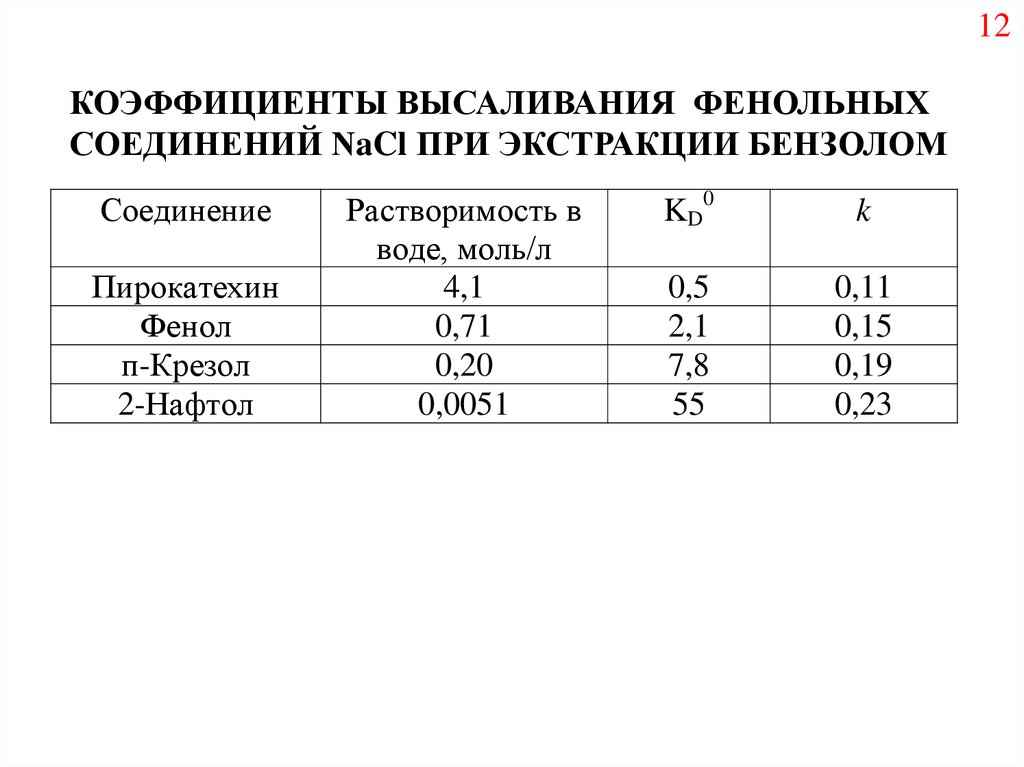
12КОЭФФИЦИЕНТЫ ВЫСАЛИВАНИЯ ФЕНОЛЬНЫХ
СОЕДИНЕНИЙ NaCl ПРИ ЭКСТРАКЦИИ БЕНЗОЛОМ
Соединение
Пирокатехин
Фенол
п-Крезол
2-Нафтол
Растворимость в
воде, моль/л
4,1
0,71
0,20
0,0051
KD0
k
0,5
2,1
7,8
55
0,11
0,15
0,19
0,23
14.
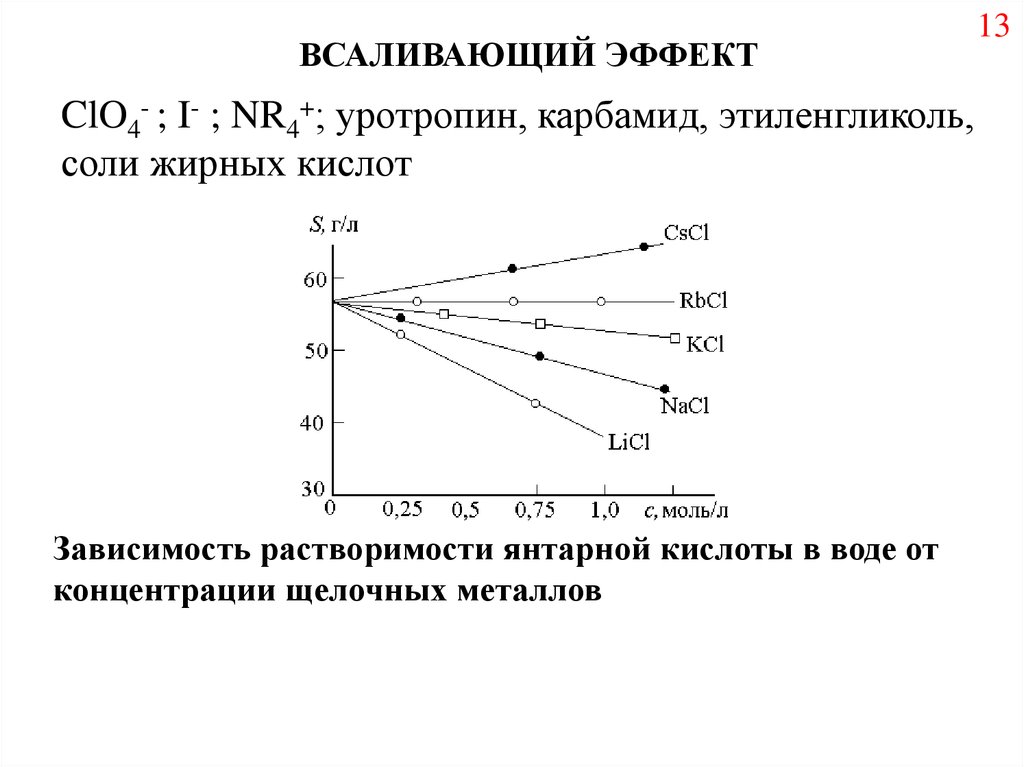
ВСАЛИВАЮЩИЙ ЭФФЕКТClO4- ; I- ; NR4+; уротропин, карбамид, этиленгликоль,
соли жирных кислот
Зависимость растворимости янтарной кислоты в воде от
концентрации щелочных металлов
13
15.
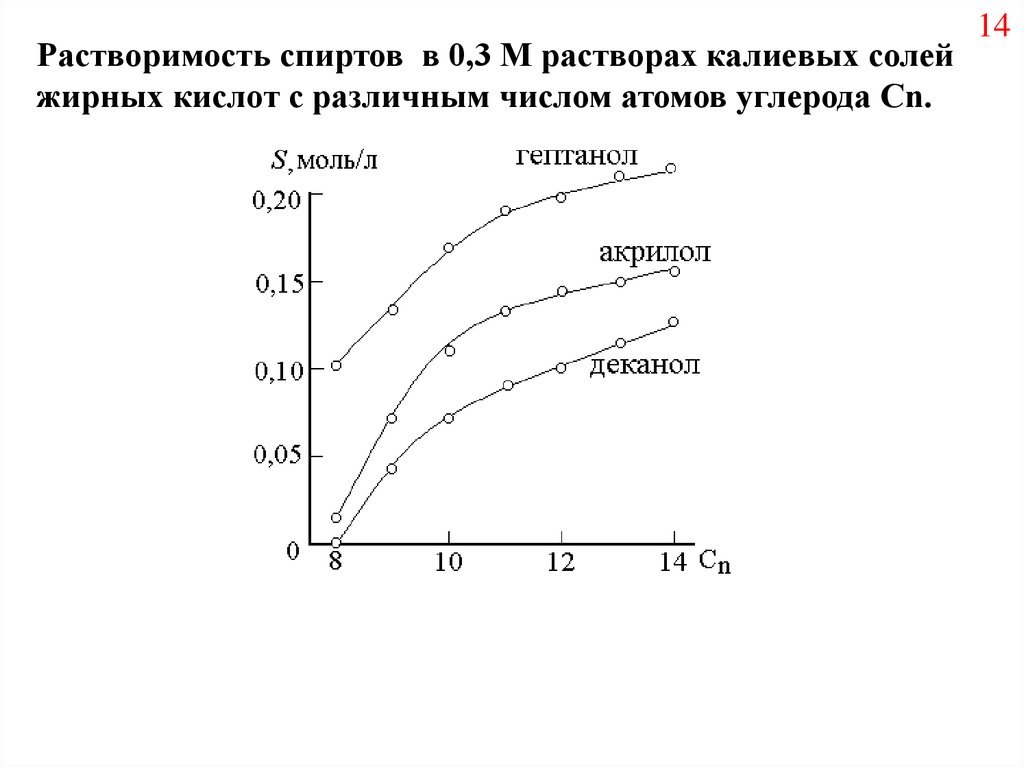
Растворимость спиртов в 0,3 М растворах калиевых солейжирных кислот с различным числом атомов углерода Cn.
14
16.
РЕАКЦИОННАЯ ЖИДКОСТНАЯЭКСТРАКЦИЯ
17.
РЕАКЦИОННАЯ ЖИДКОСТНАЯ ЭКСТРАКЦИЯхАводн + yBорг = [AxBy]орг,
К экс
[ Ax By ]орг
x
y
[ A]водн
[ B]орг
n
KD
[A1 ]орг [A2 ]орг ... [An ]орг
[A1 ]водн [A2 ]водн ... [An ]водн
[A ]
i 1
n
i
[A ]
i 1
i
орг
водн
KD = ([HA]орг +[(НА)2]орг) / ([HA]водн + [A- ]водн )
15
18.
16КЛАССИФИКАЦИЯ ПРОЦЕССОВ РЕАКЦИОННОЙ ЭКСТРАКЦИИ
тип экстрагента:
• кислорородсодержащие
• азотсодержащие
• серосодержащие
• хелатообразующие
•макроциклические
механизм экстракции:
• катионообменный
• анионообменный
• гидратно-сольватный
•координационный
• присоединения
19.
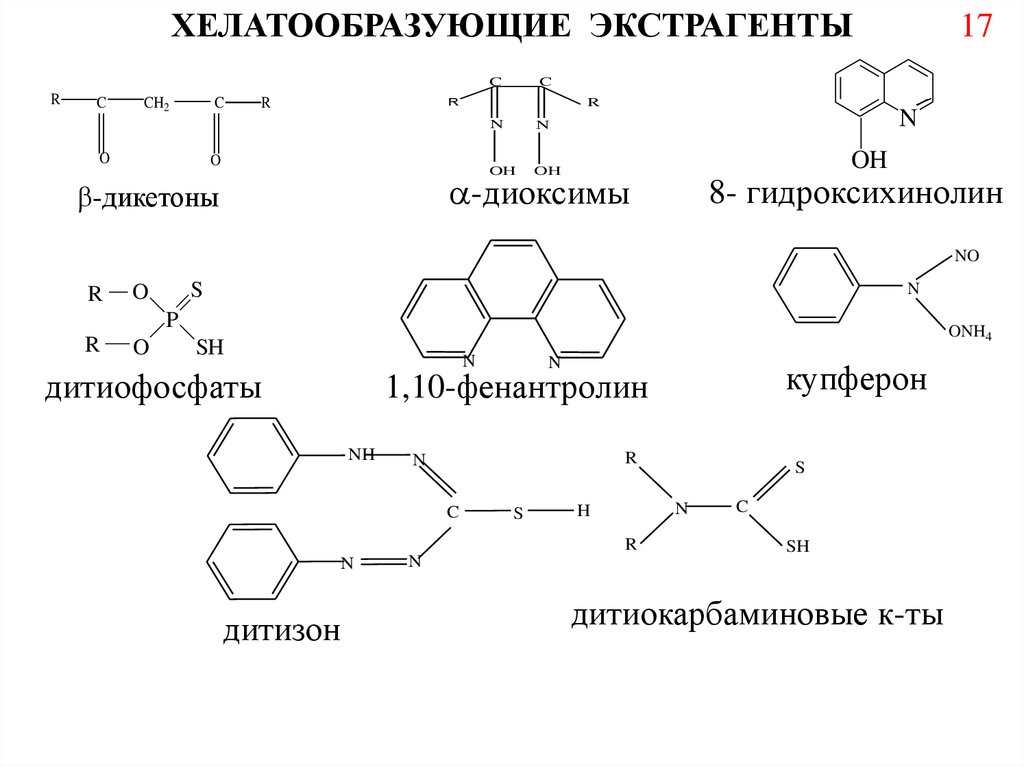
ХЕЛАТООБРАЗУЮЩИЕ ЭКСТРАГЕНТЫR
C
CH2
C
O
R
C
C
N
N
OH
OH
R
R
O
N
OH
-диоксимы
-дикетоны
17
8- гидроксихинолин
NO
R
S
O
N
P
R
O
ONH4
SH
N
дитиофосфаты
N
NH
R
N
C
S
N
S
N
H
R
N
дитизон
купферон
1,10-фенантролин
C
SH
дитиокарбаминовые к-ты
20.
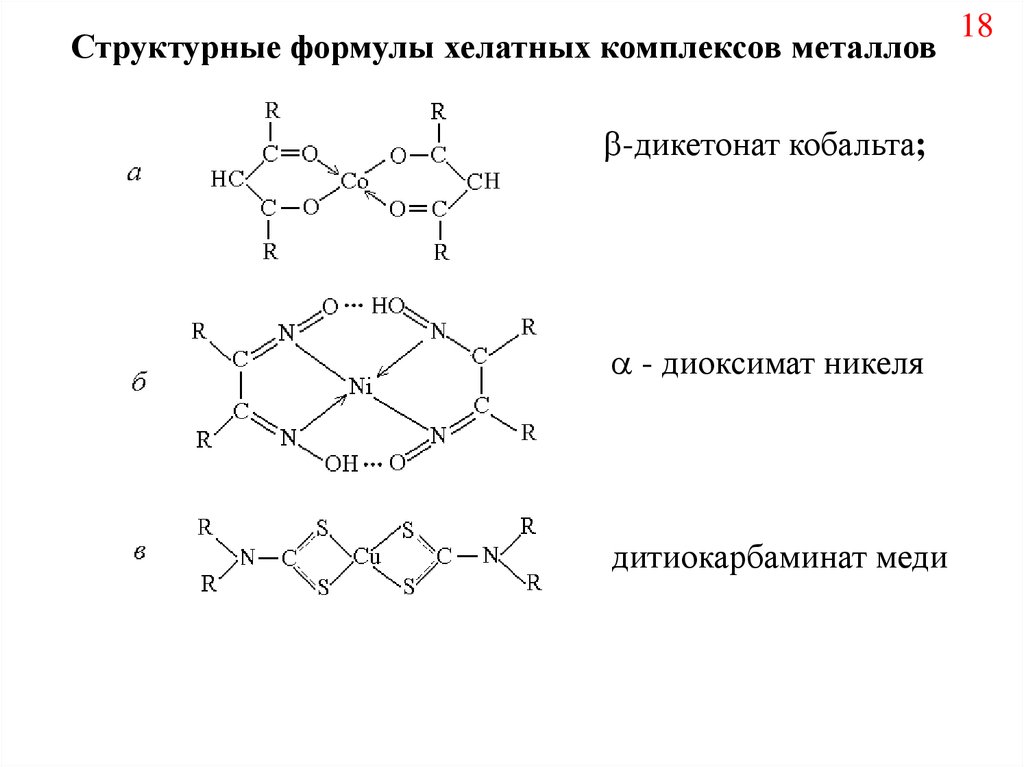
Структурные формулы хелатных комплексов металлов-дикетонат кобальта;
- диоксимат никеля
дитиокарбаминат меди
18
21.
Первая группа катионов металловMg, Ca, Sr, Ba, Ga, In, Tl, Fe (III), Co (II), Ti (IV)
19
Вторая группа катионов металлов
Be, Cr (III), Fe (II) и платиновые металлы
Третья группа катионов металлов
Сu (I), Cu (II), Hg (I), Hg (II), Ag (I), Au (I), Co (III) , Ni
Хелатный эффект – более высокая устойчивость комплексов
ионов металлов с полидентатными лигандами по сравнению с
комплексами с несколькими монодентатными лигандами.
Хелатный эффект обусловлен увеличением энтропийного вклада
в свободную энергию образования комплекса.
M(H2O)4 + 4NH3 = M(NH3)4 + 4H2O
M(H2O)4 + Y = MY + 4H2O
22.
МЕХАНИЗМ ЭКСТРАКЦИИ ХЕЛАТ. ЭКСТРАГЕНТАМИ1) HRводн HRорг распределение экстрагента KDHR
2) HRводн H+водн + R-водн ионизация экстрагента KHR
3) Mn+водн + nR-водн [MRn]водн образование комплекса MRn
4) [MRn]водн [MRn]орг распределение комплекса KDMR
lgKD = lg MRn + lgKDMRn – nlgKDHR – npKHR + npH + nlg[HR]орг
20
23.
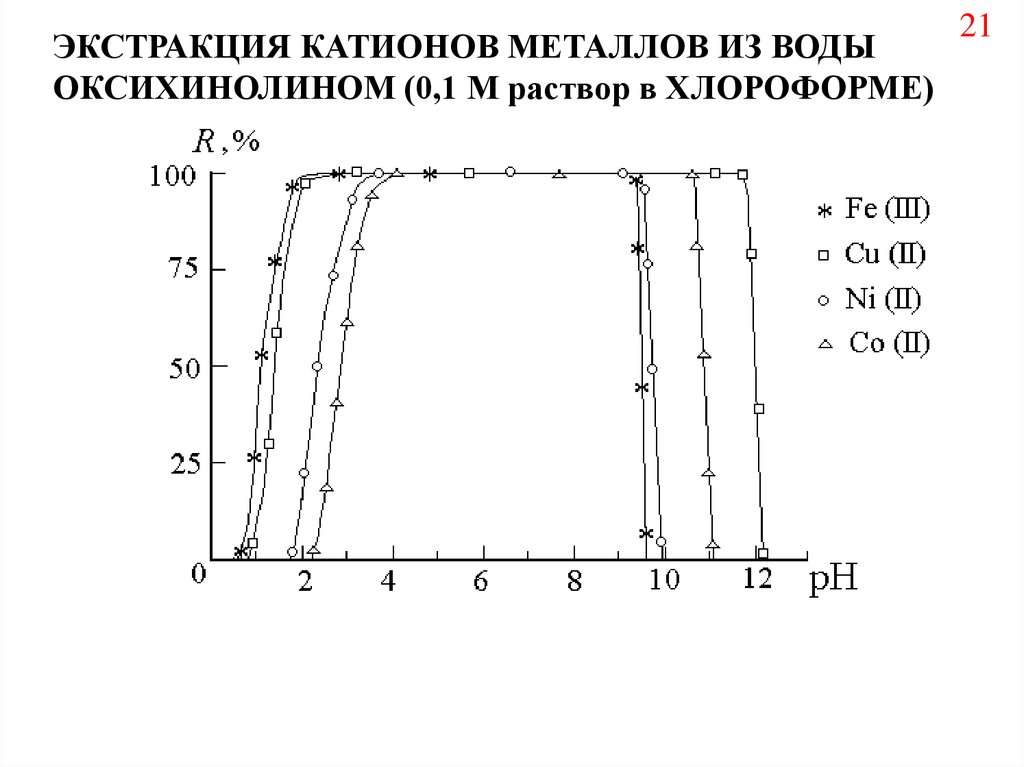
ЭКСТРАКЦИЯ КАТИОНОВ МЕТАЛЛОВ ИЗ ВОДЫОКСИХИНОЛИНОМ (0,1 М раствор в ХЛОРОФОРМЕ)
21
24.
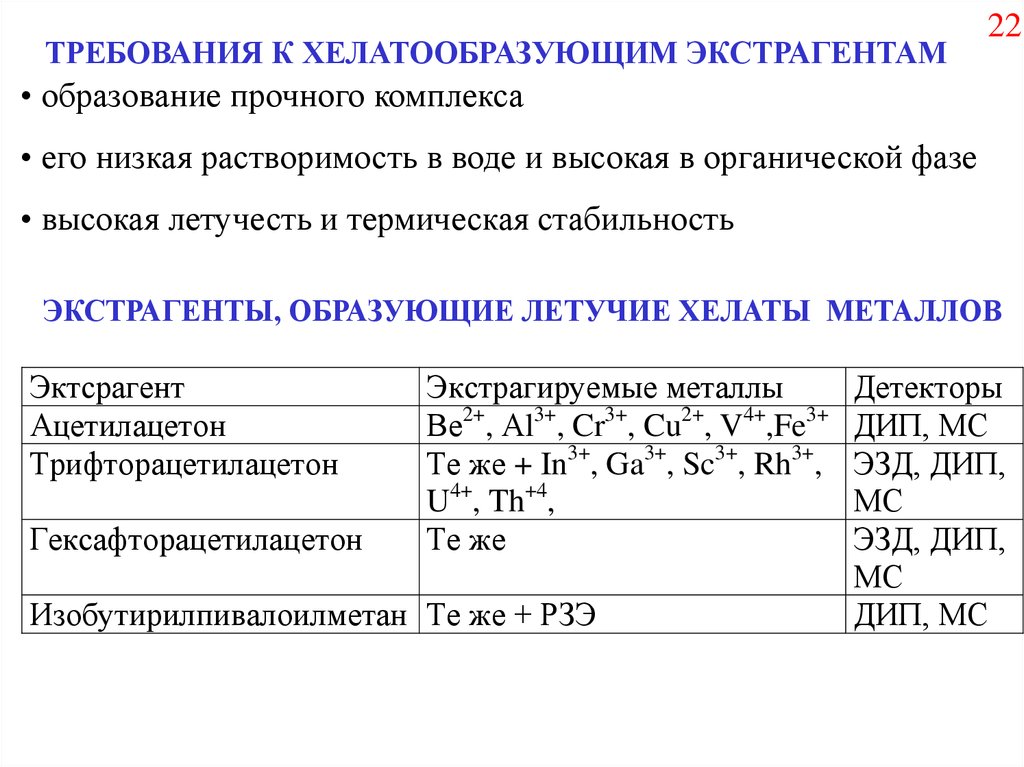
ТРЕБОВАНИЯ К ХЕЛАТООБРАЗУЮЩИМ ЭКСТРАГЕНТАМ22
• образование прочного комплекса
• его низкая растворимость в воде и высокая в органической фазе
• высокая летучесть и термическая стабильность
ЭКСТРАГЕНТЫ, ОБРАЗУЮЩИЕ ЛЕТУЧИЕ ХЕЛАТЫ МЕТАЛЛОВ
Эктсрагент
Ацетилацетон
Трифторацетилацетон
Гексафторацетилацетон
Экстрагируемые металлы
Ве2+, Аl3+, Cr3+, Cu2+, V4+,Fe3+
Те же + In3+, Ga3+, Sc3+, Rh3+,
U4+, Th+4,
Те же
Изобутирилпивалоилметан Те же + РЗЭ
Детекторы
ДИП, МС
ЭЗД, ДИП,
МС
ЭЗД, ДИП,
МС
ДИП, МС
25.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯЖИДКСТНОЙ ЭКСТРАКЦИИ
26.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯЖИДКОСТНОЙ ЭКСТРАКЦИИ
1) Статическая (однократная, многократная)
2) Динамическая (подвижна экстрагент)
3) Непрерывная (подвижны обе фазы)
24
27.
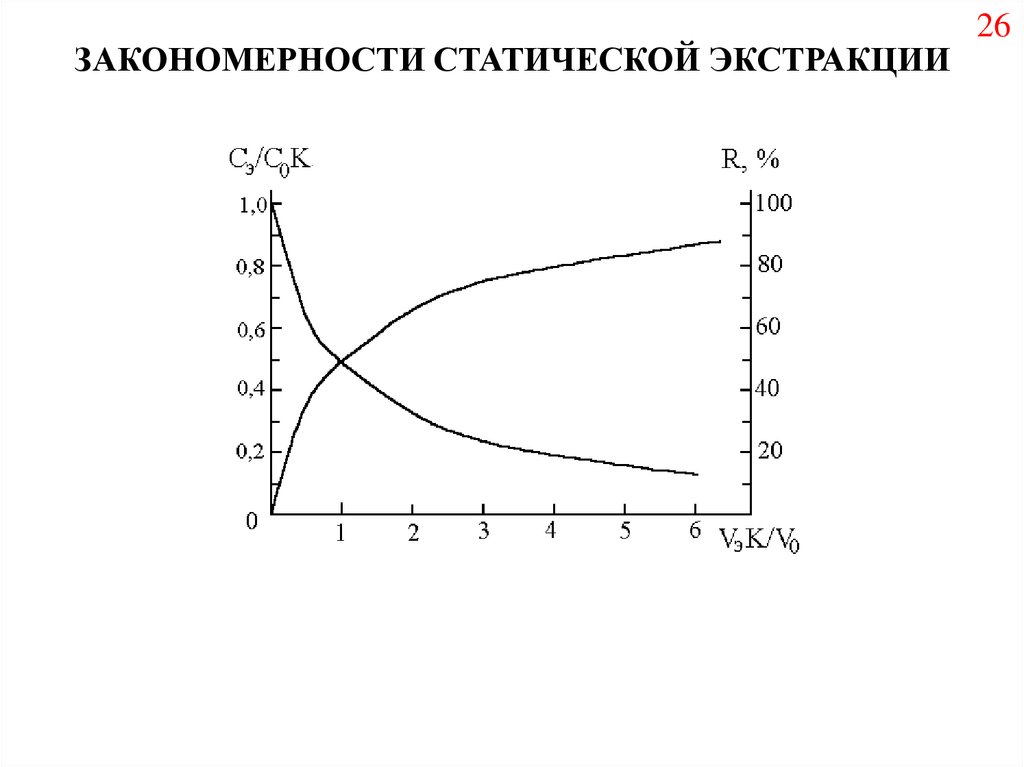
ЗАКОНОМЕРНОСТИ СТАТИЧЕСКОЙ ЭКСТРАКЦИИC0V0 CV0 CЭVЭ
СЭ
1
1 VЭ
С0
K V0
25
СЭ СK
R
K
V0
K
VЭ
С0 – начальная концентрация компонента в водной фазе;
СЭ и C – концентрация компонента в экстрагенте и водной фазе
после установления равновесия;
V0 и VЭ – объемы водной фазы и экстрагента;
K – коэффициент распределения
Если V0/VЭ << K , то СЭ/C0 = V0/VЭ; R 1 Полное извлечение
Если V0/VЭ >> K , то СЭ/C0 = K; R 0 Равновесное насыщение
28.
ЗАКОНОМЕРНОСТИ СТАТИЧЕСКОЙ ЭКСТРАКЦИИ26
29.
МНОГОКРАТНАЯ СТАТИЧЕСКАЯ ЭКСТРАКЦИЯсорг
Vводн
1
0
cводн
1
Vорг K V орг n
1 D
n
V
водн
1
R 1
n
V
1 K D орг
n
V
в
одн
n – число порций экстрагента
При R = 0,95 % двухкратная экстракция позволяет в 2,8 раза, а
трехкратная – в 3,7 раза увеличить Кконц (Сoрг/Сводн0) по
сравнению с однократной при Voрг = const
ДИНАМИЧЕСКАЯ ЭКСТРАКЦИЯ (n →∞)
Сорг = Сводн0Vводн/Voрг[1 – exp(– KDVoрг/Vводн)]
R = 1 – exp(– KDVoрг/Vводн)
27
30.
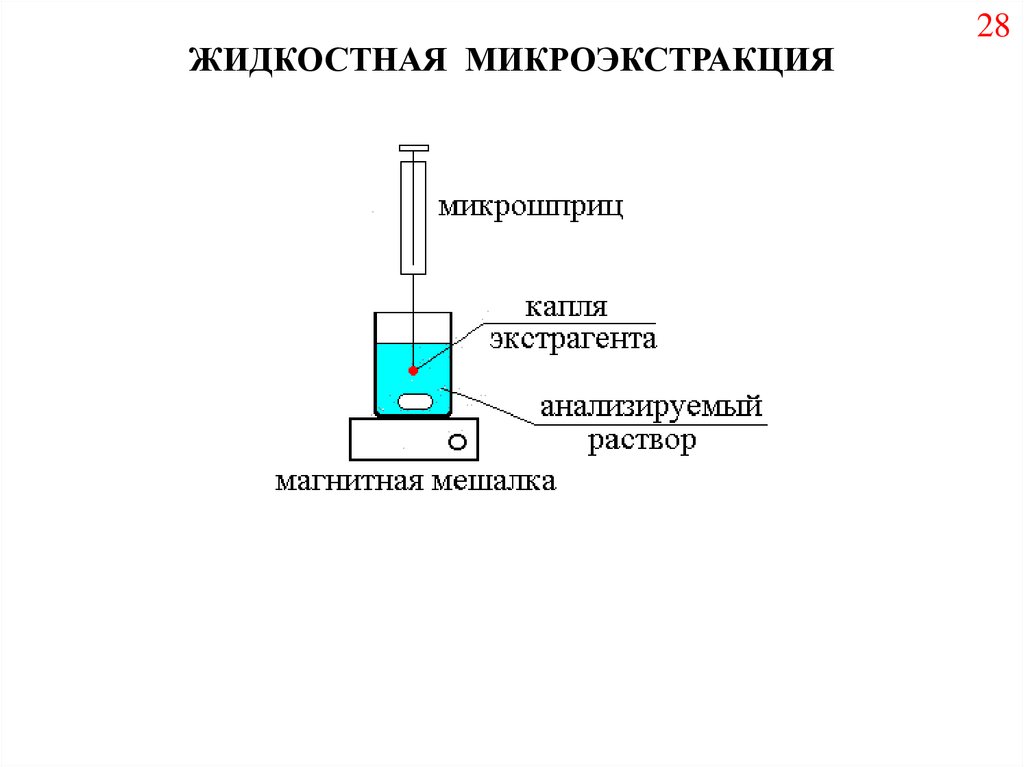
ЖИДКОСТНАЯ МИКРОЭКСТРАКЦИЯ28
31.
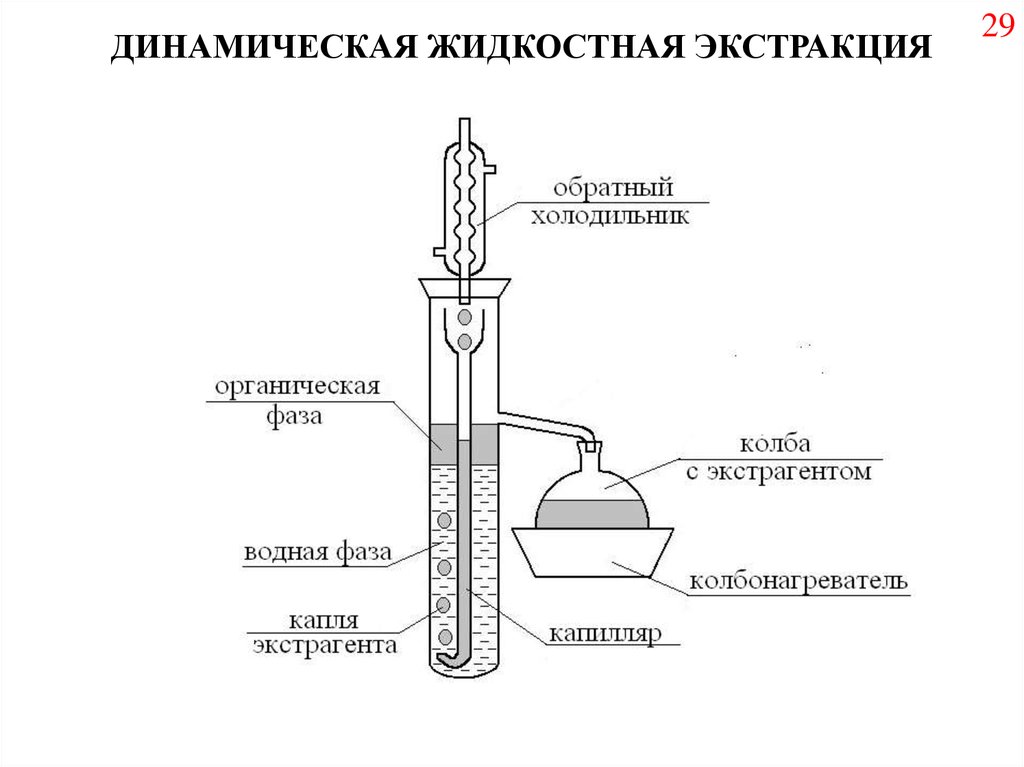
ДИНАМИЧЕСКАЯ ЖИДКОСТНАЯ ЭКСТРАКЦИЯ29
32.
ГАЗОВАЯ ЭКСТРАКЦИЯ ИПАРОФАЗНЫЙ АНАЛИЗ
33. Терминология
Парофазный анализ (ПФА) – метод получения информациио составе конденсированной фазы на основании анализа
контактирующей с ней газовой фазы.
В основе ПФА лежит процесс газовой экстракции
АРП – анализ равновесного пара – более узкое понятие
Head-Space Analysis (HSА)
30
34.
3135.
ПАРОФАЗНЫЙ АНАЛИЗ РАСТВОРОВ36.
32ДОСТОИНСТВА ПАРОФАЗНОГО
ГАЗОХРОМАТОГРАФИЧСЕСКОГО АНАЛИЗА
• Возможность анализа проб, которые нельзя непосредственно
вводить в газовый хроматограф
• Отделение нелетучих компонентов пробы – упрощение стадии
идентификации
• Возможность снижение пределов обнаружения аналитов
37.
ПОВЫШЕНИЕ ЧУВСТВИТЕЛЬНОСТИ АНАЛИЗАВведение жидкости в газовый хроматограф
Парообразование
33
Парофазный анализ
Установление межфазного равновесия
VG 103VL
СL /CG = K
CG* 10 -3CL0
CG = CL0/(K + VG/VL)
СG /CG* 103/K
38.
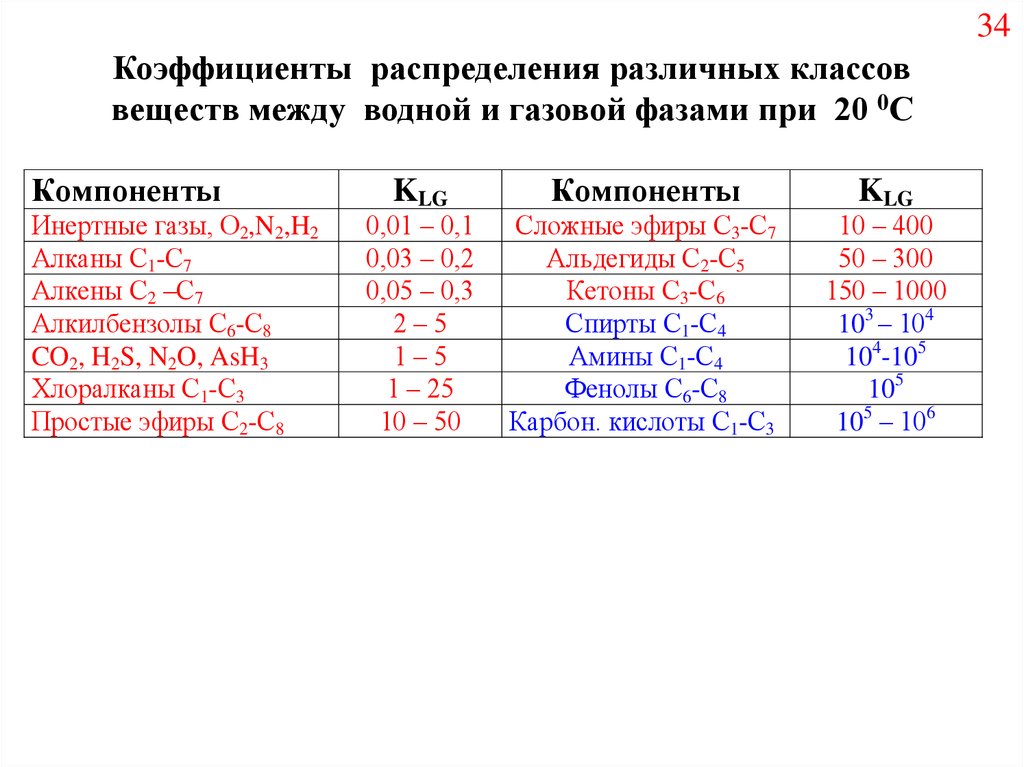
34Коэффициенты распределения различных классов
веществ между водной и газовой фазами при 20 0С
Компоненты
Инертные газы, О2,N2,H2
Алканы С1-С7
Алкены С2 –С7
Алкилбензолы С6-С8
CO2, H2S, N2O, AsH3
Хлоралканы С1-С3
Простые эфиры С2-С8
KLG
0,01 – 0,1
0,03 – 0,2
0,05 – 0,3
2–5
1–5
1 – 25
10 – 50
Компоненты
Сложные эфиры С3-С7
Альдегиды С2-С5
Кетоны С3-С6
Спирты С1-С4
Амины С1-С4
Фенолы С6-С8
Карбон. кислоты С1-С3
KLG
10 – 400
50 – 300
150 – 1000
103 – 104
104-105
105
105 – 106
39.
35ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА KLG
KLG = S/(P0RT) TкипS/(RT)
S – растворимость компонента в жидкости, моль/л;
P – давление его насыщенного пара; Ткип – температура кипения
lnKLG = A/RT – B
K 3 – 5 % при T = 10C
Высокотемпературный парофазный анализ
ИЗМЕНЕНИЕ KLG В ГОМОЛОГИЧЕСКИХ РЯДАХ
Компонент
KLG
Компонент
KLG
Компонент
KLG
Бензол
6,6
Этилацетат
210
Ацетон
750
Толуол
6,2
Пропилацетат
170
Метилэтилкетон
600
Этилбензол
6,8
Бутилацетат
130
Диэтилкетон
520
40.
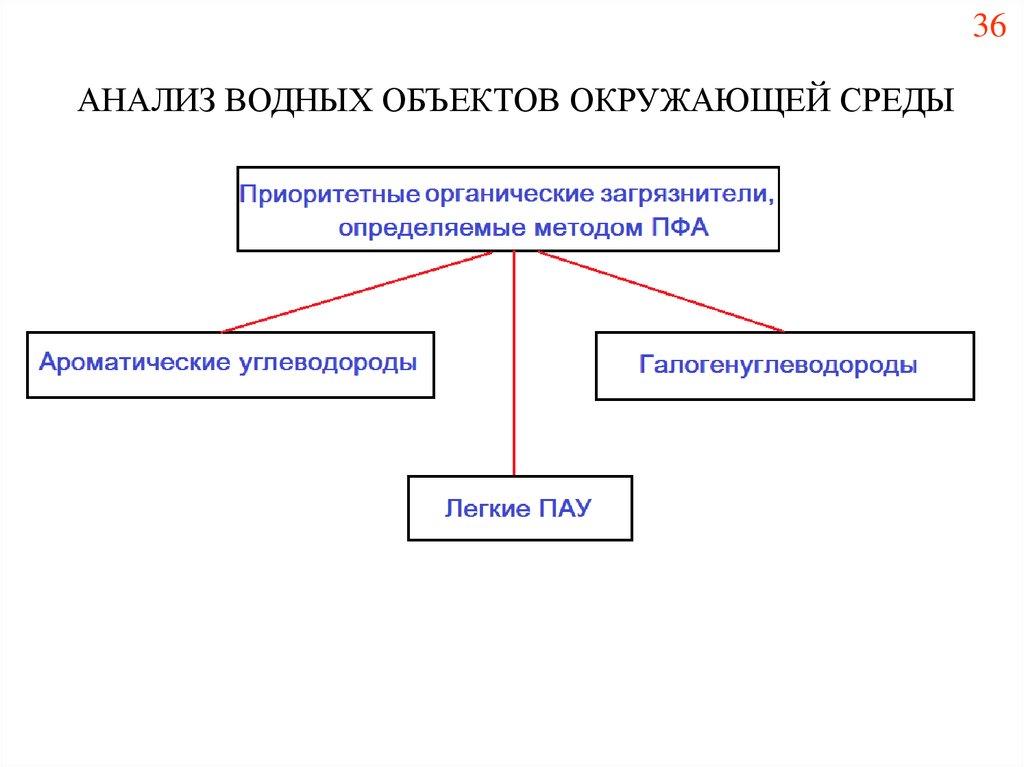
36АНАЛИЗ ВОДНЫХ ОБЪЕКТОВ ОКРУЖАЮЩЕЙ СРЕДЫ
41.
37АНАЛИЗ БИОЛОГИЧЕСКИХ СРЕД
42.
3843.
CТАТИЧЕСКИЕ ВАРИАНТЫПАРОФАЗНОГО АНАЛИЗА
44.
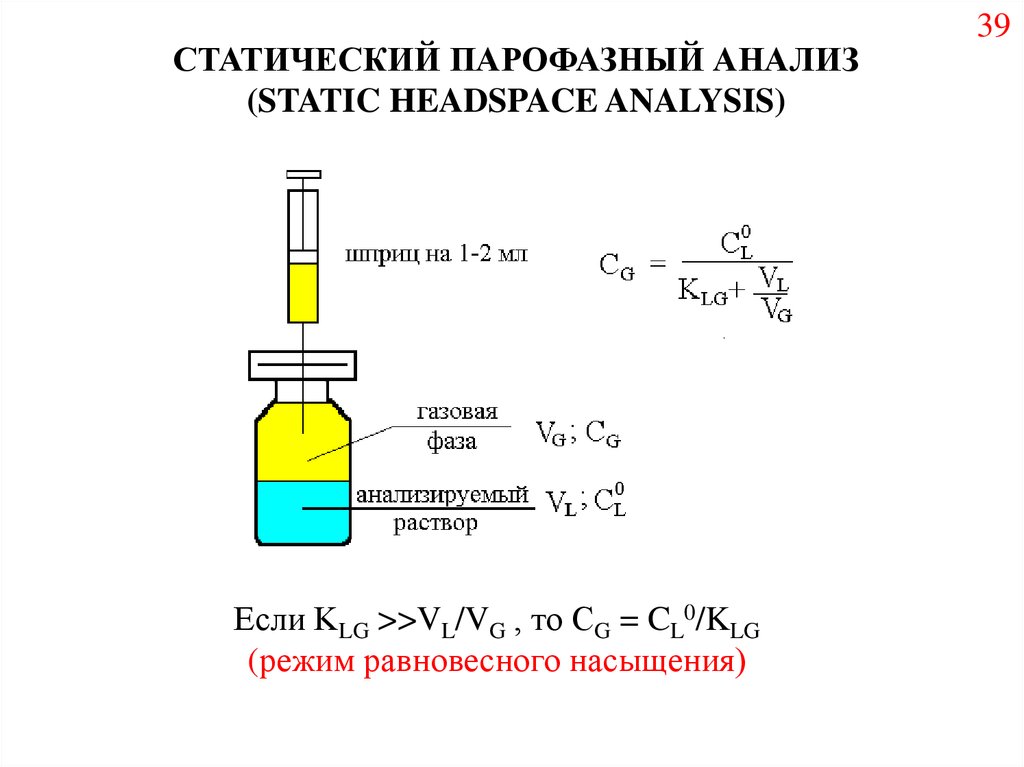
СТАТИЧЕСКИЙ ПАРОФАЗНЫЙ АНАЛИЗ(STATIC HEADSPACE ANALYSIS)
Если KLG >>VL/VG , то СG = CL0/KLG
(режим равновесного насыщения)
39
45.
40АВТОДОЗАТОР РАВНОВЕСНОГО ПАРА (СПРАВА)
С ГАЗОВЫМ ХРОМАТОГРАФОМ
46.
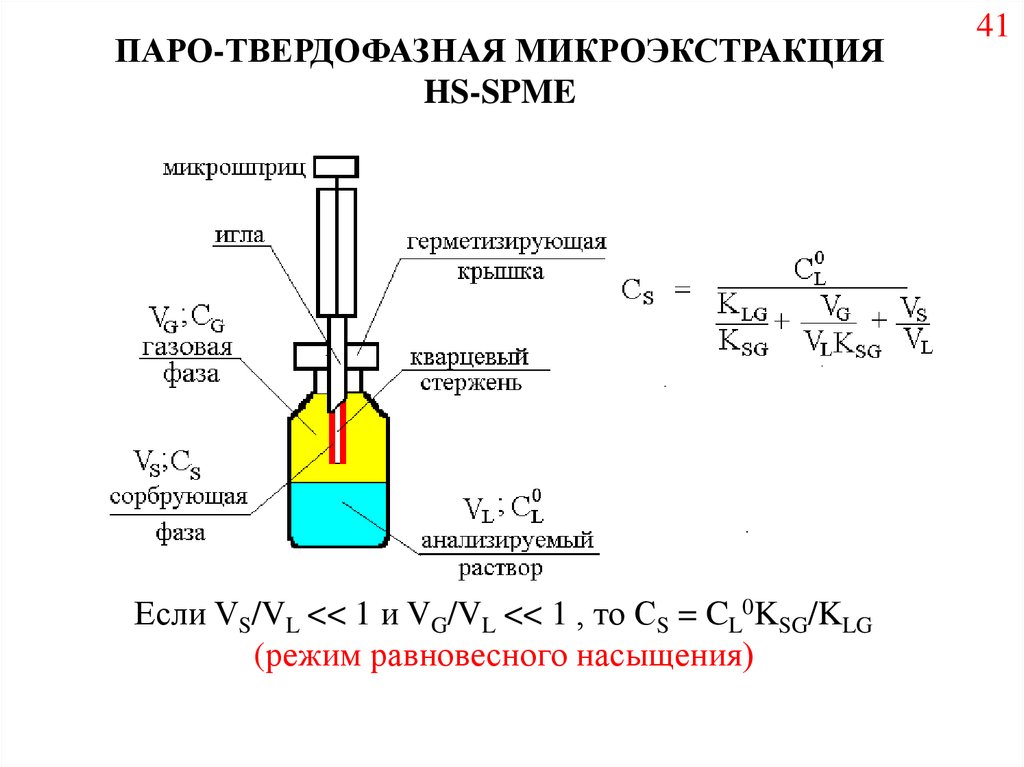
ПАРО-ТВЕРДОФАЗНАЯ МИКРОЭКСТРАКЦИЯHS-SPME
Если VS/VL << 1 и VG/VL << 1 , то СS = CL0KSG/KLG
(режим равновесного насыщения)
41
47.
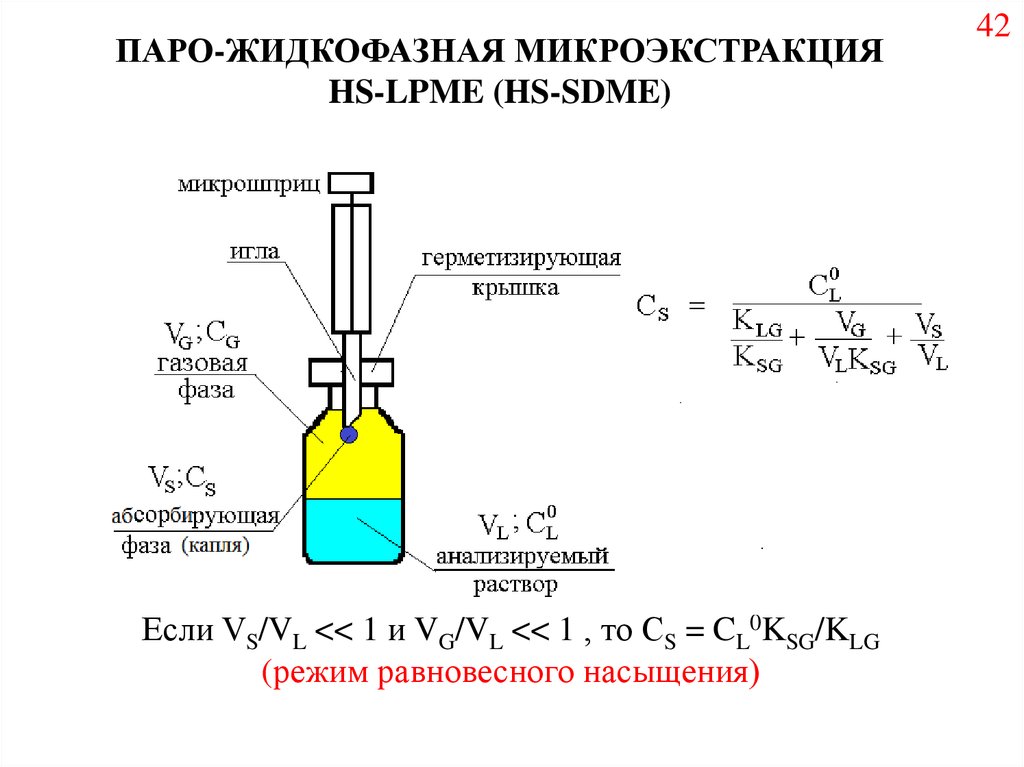
ПАРО-ЖИДКОФАЗНАЯ МИКРОЭКСТРАКЦИЯHS-LPME (HS-SDME)
Если VS/VL << 1 и VG/VL << 1 , то СS = CL0KSG/KLG
(режим равновесного насыщения)
42
48.
43СОЧЕТАНИЕ ПАРО-ЖИДКОФАЗНОЙ МИКРОЭКСТРАКЦИИ С
РАЗЛИЧНЫМИ МЕТОДАМИ АНАЛИЗА КОНЦЕНТРАТА
49.
ДИНАМИЧЕСКИЕ ВАРИАНТЫПАРОФАЗНОГО АНАЛИЗА
50.
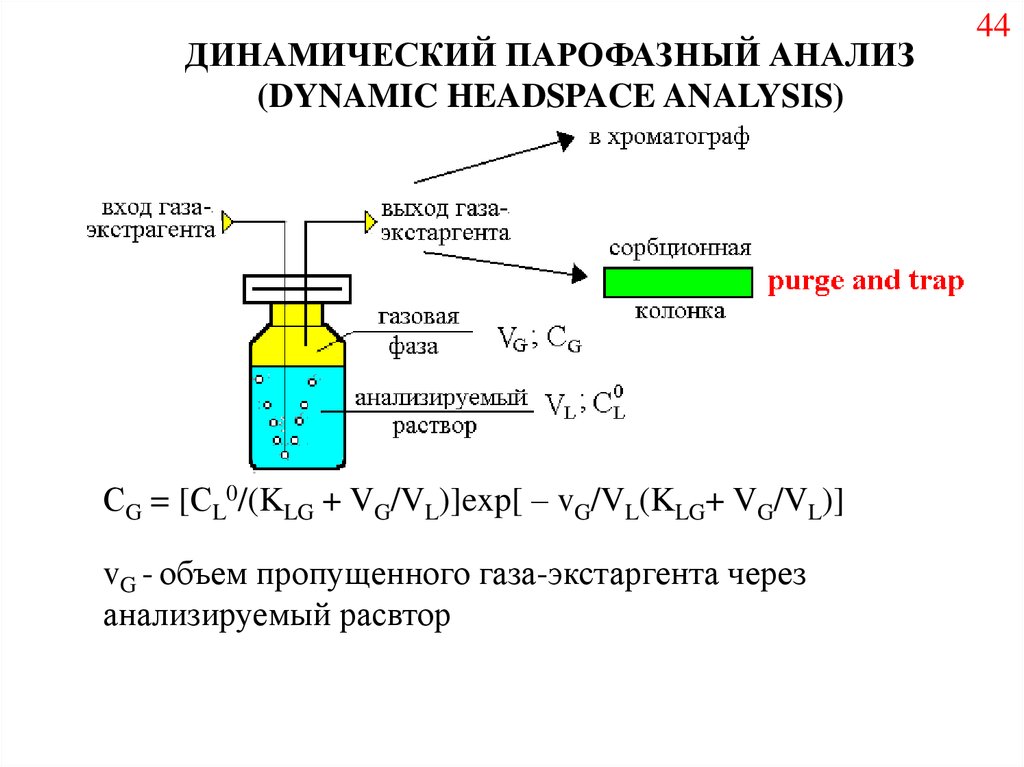
ДИНАМИЧЕСКИЙ ПАРОФАЗНЫЙ АНАЛИЗ(DYNAMIC HEADSPACE ANALYSIS)
СG = [СL0/(KLG + VG/VL)]exp[ – vG/VL(KLG+ VG/VL)]
vG - объем пропущенного газа-экстаргента через
анализируемый расвтор
44
51.
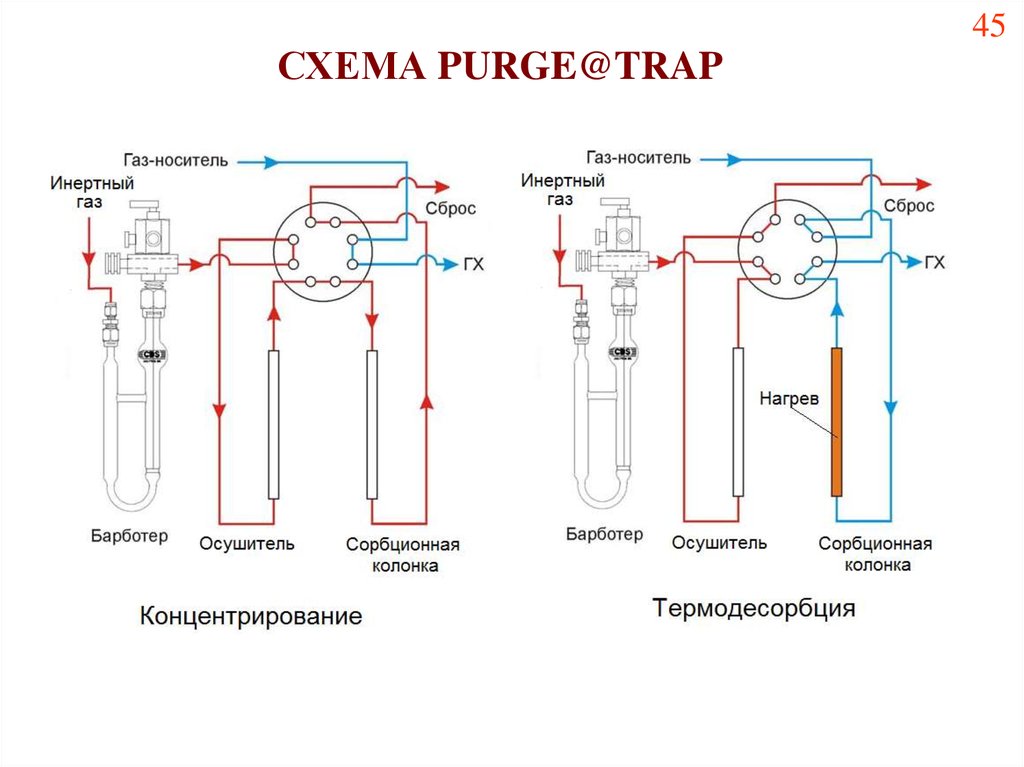
СХЕМА PURGE@TRAP45
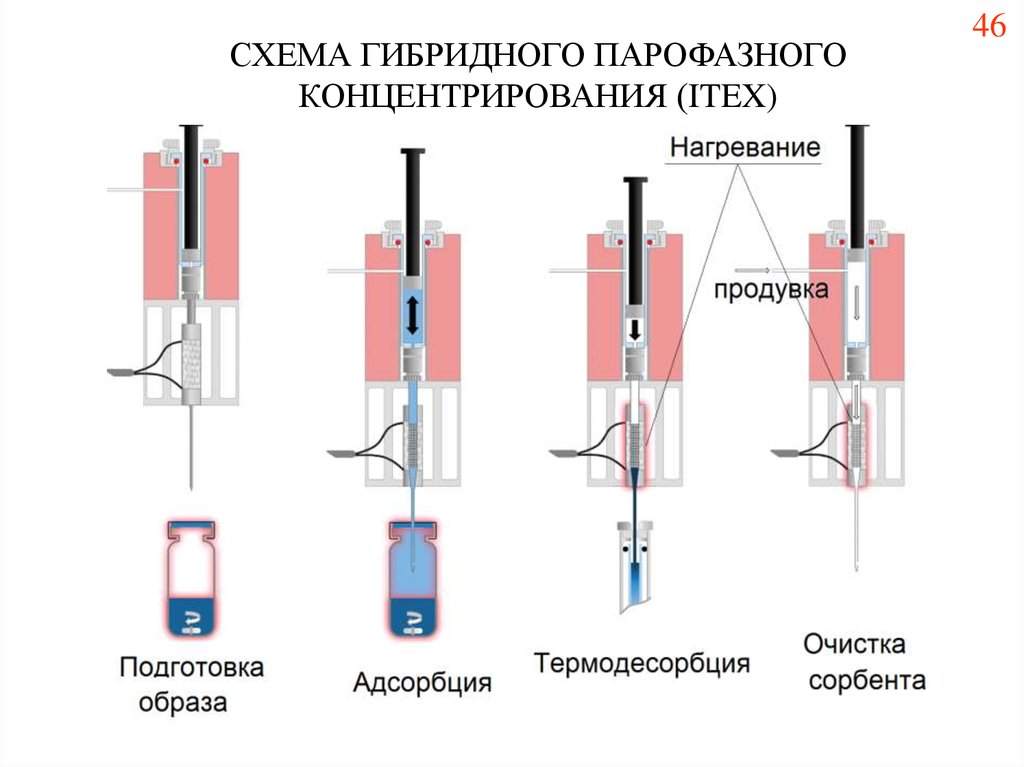
52.
СХЕМА ГИБРИДНОГО ПАРОФАЗНОГОКОНЦЕНТРИРОВАНИЯ (ITEX)
46
53.
47ПРЕДЕЛЫ ОБНАРУЖЕНИЯ ДЛЯ РАЗЛИЧНЫХ
ВАРИАНТОВ ПАРОФАЗНОГО АНАЛИЗА (МС-детектор)
Аналит
Винилхлорид
Бензол
О-Ксилол
Геосмин
(запах гнили)
Static
10
5
4
200
Предел обнаружения в воде, мкг/л
HS - SPME
ITEX
purge@trap
0,05
0,008
0,005
0,03
0,002
0,001
0,01
0,005
0,002
1
0,06
0,002
54.
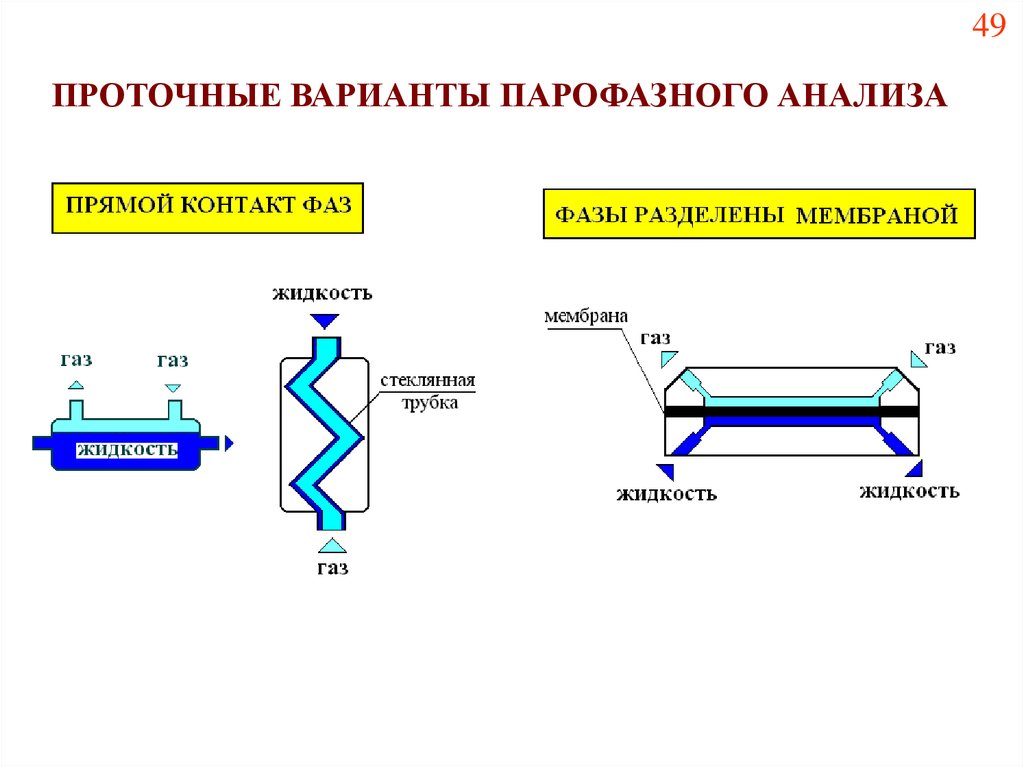
ПРОТОЧНЫЕ ВАРИАНТЫПАРОФАЗНОГО АНАЛИЗА
55.
48ПРЕИМУЩЕСТВА ПРОТОЧНЫХ ВАРИАНТОВ ПАРОФАЗНОГО АНАЛИЗА
1.
Возможность проведения анализа в режиме on line. Повышение оперативности
анализа и возможность регистрации залповых сбросов.
2.
Предотвращение образования артефактов в процессе отбора и хранения пробы.
Повышение точности анализа, уменьшение влияния «человеческого фактора.
3.
Создание предпосылок для полной автоматизации всего цикла анализа.
56.
49ПРОТОЧНЫЕ ВАРИАНТЫ ПАРОФАЗНОГО АНАЛИЗА
57. ПЕРСПЕКТИВЫ РАЗВИТИЯ ПАРОАЗНОГО АНАЛИЗА
50ПЕРСПЕКТИВЫ РАЗВИТИЯ
ПАРОАЗНОГО АНАЛИЗА
• Развитие новых проточных методов ПФА,
включая хроматомембранные
• Развитие новых схем парофазного анализа с
сорбционным и абсорбционным выделением
• Расширение круга анализируемых объектов
и аналитов, включая элементорганические
58.
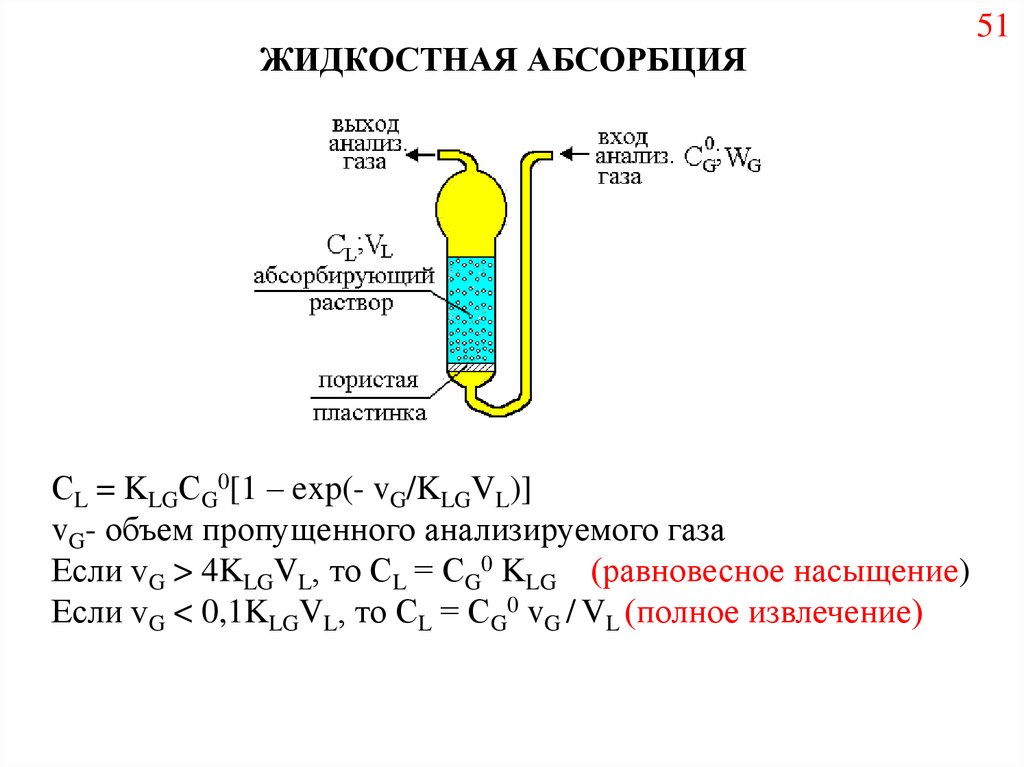
ЖИДКОСТНАЯ АБСОРБЦИЯСL = KLGСG0[1 – exp(- vG/KLGVL)]
vG- объем пропущенного анализируемого газа
Если vG > 4KLGVL, то СL = СG0 KLG (равновесное насыщение)
Если vG < 0,1KLGVL, то СL = СG0 vG / VL (полное извлечение)
51
59.
СОРБЦИОННЫЕ МЕТОДЫ60.
5261.
ТИПЫ СОРБЕНТОВ В ЗАВИСИМОСТИ ОТ РАЗМЕРОВ ПОРМакропористые
Диаметр пор,
нм
> 50
Удельная
поверхность, м2/г
<5
Мезопористые
2 – 50
5 – 500
<2
> 500
Тип сорбента
Микропористые
53
Теория
Мономолекулярной
адсорбции
Капиллярной
конденсации
Объемного заполнения
микропор
ТИПЫ АДСОРБЕНТОВ В ЗАВИСИМОСТИ ОТ ПРИРОДЫ
1) адсорбенты без локализованных зарядов - неполярныые;
2) адсорбенты с положительными зарядами – полярные;
3) Адсорбенты с отрицательными зарядами – полярные.
ТИПЫ МЕЖМОЛЕКУЛЯРНОГО ВЗАИМОДЕЙСТВИЯ
1) дисперсионное; 2) индукционное; 3) ориентационное;
4) донорно-акцепторное (образование водородных связей)
62.
МОЛЕКУЛЯРНАЯ АДСОРБЦИЯКSG ~ exp(EAS/RT)
КSG – коэффициент адсорбции из газовой фазы;
EAS
–
энергия
межмолекулярного
взаимодействия
микрокомпонента и адсорбента.
КSL ~ exp[(EAS – EAМ – EMS)/RT]
КSL - коэффициент адосрбции из жидкой фазы;
EAМ
–
энергия
межмолекулярного
взаимодействия
микрокомпонента и растворителя;
EMS
–
энергия
межмолекулярного
взаимодействия
растворителя и адсорбента.
54
63.
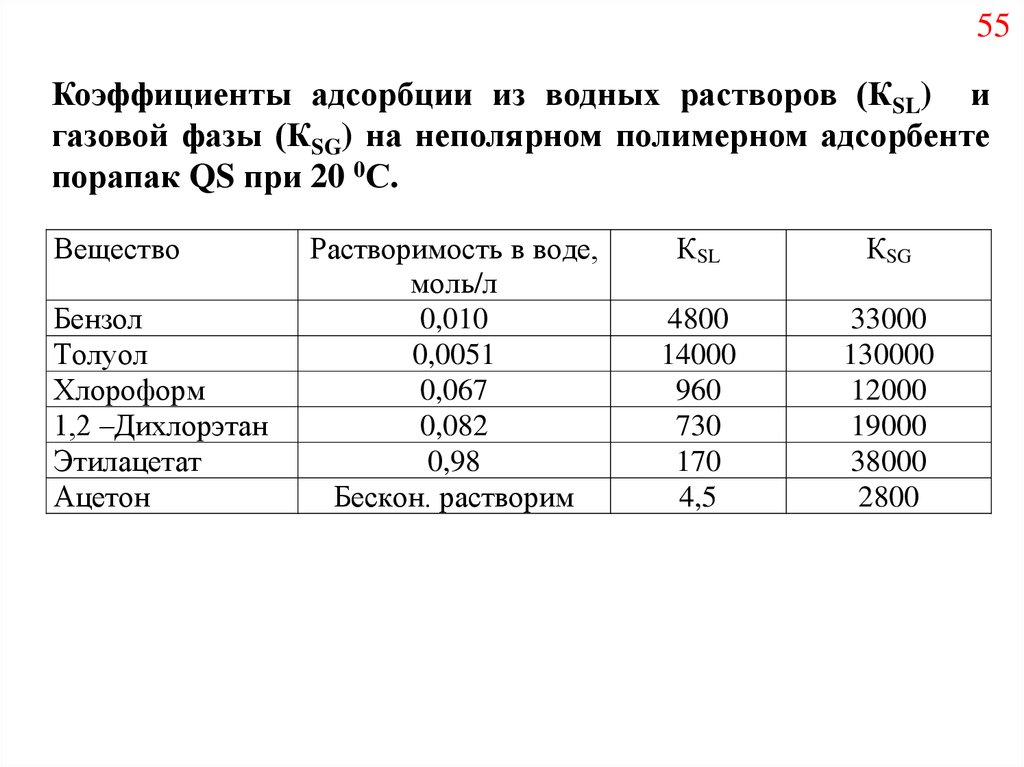
55Коэффициенты адсорбции из водных растворов (КSL) и
газовой фазы (КSG) на неполярном полимерном адсорбенте
порапак QS при 20 0С.
Вещество
Бензол
Толуол
Хлороформ
1,2 –Дихлорэтан
Этилацетат
Ацетон
Растворимость в воде,
моль/л
0,010
0,0051
0,067
0,082
0,98
Бескон. растворим
КSL
КSG
4800
14000
960
730
170
4,5
33000
130000
12000
19000
38000
2800
64.
ОСНОВНЫЕ НЕОРГАНИЧЕСКИЕ АДСОРБЕНТЫТип сорбента
Наименование
Удельная поДиаметр,
2
верхность, м /г
пор, нм
Активные угли
БАУ, АГ, СКТ
> 1000
Микро и мезопоры
Графитированная Карбопак С
12
100-200
термическая сажа Карбопак B
100
1,3
Карбосив
1000
1,5
Карбосфер
1200
1,3
Цеолиты (алюмо- 4А (NaA)
> 1000
0,4
силикаты щел. и
5A (CaA)
>1000
0,5
щел.зем. металлов) 13X (NaX)
>1000
1,0
Сферосил 400
300-500
8
Сферосил 200
140-230
15
Силикагели
Сферосил 75
75-125
30
Порасил B
125-250
10-20
Порасил С
50-100
20-40
Силохром С-80
70-90
Макропоры
Силохром С-120
100-150
Активный оксид
200-300
Мезопоры
алюминия
tmax,
0
C
400
500
500
400
400
450
450
400
250
300
400
300
56
65.
Распространенные полимерные адсорбенты, применяемыедля адсорбции из газовых и жидких сред. Символом *
отмечены полярные адсорбенты. r – средний радиус пор.
Адсорбент
Порапак Q
Порапак QS
Порапак P
Хромосорб -102
Хромосорб - 106
Полисорб –1 (ПС-1)
Полисорб- 10
Тенкас GC
*Порапак S
*Порапак Т
*Хромосорб - 105
*Нитрополисорб - 1
*Аминополисорб -1
Исходные мономеры
Этилстирол - дивинилбензол
Q c метильными группами
Стирол - дивинилбензол
Cтирол - дивинилбензол
Стирол
Стирол -дивинилбензол
Дивинилбензол
п-2,6 - дифенил-фениленоксид
Винилпиридин
Этиленгликоль диметакрилат
Акрилонитрил
ПС –1 с NO2
ПС –1 с NH2
Sуд,
м2/г
630 - 840
600 - 800
225 - 350
300 - 500
700 - 800
200 - 300
300 - 400
20
450 - 600
250 - 300
600- 700
200 - 250
200 - 250
r,
нм
4
5
8
70
90
4
10
50
40
50
Tмакс,
0
С
250
250
250
250
250
250
250
400
250
200
250
200
200
57
66.
ЗАВИСИМОСТЬ СТЕПЕНИ ИЗВЛЕЧЕНИЯ ИОНОВ МЕТАЛЛОВ 58СОРБЕНТОМ С ИМИНОДИАЦЕТАТНЫМИ ГРУППАМИ ОТ рН
67.
59ХЕЛАТООБРАЗУЮЩИЕ СОРБЕНТЫ НА ОСНОВЕ ПОЛИСТИРОЛА
68.
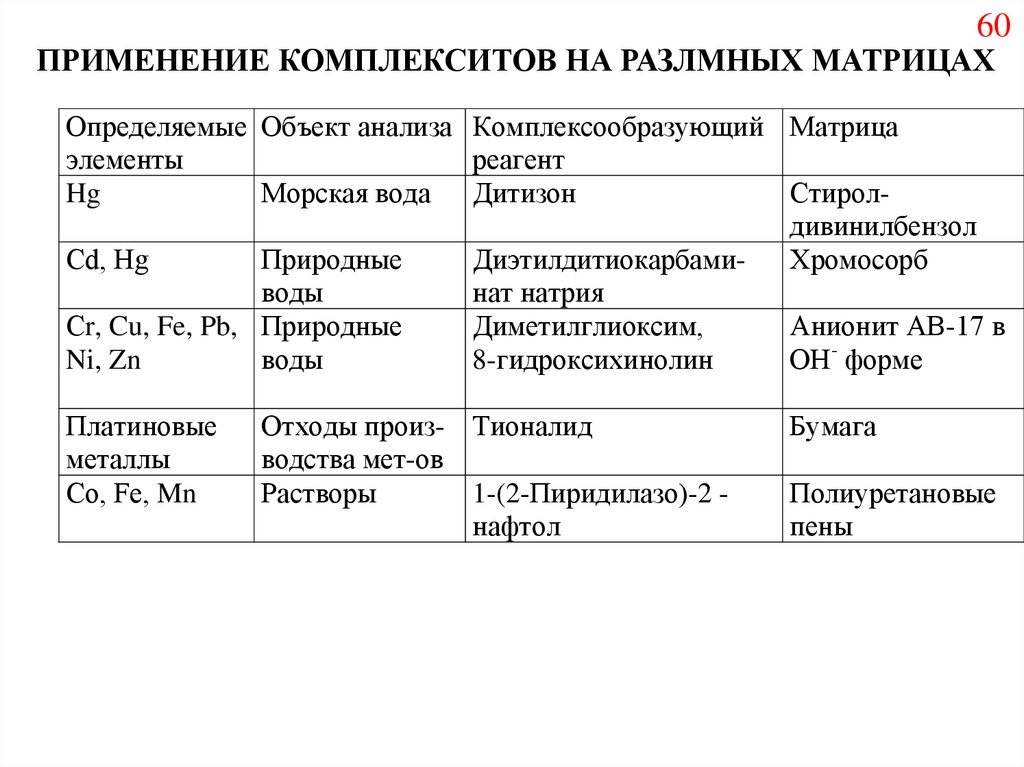
60ПРИМЕНЕНИЕ КОМПЛЕКСИТОВ НА РАЗЛМНЫХ МАТРИЦАХ
Определяемые Объект анализа Комплексообразующий Матрица
элементы
реагент
Hg
Морская вода Дитизон
Стиролдивинилбензол
Сd, Hg
Природные
ДиэтилдитиокарбамиХромосорб
воды
нат натрия
Сr, Cu, Fe, Pb, Природные
Диметилглиоксим,
Анионит АВ-17 в
Ni, Zn
воды
8-гидроксихинолин
ОН- форме
Платиновые
металлы
Со, Fe, Mn
Отходы произ- Тионалид
водства мет-ов
Растворы
1-(2-Пиридилазо)-2 нафтол
Бумага
Полиуретановые
пены
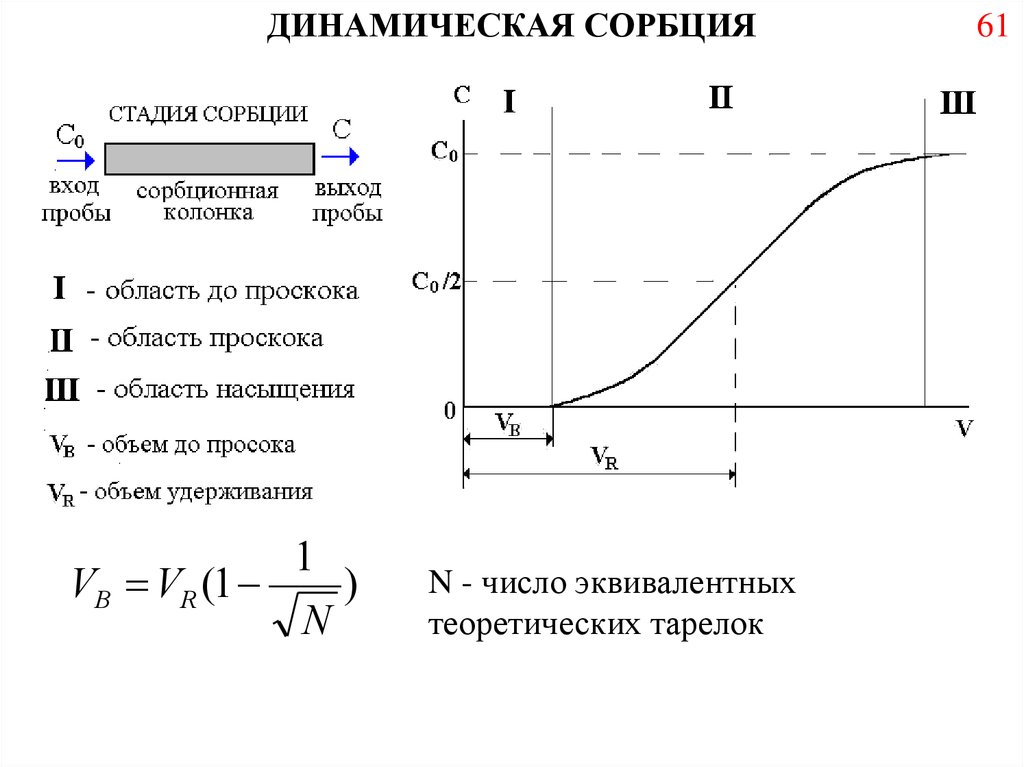
69.
ДИНАМИЧЕСКАЯ СОРБЦИЯ1
VB VR (1
)
N
N - число эквивалентных
теоретических тарелок
61
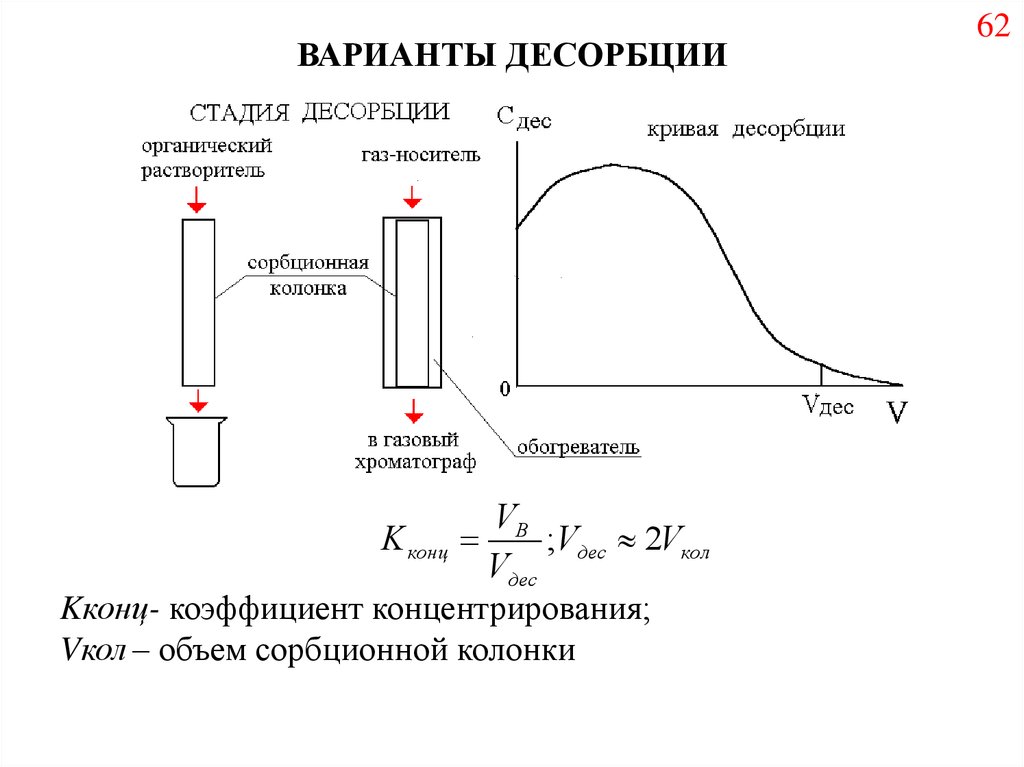
70.
ВАРИАНТЫ ДЕСОРБЦИИVB
K конц
;Vдес 2Vкол
Vдес
Kконц- коэффициент концентрирования;
Vкол – объем сорбционной колонки
62
71.
63ТИПИЧНЫЕ ПАРАМЕТРЫ ПРИ ПРОВЕДЕНИИ
СОРБЦИИ ИЗ ГАЗОВОЙ И ЖИДКОЙ ФАЗ
Параметр
Длина колонки, см
Диаметр колонки, мм
Размеры частиц, мкм
Расход пробы, мл/мин
Сорбция из газовой фазы
Сорбция из жидкой фазы
Десорбция орг. ТермоНасос высо- Без насоса вырастворителем десорбция кого давлен. сокого давлен.
3-6
5-10
3-8
6-12
3-4
3-4
2-3
3-6
300-600
500-1000
5-20
100-300
200-500
400-1000
1-2
2-5
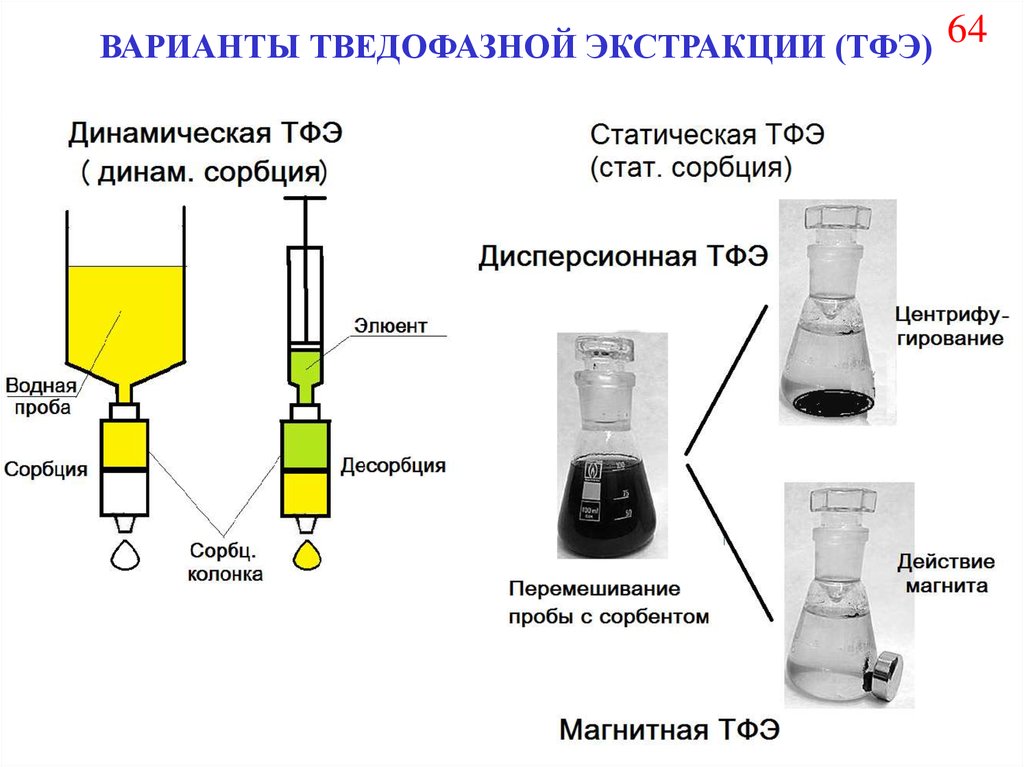
72.
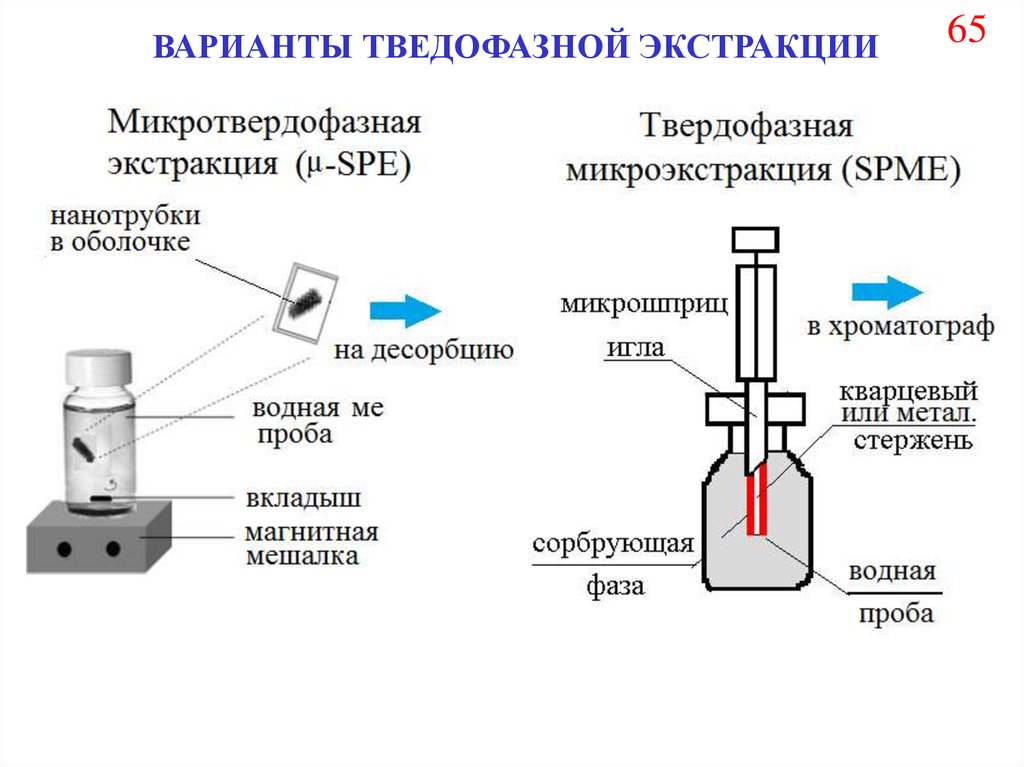
ВАРИАНТЫ ТВЕДОФАЗНОЙ ЭКСТРАКЦИИ (ТФЭ) 6473.
ВАРИАНТЫ ТВЕДОФАЗНОЙ ЭКСТРАКЦИИ65
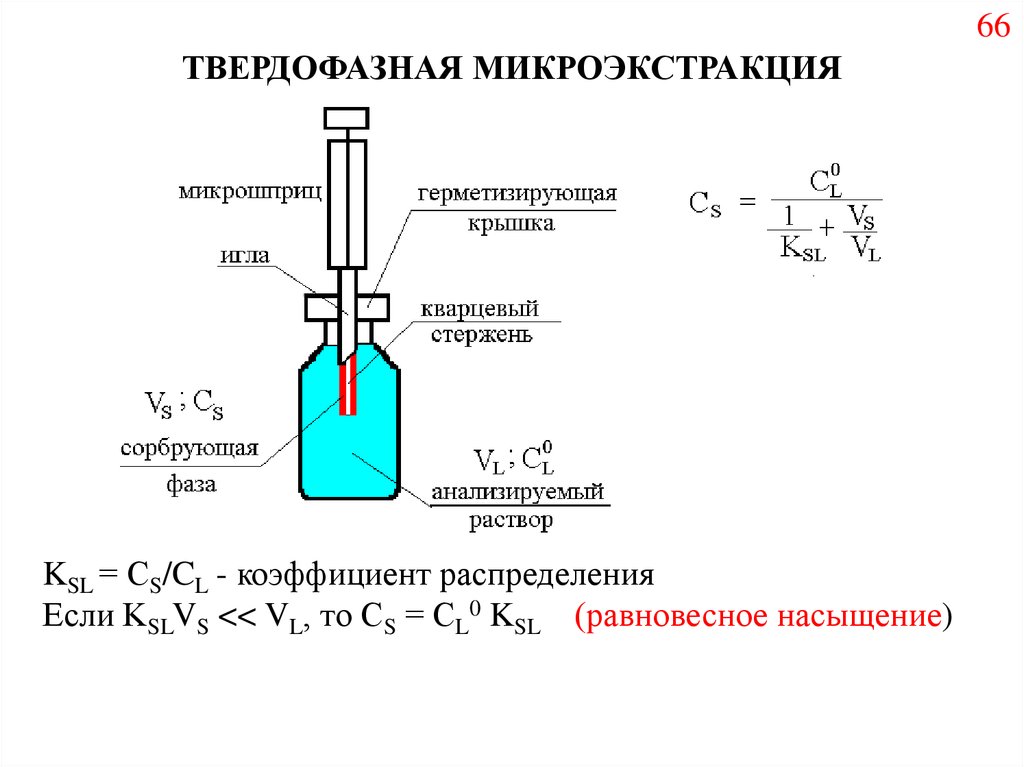
74.
66ТВЕРДОФАЗНАЯ МИКРОЭКСТРАКЦИЯ
KSL = СS/CL - коэффициент распределения
Если KSLVS << VL, то СS = СL0 KSL (равновесное насыщение)
75.
ПАРО-ТВЕРДОФАЗНАЯ МИКРОЭКСТРАКЦИЯЕсли VS/VL << 1 и VG/VL << 1 , то СS = CL0KSG/KLG
(режим равновесного насыщения)
67
76.
ХРОМАТОМЕМБРАННЫЕ МЕТОДЫПРЕДВАРИТЕЛЬНОГО
КОНЦЕНТРИРОВАНИЯ
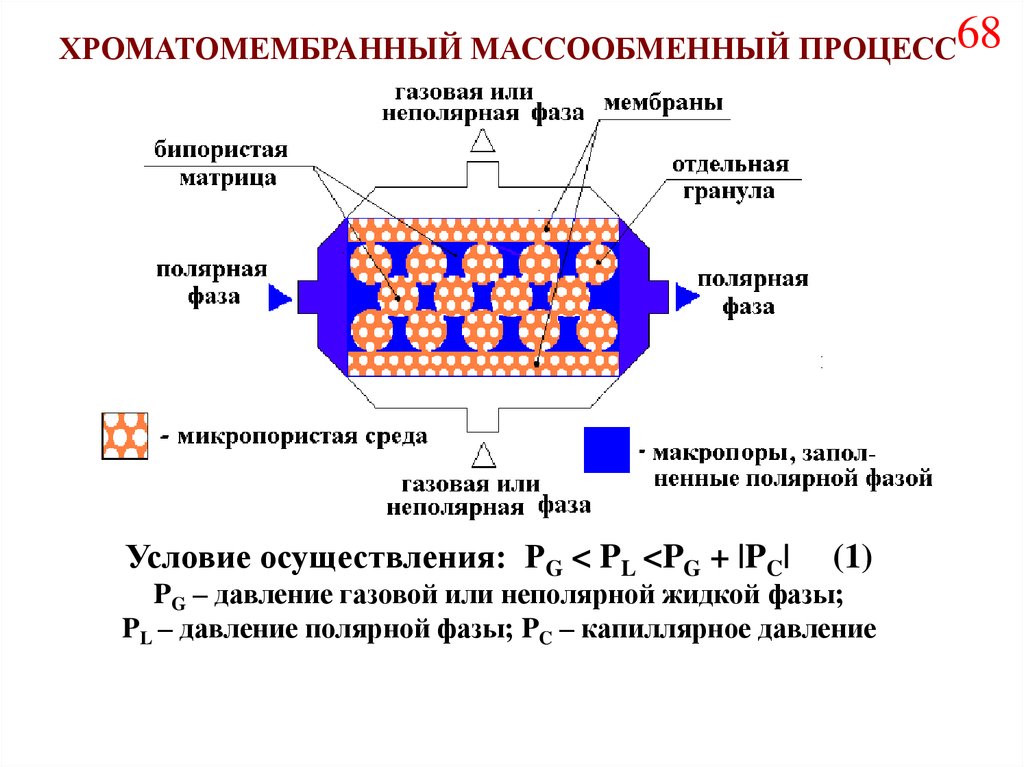
77.
ХРОМАТОМЕМБРАННЫЙ МАССООБМЕННЫЙ ПРОЦЕСС68Условие осуществления: PG < PL <PG + |PC|
(1)
PG – давление газовой или неполярной жидкой фазы;
PL – давление полярной фазы; PC – капиллярное давление
78.
ВАРИАНТЫ ХРТОМАТОМЕМБРАННЫХ МАССООБМЕННЫХ ПРОЦЕССОВПризнак
Агрегатное
состояние
фаз
Вариант
Жидкостная
экстракция
Газовая экстракция
Жидкостная
абсорбция
НаправлеПрямоточный
ние
пере- Противоточмещения
ный
фаз
Двухмерный
Характер
Непрерывный
процесса
Дискретный
70
Сущность варианта
Выделение веществ из одной жидкой в другую жидкую фазу
Выделение веществ из жидкой в газовую фазу
Выделение веществ из газовой в
жидкую фазу
Движение фаз в одном направлении
Движение фаз в противоположных
направлениях
Движение фаз под прямым углом
Одновременное движение фаз через
матрицу
Поочередное движение фаз через
матрицу
79.
71Хроматомембраная ячейка
80.
КОЭФФИЦИЕНТЫ КОНЦЕНТРИРОВАНИЯ ДЛЯРАЗЛИЧНЫХ ВАРИАНТОВ ЭКСТРАКЦИИ
Непрерывный варианат
Дискретный вариант
Kконц = W/WE
Kконц = V/VE
W – расход отдающей фазы (пробы) через ячейку;
WE – расход принимающей фазы (экстрагента);
V – объем пробы, пропущенный через ячейку;
VE – объем экстрагента в ячейке
72
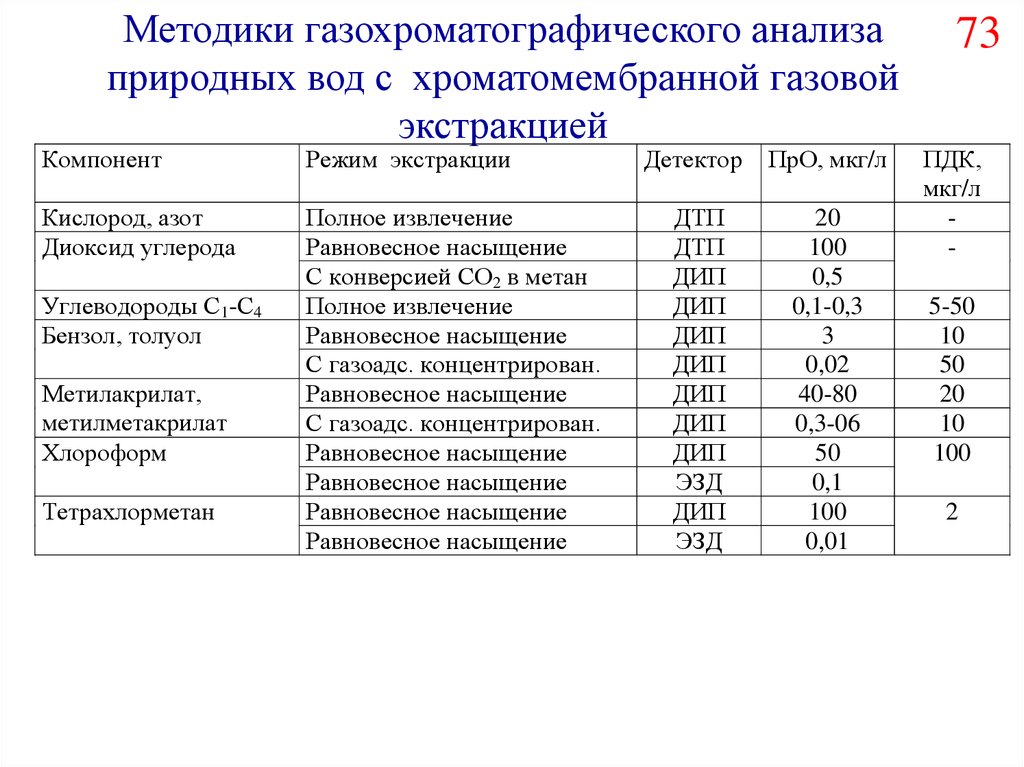
81.
Методики газохроматографического анализаприродных вод с хроматомембранной газовой
экстракцией
Компонент
Режим экстракции
Кислород, азот
Диоксид углерода
Полное извлечение
Равновесное насыщение
С конверсией СО2 в метан
Полное извлечение
Равновесное насыщение
С газоадс. концентрирован.
Равновесное насыщение
С газоадс. концентрирован.
Равновесное насыщение
Равновесное насыщение
Равновесное насыщение
Равновесное насыщение
Углеводороды С1-С4
Бензол, толуол
Метилакрилат,
метилметакрилат
Хлороформ
Тетрахлорметан
Детектор
ПрО, мкг/л
ДТП
ДТП
ДИП
ДИП
ДИП
ДИП
ДИП
ДИП
ДИП
ЭЗД
ДИП
ЭЗД
20
100
0,5
0,1-0,3
3
0,02
40-80
0,3-06
50
0,1
100
0,01
73
ПДК,
мкг/л
5-50
10
50
20
10
100
2
82.
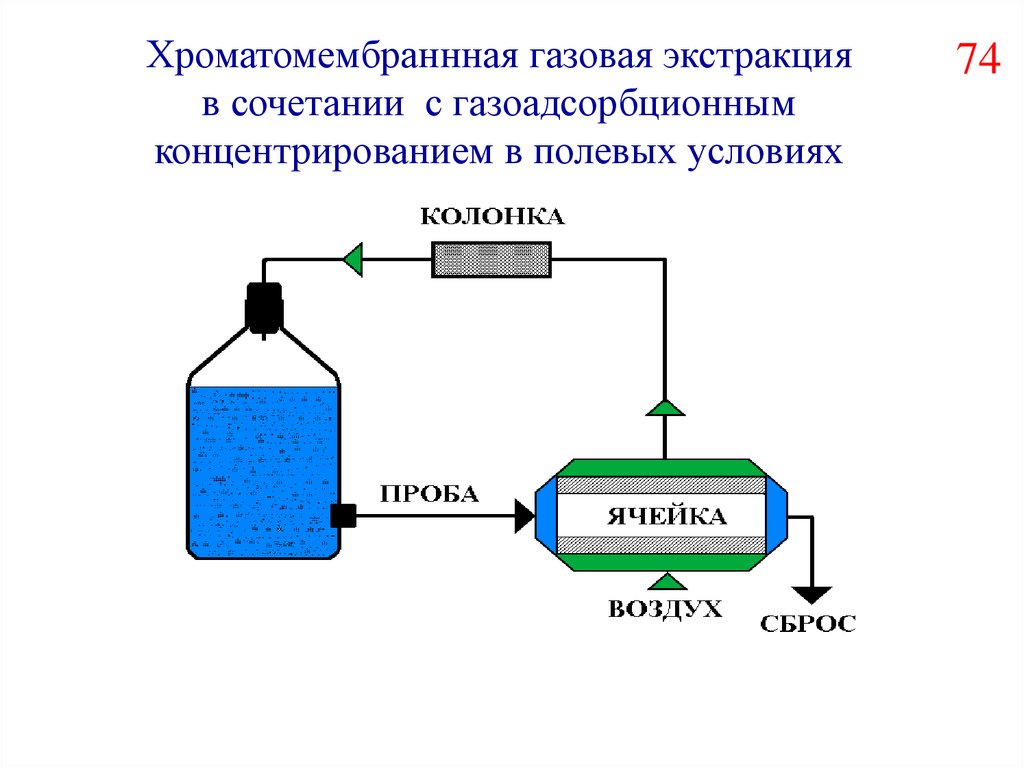
Хроматомембраннная газовая экстракцияв сочетании с газоадсорбционным
концентрированием в полевых условиях
74
83.
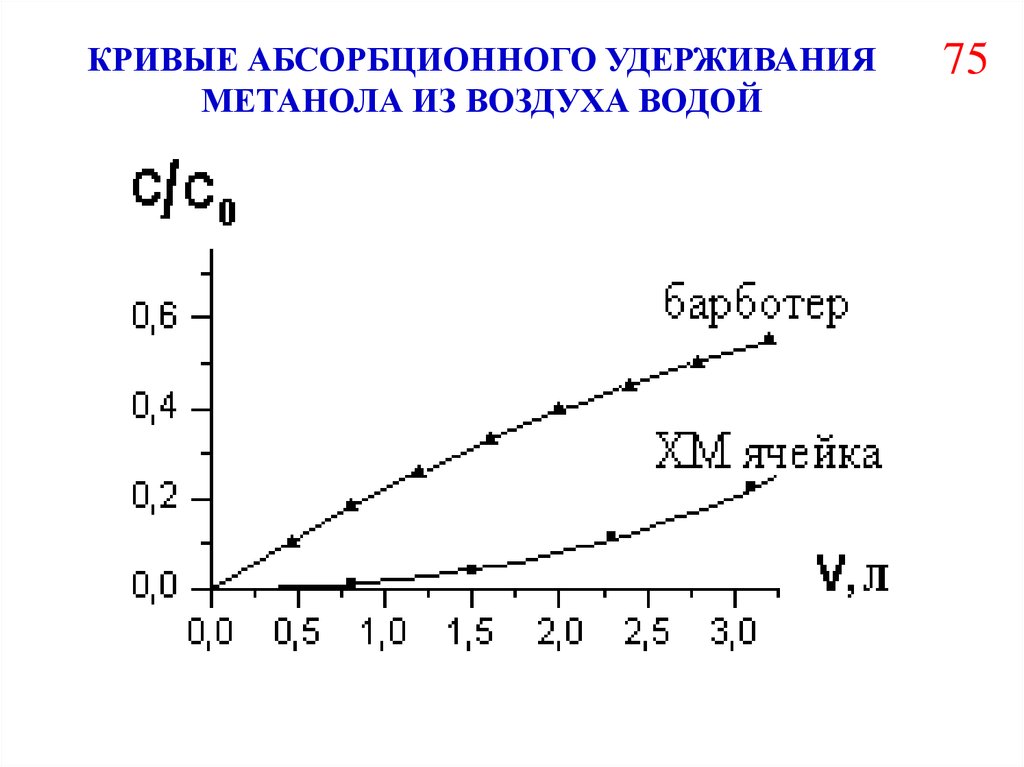
КРИВЫЕ АБСОРБЦИОННОГО УДЕРЖИВАНИЯМЕТАНОЛА ИЗ ВОЗДУХА ВОДОЙ
75
84.
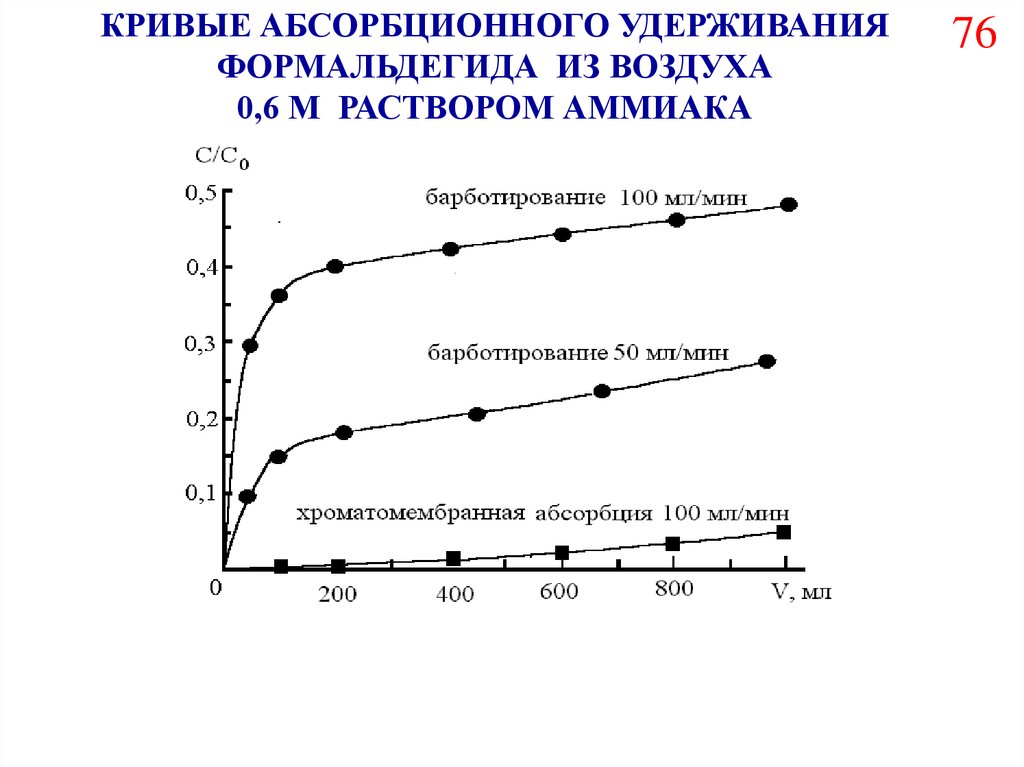
КРИВЫЕ АБСОРБЦИОННОГО УДЕРЖИВАНИЯФОРМАЛЬДЕГИДА ИЗ ВОЗДУХА
0,6 М РАСТВОРОМ АММИАКА
76
85.
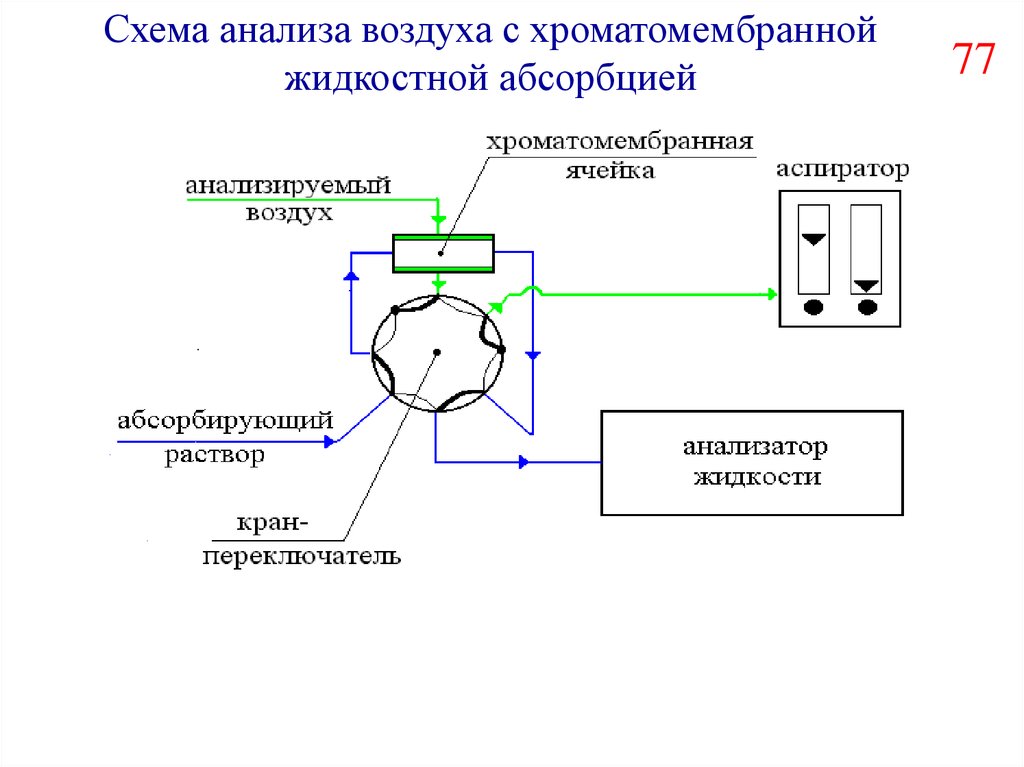
Схема анализа воздуха с хроматомембраннойжидкостной абсорбцией
77
86.
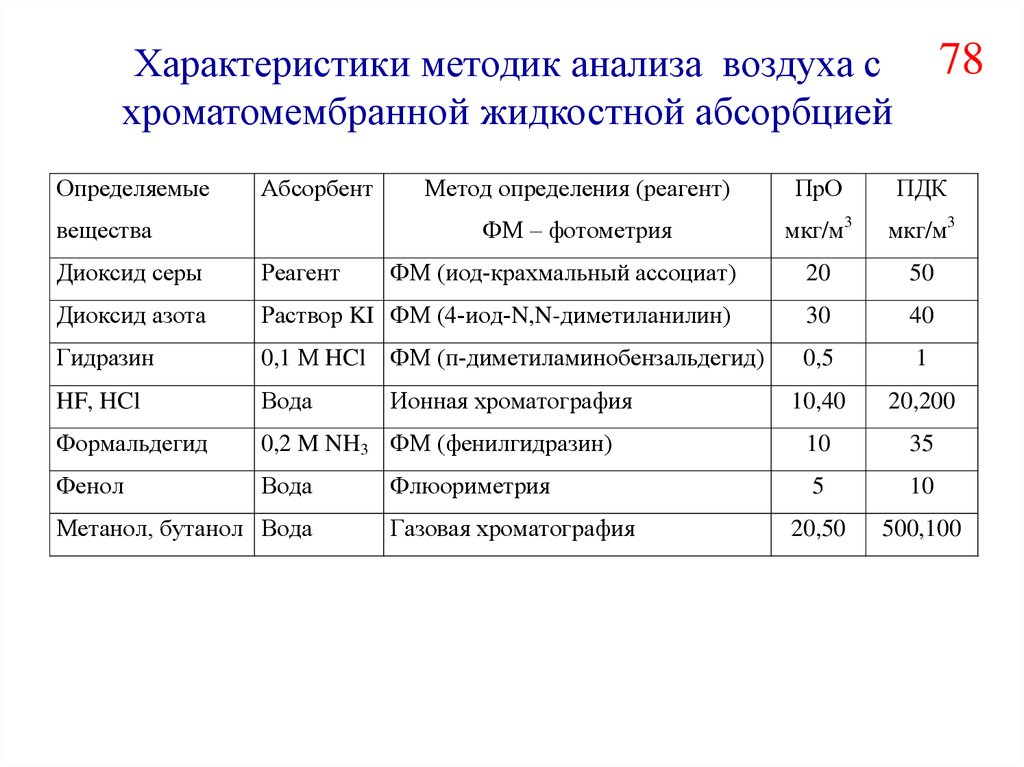
Характеристики методик анализа воздуха схроматомембранной жидкостной абсорбцией
Определяемые
Абсорбент
вещества
78
Метод определения (реагент)
ПрО
ПДК
ФМ – фотометрия
мкг/м3
мкг/м3
Диоксид серы
Реагент
ФМ (иод-крахмальный ассоциат)
20
50
Диоксид азота
Раствор KI ФМ (4-иод-N,N-диметиланилин)
30
40
Гидразин
0,1 М HCl
ФМ (п-диметиламинобензальдегид)
0,5
1
HF, HCl
Вода
Ионная хроматография
10,40
20,200
Формальдегид
0,2 M NH3 ФМ (фенилгидразин)
10
35
Фенол
Вода
5
10
20,50
500,100
Метанол, бутанол Вода
Флюориметрия
Газовая хроматография
87.
ДОСТОИНСТВА ХРОМАТОМЕМБРАННЫХМАССООБМЕННЫХ ПРОЦЕССОВ
ПРИ РЕШЕНИИ АНАЛИТИЧЕСКИХ ЗАДАЧ
• универсальность;
• высокое быстродействие;
• высокие коэффициенты концентрирования;
• простота автоматизации
79





















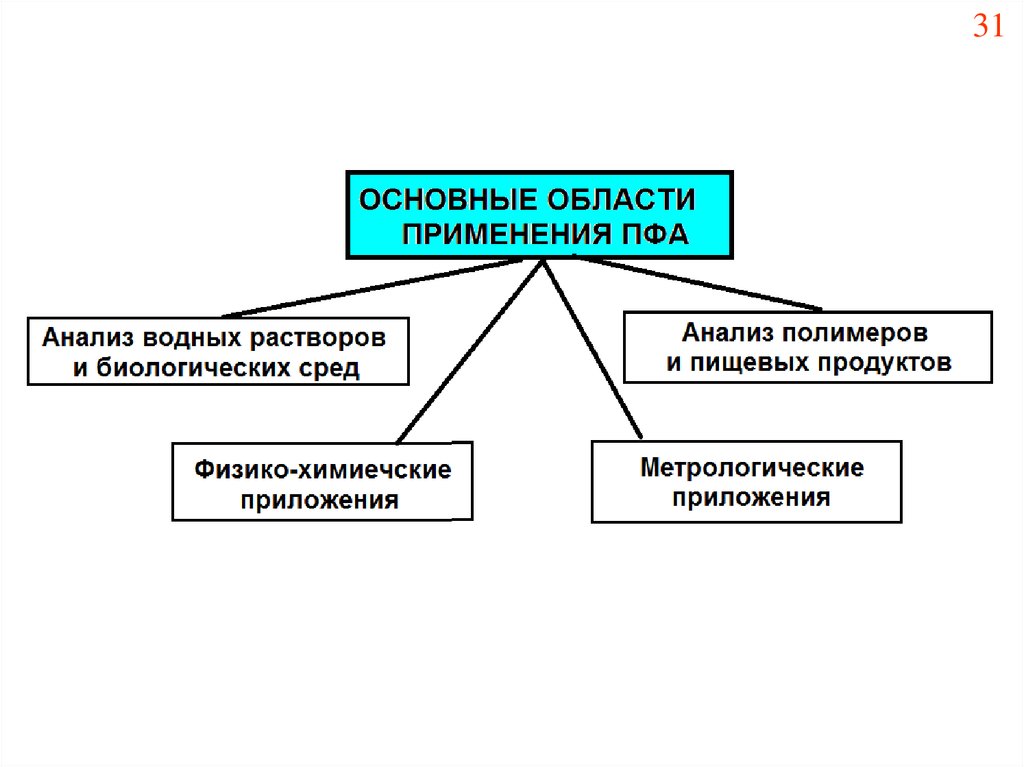

























 Химия
Химия








