Похожие презентации:
Фосфор. Характеристика элемента
1. Фосфор
04.06.20182. История открытия
Нарисуйте схему получения фосфора по рассказуФосфор открыт гамбургским алхимиком Хеннигом
Брандом в 1669 году, сфокусировался на опытах с
человеческой мочой, из-за ее золотистого цвета.
Способ заключался в том, что сначала моча
отстаивалась в течение нескольких дней, пока не
исчезнет неприятный запах, а затем кипятилась до
клейкого состояния. Паста нагревалась до высоких
температур , и конденсировалась.
3.
После нескольких часовинтенсивных кипячений
получались крупицы
белого воскоподобного
вещества, которое очень
ярко горело и мерцало в
темноте. Бранд назвал
это вещество phosphorus
mirabilis. Открытие
фосфора Брандом стало
первым открытием
нового элемента со
времён античности.
«Алхимик, открывающий
фосфор» картина Д. Райта
4. Поразмышляем:
• Что изначально искал Бранд?• Почему со времен античности до 1669 года
не открывались элементы?
• Какие методы разделения веществ
применил Бранд для выделения фосфора
из мочи?
5. Характеристика элемента
Неметалл, элемент 5 А – подгруппы, III периода?
?
?
?
6.
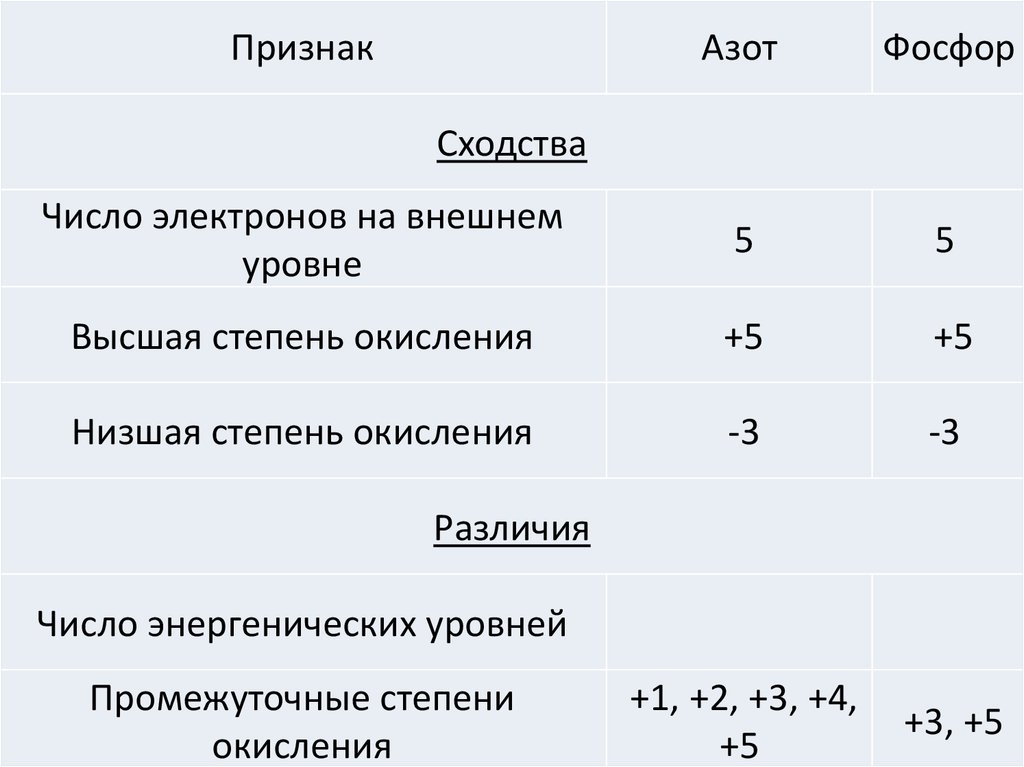
ПризнакАзот
Сходства
Число электронов на внешнем
уровне
Высшая степень окисления
Низшая степень окисления
Различия
Число энергенических уровней
Промежуточные степени
окисления
Фосфор
7.
ПризнакАзот
Фосфор
Число электронов на внешнем
уровне
5
5
Высшая степень окисления
+5
+5
Низшая степень окисления
-3
-3
+1, +2, +3, +4,
+5
+3, +5
Сходства
Различия
Число энергенических уровней
Промежуточные степени
окисления
8. Вопросы для обсуждения:
• Сравните свойства простого веществафосфора с серой и азотом
• Сравните кислотно-основные свойства
летучего водородного соединения и
высшего оксиды/гидроксида фосфора с
соответствующими соединениями серы и
азота
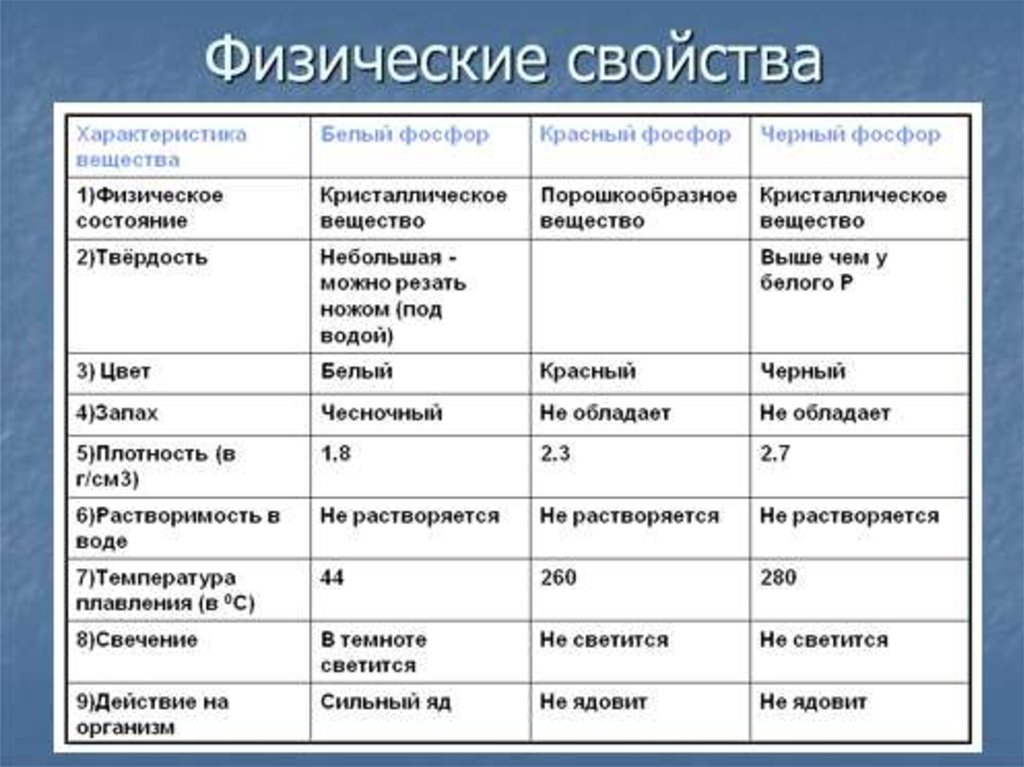
9. Характеристика простого вещества:
Фосфор обладает аллотропией:Белый
Красный
Черный Металлический
10. Разомнем мозги:
По данным таблицы определите:1. Какая модификация фосфора больше
напоминает по физическим свойствам
метал?
2. А какая наиболее опасна для человека?
11.
12. Нахождение в природе:
В природе существует практически только ввиде фосфатов, например фосфоритов и
апатитов:
13. Получение фосфора:
• Фосфор (белый) получают впромышленности, например, при
прокаливании апатита с коксом и песком:
Фосфат кальция + кокс + кварцевый песок
= фосфор + угарный газ + силикат кальция
Ca3(PO4)2 + C + SiO2 = P + CO + CaSiO3
(расставьте коэффициенты методом ЭБ)
14. Химические свойства:
КакКакокислитель:
окислитель:
Реагирует с металлами:
Реагирует с
P + Na = Na3P
металлами:
P + Ca = Ca3P2
P
+ Na =
Полученные
соли
P
+ Ca = фосфиды
называются
Полученные соли
называются фосфиды
Как
Каквосстановитель
восстановитель
Реагирует с
Реагирует с
неметаллами:
неметаллами:
4P + 5O2 = 2P2O5 Оксид
P + O2 = (V)
фосфора
P ++ Cl
2P
5Cl
2 2== 2PCl5 хлорид
фосфора (V)
4P
3O2(недост)
(нед) = 2P=2O3
P ++ O
2
Оксид фосфора (III)
P+S=
2P + 3S = P2S3 Сульфид
фосфора (III)
15. Химические свойства:
Реагируетсо сложными сильными окислителями с образованием
соединений фосфора +5:
P + HNO3 + H20 = H3PO4 + NO
P + H2SO4 = SO2 + H3PO4 + H2O
P + KClO3 = KCl + P2O5
Какая из реакций соответствует поджиганию спички?
Насколько концентрирована азотная кислота в реакции?
3P + 5HNO3 + 2H20 = 3H3PO4 + 5NO
2P + 5H2SO4 = 5SO2 + 2H3PO4 + 2H2O
6P + 5KClO3 =5 KCl + 3P2O5
16.
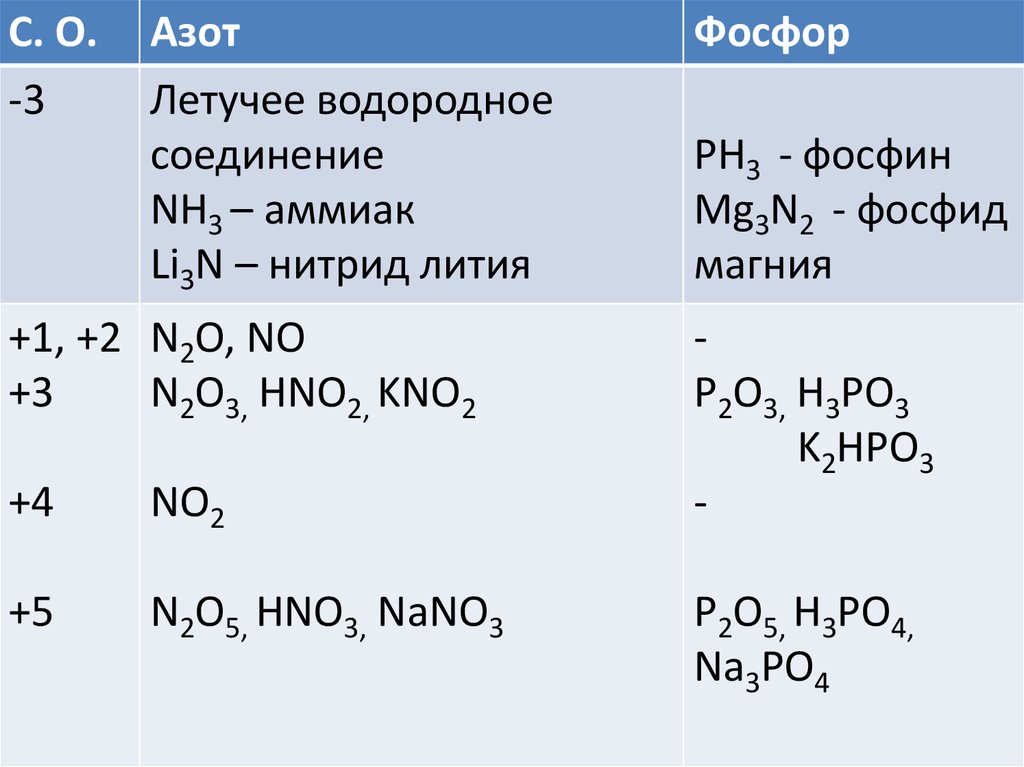
С. O.-3
Азот
Летучее водородное
соединение
NН3 – аммиак
Li3N – нитрид лития
+1, +2 N2O, NO
+3
N2O3, HNO2, KNO2
+4
NO2
+5
N2O5, HNO3, NaNO3
Фосфор
PН3 - фосфин
Mg3N2 - фосфид
магния
P2O3, H3PO3
K2HPO3
P2O5, H3PO4,
Na3PO4
17. Фосфин
• Газ с резким запахом, похожим на рыбу• Очень ядовит, вызывает ожоги дыхательных
путей и поражение центральной нервной
системы
• Получается при гидролизе фосфидов:
Ca3P2 + H2O = Ca(OH)2 + PH3
• Очень сильный восстановитель
2PH3 + 4O2 = P2O5 + 3H2O
• Создает эффект «блуждающих огней»
18. Фосфорная кислота.
Бесцветные гигроскопичные кристаллы, хорошорастворима в воде и других полярных
растворителях.
Концентрированный раствор – бесцветная
сиропообразная жидкость без запаха.
19.
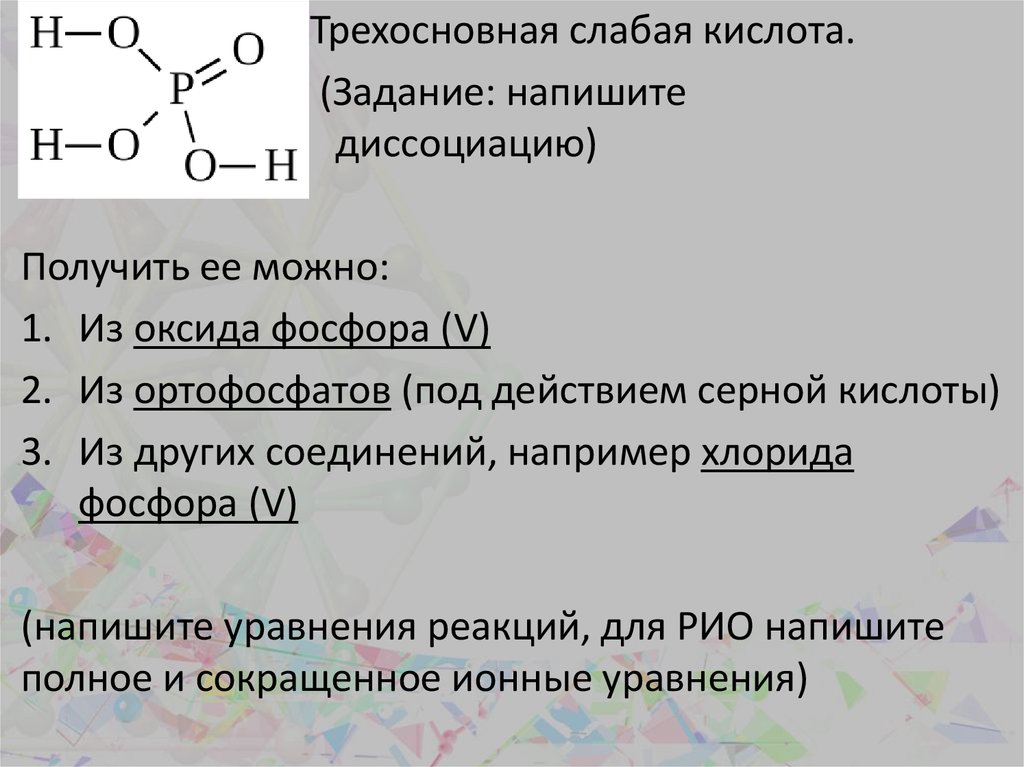
Трехосновная слабая кислота.(Задание: напишите
____________ диссоциацию)
Получить ее можно:
1. Из оксида фосфора (V)
2. Из ортофосфатов (под действием серной кислоты)
3. Из других соединений, например хлорида
фосфора (V)
(напишите уравнения реакций, для РИО напишите
полное и сокращенное ионные уравнения)
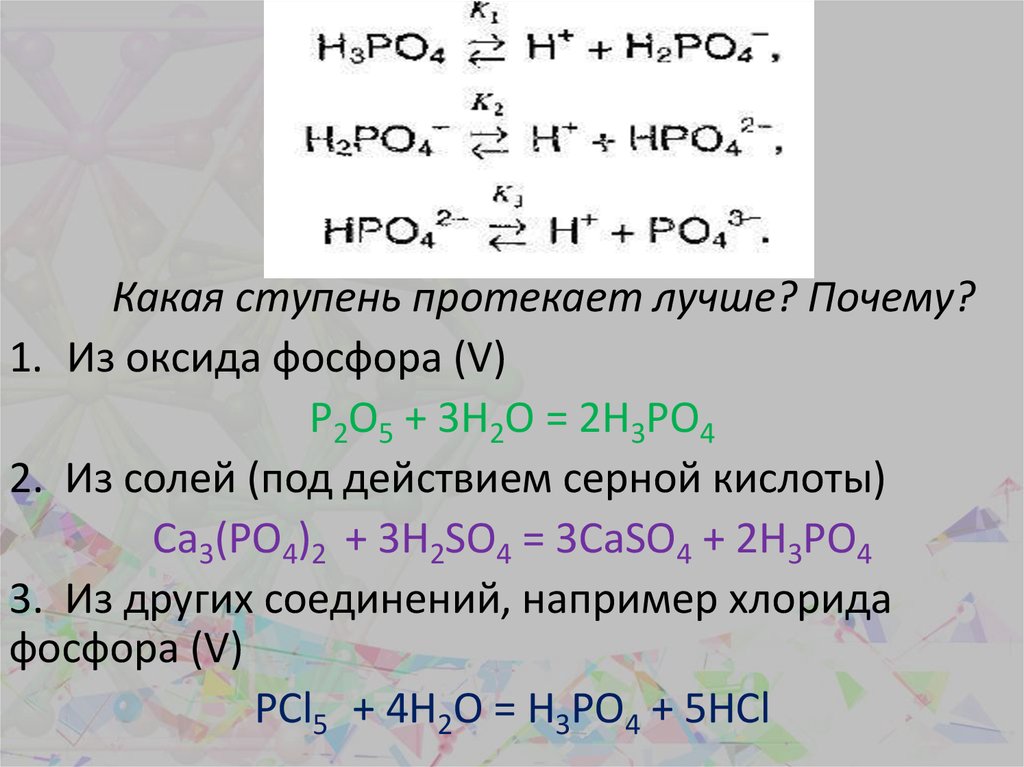
20.
Какая ступень протекает лучше? Почему?1. Из оксида фосфора (V)
P2O5 + 3H2O = 2H3PO4
2. Из солей (под действием серной кислоты)
Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
3. Из других соединений, например хлорида
фосфора (V)
PCl5 + 4H2O = H3PO4 + 5HCl
21.
Как и все слабые кислоты реагирует с (чем?)1. Основаниями
(NaOH + H3PO4 = )
2. Основными оксидами (K2O + H3PO4 = )
3. Металлами левее водорода в ряду активности
(Zn + H3PO4 = )
Образует 3 вида солей:
1. Фосфаты
Na3PO4, Ca3(PO4)2
2. Гидрофосфаты Na2HPO4, CaHPO4
3. Дигидрофосфаты
NaH2PO4, Ca(H2PO4)2
Растворимость увеличивается в этом ряду,
например фосфат кальция нерастворим, а
дигидрофосфат – растворим.
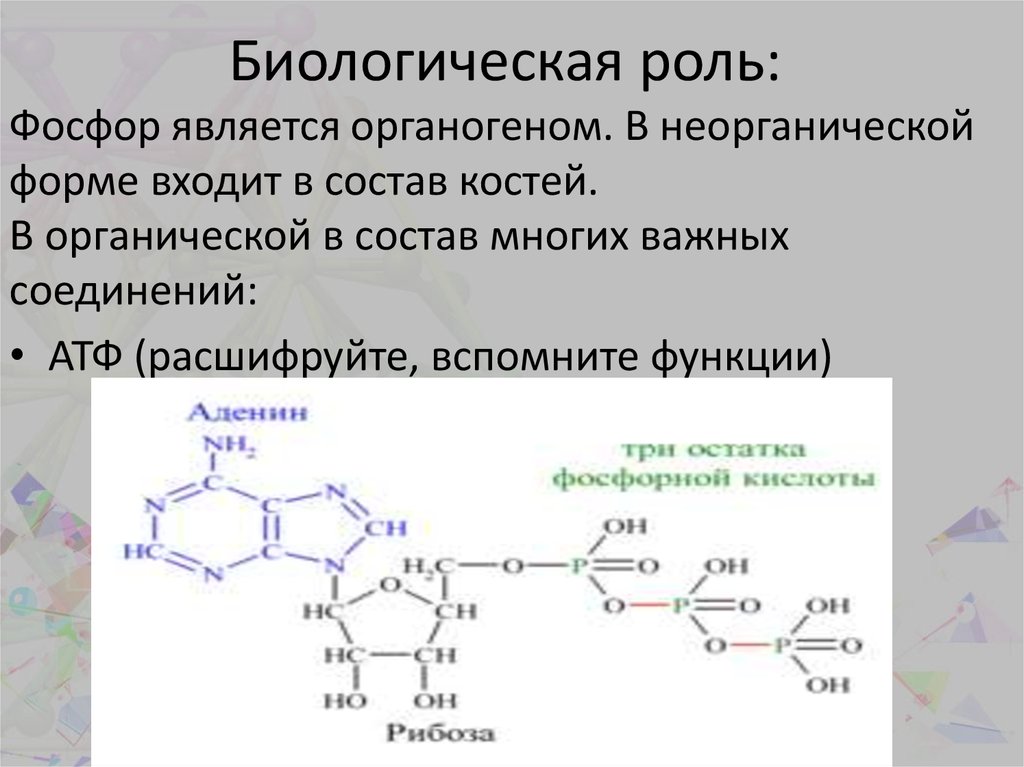
22. Биологическая роль:
Фосфор является органогеном. В неорганическойформе входит в состав костей.
В органической в состав многих важных
соединений:
• АТФ (расшифруйте, вспомните функции)
23.
• ДНК, РНК24. Применение в сельском хозяйстве
• Фосфор способствует накоплению полезных веществрастением и повышает его выносливость. Фосфорное
голодание проявляется в изменении окраски листьев на
пурпурную, бронзовую и задержке цветения и созревания.
25. Фосфорсодержащие удобрения
• Аммофос — сложное фосфорно-азотное удобрение содержитазот и фосфор.
• Нитроаммофос — азотно-фосфорное удобрение, которое
содержит водорастворимый фосфор.
• Нитрофос — двойное азотно-фосфорное удобрение.
• Диаммофос — азотно-фосфорное удобрение, широко
применяемое для овощных культур.
• Нитроаммофоска — сложное азотно-фосфорно-калийное
удобрение.
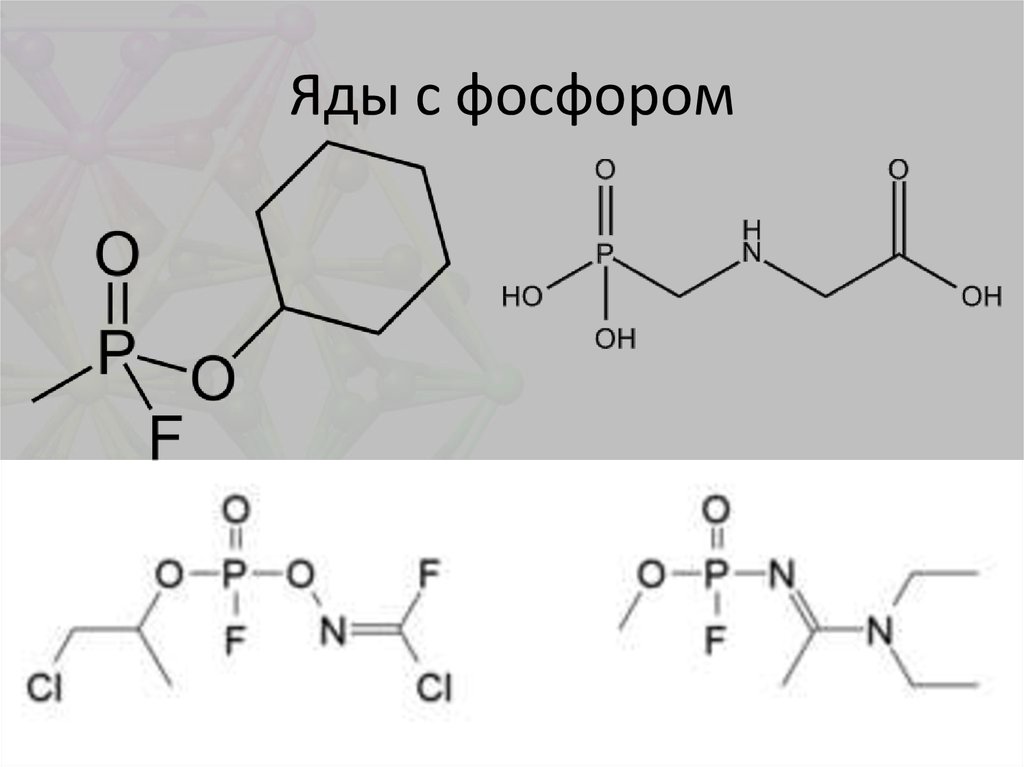
26. Яды с фосфором
27. Химия в литературе:
А. Конан Дойл описал собаку, мордакоторой была в белом фосфоре,
выглядела она так:
В сериале «Breaking Bad» главный герой залил водой прокаленную
смесь йода с фосфором, в результате выделился газ, отравивший
мексиканцев (симптомы: удушье, поражение ЦНС)
Какая из ситуаций реальна
с точки зрения химии?
Объясните ответ.
28.
• Известно, что бактерии гниения разлагают трупы свыделением соединений фосфора. Используя эти
данные, объясните «призраков» на кладбищах.
• Известно, что белый фосфор растворим в сероводороде
и в этом состоянии не самовозгорается. Однако
сероводород быстро испаряется. Используя эти данные,
предположите объяснение «снисхождения
благодатного огня».






















 Химия
Химия








