Похожие презентации:
Методы исследования и характеризации поверхностей. Поверхностное и межфазное натяжение. Тензиометрия и эллипсометрия
1.
Московский технологический университетКафедра коллоидной химии им. С.С. Воюцкого
Введение. Цели и задачи курса «Методы
исследования и характеризации
поверхностей». Поверхностное и межфазное
натяжение. Тензиометрия и эллипсометрия.
М.Ю. Плетнев, доктор хим. наук
Москва – 2016
2. Цель и задачи дисциплины
Московкий технологический университетКафедра коллоидной химии им. С.С. Воюцкого
Цель и задачи дисциплины
Современные методы исследования твердой поверхности на микрои наноуровне, включая электронную микроскопию, сканирующую
зондовую микроскопию, спектральные, в частности, рентгеновскую
фотоэлектронную спектроскопию, Оже-спектроскопию,
спектроскопию ионного рассеяния, ИК-спектроскопию многократно
нарушенного полного внутреннего отражения.
Методы изучения уд. поверхности, дисперсности, пористости,
смачиваемости, поверхностной энергии и поверхностного
натяжения твердых и жидких межфазных поверхностей.
Задачи: 1) получить представление о современных методах
исследования и характеризации поверхностей, контроля качества и
состава покрытий; 2) приобрести важные дополнительные
компетенции и практические навыки в исследовании поверхности
материалов.
2
3.
Кафедра коллоидной химии им. С.С. ВоюцкогоПлан лекции
Поверхностные и межфазные явления в химической технологии
и материаловедении.
Обзор инструментальных методов исследования и
характеризации поверхности. Модифицирование поверхностей
и его контроль.
Связь поверхностного натяжения с химической природой
веществ.
Роль поверхности, поверхностного натяжения в
технологических процессах с жидкими и твердыми
межфазными границами.
Межфазная тензиометрия. Современные тензиометры, их
классификация, возможности и сферы применения.
Динамическое поверхностное натяжение и способы его оценки.
Эллипсометрия в исследовании адсорбционных слоев и тонких
пленок. Принцип работы эллипсометоров.
3
4.
Кафедра коллоидной химии им. С.С. ВоюцкогоПоверхностное натяжение
Там, где межфазные границы существенны, свободную энергию
системы можно представить в виде суммы ее объемной и
поверхностной составляющей:
F = FV + FS.
Нескомпенсированность молекулярных сил на границе раздела
фаз проявляется в наличии запаса свободной поверхностной энергии
FS, которая пропорциональна площади поверхности раздела S:
FS = σ·S,
где σ – коэффициент пропорциональности, называемый
коэффициентом поверхностного натяжения. Его размерность
(энергия, отнесенная к единице площади FS/S): Дж/м2 или Н/м.
Поверхностное натяжение можно трактовать двояко:
1) как удельную энергию, приходящуюся на 1 м2 поверхности (или
работу, затрачиваемую на образование 1 м2 поверхности);
2) как силу, действующую вдоль поверхности раздела и
препятствующую ее увеличению (растяжению, дроблению).
4
5.
Кафедра коллоидной химии им. С.С. ВоюцкогоСвободная энергия двухфазной системы: F = FV1 + FV2 + FS.
Нескомпенсированность молекулярных сил на границе раздела фаз
проявляется в наличии запаса свободной поверхностной энергии FS, которая
пропорциональна площади поверхности раздела S:
где σ – коэффициент пропорциональности, называемый коэффициентом
поверхностного натяжения. Его размерность (энергия, отнесенная к
единице площади FS/S) следует из этого уравнения: Дж/м2.
σ=
∂F
∂S T,V,ni
= ∂G
∂U
=
∂S T,P,ni ∂S S,V,ni
V1
А
Поверхностное натяжение – частная
производная любой характеристической
термодинамической функции по площади
при постоянных соответствующих
параметрах.
Кафедра коллоидной химии МИТХТ
V2
5
6.
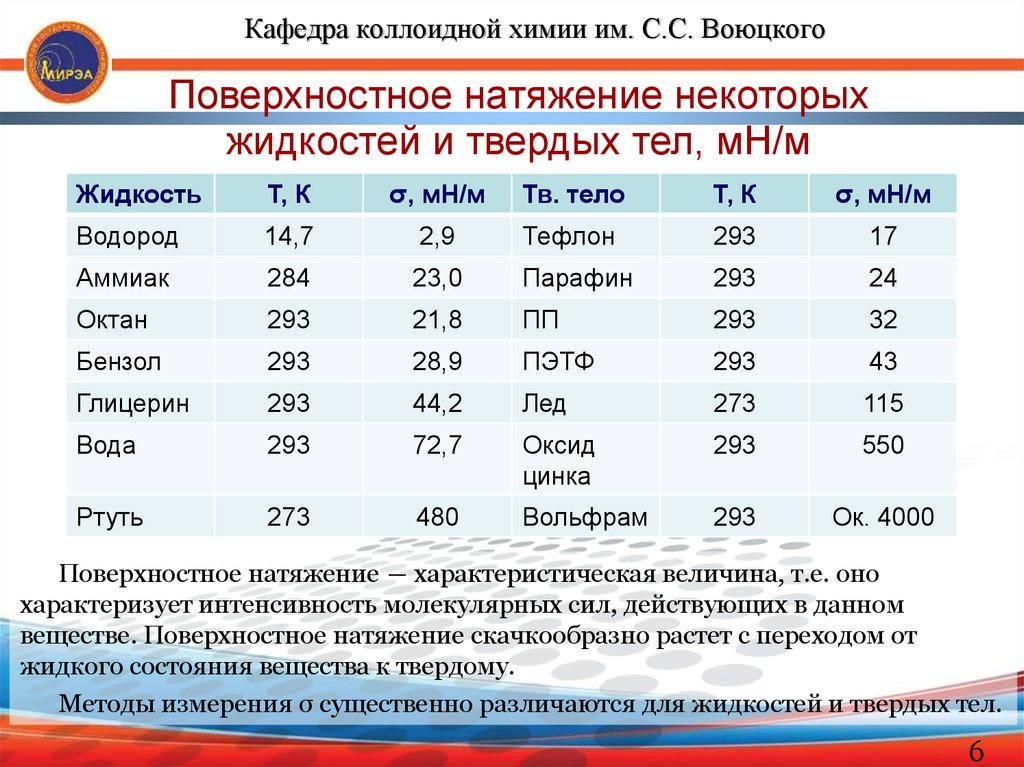
Кафедра коллоидной химии им. С.С. ВоюцкогоПоверхностное натяжение некоторых
жидкостей и твердых тел, мН/м
Жидкость
Т, К
σ, мН/м
Тв. тело
Т, К
σ, мН/м
Водород
14,7
2,9
Тефлон
293
17
Аммиак
284
23,0
Парафин
293
24
Октан
293
21,8
ПП
293
32
Бензол
293
28,9
ПЭТФ
293
43
Глицерин
293
44,2
Лед
273
115
Вода
293
72,7
Оксид
цинка
293
550
Ртуть
273
480
Вольфрам
293
Ок. 4000
Поверхностное натяжение ― характеристическая величина, т.е. оно
характеризует интенсивность молекулярных сил, действующих в данном
веществе. Поверхностное натяжение скачкообразно растет с переходом от
жидкого состояния вещества к твердому.
Методы измерения σ существенно различаются для жидкостей и твердых тел.
6
7.
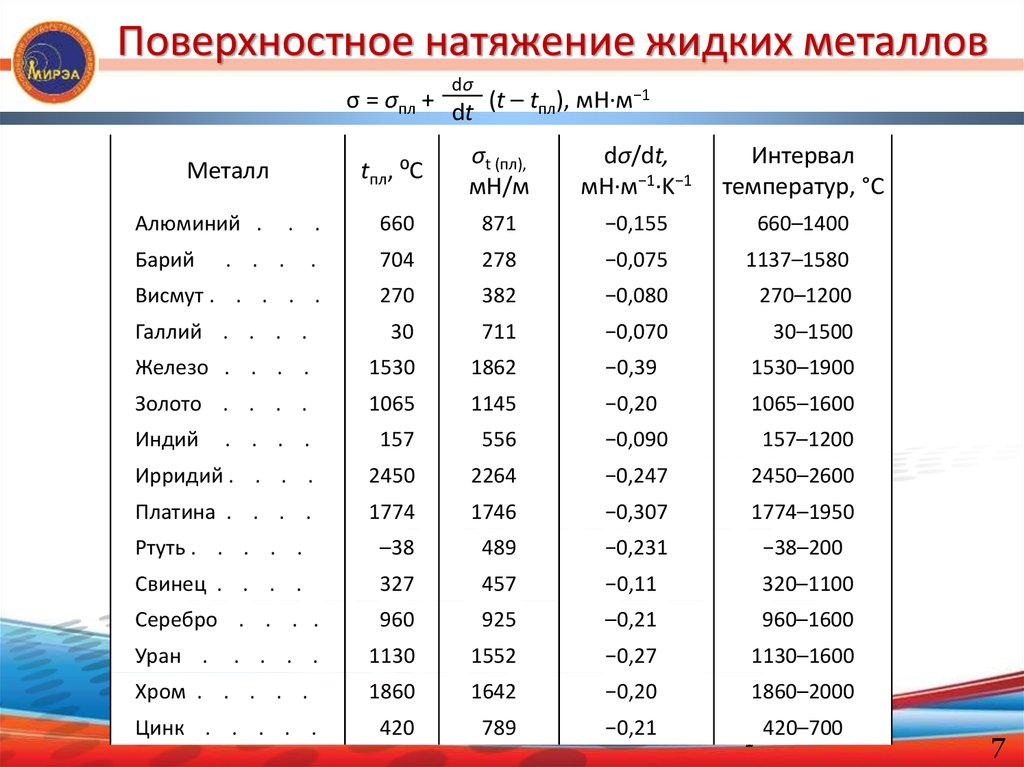
Поверхностное натяжение жидких металловdσ
σ = σпл + dt (t – tпл), мН·м−1
tпл, ⁰C
σt (пл),
мН/м
dσ/dt,
мН·м−1·K−1
Интервал
температур, °C
. .
660
871
−0,155
660–1400
.
704
278
−0,075
1137–1580
Висмут . . . . .
270
382
−0,080
270–1200
Галлий . . . .
30
711
−0,070
30–1500
Железо . . . .
1530
1862
−0,39
1530–1900
Золото . . . .
1065
1145
−0,20
1065–1600
. . . .
157
556
−0,090
157–1200
Ирридий . . . .
2450
2264
−0,247
2450–2600
Платина . . . .
1774
1746
−0,307
1774–1950
Ртуть . . . . .
–38
489
−0,231
−38–200
Свинец . . . .
327
457
−0,11
320–1100
Серебро . . . .
960
925
–0,21
960–1600
1130
1552
−0,27
1130–1600
Хром . . . . .
1860
1642
−0,20
1860–2000
Цинк . . . . .
420
789
−0,21
7 420–700
Металл
Алюминий .
Барий
Индий
Уран .
. . .
. . . .
7
8.
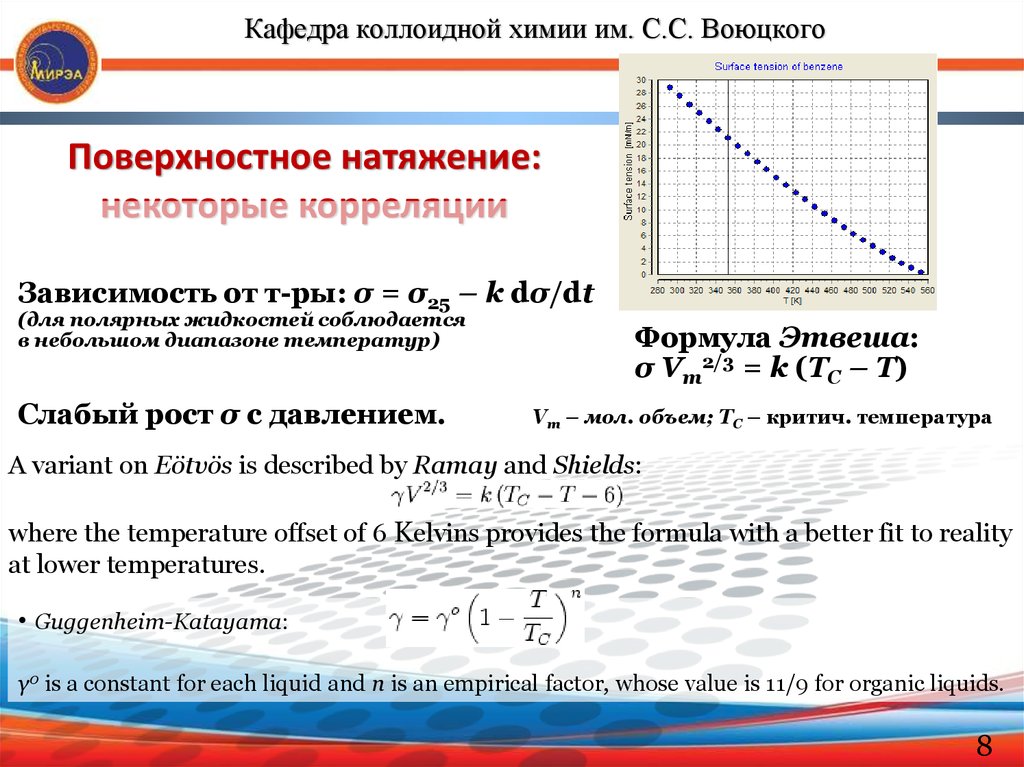
Кафедра коллоидной химии им. С.С. ВоюцкогоПоверхностное натяжение:
некоторые корреляции
Зависимость от т-ры: σ = σ25 – k dσ/dt
(для полярных жидкостей соблюдается
в небольшом диапазоне температур)
Слабый рост σ с давлением.
Формула Этвеша:
σ Vm2/3 = k (TC – T)
Vm – мол. объем; TC – критич. температура
A variant on Eötvös is described by Ramay and Shields:
where the temperature offset of 6 Kelvins provides the formula with a better fit to reality
at lower temperatures.
• Guggenheim-Katayama:
γ0 is a constant for each liquid and n is an empirical factor, whose value is 11/9 for organic liquids.
8
9.
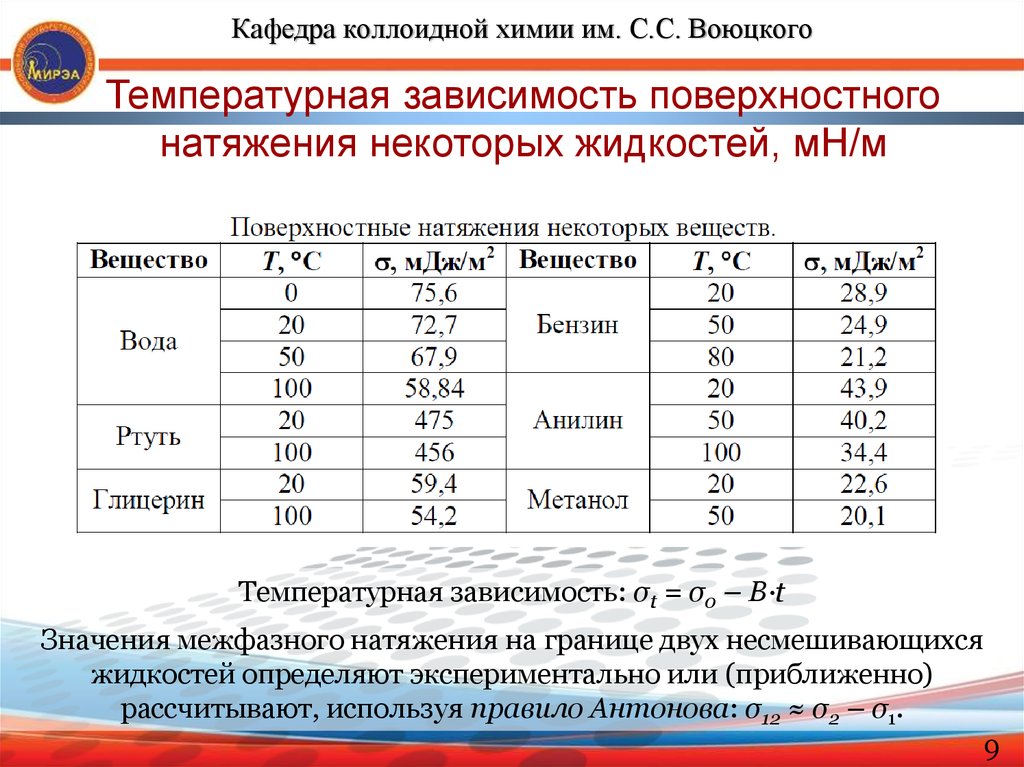
Кафедра коллоидной химии им. С.С. ВоюцкогоТемпературная зависимость поверхностного
натяжения некоторых жидкостей, мН/м
Температурная зависимость: σt = σ0 – B·t
Значения межфазного натяжения на границе двух несмешивающихся
жидкостей определяют экспериментально или (приближенно)
рассчитывают, используя правило Антонова: σ12 ≈ σ2 – σ1.
9
10.
Кафедра коллоидной химии им. С.С. ВоюцкогоМетоды измерения поверхностного натяжения
Проблема выбора
Методы – статические, полустатические, динамические
Статические методы:
o Метод капиллярного поднятия
o Методы висячей и лежачей капли
o Метод втягивания пластинки
(Вильгельми) или стержня
o Метод вращающейся капли (М/В)
Полустатические методы:
o Метод отрыва кольца (Дю-Нуи) или
серьги
o Метод, базирующийся на анализе
формы капли (пузырька)
Применимость некоторых методов в
зависимости от стоящих задач.
Данные из статьи Р. Миллера с сотр. SÖFW J. Рус.
версия (2004) No. 4, 51-55.
Динамические методы:
o Метод объема (счета) капель
o Метод максимального давления в
пузырьке
o Метод колеблющейся струи
11.
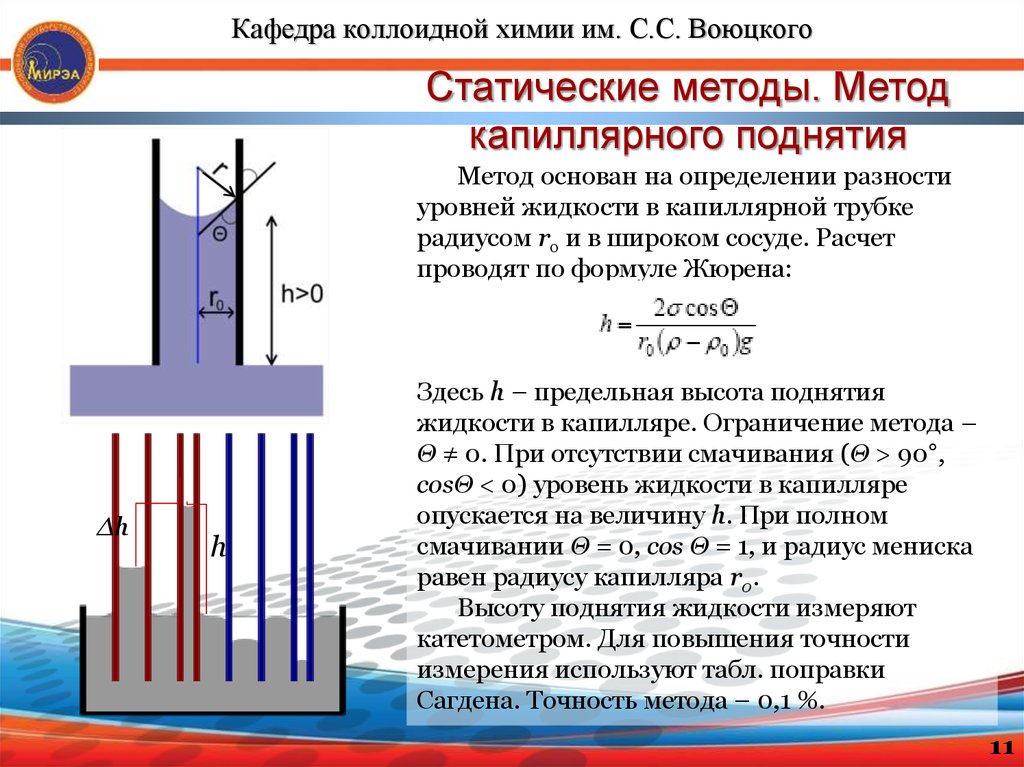
Кафедра коллоидной химии им. С.С. ВоюцкогоСтатические методы. Метод
капиллярного поднятия
Метод основан на определении разности
уровней жидкости в капиллярной трубке
радиусом rо и в широком сосуде. Расчет
проводят по формуле Жюрена:
Δh
h
Здесь h – предельная высота поднятия
жидкости в капилляре. Ограничение метода –
Θ ≠ 0. При отсутствии смачивания (Θ > 90°,
cosΘ < 0) уровень жидкости в капилляре
опускается на величину h. При полном
смачивании Θ = 0, cos Θ = 1, и радиус мениска
равен радиусу капилляра r0.
Высоту поднятия жидкости измеряют
катетометром. Для повышения точности
измерения используют табл. поправки
Сагдена. Точность метода – 0,1 %.
11
12.
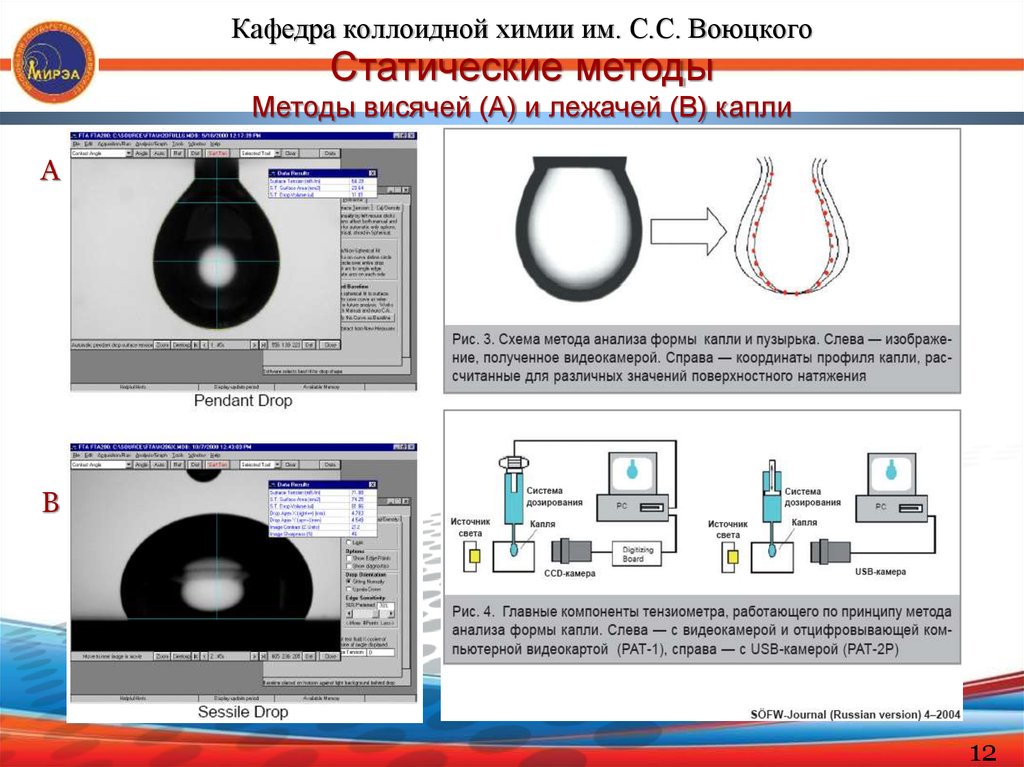
Кафедра коллоидной химии им. С.С. ВоюцкогоСтатические методы
Методы висячей (А) и лежачей (В) капли
А
В
12
13.
Кафедра коллоидной химии им. С.С. ВоюцкогоМетоды висячей капли и лежачей капли
Эти статические методы особенно удобны для определения σжг и σжж
очень вязких жидкостей, в т.ч. расплавов полимеров. Другие преимущества:
малый расход вещества
легкость контроля температуры
независимость результатов измерения от краевого угла (висячая капля).
Теория метода хорошо разработана и базируется на уравнении
капиллярной статистики, которое описывает форму капли как фигуры
вращения.
Метод висячей капли: σ = d2mΔρg/H
где: Δρ – разность плотностей жидкости и окружающей ее среды (газа или
др. жидкости); Н – безразмерный параметр, который находят в таблицах
Бешфорда-Адамса-Штауфера в зависимости от величины S = dS/dm
(соотношения диаметра шейки и максимального диаметра капли).
Метод лежачей капли: σ = 0,5Δρgh2
Для крупных капель; h – расстояние от максимального сечения до вершины
капли.
13
14.
Кафедра коллоидной химии им. С.С. ВоюцкогоМетод веса (объема) капель
Динамический метод веса (объема) капель,
упрощенный вариант –
сталагмометрический метод (счета капель
– динамический/полустатический).
Масса капли W, сформировавшейся на
конце трубки, в момент отрыва
пропорциональна силе поверхностного
натяжения σ, действующей по периметру
капли:
W = 2πKrσ,
где К = f (r/V1/3)– табл. поправка ГаркинсаБрауна (см., например: Русанов А.И.,
Прохоров В.А. Межфазная тензиомертрия.
– СПб: Химия, 1994, с. 258-278).
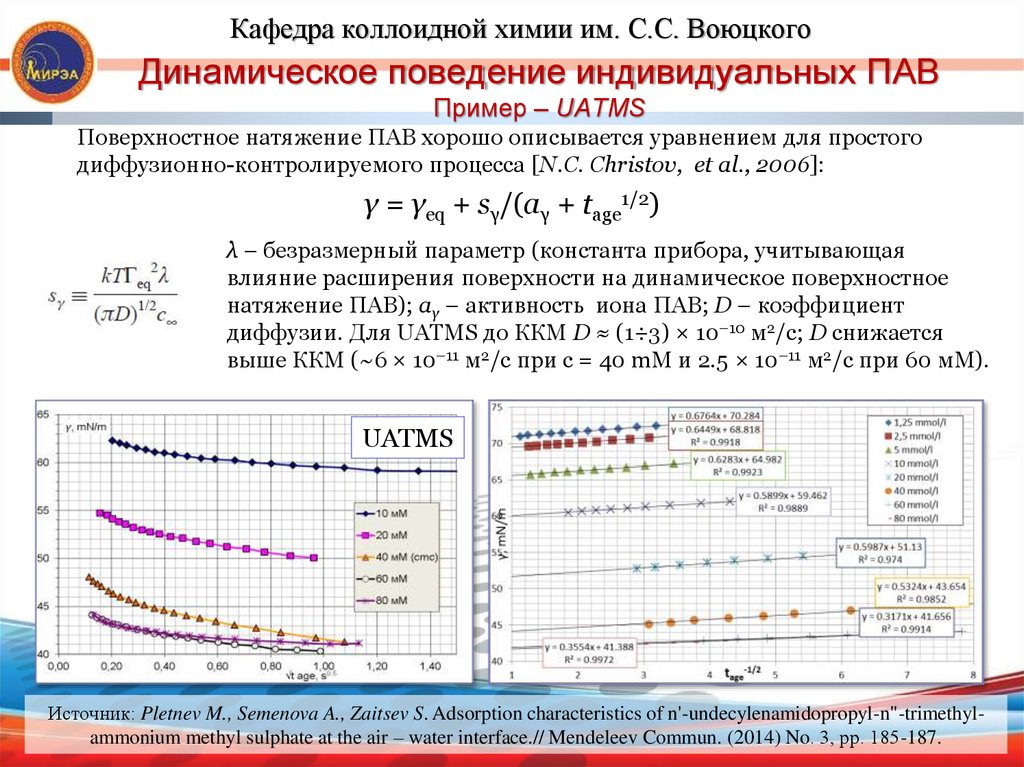
15. Динамическое поведение индивидуальных ПАВ Пример – UATMS
Кафедра коллоидной химии им. С.С. ВоюцкогоДинамическое поведение индивидуальных ПАВ
Пример – UATMS
Поверхностное натяжение ПАВ хорошо описывается уравнением для простого
диффузионно-контролируемого процесса [N.C. Christov, et al., 2006]:
γ = γeq + sγ/(aγ + tage1/2)
λ – безразмерный параметр (константа прибора, учитывающая
влияние расширения поверхности на динамическое поверхностное
натяжение ПАВ); аγ – активность иона ПАВ; D – коэффициент
диффузии. Для UATMS до ККМ D ≈ (1÷3) × 10–10 м2/с; D снижается
выше ККМ (~6 × 10–11 м2/с при с = 40 mM и 2.5 × 10–11 м2/с при 60 мM).
UATMS
Источник: Pletnev M., Semenova A., Zaitsev S. Adsorption characteristics of n'-undecylenamidopropyl-n"-trimethylammonium methyl sulphate at the air – water interface.// Mendeleev Commun. (2014) No. 3, рр. 185-187.
16.
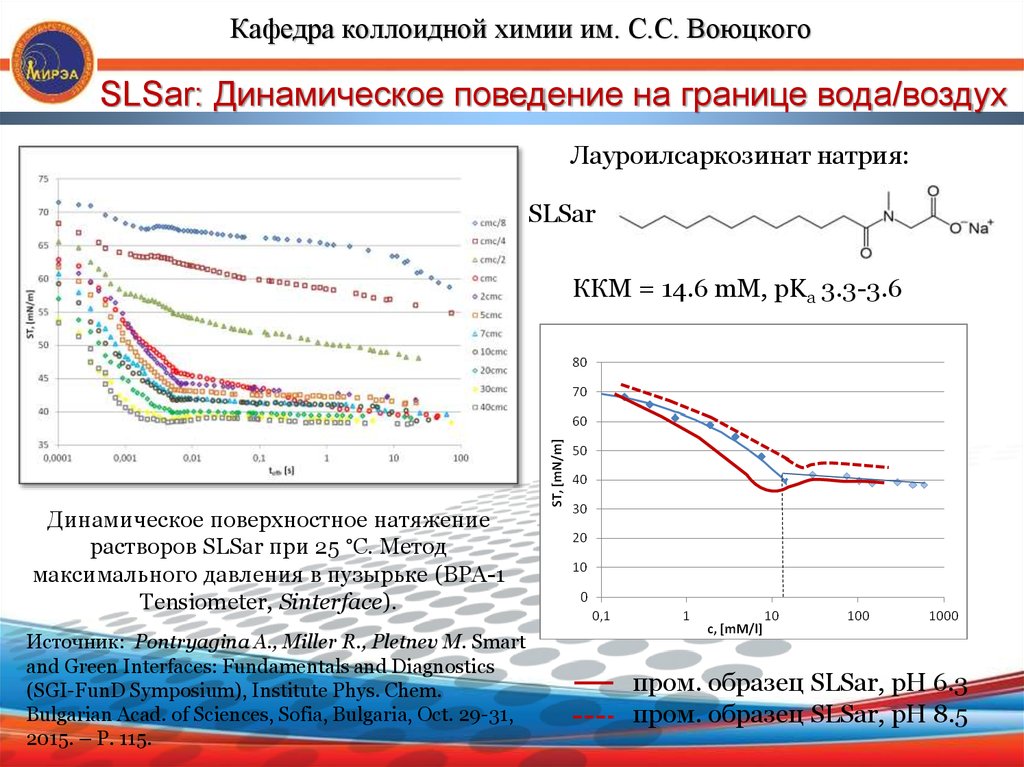
Кафедра коллоидной химии им. С.С. ВоюцкогоSLSar: Динамическое поведение на границе вода/воздух
Лауроилсаркозинат натрия:
SLSar
ККМ = 14.6 mM, pKa 3.3-3.6
Динамическое поверхностное натяжение
растворов SLSar при 25 °C. Метод
максимального давления в пузырьке (BPA-1
Tensiometer, Sinterface).
Источник: Pontryagina A., Miller R., Pletnev M. Smart
and Green Interfaces: Fundamentals and Diagnostics
(SGI-FunD Symposium), Institute Phys. Chem.
Bulgarian Acad. of Sciences, Sofia, Bulgaria, Oct. 29-31,
2015. – P. 115.
пром. образец SLSar, рН 6.3
пром. образец SLSar, рН 8.5
17. ДИНАМИЧЕСКОЕ ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ КАК КРИТЕРИЙ В ВЫБОРЕ ПАВ
Кафедра коллоидной химии им. С.С. ВоюцкогоДИНАМИЧЕСКОЕ ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ
КАК КРИТЕРИЙ В ВЫБОРЕ ПАВ
• Критерий эффективности смачивателей
• Роль кинетики установления
поверхностного натяжения в
практически важных процессах
Процессы смачивания в стирке, очистке
тв. поверхностей
Струйная печать
Получение разных покрытий (лакокрасочные, гальванические, ламинаты…)
Пеногенерация
Средства защиты растений
Диспергирование порошков и пигментов
Атомизация и эмульгирование жидкостей
18.
Кафедра коллоидной химии им. С.С. ВоюцкогоДинамическое натяжение – критерий
эффективности ПАВ-смачивателей
На примере смачивателя Surfynol 104
Surfynol 104
19.
Кафедра коллоидной химии им. С.С. ВоюцкогоПолустатические методы. Метод отрыва кольца (А)
и метод отрыва или втягивания цилиндра (В)
А
В
Тензиометр Дю-Нуи: измерение
усилия отрыва кольца, серьги или
стержня
19
20.
Кафедра коллоидной химии им. С.С. ВоюцкогоПрибор для измерения поверхностного
натяжения и краевого угла смачивания
20
21.
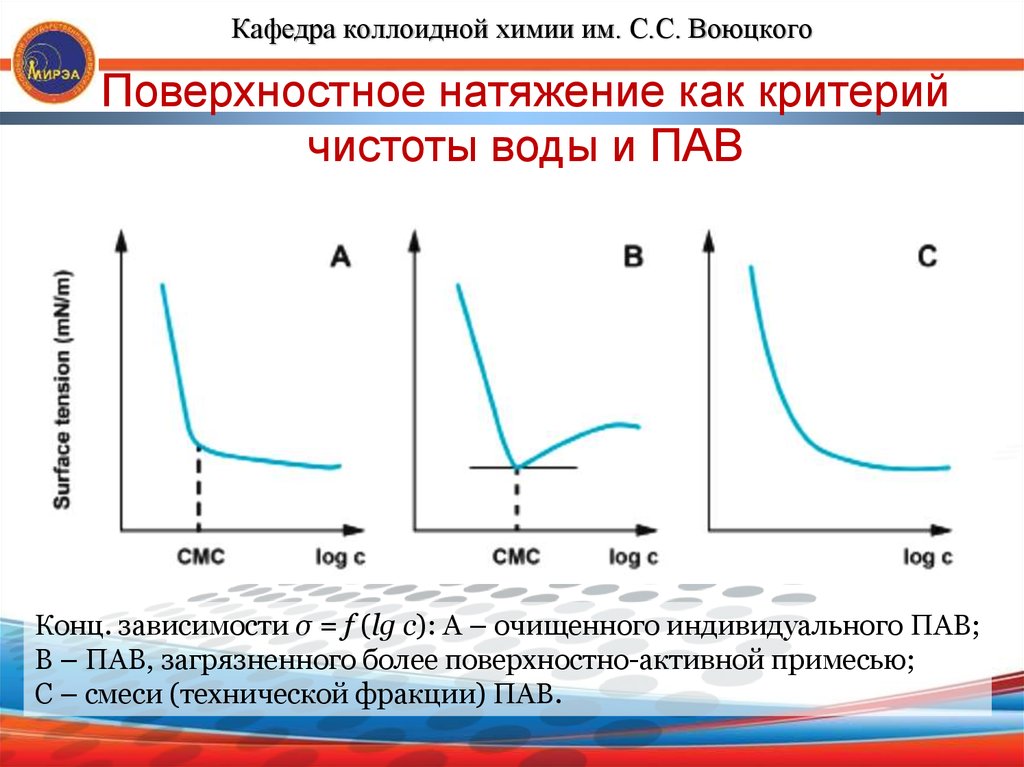
Кафедра коллоидной химии им. С.С. ВоюцкогоПоверхностное натяжение как критерий
чистоты воды и ПАВ
Конц. зависимости σ = f (lg c): А – очищенного индивидуального ПАВ;
В – ПАВ, загрязненного более поверхностно-активной примесью;
С – смеси (технической фракции) ПАВ.
22.
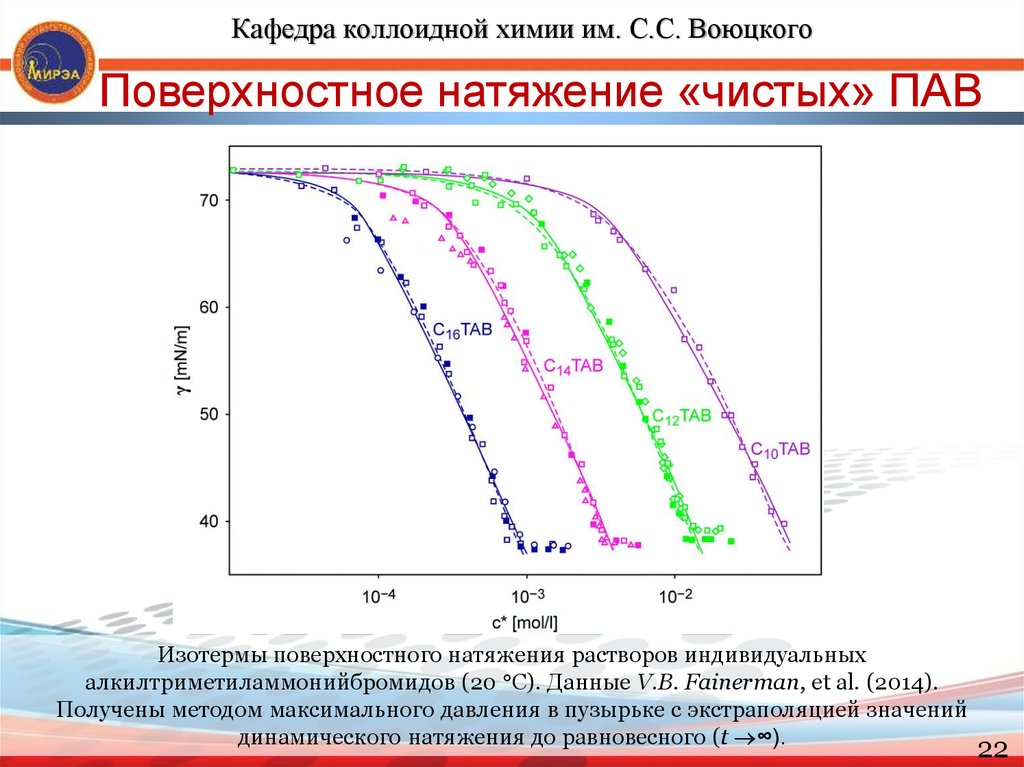
Кафедра коллоидной химии им. С.С. ВоюцкогоПоверхностное натяжение «чистых» ПАВ
Изотермы поверхностного натяжения растворов индивидуальных
алкилтриметиламмонийбромидов (20 С). Данные V.B. Fainerman, et al. (2014).
Получены методом максимального давления в пузырьке с экстраполяцией значений
динамического натяжения до равновесного (t ∞).
22
23.
Кафедра коллоидной химии им. С.С. ВоюцкогоМетод вращающейся капли – для ультранизких
межфазных натяжений
Для измерения очень малых значений – статический метод вращающейся
капли. Капля легкой фазы (обычно, масло) вводится в толщу более тяжелой
фазы. В состоянии покоя капля имеет форму шара.
Трубка вращается вдоль своей оси с определенной скоростью (частотой ω).
При увеличении скорости вращения молекулы межфазного слоя
подвергаются действию центробежных сил, направленных перпендикулярно
оси вращения капилляра. Силы межфазного натяжения уравновешиваются
центробежной силой, а молекулы в межфазном слое размещаются по
поверхности цилиндра с радиусом r. Капля вытягивается вдоль оси вращения
до достижения равновесия.
Принцип вращающейся капли используется, например, в тензиометре
SITE100. Диапазон измерения межфазного натяжения – от 10–6 до 50 мН/м.
23
24.
Лекция 11-12. Дисперсии и коллоиды в освоении, эксплуатации нефтяных игазовых месторождений
Пример использования метода вращающейся капли
Тестирование систем для заводнения нефтеносных пластов
DataPhysics Instruments GmbH
24
25. Рекомендуемая литература
Кафедра коллоидной химии им. С.С. ВоюцкогоРекомендуемая литература
Сумм Б.Д. Коллоидная химия, 4-е изд. – М.: ИЦ
«Академия», 2014. – 239 с.
Щукин Е.Д., Перцов А.В., Амелина Е.А.
Коллоидная химия, 3-е изд. М.: Высшая школа,
2004.
Русанов А.И., Прохоров В.А. Межфазная
тензиометрия. – СПб: Химия, 1994, 400 с.
Григорьев Г.А., Киселев В.Я., Копытин В.С.
Методы определения поверхностного натяжения
жидкостей и энергии твердой поверхности. Уч.
пособие. М.: МИТХТ, 2005, 69 с.
Handbook of Surface and Interface Analysis,
Methods for Problem Solving, 2nd Edn./ Ed. by J.C.
Riviere, S. Myhra. – Boca Raton – London: CRC
Press, 2009, 682 pp.
25
26. Пожалуйста, задавайте вопросы
МОСКОВСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТКафедра коллоидной химии им. С.С. Воюцкого
Пожалуйста, задавайте вопросы
Москва, 2016
26
















 Химия
Химия








