Похожие презентации:
Мультифакториальные заболевания
1. Лекция Мультифакториальные заболевания
2. Классификация патологии человека в зависимости от значимости генетических и средовых факторов
• Заболевания, связанные с изменением генетическогоматериала: моногенные менделирующие заболевания,
хромосомные синдромы, моногенные заболевания с
нетрадиционным типом наследования;
• Мультифакториальные заболевания (многофакторные) –
развитие определяется взаимодействием генотипа и
факторов окружающей среды: хронические
неинфекционные и инфекционные заболевания и ВПР.
• Заболевания, обусловленные действием внешнесредовых
факторов: травмы, ожоги, острые инфекционные болезни;
3. Классификация МФЗ
• Врожденные пороки развития – возникают внутриутробно врезультате взаимодействия многочисленных генетических,
неблагоприятных материнских факторов или факторов
среды (тератогены) в период развития плода: расщелина
губы и нёба, анэнцефалия, гидроцефалия, косолапость,
вывих бедра, изолированные пороки развития органов и
др.;
• Болезни с наследственным предрасположеннием –
возникают в любом периоде постнатального развития:
сердечно-сосудистые, бронхолегочные, психические, ЖКТ,
хронические инфекционные заболевания и
злокачественные новообразования и др.
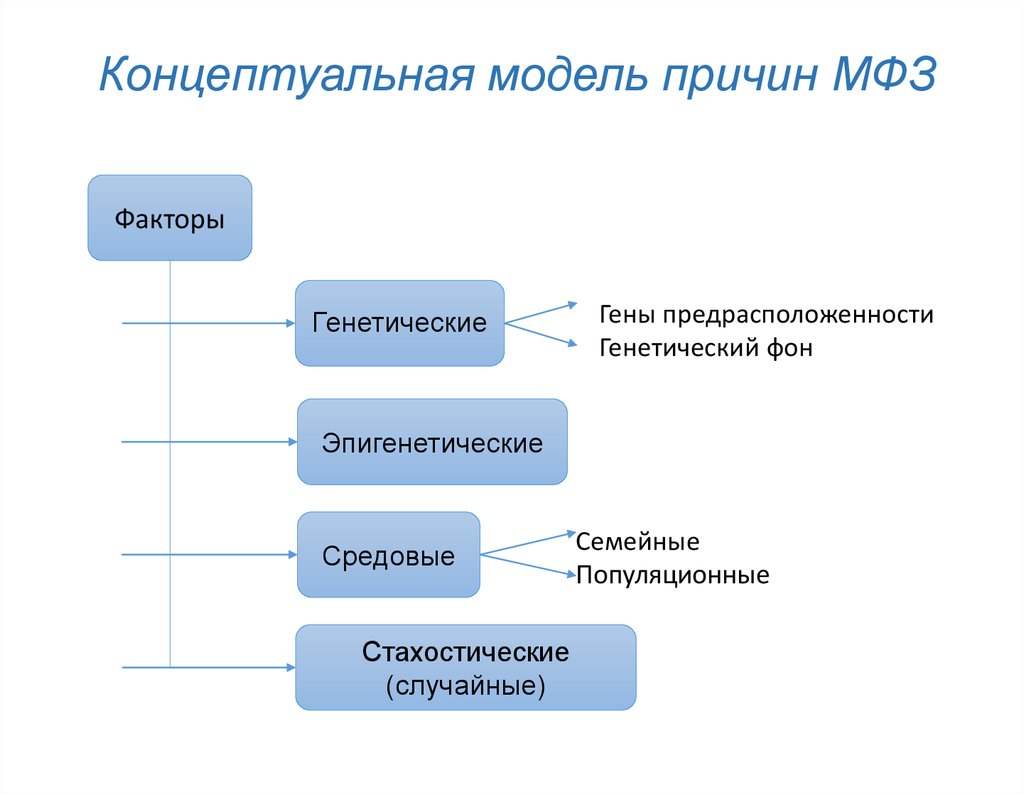
4. Концептуальная модель причин МФЗ
ФакторыГенетические
Гены предрасположенности
Генетический фон
Эпигенетические
Средовые
Стахостические
(случайные)
Семейные
Популяционные
5. Семейное накопление МФЗ
• Метод случай-контроль: сравнивают частоту, с которой болезньобнаруживают в родословной больных, с таковой в специально
подобранных контрольных группах или с заболеваемостью в общей
популяции;
• Общее свойство МФЗ – склонность к более ранней манифестации
первых признаков болезни, более тяжелому течению и исходам у
пациентов с отягощенной наследственностью по конкретному
заболеванию в сравнении с людьми с благоприятной
наследственностью.
Клиническая характеристика ИБС у больных с отягощенным (I) и
неотягощенным анамнезом (II)
6. Семейное накопление МФЗ
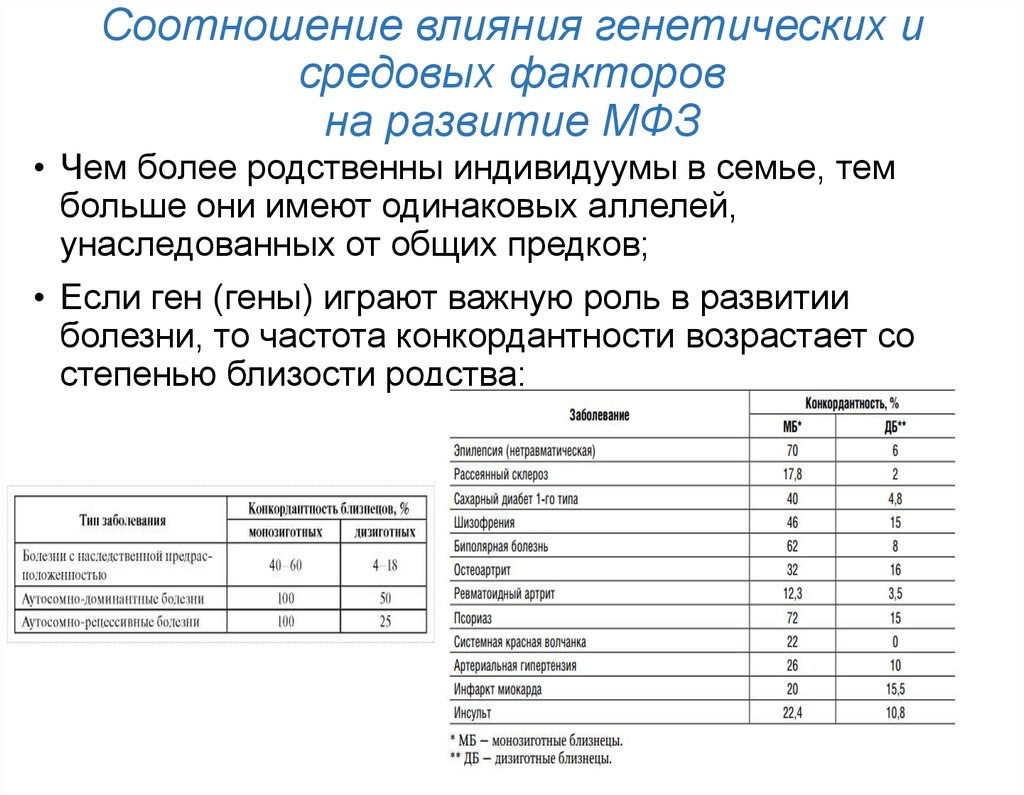
7. Соотношение влияния генетических и средовых факторов на развитие МФЗ
• Чем более родственны индивидуумы в семье, тембольше они имеют одинаковых аллелей,
унаследованных от общих предков;
• Если ген (гены) играют важную роль в развитии
болезни, то частота конкордантности возрастает со
степенью близости родства;
8. Критерии МФЗ
• Различия популяционной и семейной частоты;• Риск развития заболевания у ребенка зависит от состояния
здоровья родителей;
• Если в популяции МФЗ среди людей разного пола (половой
диморфизм) регистрируют с разной частотой, то риск
заболевания выше в семьях пробандов реже поражаемого
пола, и наоборот;
• Если в двух сравниваемых популяциях МФЗ регистрируют с
разной частотой, то риск для родственников выше, если
семья принадлежит к более поражаемой популяции;
• Риск заболевания у родственников зависит от степени
тяжести болезни у пробанда;
• Изменение повторного риска в зависимости от числа
больных в семье;
• Роль кровного родства.
9. Генетика количественных признаков МФЗ
Корреляция (r) – степень сходства между родственниками по количественному
признаку;
Если корреляция между родственниками соответствует пропорции общих генов –
признак полностью детерминирован наследственностью;
Для количественных признаков r редко совпадает с теоретически ожидаемыми
величинами;
Корреляция конкретного физиологического показателя между родственниками
отражает влияние как наследственности, так и общих внешнесредовых факторов;
Наследуемость (h2) – доля общей фенотипической изменчивости количественного
признака, обусловленной вкладом генетических факторов:
h2 = 2r – для родственников I степени родства
h2 = 4r – для родственников II степени родства
Фенотипы
МФЗ
Качественные
(существовани
е/отсутствие
заболевания)
Количественные
(физиологические
и биохимические
параметры)
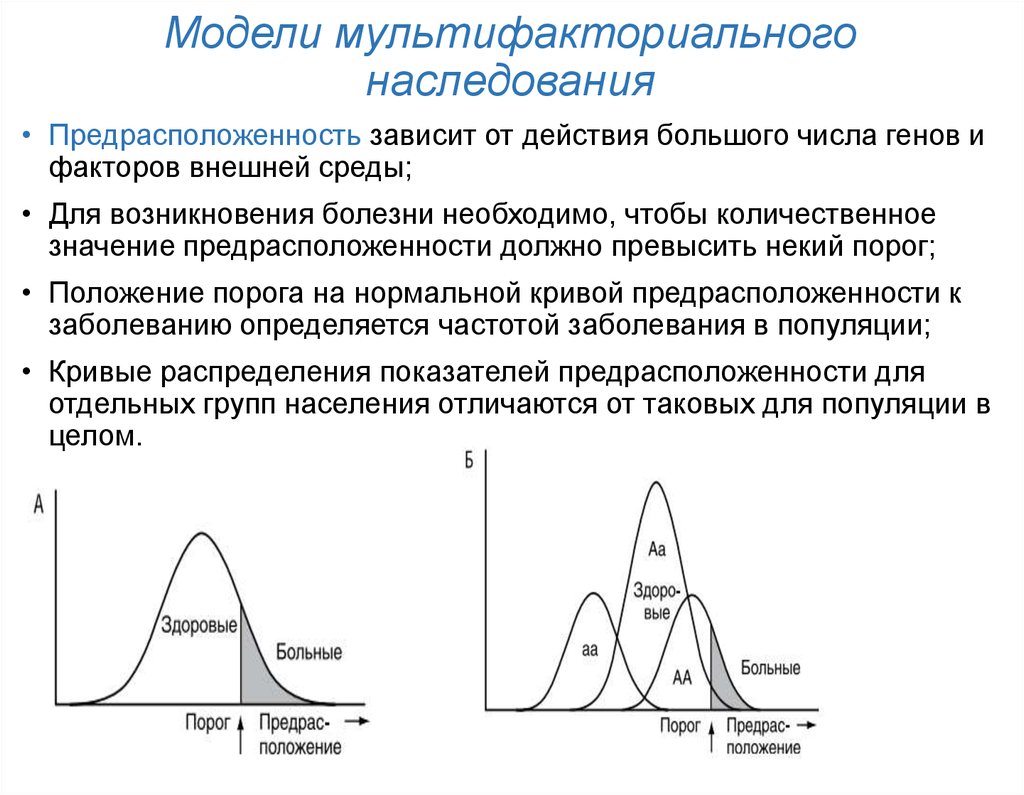
10. Модели мультифакториального наследования
• Характер распределения величин количественного признака впопуляции – кривая нормального распределения;
• Общая изменчивость величины признака в популяции – общая
фенотипическая изменчивость;
• Изменчивость определяется действием многочисленных
внешнесредовых и генетических факторов, каждый из которых
вносит в нее относительно небольшой вклад, обе группы факторов
независимы друг от друга, а взаимодействие внутри них
аддитивно.
11. Модели мультифакториального наследования
• Предрасположенность зависит от действия большого числа генов ифакторов внешней среды;
• Для возникновения болезни необходимо, чтобы количественное
значение предрасположенности должно превысить некий порог;
• Положение порога на нормальной кривой предрасположенности к
заболеванию определяется частотой заболевания в популяции;
• Кривые распределения показателей предрасположенности для
отдельных групп населения отличаются от таковых для популяции в
целом.
12. Генетическая гетерогенность МФЗ
• Генетическая гетерогенность МФЗ – существование внутриклинического континуума болезни двух и более форм,
наследуемых независимо друг от друга;
• r = 0 между разными клиническими формами одного и того
же МФЗ;
• Сахарный диабет 1-го и 2-го типа – генетическая
самостоятельность форм.
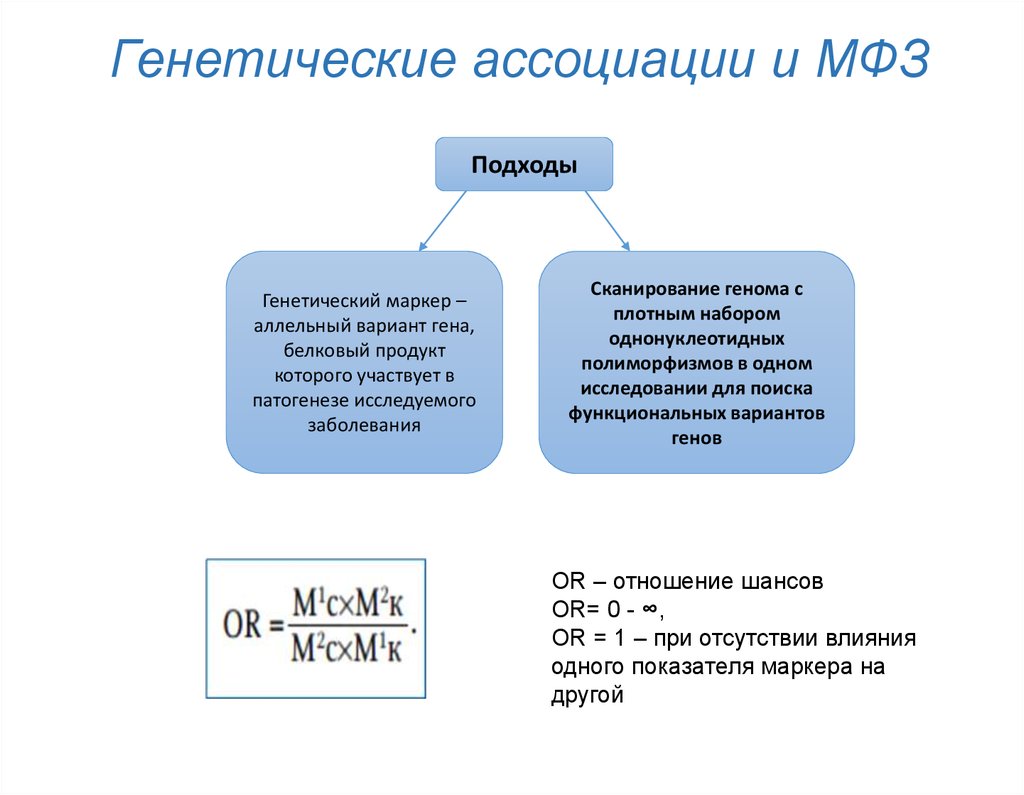
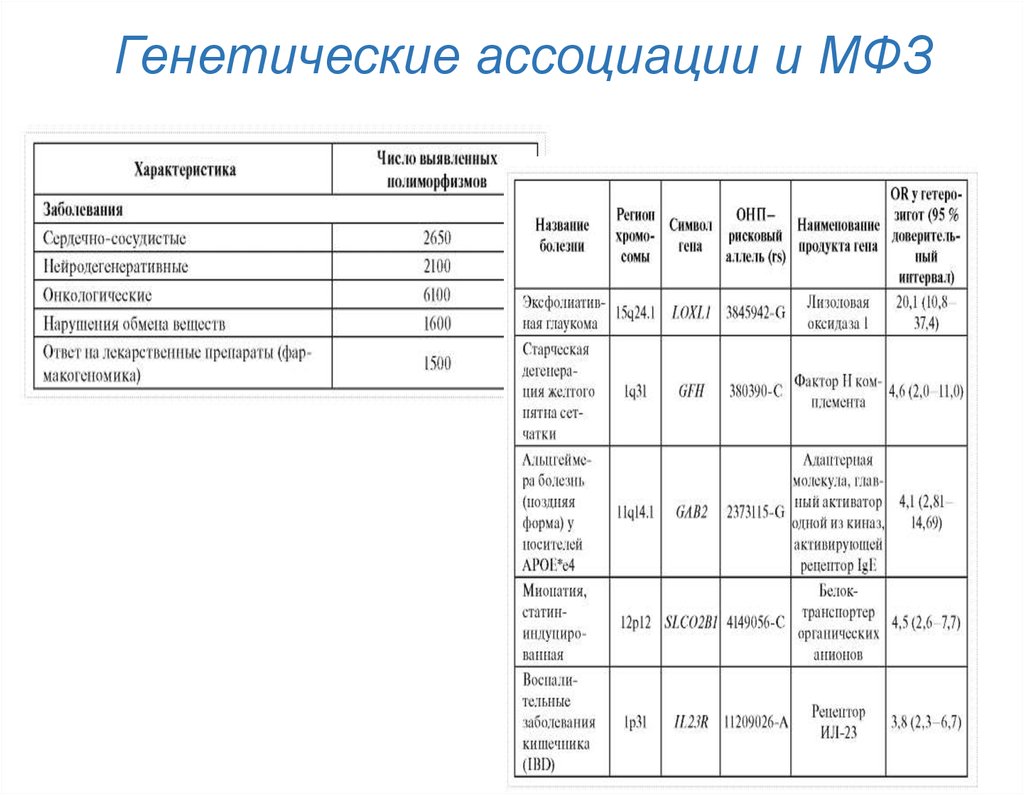
13. Генетические ассоциации и МФЗ
ПодходыГенетический маркер –
аллельный вариант гена,
белковый продукт
которого участвует в
патогенезе исследуемого
заболевания
Сканирование генома с
плотным набором
однонуклеотидных
полиморфизмов в одном
исследовании для поиска
функциональных вариантов
генов
OR – отношение шансов
OR= 0 - ∞,
OR = 1 – при отсутствии влияния
одного показателя маркера на
другой
14. Генетические ассоциации и МФЗ
Особенности обнаруживаемых генетических ассоциаций:1)Большая часть генетических ассоциаций вызывает эффекты
небольшой величины (риск 1,1–1,5, т.е. 10–15% увеличения
вероятности развития заболевания). Любой отдельный
полиморфизм гена обычно объясняет только 1–8% общего риска
заболевания в популяции, т.е. добавочный предсказательный
эффект отдельных генетических полиморфизмов небольшой;
2)У индивидуумов-носителей комбинаций (ансамблей) аллельных
вариантов генов отмечают заметное увеличение риска
возникновения заболеваний и вероятности их осложненного
течения. Расчеты показывают, что аддитивный эффект нескольких
таких полиморфизмов может составлять до 20–70% общего риска,
обусловленного генетическими факторами;
3)Установлено, что некоторые полиморфизмы генов оказываются
общими для совершенно разных по патогенезу МФЗ, а тем более
для болезней, демонстрирующих тенденцию к возникновению у
пациента и его ближайших родственников.
15. Генетические ассоциации и МФЗ
16. Генетика коморбидных состояний
• Полипатии – множественность болезней у одного пациента (коморбидность);• Коморбидность составляет 17%, для метаболических синдромов – 31%;
Соседство болезней – случайный характер сочетания
болезней
Полипатии
Синтропия (семейство болезней) – природновидовое сочетание двух и более патологических
состояний (нозологий, синдромов) у индивидуума и
его ближайших родственников, неслучайное и имеющее эволюционно-генетическую основу
• Дистропия – патологические явления, которые редко сочетаются у одного
человека, упорно не ассоциируются и взаимно отталкиваются;
• Синтропные гены — набор функционально взаимодействующих
корегулируемых генов, локализованных во всем пространстве генома
человека и вовлеченных в общий для конкретной синтропии биохимический
или иной путь;
• В том случае, когда регуляторные связи складываются так, что их
особенностью служат альтернативные отношения, объясняющие
взаимоисключения на клиническом уровне таких фенотипов (дистропии),
гены называют дистропными в отношении соответствующих фенотипов.
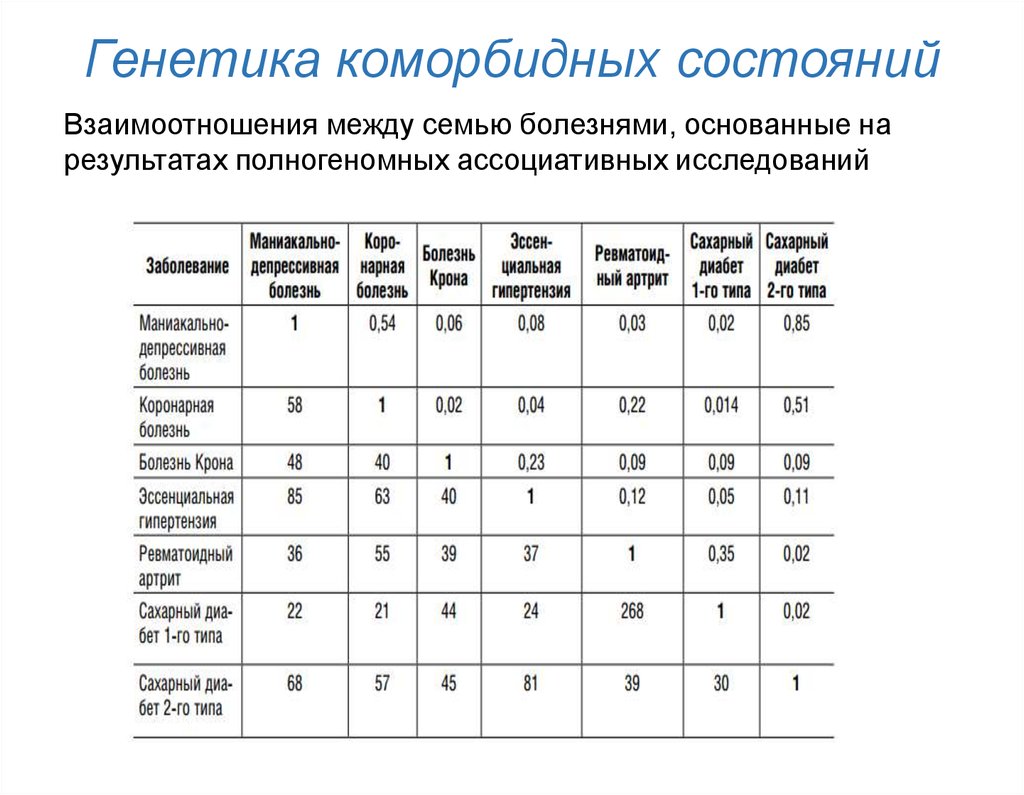
17. Генетика коморбидных состояний
Взаимоотношения между семью болезнями, основанные нарезультатах полногеномных ассоциативных исследований
18. Идентификация генов предрасположенности к МФЗ
• Характеристика структуры генов и их многочисленных аллельныхвариантов;
• Определение точной локализации генов на определенной
хромосоме.
19. Идентификация генов предрасположенности к МФЗ
• Анализ сцепления - метод генетического картирования,основанный на прослеживании косегрегации генов при
передаче от родителей к потомкам в ряду поколений.
Он состоит в проверке сегрегации признаков и
генетических маркеров в родословной на соответствие
определенной модели наследования;
• При этом рассчитывают шансы (вероятности) за и
против сцепления в конкретной семье;
• Анализ картирования простых моногенных признаков;
• Зависит от: размера родословной, типа наследования,
уровня пенетрантности, распределения генотипов в
популяции;
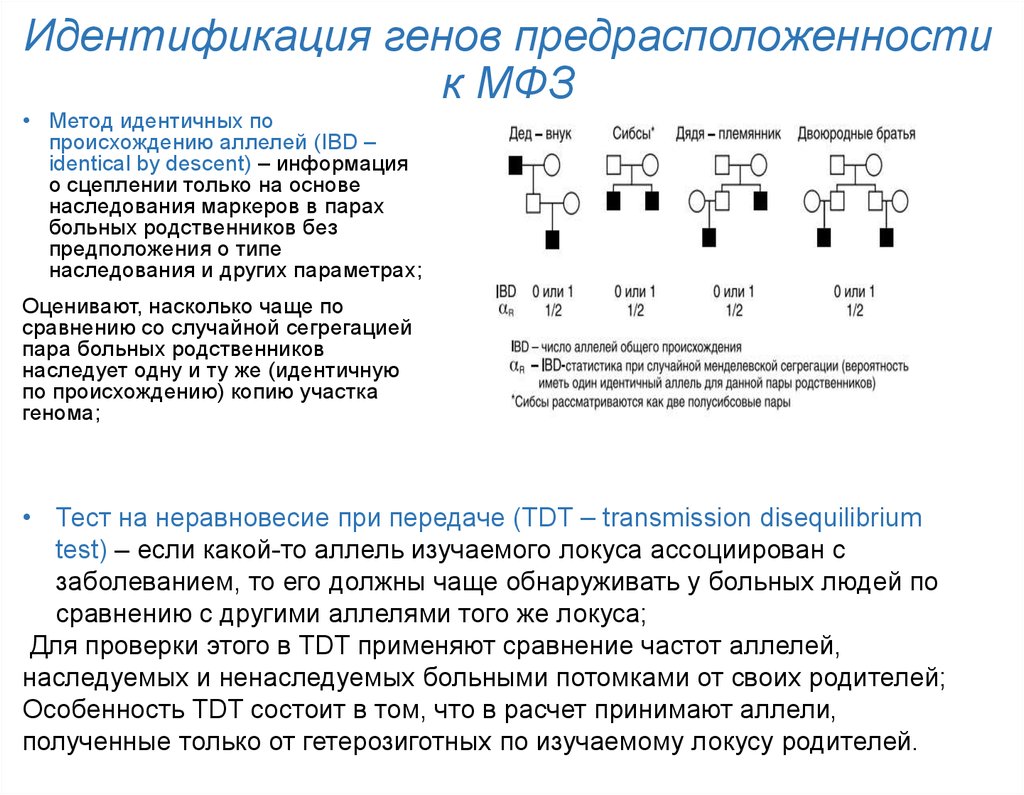
20. Идентификация генов предрасположенности к МФЗ
• Метод идентичных попроисхождению аллелей (IBD –
identical by descent) – информация
о сцеплении только на основе
наследования маркеров в парах
больных родственников без
предположения о типе
наследования и других параметрах;
Оценивают, насколько чаще по
сравнению со случайной сегрегацией
пара больных родственников
наследует одну и ту же (идентичную
по происхождению) копию участка
генома;
• Тест на неравновесие при передаче (TDT – transmission disequilibrium
test) – если какой-то аллель изучаемого локуса ассоциирован с
заболеванием, то его должны чаще обнаруживать у больных людей по
сравнению с другими аллелями того же локуса;
Для проверки этого в TDT применяют сравнение частот аллелей,
наследуемых и ненаследуемых больными потомками от своих родителей;
Особенность TDT состоит в том, что в расчет принимают аллели,
полученные только от гетерозиготных по изучаемому локусу родителей.
21. Гипотезы рисковых аллелей
CD/CV (common disease/common variant — распространенная
болезнь/распространенный вариант гена) —значительную часть аллелей
подверженности МФЗ составляют аллели, существовавшие до начала глобального
расселения человечества, или те из них, которые прошли положительный отбор;
CD/RA (common disease/rare allele — распро-страненная болезнь/редкий аллель) —
основана на том, что в основном предрасположенность к МФЗ определяет избыток
у индивидуума редких рисковых аллелей генов метаболических и сигнальных
путей, ответственных за формирование соответствующего болезненного фенотипа.
22. Идентификация генетических вариантов в соответствии с частотой рисковых аллелей и силой генетических эффектов
• Частота генетического варианта (мутация,полиморфизм) находится в обратной зависимости от
эффектов гена: частые генетические вари- анты в
популяции обладают малыми эффектами по сравнению
с редкими.
23. Гены предрасположенности к атеросклерозу
Гены предрасположенности к
атеросклерозу
Атеросклероз —
многофакторное заболевание
артерий крупного и среднего
диаметра, развивающееся в
результате сложного
взаимодействия различных
генетических и
внешнесредовых факторов;
• В целом наследственная
компонента подверженности к
атеросклерозу в большинстве
популяций варьирует в
пределах 40–60% .
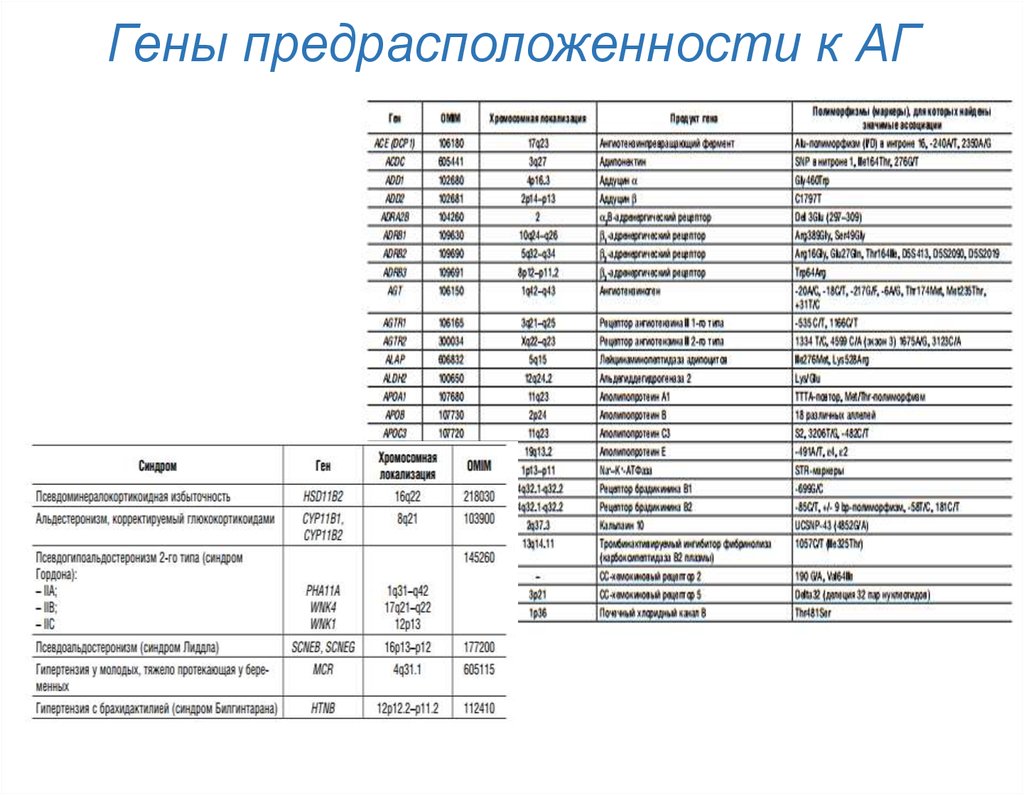
24. Гены предрасположенности к АГ
25. Изучение генетики МФЗ
• Понимание патогенетических путей развитиязаболевания
• Разработка генетических тестов, которые существенно
улучшат качество медицинской помощи населению,
обусловленное своевременной диагностикой,
прогнозированием течения и лечением.


















 Биология
Биология








