Похожие презентации:
Спирты. Классификация спиртов
1. Спирты
Выполнил ученик 10<А>класса Ведерников
Максим
2. Спирты
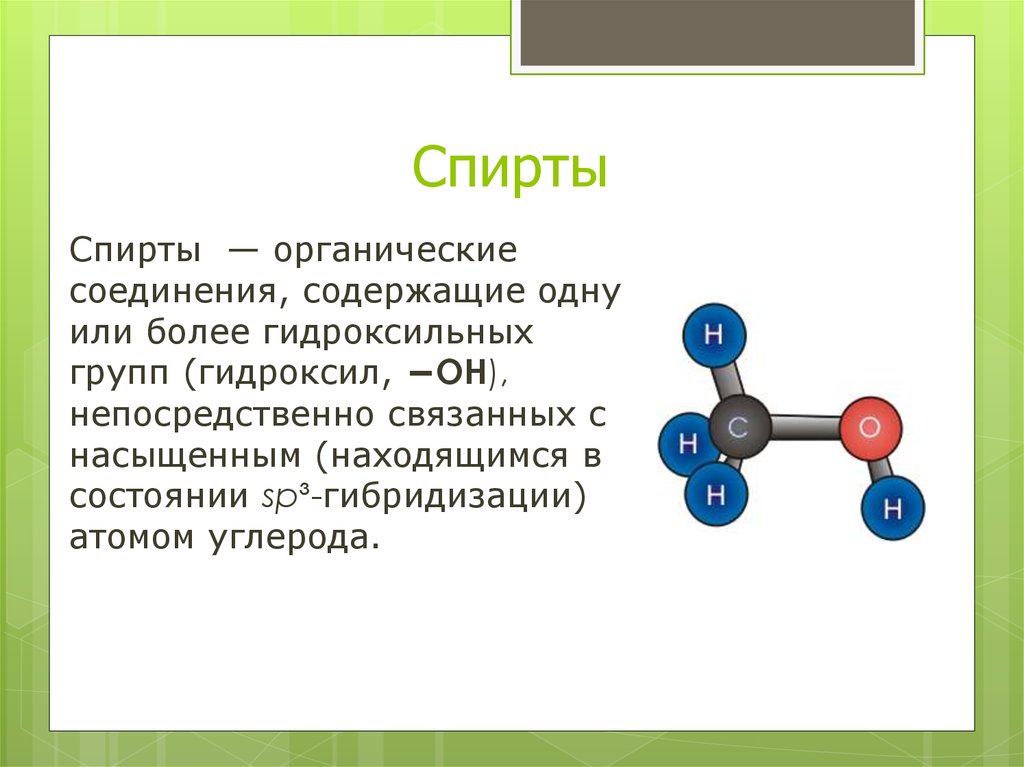
Спирты — органическиесоединения, содержащие одну
или более гидроксильных
групп (гидроксил, −OH),
непосредственно связанных с
насыщенным (находящимся в
состоянии sp³-гибридизации)
атомом углерода.
3. Классификация спиртов
По числу гидроксильных групп:Одноатомные
двухатомные
трёхатомные
(гликоли)
4.
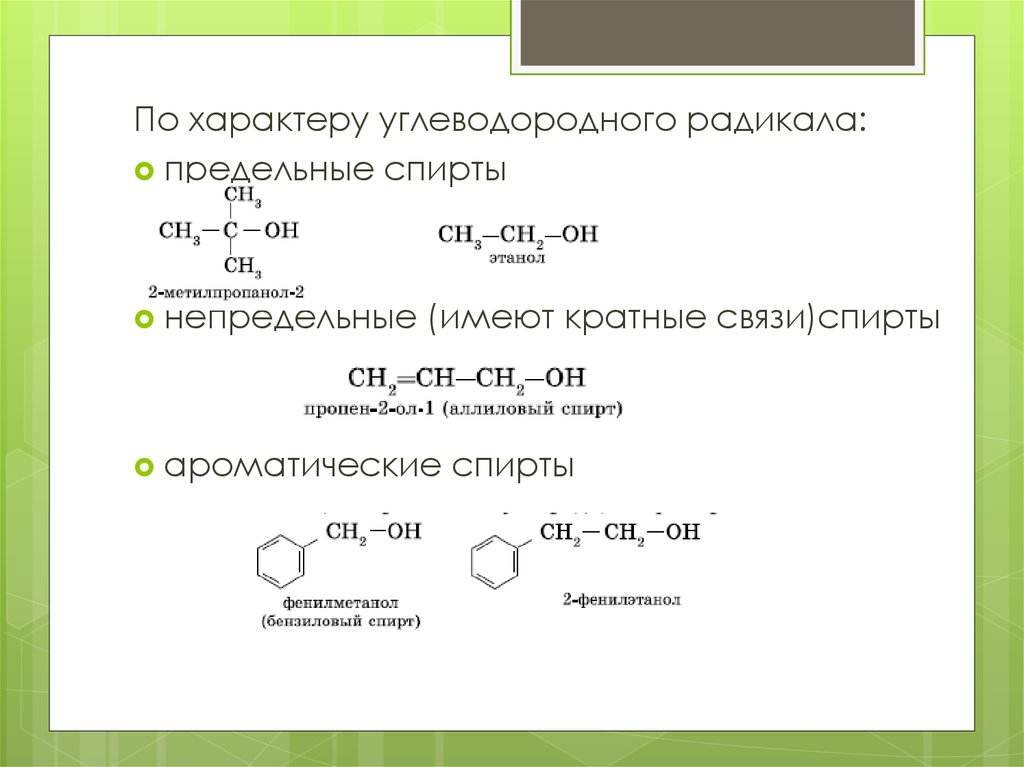
По характеру углеводородного радикала:предельные спирты
непредельные
(имеют кратные связи)спирты
ароматические
спирты
5. Номенклатура
По номенклатуре ИЮПАК названия простыхспиртов образуются от названий
соответствующих алканов с добавлением
суффикса «-ол», положение которого
указывается арабской цифрой.
6. Изомерия
Начинаяс 3 гомологического ряда
появляется изомерия положения
функциональной группы (пропанол-1 и
пропанол-2), а ч 4 – изомерия углеродного
скелета.
Межклассовая с простыми эфирами
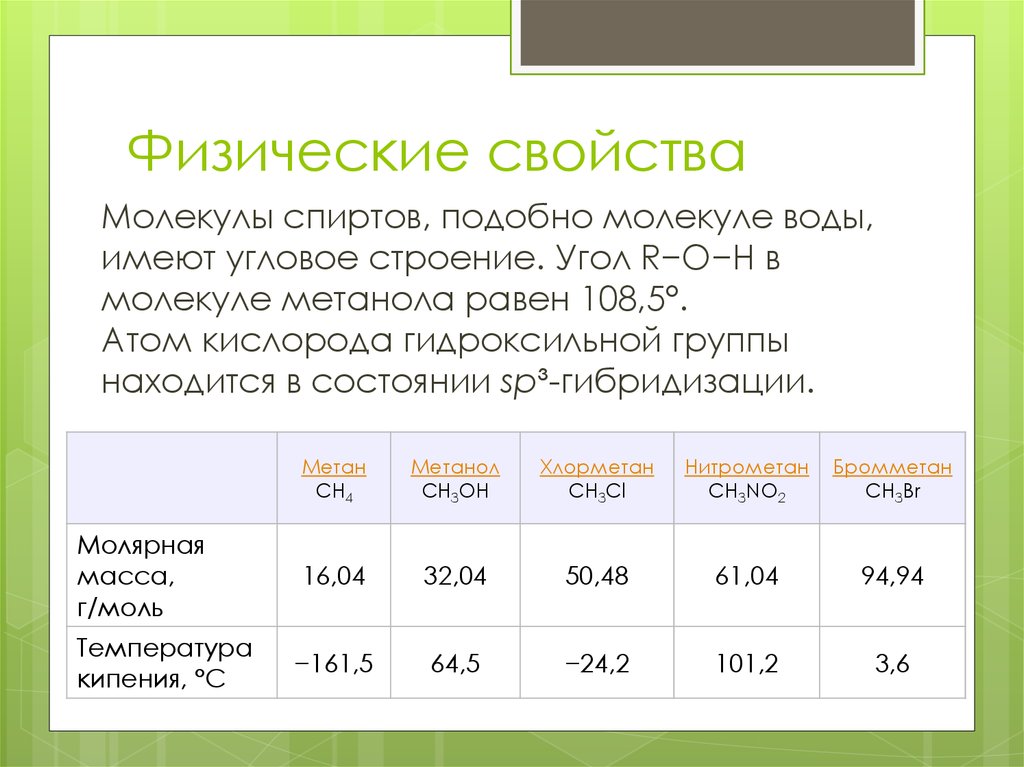
7. Физические свойства
Молекулы спиртов, подобно молекуле воды,имеют угловое строение. Угол R−O−H в
молекуле метанола равен 108,5°.
Атом кислорода гидроксильной группы
находится в состоянии sp³-гибридизации.
Молярная
масса,
г/моль
Температура
кипения, °С
Метан
CH4
Метанол
CH3OH
Хлорметан
CH3Cl
Нитрометан
CH3NO2
Бромметан
CH3Br
16,04
32,04
50,48
61,04
94,94
−161,5
64,5
−24,2
101,2
3,6
8. Химические свойства
Реакции,протекающие по связи О–Н.
При взаимодействии с активными металлами (Na,
K, Mg, Al) спирты проявляют свойства слабых
кислот и образуют соли, называемые
алкоголятами или алкоксидами:
2CH3OH + 2Na 2CH3OK + H2
Алкоголяты химически не стабильны и при
действии воды гидролизуются с образованием
спирта и гидроксида металла:
C2H5OК + H2O C2H5OH + КOH
9.
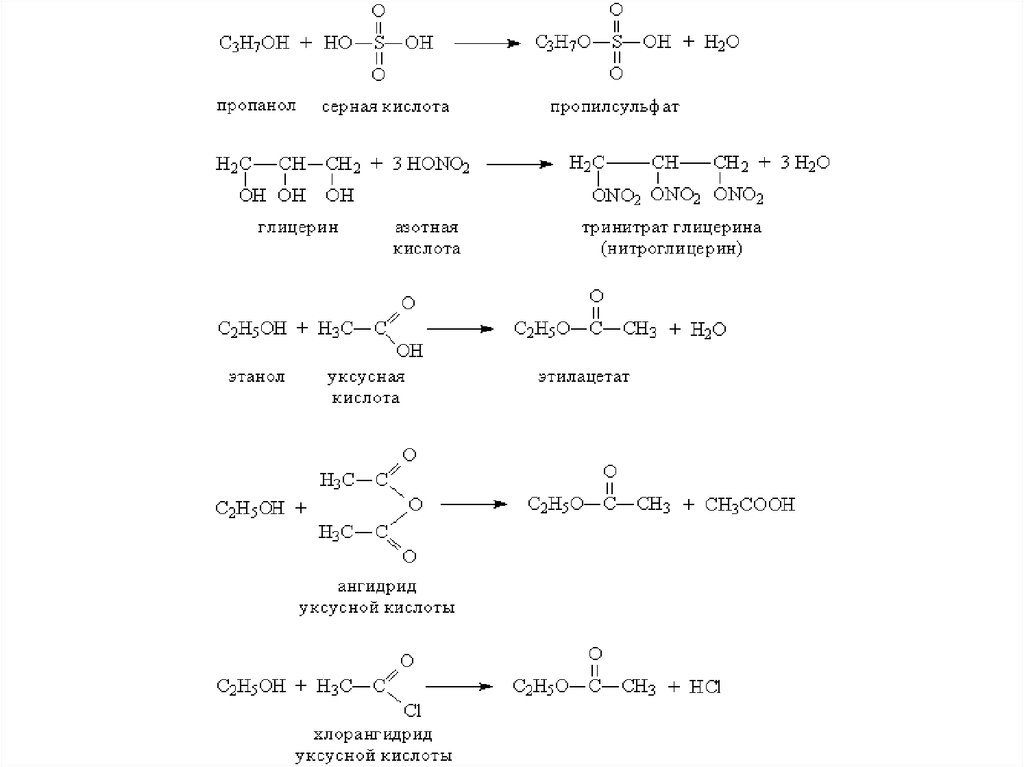
Привзаимодействии с минеральными или
органическими кислотами спирты
образуют сложные эфиры – соединения,
содержащие фрагмент R–O–A (А –
остаток кислоты). Образование сложных
эфиров происходит и при взаимодействии
спиртов с ангидридами и
хлорангидридами карбоновых кислот
10.
11.
Придействии окислителей (К2Cr2O7,
KMnO4) первичные спирты образуют
альдегиды, а вторичные – кетоны.
12.
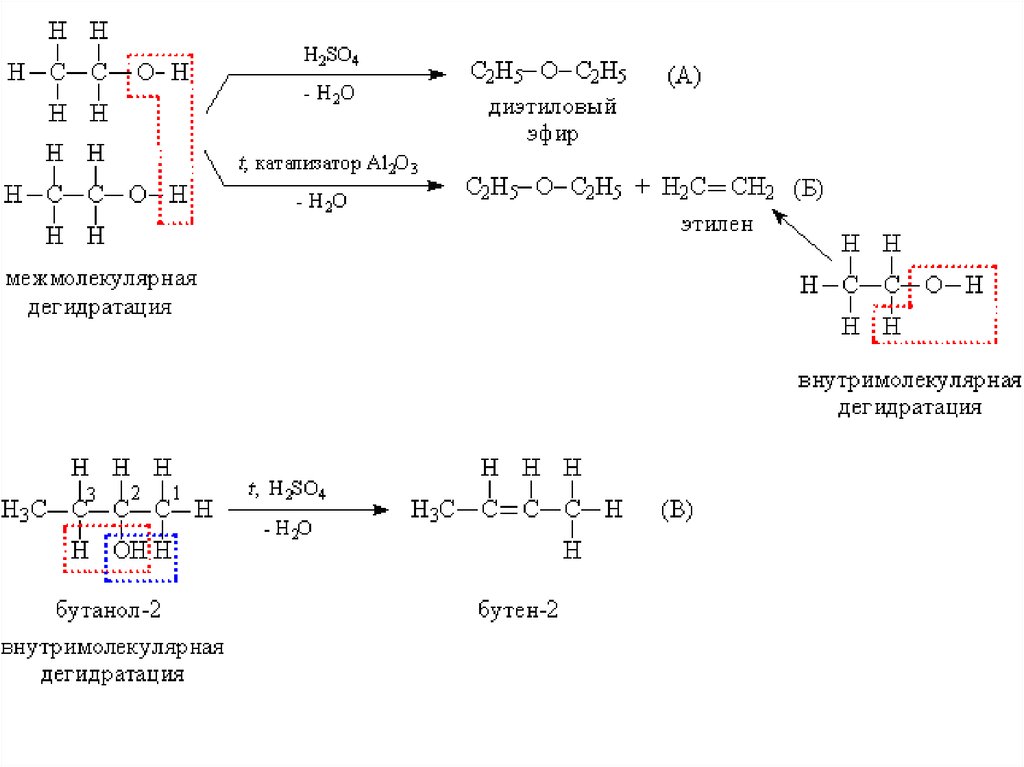
В присутствии катализаторов или сильныхминеральных кислот происходит дегидратация
спиртов (отщепление воды), при этом реакция
может идти в двух направлениях:
а) межмолекулярная дегидратация с участием
двух молекул спирта, при этом связи С–О у
одной из молекул разрываются, в результате
образуются простые эфиры – соединения,
содержащие фрагмент R–О–R.
б) при внутримолекулярной дегидратации
образуются алкены - углеводороды с двойной
связью. Часто оба процесса – образование
простого эфира и алкена – протекают
параллельно.
13.
14.
Взаимодействиеспиртов с галогеноводородами
15. Получение спиртов
Гидратация алкенов (правило Марковникова):Алкены присоединяют воду в кислой среде по
механизму электрофильного присоединения, по
правилу Марковникова.
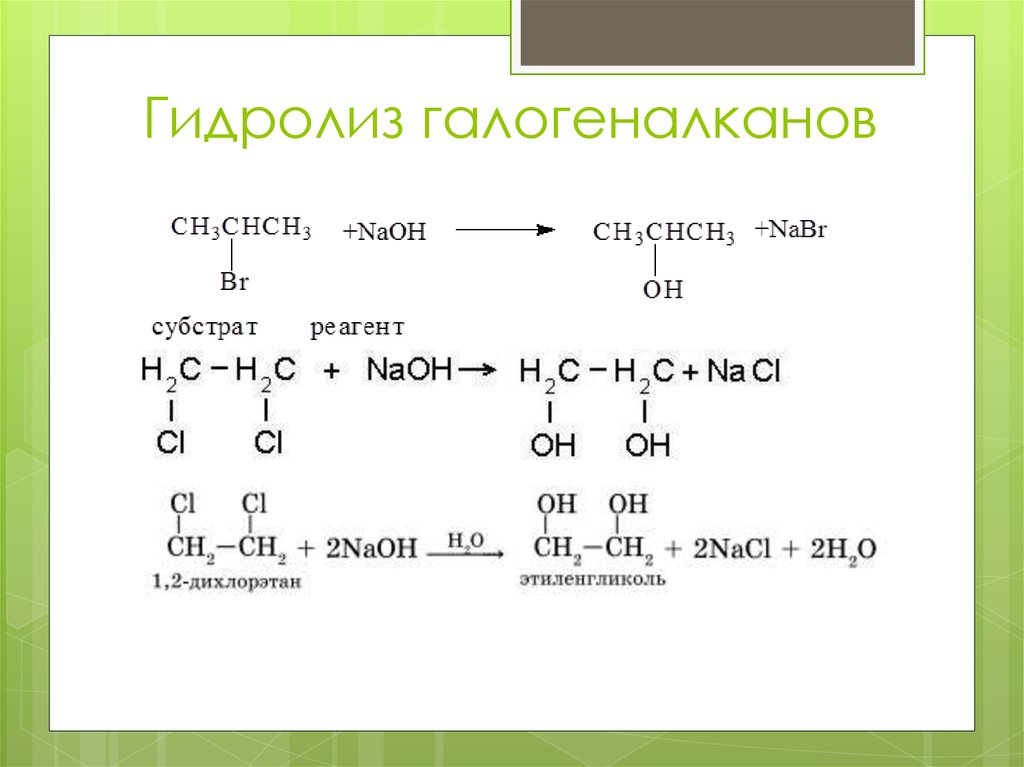
16. Гидролиз галогеналканов
17. Гидрирование альдегидов и кетонов
(при воздействии температуры и платиновогокатализатора)













 Химия
Химия








