Похожие презентации:
Первый закон термодинамики
1.
2. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Первый закон термодинамикиВнутренняя энергия изолированной системы есть
величина постоянная.
∆U = 0
Если в неизолированной системе протекает процесс, в
котором поглощается Q теплоты и совершается работа
W, то при этом происходит изменение внутренней
энергии системы, выражаемое уравнением
∆U =Q - W
2
3. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Тепловой эффект. Термохимия.При отсутствии немеханической работы:
QV = ∆U
QP = ∆H
Тепловым эффектом реакции называется
количество
тепла,
выделенное
или
поглощенное при протекании химической
реакции в следующих условиях:
•отсутствие немеханической работы
•постоянство температуры
•постоянство объема или давления.
Г. Гесс, 1836г.
3
4. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Закон Гесса. Термохимия.Тепловой эффект процесса не зависит от
промежуточных стадий, а определяется
лишь начальным и конечным
состояниями системы
при условиях:
1.Единственной работой, совершаемой системой,
является работа против внешнего давления
2.Давление или объем в течение всего процесса
остаются неизменными
Г. Гесс, 1836г.
4
5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Термохимия.H2 (г) + 0.5О2 (г) = Н2О (ж) ∆Н298 = -285,84 кДж/моль
С6Н6 (ж) + 7,5 О2 (г) = 6СО2 (г) +3Н2О (ж) ∆Н298 = - 3267,62 кДж/моль
∆Н > 0 тепло поглощается (эндоэффект)
∆Н < 0 тепло выделяется (экзоэффект)
С, О2
0
Нх
С (графит) + О2 = СО2 ∆Н1
- 393,51 кДЖ/моль
СО + 0,5 О2 = СО2 ∆Н2298 = - 283,01 кДЖ/моль
С (графит) + 0,5 О2 = СО ∆Н1298 - ∆Н2298 = - 101,5 кДЖ/моль
СО, 0.5О2
H, кДж/моль
298 =
Н1
-200
-400
Н2
СО2
5
6. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Следствия из закона ГессаПервое следствие. Тепловой эффект реакции равен разности между
суммой теплот образования продуктов реакции и суммой теплот
образования исходных веществ с учетом их стехиометрической реакции.
В общем виде уравнение химической реакции:
v1A1 + v2A2 = v3A3 + v4A4 ∆rH0
∆rH0 = (v3 ∆fH30 + v4 ∆fH40) – (v1 ∆fH10 + v2 ∆fH20)
∆rH0, ∆fH0, ∆cH0, ∆vH0
6
7. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Следствия из закона ГессаВторое следствие. Тепловой эффект разложения какого-либо
химического соединения точно равен и противоположен по знаку
тепловому эффекту его образования.
(закон Лавуазье – Лапласа, 1780 - 1784)
Третье следствие. Если совершаются две реакции, приводящие из
различных начальных состояний к одинаковым конечным, то разница
между тепловыми эффектами представляет тепловой эффект перехода из
одного начального состояния в другое.
Суг
Суг + О2 = СО2 ∆rH1 = -409 кДж/моль
Сгр + О2 = СО2 ∆rH 2= -395,5 кДж/моль
Салм + О2 = СО2 ∆rH3 = -395,4 кДж/моль
∆rH 1
∆rHх
Салм
СО2
∆rH 3
7
8. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Следствия из закона ГессаЧетвертое следствие. Если совершается две реакции, приводящие из
одинаковых начальных состояний к различным конечным, то разница
между их тепловыми эффектами представляет тепловой эффект перехода
от одного конечного состояния в другое.
8
9. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ТеплоемкостьТеплоемкость – количество тепла Q, поглощаемое телом при нагревании на 1
градус
9
10. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ТеплоемкостьδQV = dU
При постоянном объеме
При постоянном давлении
δQP = dH
10
11. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ТеплоемкостьH = U+PV
Для идеального газа:
PV = RT
11
12. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
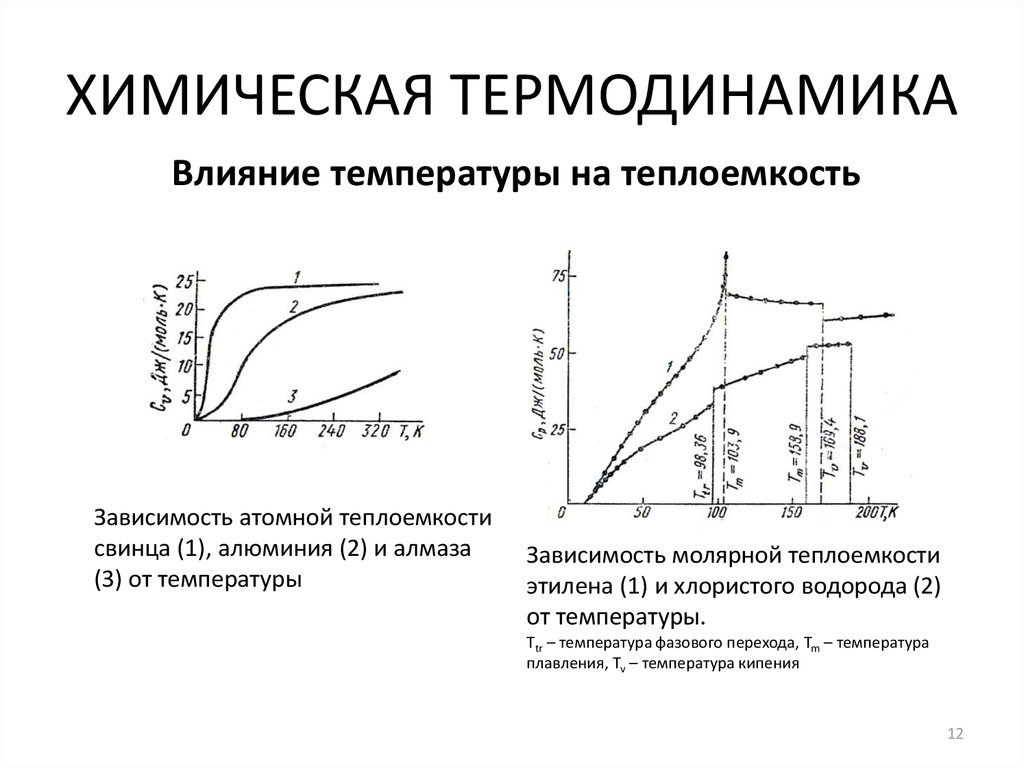
Влияние температуры на теплоемкостьЗависимость атомной теплоемкости
свинца (1), алюминия (2) и алмаза
(3) от температуры
Зависимость молярной теплоемкости
этилена (1) и хлористого водорода (2)
от температуры.
Ttr – температура фазового перехода, Tm – температура
плавления, Tv – температура кипения
12
13. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Влияние температуры на теплоемкостьCP = a + bT + cT2
для органических соединений
CP = a + bT + cT-2 для неорганических соединений
13
14.
Зависимость теплового эффекта от температуры.Уравнение Кирхгофа
В общем виде уравнение химической реакции:
v1A1 + v2A2 = v3A3 + v4A4 ∆rH0
∆rH0 = (v3 H3 + v4 H4) – (v1 H1 + v2 H2) = ΣviHi
14
15. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Зависимость теплового эффекта от температуры.Уравнение Кирхгофа
Выведено Кирхгофом в 1858г.
Густав Роберт Кирхгоф, 1824 - 1887
15
16. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Зависимость теплового эффекта от температуры.Уравнение Кирхгофа
16
17. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Зависимость теплового эффекта от температуры.Уравнение Кирхгофа
При интегрировании
17
18. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Расчет теплового эффекта по температурнымрядам теплоемкости
CP = a + bT + c*T-2 для неорганических соединений
=> ∆CP = ∆a + ∆bT + ∆c*T-2
18
19. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Расчет теплового эффекта повысокотемпературным составляющим энтальпии
19
20. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Второй закон термодинамикиВсе процессы в природе можно разделить
самопроизвольные и несамопроизвольные.
на
В изолированной системе без внешнего воздействия могут
протекать только самопроизвольные процессы.
20
21. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Второй закон термодинамикиВ 1752 г. Ломоносов сформулировал постулат о
невозможности перехода тепла от холодного тела
к теплому.
В 1824г. Карно, на основании исследования
циклических процессов в тепловой машине,
высказал ряд положений, составивших основу
формулировки второго закона.
Вторая половина 19в. Работами Клаузиуса,
Томсона и Максвелла показано, что второй закон
является одним из общих законов природы.
21
22. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
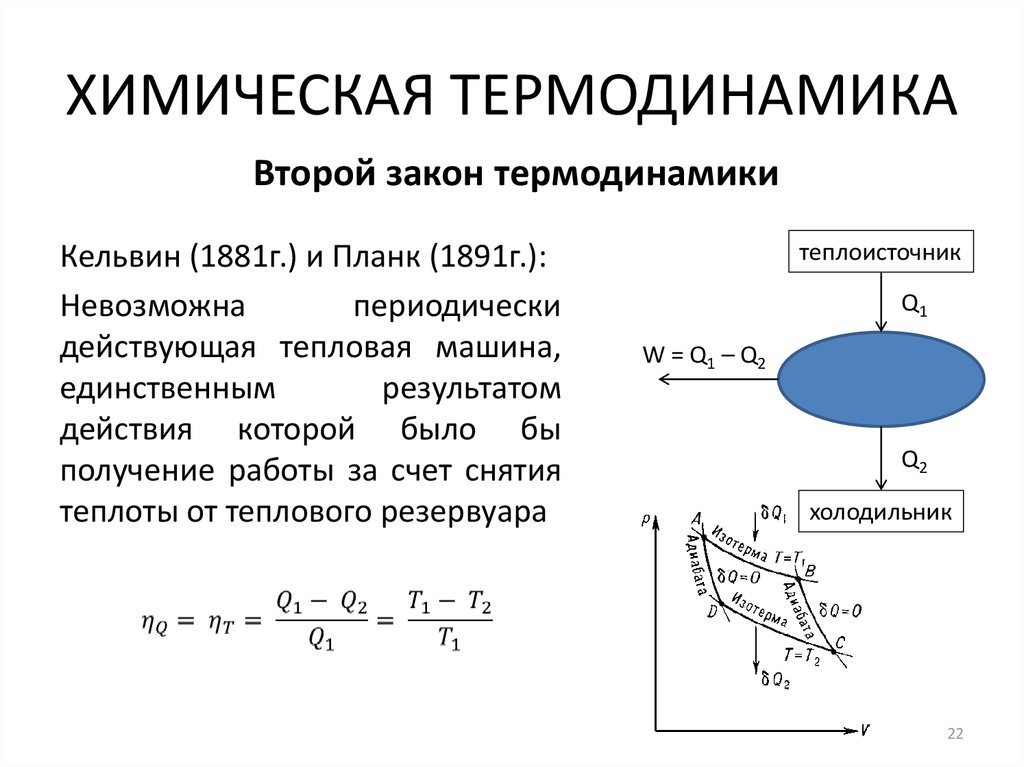
Второй закон термодинамикиКельвин (1881г.) и Планк (1891г.):
Невозможна
периодически
действующая тепловая машина,
единственным
результатом
действия которой было бы
получение работы за счет снятия
теплоты от теплового резервуара
теплоисточник
Q1
W = Q 1 – Q2
Q2
холодильник
22
23. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ЭнтропияДля бесконечно малого квазистатического процесса
23
24. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ЭнтропияЕсли интеграл, взятый по замкнутому контуру, равен нулю, то существует
функция состояния, полный дифференциал которой равен подынтегральной
величине:
Клаузиус, 1865г., назвал функцию состояния энтропией.
24
25. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Энтропия25
26. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Изменение энтропии как критерийнаправленности и равновесия в изолированной
системе
При квазистатическом процессе в изолированной системе
Для нестатического процесса
26
27. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Физический смысл энтропии. Границыприменимости второго закона
Закон применим только для макроскопических систем.
Не может быть примененным ко всей вселенной в целом.
Изменение энтропии характеризует вероятность протекания
самопроизвольных процессов в изолированной системе и
невозможность полного превращения теплоты в работу в циклических
процессах.
Больцман показал:
27
28. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Изменение энтропии в различных процессахПроцессы нагрева и охлаждения
28
29. Термодинамические потенциалы
Энергия ГиббсаИзобарно-изотермический потенциал
При Т, P = const
29
30. Термодинамические потенциалы
Энергия ГельмгольцаИзохоно-изотермический потенциал
При Т, V = const
30
31. Термодинамические потенциалы
Химический потенциал.Характеристические функции
Полный дифференциал
31
32. Термодинамические потенциалы
Химический потенциал.Характеристические функции
Химический потенциал, мера реакционной
способности вещества
Ввел в 1875г. Гиббс
32
33. Термодинамические потенциалы
Химический потенциал.Характеристические функции
часть изменения энергии системы, которая связана
непосредственно с изменением природы и числа частиц,
происходящим при протекании химической реакции
Фундаментальные
уравнения
химической
термодинамики
33
34. Термодинамические потенциалы
Химический потенциал.Характеристические функции
В равновесной системе
Umin
S, V = const
=> U минимально
S, P = const
=> H минимально
V, T = const
=> F минимально
P, T = const
=> G минимально
Pmax
Vmin
Smax
Tmin
Hmin
Fmin
Gmin
34
35. Термодинамические потенциалы
Закон действующих масс.Константа равновесия для газофазных реакций
v1A1 + v2A2 <-> v3A3 + v4A4
Химические реакции протекают до тех пор, пока не
достигнуто химическое равновесие между реагирующими
веществами.
Химическое равновесие является динамическим
равновесием, при котором скорости прямой и обратной
реакций равны друг другу.
35
36. Термодинамические потенциалы
Закон действующих масс.Константа равновесия для газофазных реакций
Состояние химического равновесия определяется:
•Если система находится в состоянии равновесия, то состав ее с
течением времени при постоянных внешних условиях не изменяются.
•Если система, находящаяся в равновесии, будет выведена из этого
состояния вследствие внешних воздействий, то с прекращением их
действия она возвращается к прежнему состоянию.
При установлении равновесия в газовой фазе:
36
37. Термодинамические потенциалы
Закон действующих масс.Константа равновесия для газофазных реакций
Стандартная константа равновесия
37
38. Термодинамическое равновесие
Закон действующих масс.Константа равновесия для газофазных реакций
38
39. Термодинамическое равновесие
Уравнение изотермы реакцииОтносительные парциальные давления реагентов
39
40. Термодинамическое равновесие
Уравнение изотермы реакцииУравнение изотермы Вант-Гоффа, сформулировано в 1886г
40
41. Термодинамическое равновесие
Влияние температуры на химическое равновесие.Уравнение изобары реакции
Изобара Вант-Гоффа
41
42. Термодинамическое равновесие
Влияние температуры на химическое равновесие.Уравнение изобары реакции
Изобара Вант-Гоффа
Влияние температуры на константу равновесия определяется знаком
теплового эффекта
Рост температуры для эндотермической реакции увеличивает константу
равновесия.
Рост температуры для экзотермической реакции снижает константу
равновесия.
42








































 Химия
Химия








