Похожие презентации:
Общий анализ мочи
1. Общий анализ мочи
2. ОАМ
• Физические свойства (цвет, прозрачность,плотность)
• Химический состав (рН, белок, глюкоза)
• Микроскопия осадка мочи (эпителий, э/ц,
лейкоциты, цилиндры, соли)
3. Преаналитический этап
• Для исследования берут всю утреннююмочу, собранную в чистую сухую посуду
после туалета половых органов
• Исследовать мочу необходимо в сроки от 30
мин до 1,5 часа после выделения
4. ОАМ. Физические свойства
Количество
N=0,8-2,0 л мочи в сутки (в среднем 1,5 л)
Олигурия – меньше 600 мл мочи в сутки
Анурия – отсутствие мочи (или не более 50
мл)
• Полиурия – более 2,0 л (4-6 л при
несахарном диабете)
5. ОАМ. Физические свойства
• Цвет• N – соломенно-желтый (пигмент урохром)
• Красный цвет – гемоглобинурия, миоглобин в
моче, порфирин, ЛС или их метаболиты
• Темно-желтый с зеленым или зеленовато-бурым
оттенком – билирубин (при механической
желтухе);
• Зеленовато-желтый – гной в моче;
• Темный, почти черный – остр.гемолитическая
анемия
6. ОАМ. Физические свойства
• Прозрачность• N – прозрачная
• Помутнение – наличие э/ц, лейкоцитов,
эпителия, бактерий, слизи, выпадение в
осадок солей
7. ОАМ. Физические свойства
• Плотность• N – 1,008-1,025 г/л
• ↑ плотности ˃1,030:
глюкоза в моче, белок, ЛС
• ↓ плотн. ˂ 1,015 г/л:
почечный диабет, ХПН,
острое поражение
почечных канальцев
8. Химическое исследование
• рН• N слабокислая ~6 (4,58,0)
• ↑рН ˃7 – растительная
пища, кислая рвота,
гиперкалиемия,
метаболический и
дыхательный алкалоз;
• ↓рН ˃5 - метаболический
и дыхательный ацидоз,
обезвоживание, ХПН,
МКБ, сахарный диабет
9. Химическое исследование
• Белок• N – отрицательно, в суточном количестве мочи м.б.
– 50-100 мг белка;
• Физиологическая протеинурия (не связана с
заболеванием) – пища, богатая белками, физические
нагрузки, эмоциональное напряжение;
• Патологическая протеинурия: почечная,
внепочечная;
• Если качественно – белок «+», необходимо
определение кол-ва (метод пирогаллоловый
красный)
10. Химическое исследование
Глюкоза – отсутствует;
Кетоновые тела – отсутствуют
«+» – сахарный диабет;
Нитриты – отсутствуют
«+» – инфицирование мочевого тракта
(кишечная палочка, протей, клебсиелла)
• Билирубин – отсутствует
• «+» – поражение паренхимы печени и
нарушение оттока желчи
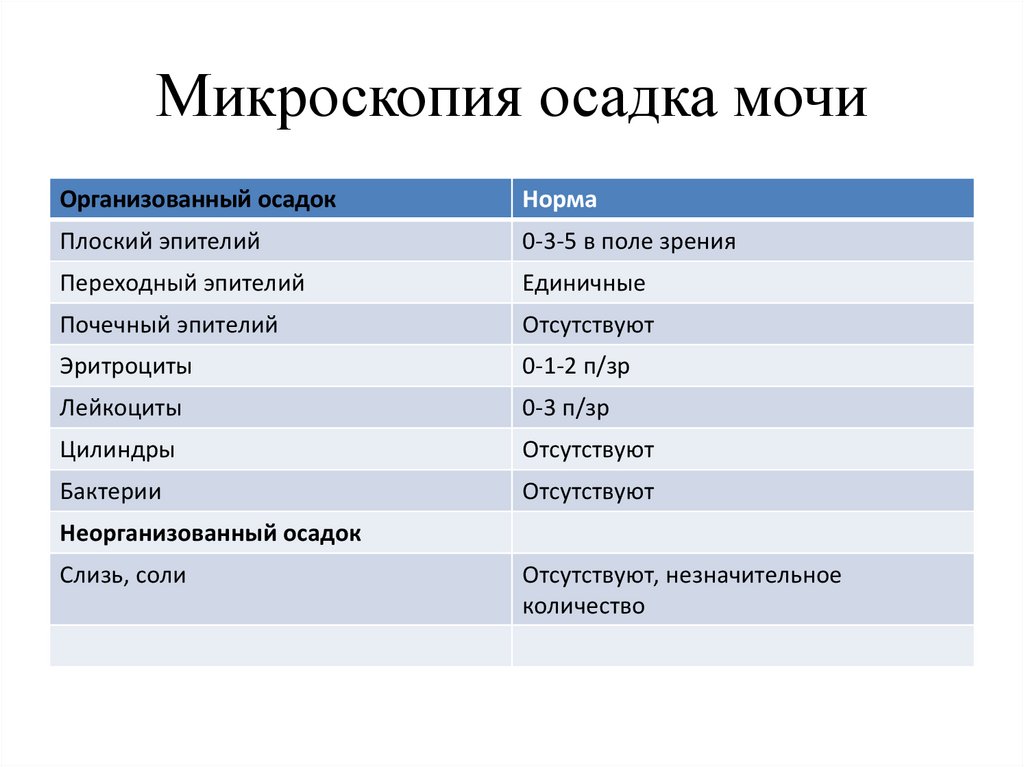
11. Микроскопия осадка мочи
Организованный осадокНорма
Плоский эпителий
0-3-5 в поле зрения
Переходный эпителий
Единичные
Почечный эпителий
Отсутствуют
Эритроциты
0-1-2 п/зр
Лейкоциты
0-3 п/зр
Цилиндры
Отсутствуют
Бактерии
Отсутствуют
Неорганизованный осадок
Слизь, соли
Отсутствуют, незначительное
количество
12. Оксалаты
Трипельфосфаты
13. Коагулограмма
• Преаналитический этап:• Кровь необходимо забирать утром, натощак из
локтевой вены, без шприца, без наложения жгута, с
использованием иглы с широким просветом
• Кровь забирают в пробирку самотеком с цитратом
натрия (3,8%) в соотношении 9:1 в пластиковые
центрифужные пробирки
• При наложении жгута – замедляется кровоток
(искажение результатов-укорочение показателей)
• При физической нагрузке (адреналин) - ↑ свертывание
крови (кровь м.свернуться даже с антикоагулянтом)
14. Основные компоненты системы гемостаза
• Сосудистая стенка (эндотелий) – главная роль вформировании тромботической пробки
• Клетки крови (преимущественно тромбоциты) + э/ц
и лейкоциты участвуют в гемостазе
• Плазменные факторы (13 компонентов – в основном
это ферменты, активирующиеся один за другим,
записаны в геноме человека)
• Антикоагулянты (система ингибиторов
свертывания) – например, гепарин (вырабатывается
в печени)
• Фибринолитическое звено (плазминовая система) –
растворяет фибриновые сгустки
15. Коагулограмма
• Центрифугирование• 15 мин 3000 об/мин → бедная
тромбоцитами плазма
• Время хранения исследуемой плазмы до
анализа – не более 4 час при комнатной
температуре и не более 8 час при t°2-8°C
• Допускается однократное замораживание
плазмы при температуре минус 18-20°С и
хранение не более 2 месяцев
16. Плазменный гемостаз моделируется тестами
АЧТВактивированное
частично
тромбопластиново
е время
25-35 с
Характеризует внутренний путь свертывания; АЧТВ
изменяется в зависимости от различных количеств
фибриногена, активности протромбина, факторов V,
VIII, IX, X, XI, XII
Укорочение АЧТВ – гиперкоагуляция (при тромбозе
глубоких вен, ДВС – 1ой фазы)
Удлинение АЧТВ – при гепаринотерапии, заболевании
печени
ПТВ
Протромбиновое
время
11-15, с
(взрос.),
13-18
новорож.
Характеризует внешний путь (ф.II, V, VII, X)
Укорочение ПТВ – при тромбозах, на фоне
введения ряда лекарств (антибиотики,
пероральные контрацептивы)
Удлинение – заболевание печени
МНО (международное 1,0-1,4
нормализованное
отношение)
МНО=ПТВ(больного),с/ПТВ(контроль),с в степени МИЧ
(международный индекс чувствительности)=1
ПТВ не выражают в виде ПТИ, % (протромбиновый
индекс)
ТВ тромбиновое
время
Предназначен для оценки конечного этапа свертывания
крови, т.е. скорости превращения фибриногена в фибрин.
Контроль за гепаринотерапией (нет тромбина – нет
фибрина)
12-16 с
17. АЧТВ принцип метода
• К исследуемой плазме кровипоследовательно добавляют АЧТВ реагент,
представляющий собой водный раствор
эллаговой кислоты (активатор внутреннего
пути свертывания) в комплексе с соевыми
фосфолипидами, и кальций хлористый
• В процессе измерения АЧТВ регистрируют
время от момента добавления ионов
кальция до момента образования сгустка
18.
• Фибриноген• 2-4 г/л
• ↑ф.ген при воспалении, кроме
воспаления печени
19. D-димер
D-димер• D-димер — это продукт распада фибрина,
небольшой фрагмент белка, присутствующий в
крови после разрушения тромба (процесс
фибринолиза)
• Он называется «димер», так как содержит два
соединяющихся D фрагмента белка
фибриногена
• Анализ на D-димеры показан при подозрениях
на тромбоз глубоких вен (ТГВ), легочную
эмболию (ТЭЛА) или ДВС-синдром
20.
D-димер больше 0,5:
Тромбоз глубоких вен (но не факт)
Беременность
Инфаркт миокарда
Пневмония
Острые воспалительные процессы
D-димер меньше 0,5:
В 99% - исключается тромбоз глубоких вен
21. Принципы микробиологической диагностики инфекционных заболеваний
Техника сбора и транспортированиябиоматериалов в микробиологические
лаборатории
Методические указания
МУ 4.2.2039—05
22. Эффективность лабораторной диагностики зависит от:
• 1. правильности выбора материала дляисследования
• 2. сроков взятия материала от больного (до
применения А/б)
• 3. объема проб
• 4. стерильности посуды для исследования
• 5. сокращения сроков от момента взятия
проб до начала исследования
23. Правила забора и посева крови на стерильность и гемокультуру
• Производится при тифо-паратифозных заболеваниях, сепсисе,менингококковой инфекции или других инфекциях,
сопровождающихся лихорадкой, причем на протяжении всего
лихорадочного периода болезни, но лучше в начальном периоде или в
разгаре болезни (при выраженной бактериемии).
• Для исследования берут кровь из вены локтевого сгиба, у маленьких
детей кровь берут в меньшем количестве из мочки уха, пятки, пальца.
• Пробы крови отбирают после тщательной обработки кожи с
соблюдением правил асептики, одноразовым стерильным шприцем.
• Посев на питательные среды стерильного материала (кровь или
другие, содержащие микробов жидкости у здоровых лиц) также лучше
делать у постели больного, либо помещать в стерильную посуду,
содержащую вещества, препятствующие свертыванию крови 0,3%
раствора цитрата натрия, 0,1% раствор оксалата натрия).
24. Правила забора и посева крови на стерильность и гемокультуру
• Обычно берут 5-10 мл крови и засевают во флакон,содержащий 50-100 мл среды.
• Для этого используют для флакона с питательной средой
(один для аэробов, другой для анаэробов).
• Посев крови производится на жидкие питательные среды
– 10% желчный бульон, 1% сахарный бульон, двухфазную
среду, а также жидкие и полужидкие среды для
культивирования анаэробов в разведении 1:10.
• Флаконы с питательной средой получают в лаборатории,
переливание крови из шприца во флакон необходимо
производить над пламенем спиртовки, предварительно
сняв иглу. Флакон с посевом направляется в лабораторию,
а в вечернее и ночное время помещают в термостат.
25. Правила забора и посева испражнений
Производится при кишечных инфекциях (брюшной тиф, паратифы, шигеллезы,
сальмонеллезы и т.д.), а так же при всех болезнях, протекающих с поражением
ЖКТ и сопровождающихся расстройством стула.
Сбор испражнений производится стерильным деревянным шпателем или
стеклянной палочкой в количестве 2-3г в стерильные баночки из судна, горшка
или лотка, а так же непосредственно из прямой кишки с помощью тампонов.
Необходимо помнить, что даже остаточное количество дезинфицирующих
средств на стенках судна или горшка способно значительно изменить как
количественный, так и качественный состав микробов в клиническом
материале, поэтому их следует тщательно промывать горячей водой.
Следует брать слизь, гной. При невозможности своевременного посева кала
используют консервант – глицериновую смесь, составляющую 2\3 общего
объема. Посев испражнений производят прямым способом на чашки Петри со
средой Плоскирева, Левина, Эндо, висмут-сульфит агаром или на среды
обогащения (селенитовая, среда Мюллера), с последующим пересевом на
перечисленные выше среды для выделения энтеробактерий, на щелочной агар
(1% пептонную воду с последующим пересевом на щелочной агар) – для
вибрионов, МПА – для бацилл, ЖСА – для выделения стафилококков, среду
Китта-Тароцци – для клостридий.
26. Правила забора мочи
• Производится при воспалительных заболеваниях мочевыводящихпутей.
• Для бактериологического исследования следует брать среднюю
порцию утренней мочи после тщательного туалета мочеполовых
органов кипяченой водой с мылом.
• Мочу собирают в стерильную посуду, на исследование отбирают 3-5
мл в стерильной, плотно закрывающийся флакон и доставляют в
лабораторию в течение 1 часа.
• При бактериологическом исследовании определяют степень
бактериурии, т.е. количество колониеобразующих единиц в 1мл мочи,
методом секреторных посевов мочи.
• Для этого чашку Петри с питательной средой 3-5% кровяным агаром
необходимо разделить на 4 сектора. Бактериологической петлей
диаметром 2мм (вместимость 0,005мл) производят посев мочи (30-40
штрихов) на сектор а чашки Петри, после этого петлю прожигают и
производят 4 штриховых посева из сектора А в сектор В и
аналогичным образом – из 1 во 2, из 2 в 3.
27. Правила забора мочи
• Наносят по капле мочи на чашки Петри со средами Эндо(для энтеробактерий) и Сарубо (для грибов), а затем
засевают штрихом по всей поверхности чашек.
• После инкубации число выросших колоний на разных
секторах подсчитывают и определяют степень бактериурии
по таблице.
• Наличие в 1 мл мочи у детей 104, а у взрослых 105 м/о и
более, говорит о наличии инфекции в мочевыводящих
путях или почках.
• После подсчета микробных клеток в 1мл мочи проводят
выделение чистой культуры микробов для дальнейшей
идентификации и определения чувствительности к
антибиотикам. Окончательный результат исследования
выдается на 4-5 сутки.
28. Правила забора и посева носоглоточной слизи
• Производится при менингококковом назофарингите и длявыявления носительства менингококка, реже – при других
формах менингококковой инфекции.
• Слизь из носоглотки берется натощак или через 3-4 часа после
еды. Стерильный тампон, укрепленный на изогнутой проволоке
(угол 120-130 градусов), направляется концом вверх и
подводится под мягкое небо в носоглотку.
• Материал берется при надавливании шпателем на корень языка.
После взятия носоглоточной слизи необходимо сразу же сделать
посев на теплые чашки с сывороточным агаром, можно с
добавлением ристомицина, который ингибирует рост
сопутствующей флоры.
• После посева необходимо незамедлительно поставить чашки в
термостат и, не допуская охлаждения, доставить их в
лабораторию, так как менингококк очень чувствителен к
снижению температуры ниже 36 градусов. Окончательный ответ
посева выдается на 4 день исследования.
29. Правила забора слизи из зева и носа
• Производятся при ангине, дифтерии и другихинфекциях.
• Тампон для взятия мазков должен быть заранее
простерилизован в лаборатории.
• Мазок из зева берут натощак или не ранее 2 часов после
полоскания, питья, или еды под контролем глаза, не
касаясь тампоном слизистых оболочек рта, языка, зубов.
• Корень языка придавливают книзу и кпереди шпателем,
держа его левой рукой, а правой осторожно вводят в
ротовую полость тампон и осторожно снимают налет
или слизь на границе пораженного участка и здоровой
ткани, где количество возбудителей больше, чем в
других местах.
30. Правила забора слизи из зева и носа
• Перед взятием слизи из носа предварительнонеобходимо очистить нос, удалить корки.
• Тампон вводят поочередно в обе ноздри, плотно
прикасаясь к стенкам, перегородке носа и плотно
прижимая крылья носа к тампону.
• Полученный материал с тампона немедленно
засевается на плотные питательные среды и
одновременно наносится на предметное стекло,
подсушивается и направляется в лабораторию для
микроскопического исследования.
31. Правила забора слизи из зева и носа
• При подозрении на дифтерию материал засевают на кровянотеллуритовый агар, предварительно подогретый до комнатнойтемпературы.
• При посеве материал со всех сторон тампона втирают в среду на
участке площадью 2х1см, а затем этим же тампоном засевают
круговыми движениями, втирая в общую поверхность среды.
• Засеянные чашки инкубируют при 37 градусах 24-48 часа.
• При отсутствии возможности доставить материал в лабораторию в
течение 3 часов с момента взятия пробы рекомендуется засевать
материал на чашки с питательной средой непосредственно у постели
больного или пробирки с транспортной средой помещают в термостат
и затем доставляют в лабораторию.
• Через 24 часа инкубации с транспортной среды проводится пересев на
КТА, поэтому срок исследования увеличивается на одни сутки.
Проводится выделение чистой культуры. Определяется род и вид.
Кроме того, обязательно определяется токсигенность возбудителя
дифтерии.
32. Правила забора слизи из зева и носа
• При подозрении на другую инфекцию мазок из зеваберется параллельно двумя стерильными тампонами.
• Один помещают в пробирку с сахарным бульоном,
другой используют для приготовления мазка.
• После инкубации через 24 часа проводится пересев с
сахарного бульона на питательные среды (кровяной
агар, шоколадный агар, ЖСА, Эндо, Сабуро).
• Чем больше набор селективных питательных сред
используется для посева материала, тем больше
вероятность выделения и идентификации
микроорганизмов, вызвавших болезнь.
• После идентификации до рода и вида необходимо
определить чувствительность к антибиотикам.
33. Правила забора и посева ликвора
• Производится на 20% сывороточный агар или на среду обогащения –0,1% полужидкий агар.
• Среды должны быть свежими: срок хранения их в холодильнике не
более суток.
• Ликвор необходимо собирать в стерильную пробирку и немедленно
доставлять в лабораторию на исследование в водяной бане при 37
град.
• Ликвор центрифугируют, берут 2-3 капли осадка жидкости, взятой со
дна пробирки, засевают на поверхность подогретого сывороточного
агара в чашку Петри.
• Готовится мазок для бактериоскопического исследования, а
оставшийся ликвор в пробирке заливается 5мл стерильного
полужидкого 0,1% агара с добавлением сыворотки и помещается в
термостат для накопления микробных клеток (так называемое
«обогащение»).
• Предварительный результат посева, получается через 1-2 дня, а
окончательный – через 3-4 дня, при выделении чистой культуры
менингококка с помощью метода обогащения – через 7-8 дней.
































 Биология
Биология








