Похожие презентации:
Строение атома
1. Строение атома
Занятие №12. Уровни изучения объектов в химии
• Субмолекулярный – атом• Молекулярный – молекула
• Надмолекулярный - вещество
3. Планетарная модель атома
4. Современные представления об атоме
• Атом – электроотрицательная частица, состоящая из положительнозаряженного ядра и отрицательно заряженной электронной
оболочки
• Химический элемент – вид атомов с одинаковым зарядом ядра
• Ядро атома состоит из положительно заряженных протонов (р) и не
имеющих электрического заряда нейтронов (n)
• Электронная оболочка состоит из отрицательно заряженных
электронов (е)
5. Состав атома и его свойства
Протон – элементарная частица в составе ядра атома. Имеетположительный электрический заряд, равны по величине заряду и
противоположный по знаку заряду электрона, и относительную массу
1,0073. Число протонов обозначается Z
Нейтрон - элементарная частица в составе ядра атома.
Не имеет электрического заряда. Имеет относительную
массу 1,0087. Число нейтронов в ядре обозначается
буквой N. Число нейтронов в атомах одного и того же
элемента может меняться
Электрон - элементарная частица в составе
электронной оболочки атома. Имеет
отрицательный электрический заряд, равный по
величине, но противоположный по знаку заряду
протона. Масса электрона примерно в 2000 раз
меньше массы протона и практически не влияет
на массу атома.
6. Массовое число атома. Физический смысл порядкового номера в пс.
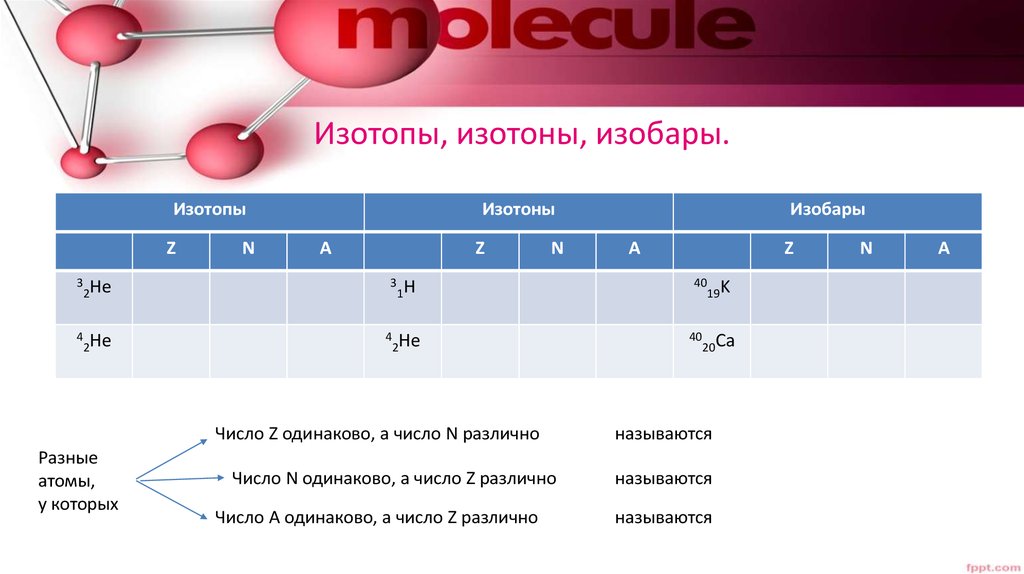
7. Изотопы, изотоны, изобары.
ИзотопыZ
3
2He
4
2He
N
Изотоны
A
Z
3
4
N
1H
2He
Число Z одинаково, а число N различно
Разные
атомы,
у которых
Число N одинаково, а число Z различно
Число A одинаково, а число Z различно
Изобары
A
Z
40
40
19K
20Ca
называются
называются
называются
N
A
8. Основное состояние атома. Строение электронной оболочки.
• Электронная орбиталь – пространство вокруг ядра, в которомнаиболее вероятно нахождение электронов
• Принцип Паули – в атоме не бывает 2 электронов, у которых все
квантовые числа одинаковы
9. Энергетические уровни. Главное квантовое число
• Электронная оболочка атома состоит из10.
n=2n=3
n=4
n=∞
Номер
уровня
Значение n
Буквенное
обозначение
уровня
n=1
К
Номер уровня=
L
M
N
В п.с. последовательность
элементов
горизонтальная
вертикальная
Число уровней в электронной оболочке атома =
называется
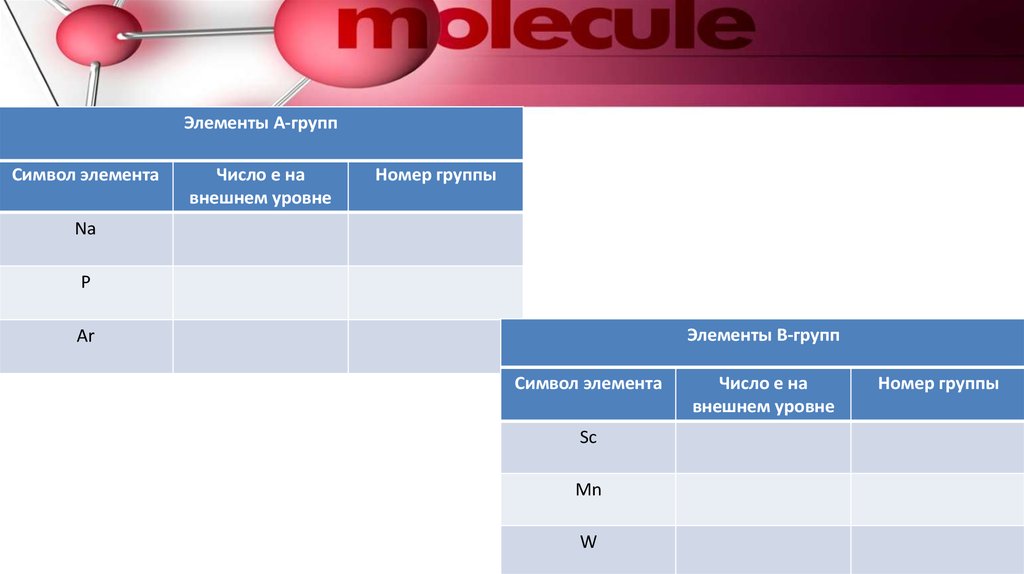
11.
Элементы А-группСимвол элемента
Число е на
внешнем уровне
Номер группы
Na
P
Элементы В-групп
Ar
Символ элемента
Sc
Mn
W
Число е на
внешнем уровне
Номер группы
12.
у А-группЧисло е
внешнего
уровня
0е
у В-групп
1е
2е
13. Энергетический подуровень. Побочное (орбитальное) квантовое число
Электроннаяоболочка
Состоит из
Состоят из
14.
n=1s
n=2
s p
Число
подуровней =
n=3
n=4
s p d
s p d f
n=5
n=6
s p d f g h
15.
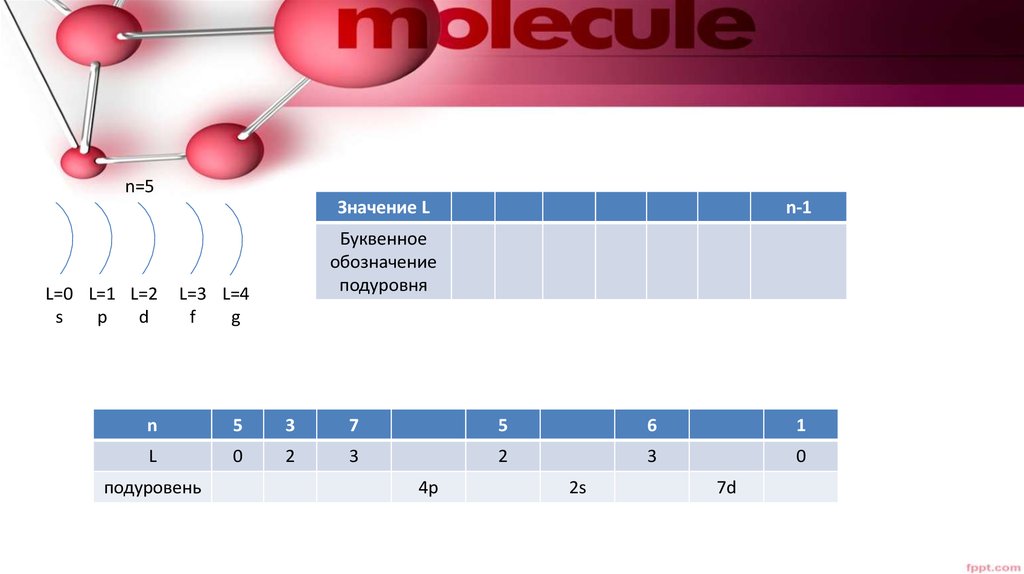
n=5Значение L
L=0 L=1 L=2
s
p
d
n-1
Буквенное
обозначение
подуровня
L=3 L=4
g
f
n
5
3
7
5
6
1
L
0
2
3
2
3
0
подуровень
4р
2s
7d
16. Электронная орбиталь. Магнитное квантовое число.
Орбиталь -Электронная Состоит
из
оболочка
Состоят
из
Состоят
из
На
которых
17.
Подуровеньs
p
d
f
Значение L
0
1
2
3
Значение mL
0
-1, 0, +1
-2, -1, 0, +1, +2
Число орбиталей
на подуровне
1
3
Число орбиталей на подуровне =
На s-подуровне
На р-подуровне
орбиталь
орбиталей
На d-подуровне
орбиталей
На f-подуровне
орбиталей
L
18.
Значение L3
5
2
Значение mL
Число орбиталей на
подуровне
5
9
2
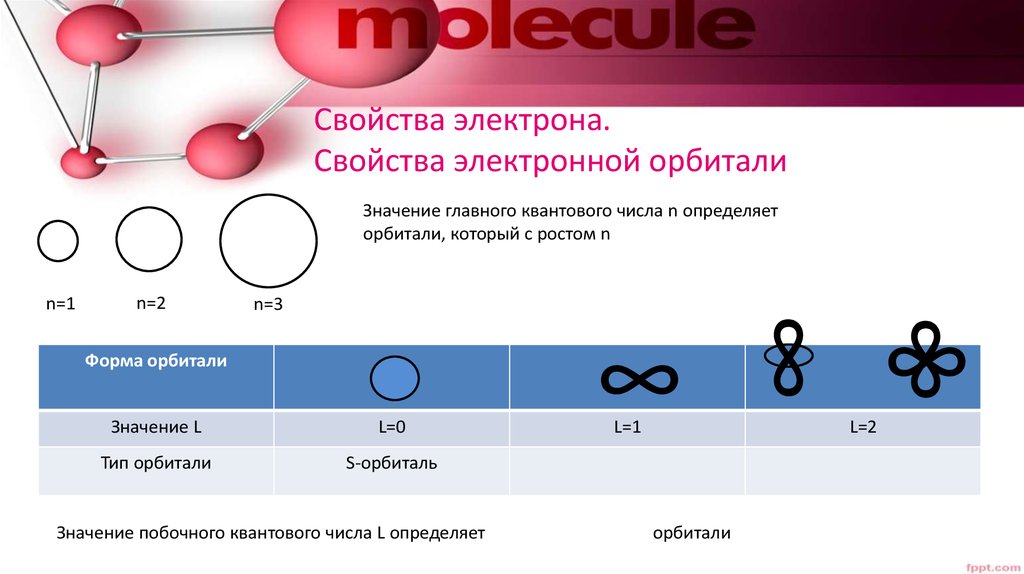
19. Свойства электрона. Свойства электронной орбитали
Значение главного квантового числа n определяеторбитали, который с ростом n
n=2
n=3
Форма орбитали
Значение L
L=0
Тип орбитали
S-орбиталь
Значение побочного квантового числа L определяет
∞
∞
∞
n=1
L=1
орбитали
L=2
∞
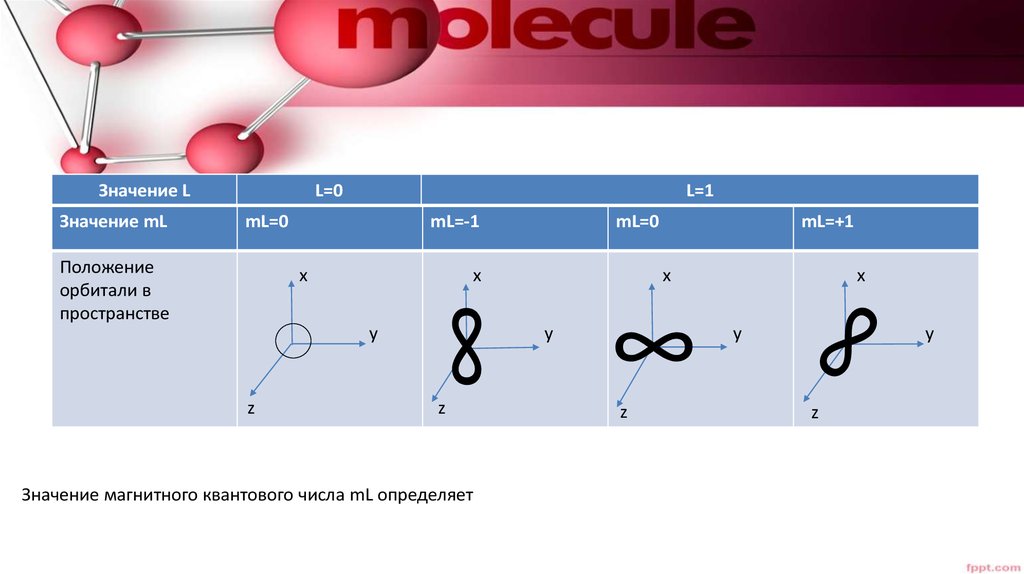
20.
Значение LЗначение mL
L=0
L=1
mL=0
Положение
орбитали в
пространстве
mL=-1
x
x
∞
y
z
mL=0
z
Значение магнитного квантового числа mL определяет
mL=+1
x
y
∞
z
x
y
y
z
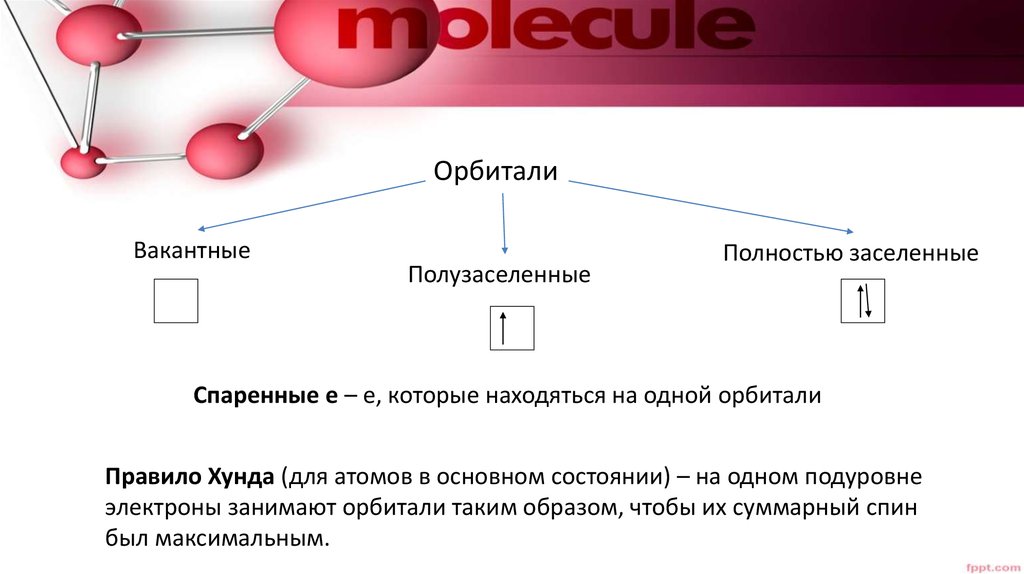
21. Спиновое квантовое число. Правило Хунда
• Принцип Паули –• Максимальное число электронов на орбитали =
22.
ОрбиталиВакантные
Полузаселенные
Полностью заселенные
Спаренные е – е, которые находяться на одной орбитали
Правило Хунда (для атомов в основном состоянии) – на одном подуровне
электроны занимают орбитали таким образом, чтобы их суммарный спин
был максимальным.
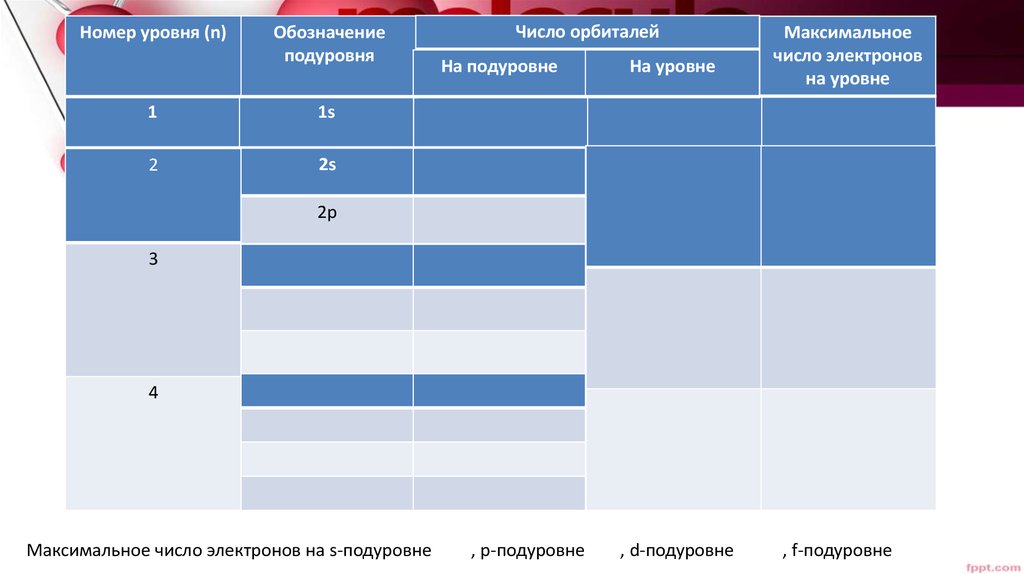
23.
Номер уровня (n)Обозначение
подуровня
1
1s
2
2s
Число орбиталей
На подуровне
На уровне
Максимальное
число электронов
на уровне
2p
3
4
Максимальное число электронов на s-подуровне
, р-подуровне
, d-подуровне
, f-подуровне
24.
• Как зависит число орбиталей на уровне от значенияглавного квантового числа n
• Как зависит максимальное число электронов на
уровне от значения главного квантового числа n
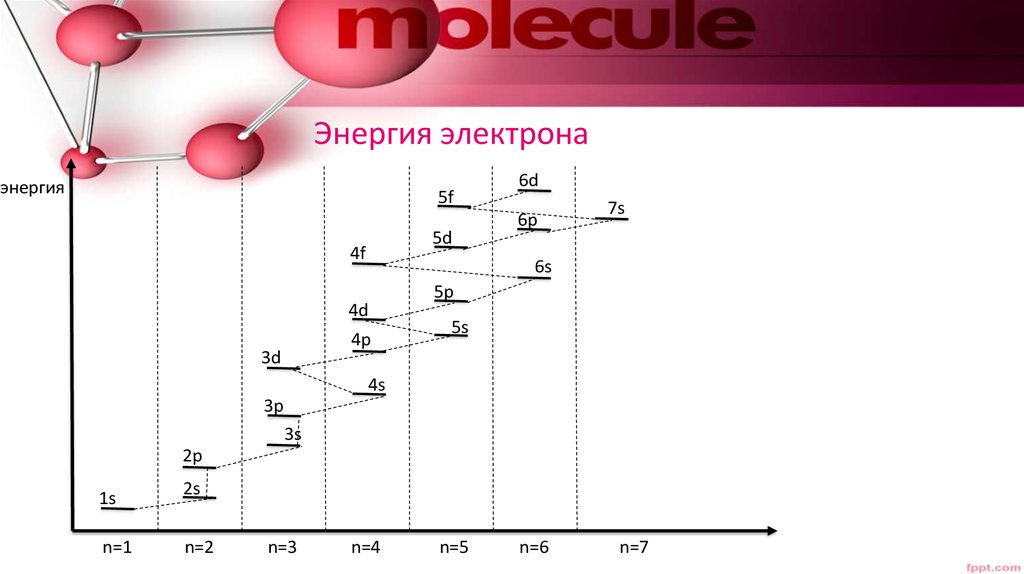
25. Энергия электрона
энергия5f
5d
4f
6p
7s
6s
4d
4p
3d
6d
5p
5s
4s
3p
3s
2p
1s
n=1
2s
n=2
n=3
n=4
n=5
n=6
n=7
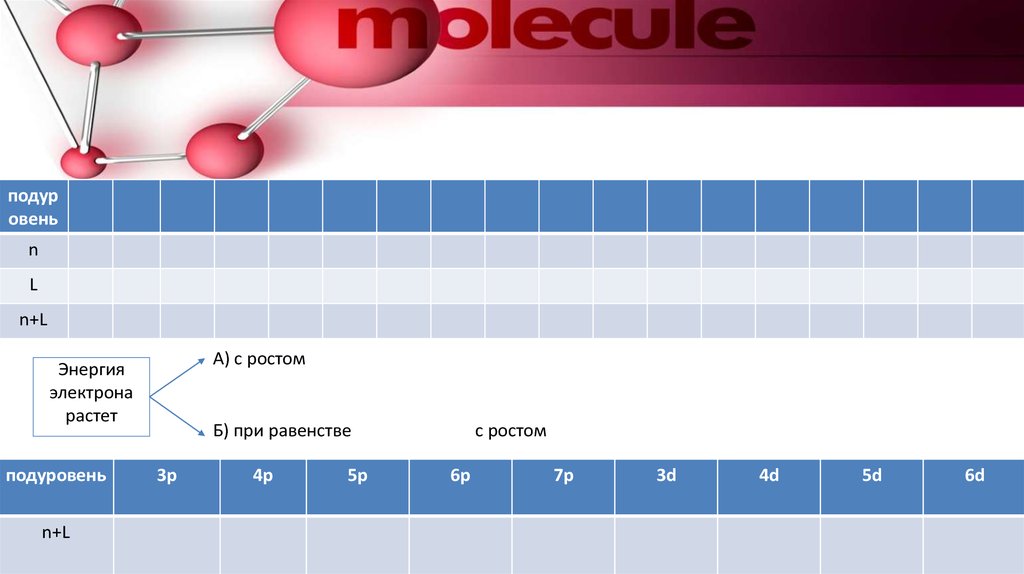
26.
подуровень
n
L
n+L
А) с ростом
Энергия
электрона
растет
подуровень
n+L
Б) при равенстве
3p
4p
5p
с ростом
6p
7p
3d
4d
5d
6d


















 Химия
Химия








