Похожие презентации:
Металлы в природе, общие способы получения металлов
1. Металлы в природе, общие способы получения металлов.
2.
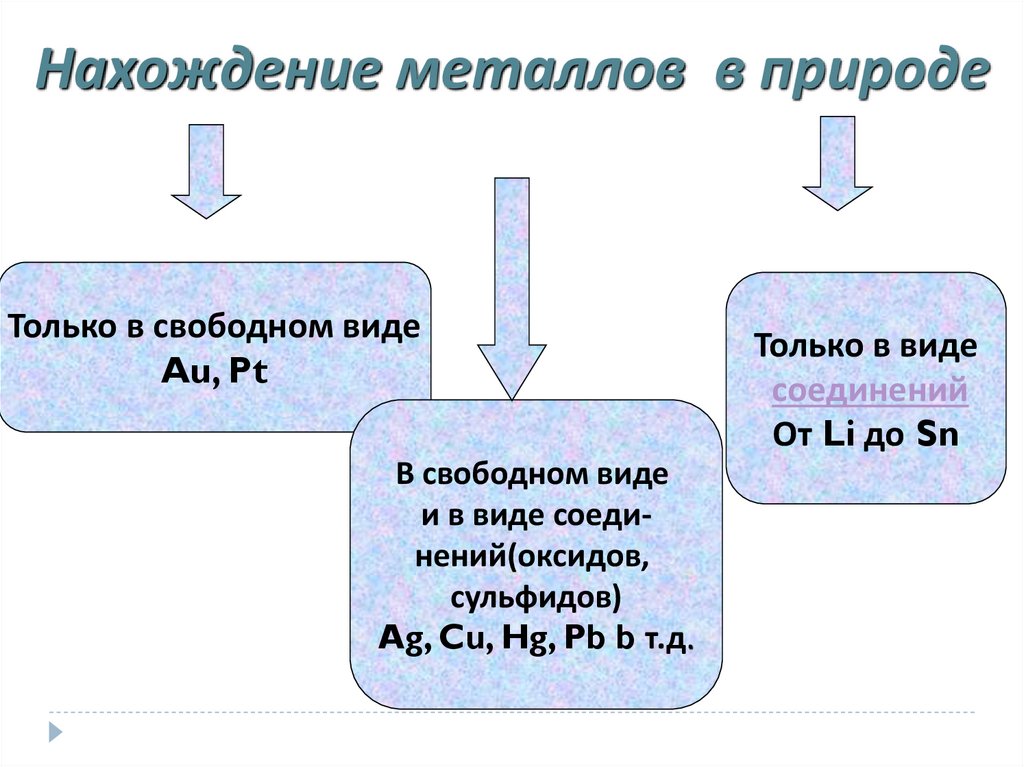
Нахождение металлов в природеТолько в свободном виде
Au, Pt
В свободном виде
и в виде соединений(оксидов,
сульфидов)
Ag, Cu, Hg, Pb b т.д.
Только в виде
соединений
От Li до Sn
3. Золото
4.
Самый большой в мире самородокзолота был найден 19 октября 1872 года на
шахте "Звезда надежды" компании
"Бейерса и Холтермана" в районе Хилл-Энд,
штат Новый Южный Уэльс, Австралия. Этот
золотой самородок имел форму плиты. Ее
габарит составлял: длина 142 см, ширина 66
см, толщина 10 см. Такая "плиточка"
содержала в себе более 82 кг чистого
золота, общий вес плиты с кварцем - 235 кг.
Этот самородок получил название "Плита
Холтермана" и занесен в Книгу рекордов
Гиннеса.
5. Серебро
6.
В 1894 году в шахте «Smuggler Mine» в штатеКолорадо, США, был найден крупнейший в мире
самородок весом 1065 кг. При переплавке из него
получили 835 кг чистого серебра.
7. Сильвинит КСl • NaCl
Сильвинит КСl • NaCl8. Чилийская селитра NaNO3
Чилийская селитра NaNO39. Глауберова соль Na2SO4 · 10 H2O
Глауберова соль Na2SO4 · 10 H2O10. Гипс CaSO4 • 2Н2О
Гипс CaSO4 • 2Н2О11. Гипс
12. Известняк СаСО3
13. Мел
14. Апатиты Ca3(PO4)2
Апатиты Ca3(PO4)215. Магнезит MgCO3
16. Доломит CaCO3 • MgCO3
Доломит CaCO3 • MgCO317. Киноварь HgS
18. Цинковая обманка ZnS (сфалерит)
19. Серный колчедан FeS2 (ПИРИТ)
20. Магнитный железняк Fe3O4
21. Красный железняк Fe2O3
22. Бурый железняк Fe2O3 • Н2О
Бурый железняк Fe2O3 • Н2О23.
Минералы и горные породы, содержащиеметаллы и их соединения и пригодные для
промышленного получения металлов,
называются рудами.
Отрасль промышленности, занимающаяся
получением металлов из руд, называется
металлургией.
24.
Общие способы полученияметаллов:
Пирометаллургия
Гидрометаллургия
Электрометаллургия
25. 1. Пирометаллургия
Восстановление металлов из руд при высокихтемпературах с помощью восстановителей:
углерода, оксида углерода(II), водорода или
металлов алюминия, магния.
Соль → оксид
Соли кислородсодержащих кислот –
термическое разложение:
CuCO3 = CuO + CO2
Соли бескислородных кислот- обжиг:
2ZnS + ЗО2 = 2ZnО + 2SО2
26.
Пирометаллургия – восстановление металлов изруд при высоких температурах с помощью
восстановителей: углерода, оксида углерода(II),
водорода или металлов алюминия, магния.
t
CuO + H2 ⇒ Cu + H2O (баланс)
t
Al + Fe2O3 ⇒ Fe + Al2O3 (баланс)
t
CuO + CO ⇒ Cu + CO2 (баланс)
27.
ГИДРОМЕТАЛЛУРГИЯ - извлечение металлов из рудпри помощи водных растворов химических
реагентов с последующим выделением металлов из
растворов
ZnO + H2SO4 = ZnSO4 + H2O
3ZnSO4 + 2Al = Al2(SO4)3 + 3Zn
28. 2. Гидрометаллургия
1.2.
Получение металлов из растворов их
солей.
Перевод нерастворимого соединения в
раствор:
CuO + H2SO4 = CuSO4 + H2O
Восстановление металла из раствора:
CuSO4 + Fe = FeSO4 + Cu.
29.
Электрометаллургия – это способыполучения металлов с помощью
электрического тока
(электролиза).
2NaCl → 2Na + Cl2
MgBr2 → Mg + Br2
30. Микробиологические методы получения металлов.
Большого внимания заслуживаютмикробиологические методы получения металлов, в
которых используется жизнедеятельность некоторых
видов бактерий. Например, так называемые тионовые
бактерии способны переводить нерастворимые
сульфиды в растворимые сульфаты. В частности, такой
бактериальный метод применяется для извлечения
меди из ее сульфидных руд непосредственно на месте
их залегания. Далее рабочий раствор, обогащенный
сульфатом меди(II), подается на
гидрометаллургическую переработку.






























 Химия
Химия








