Похожие презентации:
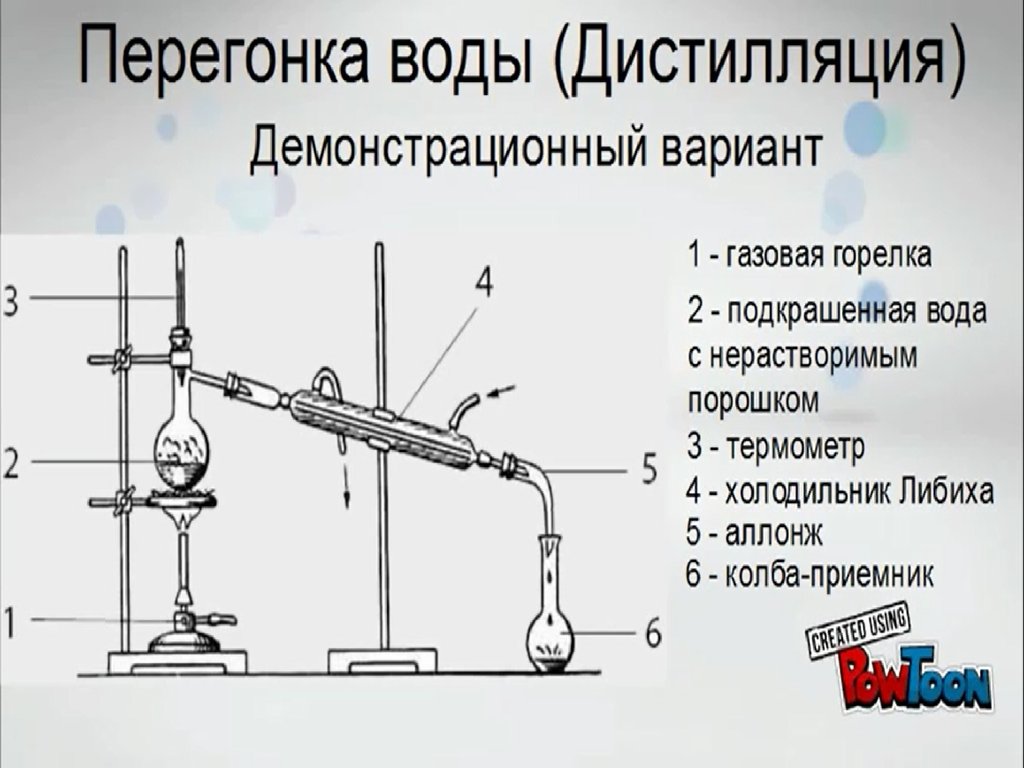
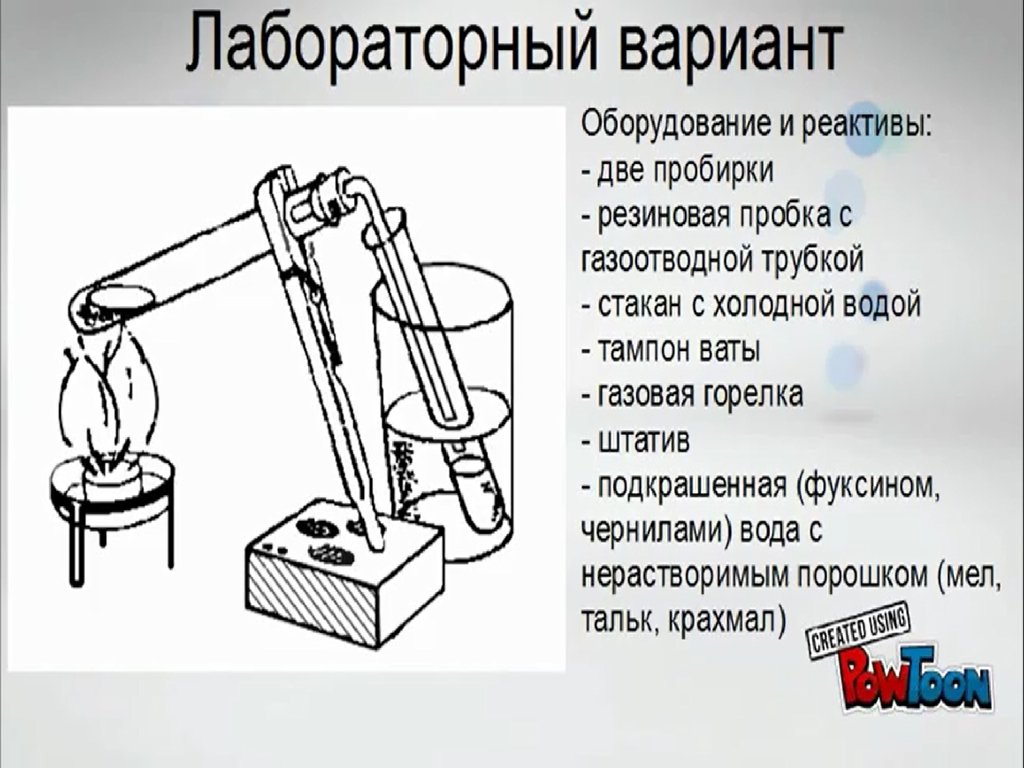
Перегонка воды (дистилляция). Демонстрационный вариант
1.
2.
3.
4.
5.
6.
7.
8.
9. Взаимодействие щелочных и щелочно-земельных металлов с водой
I. ЛитийОборудование: чашка Петри, лучинка.
Реактивы: литий, вода, фенолфталеин.
Ход работы:
1) Наливаем в простоквашницу воду, добавив фенолфталеин
2) Достаем литий из парафина, в котором он хранится;
3) Отрезаем скальпелем маленький кусочек лития;
4) Кладем его в воду, наблюдаем , что литий «бегает» по воде, так
как его толкает выделяющийся водород. Кусочек лития не
плавится.
2Li+2H2O=2LiOH+H2↑
5) Лучинкой поджигаем выделяющийся газ, наблюдаем пламя
ярко-красного цвета.
10.
II. НатрийОборудование: чашка Петри, пинцет, фильтровальная бумага.
Ход работы:
а) Приготовим дистиллированную воду и добавим к воде фенолфталеина.
Фенолфталеин изменит окраску, когда в растворе появится щелочь. Счищаем
оксидную пленку и опускаем натрий в воду. Металл бурно взаимодействует с водой.
Выделяется газообразный водород.
Фенолфталеин становится малиновым: в растворе образовалась щелочь - едкий натр.
2Na + 2H2O = 2NaOH + H2 ↑
б) На поверхность воды положить кусочек фильтровальной бумаги и на нее кусочек
металла.
Происходит 2 процесса:
2Na + 2H2O = 2NaOH + H2 ↑
2) 2Na + O2 = Na2O2
Na2O2 + 2H2O = 2NaOH + H2O2
H2O2 = H2O + O2 ↑
1)
11.
III.КалийОборудование: стакан, воронка.
Реактивы: калий, вода, фенолфталеин.
Ход работы:
Стакан 0,5 л заполнить на ¾ водой. Положить кусочек
калия на поверхность воды и сразу же закрыть воронкой.
Наблюдать фиолетовое пламя горящего калия. В конце
реакции всегда происходит небольшой взрыв, поэтому
нельзя снимать воронку до окончания реакции.
Полученный раствор испытать фенолфталеином.
2K+2H2O = 2KOH+H2↑
12.
IV.КальцийОборудование: фильтровальная бумага,
напильник, марля, тигельные щипцы,
цилиндр.
Реактивы: кальций, вода.
Ход работы: Кальций осушить
фильтровальной бумагой и зачистить
напильником. Завернуть кальций в марлю.
Захватить тигельными щипцами и подвести
под цилиндр заполненный водой.
Са + 2Н2О = Са(ОН)2 + Н2 ↑
13.
V. МагнийОборудование: асбестовая сетка, пробирка,
держатель, плитка, колба.
Реактивы: вода, стружки магния
Ход работы:
а) На демонстрационный стол положить асбестовую
сетку, на нее насыпать горку стружек магния.
Приготовить пробирку с водой, закрепленной в
держателе. Стружки магния поджечь. Когда магний
хорошо разгорится, полить на него водой.
Наблюдать образование белых «иголок».
Mg+2H2O=Mg(OH) 2 ↓+H2↑
14. Магний
Оборудование: асбестовая сетка, плитка, колба,ложечка.
Реактивы: вода, порошок магния
Ход работы:
б)Асбестовую сетку положить на плитку, на нее
поставить колбу с водой (плиту включить
заранее, чтобы вода закипела). На ложечку
поместить порошок магния, поджечь и внести в
колбу. Держать ложечку над поверхностью
воды, чуть касаясь воды.
15. Магний
Оборудование: пробирка, тюльпанообразная воронка, 2спиртовки, тарелка, штатив, картонная лопаточка.
Реактивы: речной песок, порошок магния.
Ход работы:
в) В пробирку положить немного речного песка (1,5 см) через
тюльпанообразную воронку налить воду, чтобы смочить
песок, вынуть резко воронку( не намочив края). Закрепить
пробирку в лапке штатива над тарелкой с песком. С
помощью картонной лопаточки поместить в пробирку
магний. Нагреваем магний активно, а воду слегка. Когда
магний раскалится, начинаем активно нагревать воду.
Образующийся водород загорается.
Mg + H2O = MgO + H2↑
16.
17. Опыт «Примораживание стакана»
Оборудование: стакан, деревянная дощечка,стеклянная палочка.
Реактивы: вода, нитрат аммония.
Ход работы: В тонкостенный стаканчик объемом
50 мл с плоским (не вогнутым внутрь) дном
наливают 1/3 воды и ставят его на деревянную
дощечку. Под дно стаканчика наливают немного
воды (d капли ≈ 2,5 см), высыпают в стаканчик с
налитой в него водой измельченный нитрат
аммония и перемешивают стеклянной палочкой,
придерживая стаканчик рукой, чтобы не сдвигать
его с места.
18. Опыт «Закипание эфира при растворении гидроксида натрия»
Оборудование: пробирка, газоотводная трубка, стакан,стеклянная палочка с резиновым наконечником.
Реактивы: вода, серный эфир, гидроксид натрия.
Ход работы: В пробирку, снабженную пробкой с
газоотводной трубкой, изогнутой наливают 2—3 мл серного
эфира. В стакан емкостью 100 мл наливают 40—50 мл воды
и осторожно всыпают около одной чайной ложки едкого
натра и взбалтывают стеклянной палочкой с надетым на
конце куском резиновой трубки, чтобы случайно не
пробить дно стакана. В образовавшийся горячий раствор
опускают пробирку с эфиром и продолжают взбалтывание.
Через некоторое время эфир закипает, и пары его можно
зажечь у оттянутого конца стеклянной трубки.
















 Химия
Химия








