Похожие презентации:
Химия и патохимия кислотно-основного гомеостаза
1. ХИМИЯ И ПАТОХИМИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
ПИУВ – филиал ФГБОУ ДПО РМАНПОМинздрава России
Кафедра клинической лабораторной диагностики
ХИМИЯ И ПАТОХИМИЯ
КИСЛОТНО-ОСНОВНОГО
ГОМЕОСТАЗА
Врач-ординатор кафедры КЛД Вахитова А.С.
1
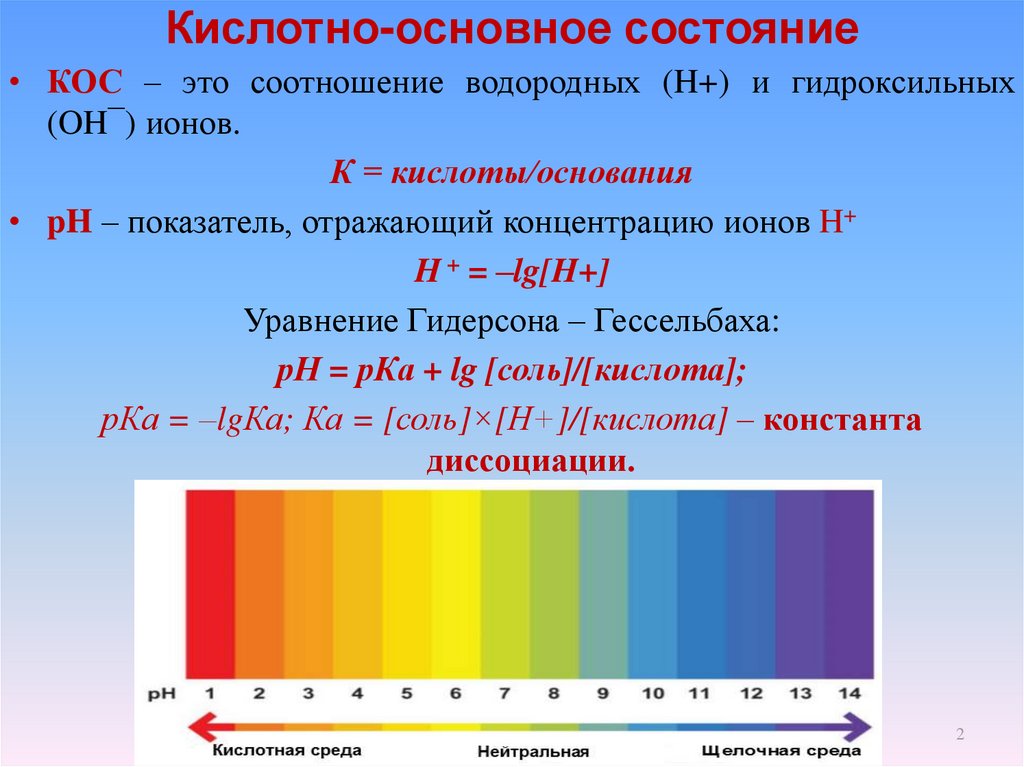
2. Кислотно-основное состояние
• КОС – это соотношение водородных (H+) и гидроксильных(OH¯) ионов.
К = кислоты/основания
• pH – показатель, отражающий концентрацию ионов H+
H + = –lg[H+]
Уравнение Гидерсона – Гессельбаха:
рН = рКа + lg [соль]/[кислота];
рКа = –lgКа; Ка = [соль]×[Н+]/[кислота] – константа
диссоциации.
2
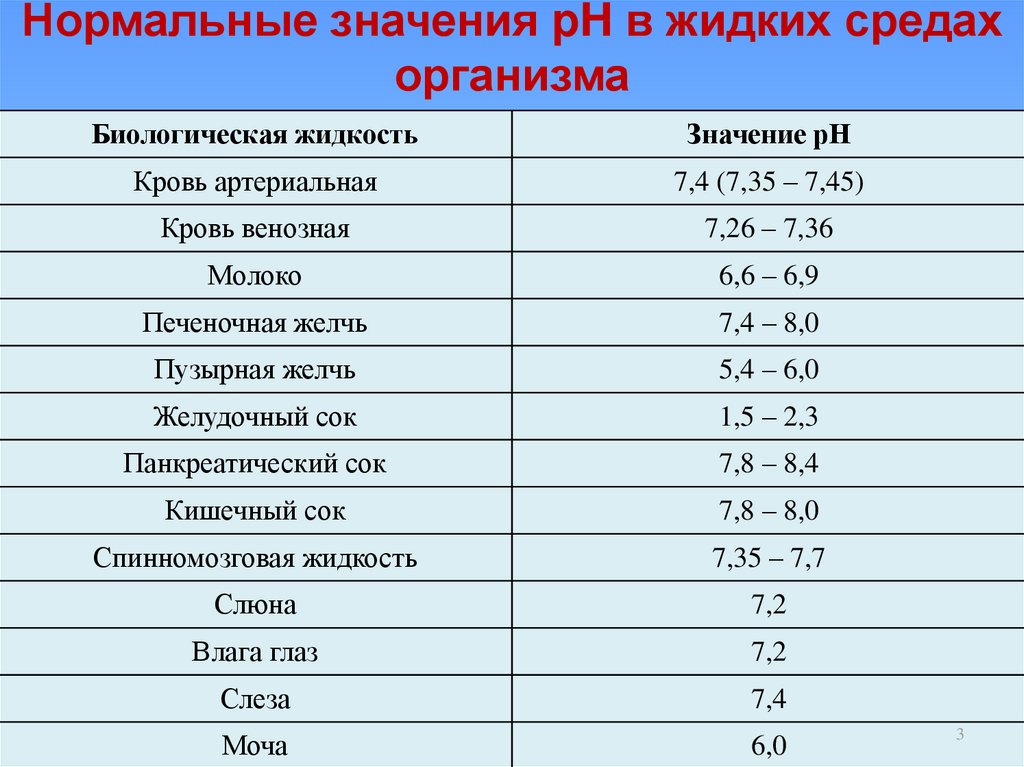
3. Нормальные значения pH в жидких средах организма
Биологическая жидкостьЗначение рН
Кровь артериальная
7,4 (7,35 – 7,45)
Кровь венозная
7,26 – 7,36
Молоко
6,6 – 6,9
Печеночная желчь
7,4 – 8,0
Пузырная желчь
5,4 – 6,0
Желудочный сок
1,5 – 2,3
Панкреатический сок
7,8 – 8,4
Кишечный сок
7,8 – 8,0
Спинномозговая жидкость
7,35 – 7,7
Слюна
7,2
Влага глаз
7,2
Слеза
7,4
Моча
6,0
3
4. Образование кислот и оснований в процессе обмена веществ
Кислотылетучие (Н2СО3)
нелетучие (H2SO4; H2PO4¯)
H+ в плазме
С дыханием выделяется 230 мл CO2 в 1 мин.
Нелетучие кислоты метаболизируются
либо выделяются с мочой.
Факторы, определяющие КОС: величина легочной
вентиляции, функции почек, уровень оксигенации,
интенсивность метаболизма, состояние гемодинамики.
4
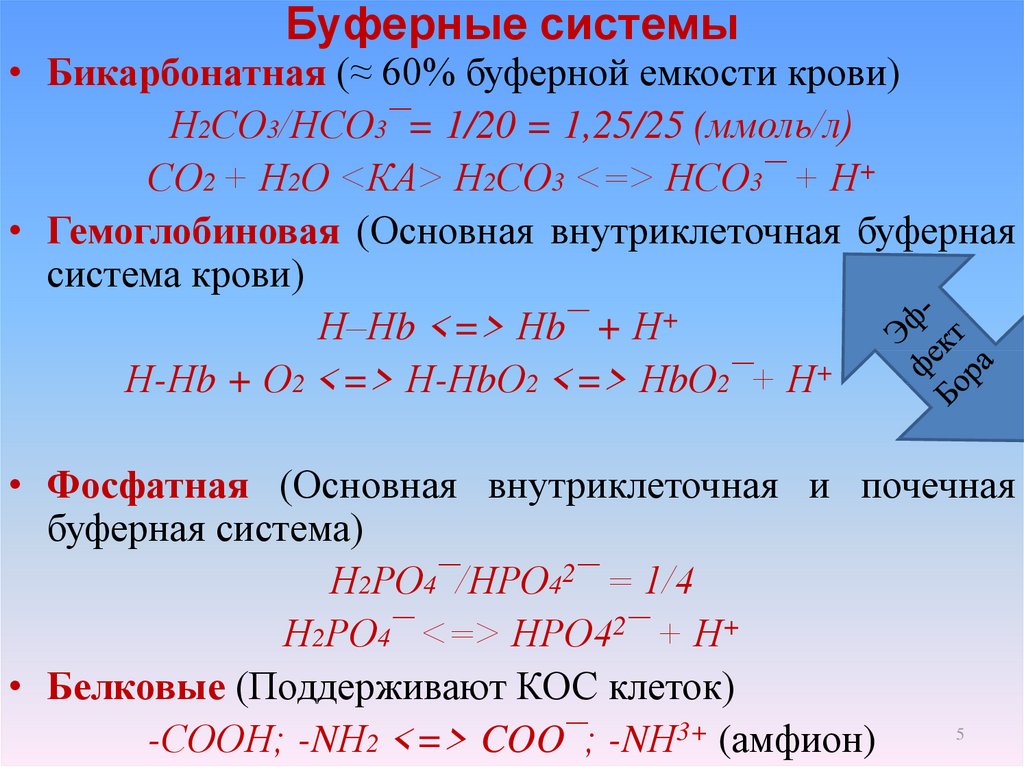
5. Буферные системы
• Бикарбонатная (≈ 60% буферной емкости крови)Н2СО3/НСО3¯= 1/20 = 1,25/25 (ммоль/л)
СО2 + Н2О <КА> Н2СО3 <=> НСО3¯ + Н+
• Гемоглобиновая (Основная внутриклеточная буферная
система крови)
Н–Нb <=> Нb¯ + Н+
Н-Нb + О2 <=> Н-НbО2 <=> НbО2¯+ Н+
• Фосфатная (Основная внутриклеточная и почечная
буферная система)
Н2РО4¯/НРО42¯ = 1/4
Н2РО4¯ <=> НРО42¯ + Н+
• Белковые (Поддерживают КОС клеток)
5
-СООН; -NН2 <=> COO¯; -NН3+ (амфион)
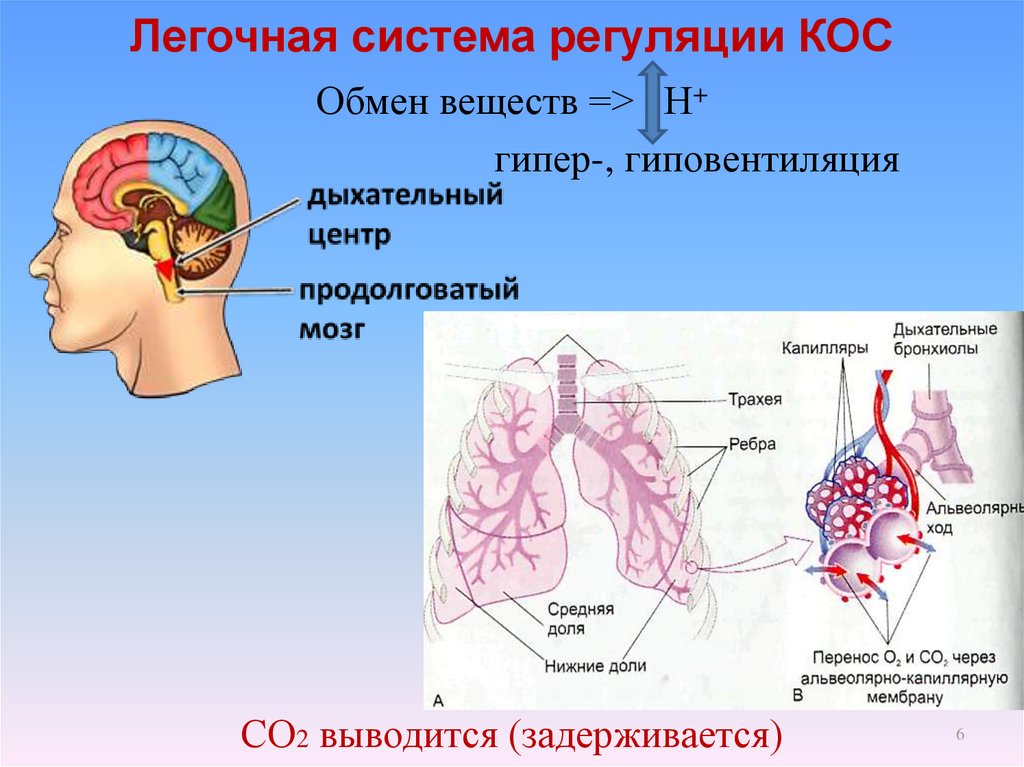
6. Легочная система регуляции КОС
Обмен веществ => Н+гипер-, гиповентиляция
СО2 выводится (задерживается)
6
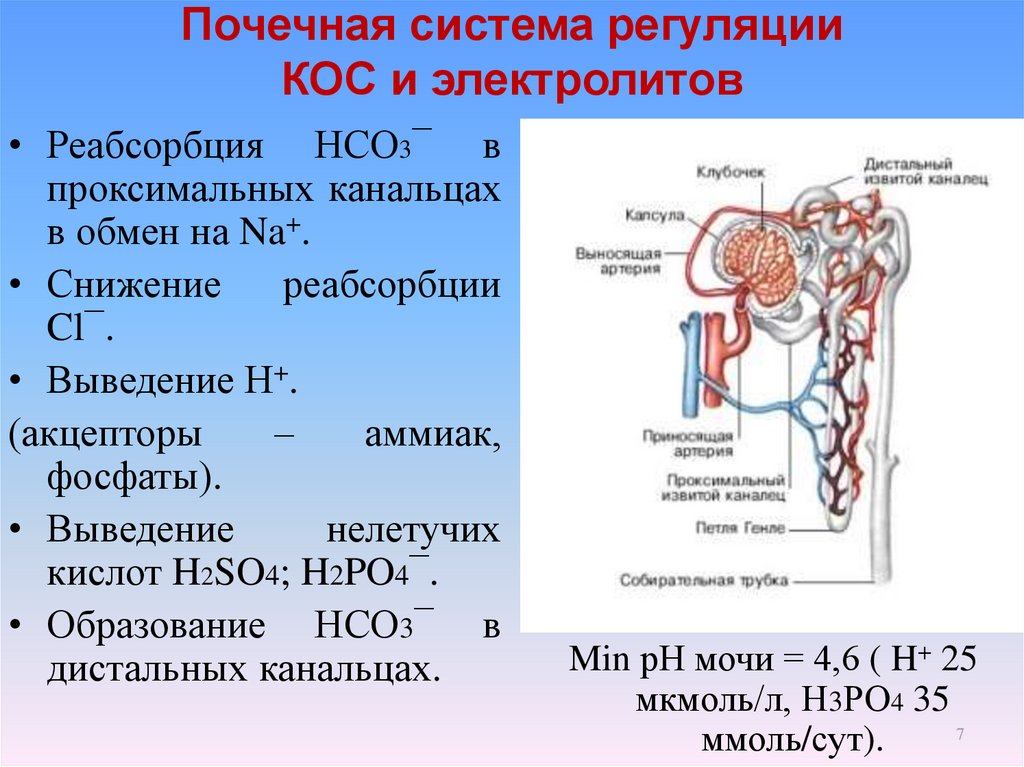
7. Почечная система регуляции КОС и электролитов
• Реабсорбция НСО3¯ впроксимальных канальцах
в обмен на Na+.
• Снижение
реабсорбции
Cl¯.
• Выведение Н+.
(акцепторы
–
аммиак,
фосфаты).
• Выведение
нелетучих
кислот H2SO4; H2PO4¯.
• Образование НСО3¯ в
дистальных канальцах.
Min рН мочи = 4,6 ( H+ 25
мкмоль/л, Н3РО4 35
7
ммоль/сут).
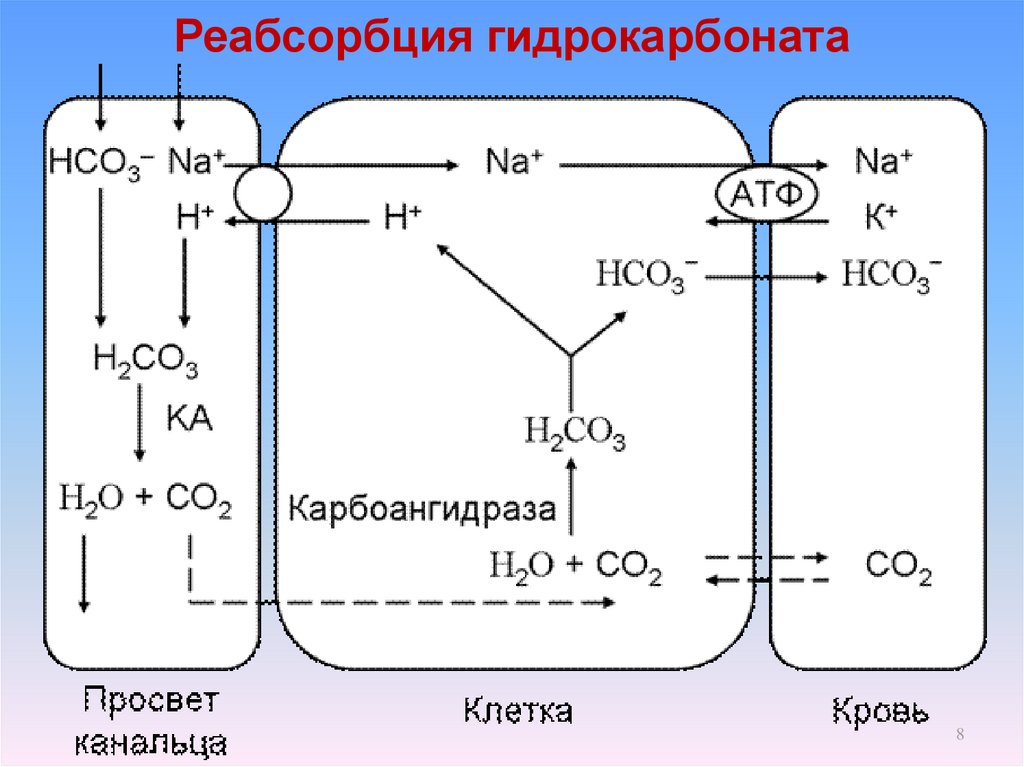
8. Реабсорбция гидрокарбоната
89.
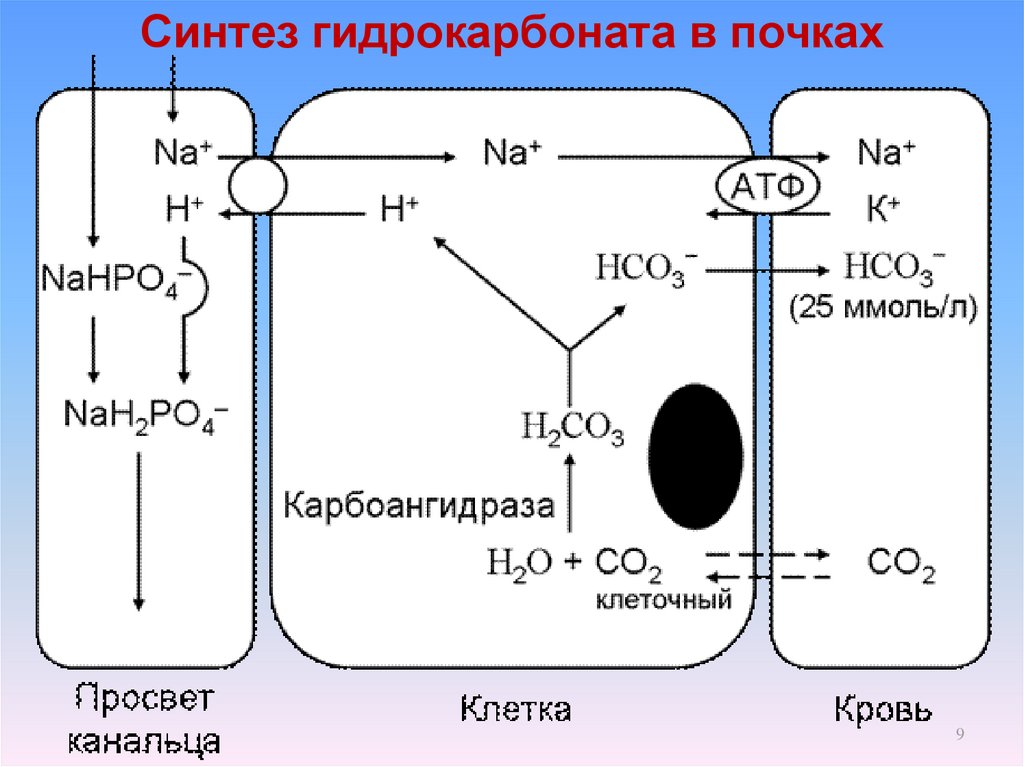
Синтез гидрокарбоната в почках9
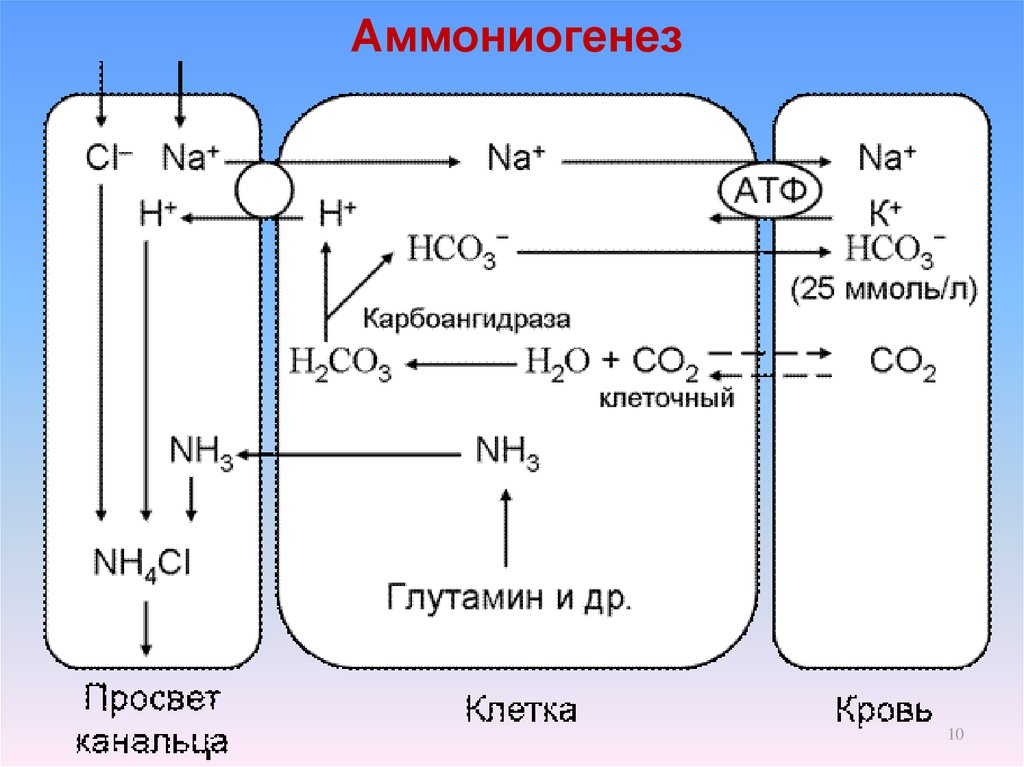
10. Аммониогенез
1011. Кислотность мочи
Выводимые с мочой кислоты образуют 3 фракции.1). Фракция свободных ионов водорода (1%) - актуальная
кислотность мочи определяется рН-метром или
ионометром.
2). Протоны в составе Н2РО4¯ (45%) - потенциальная
кислтность определяют титрованием щелочью (титруемая
кислотность).
3). Ионы Н+, выделяемые в составе аммонийных солей
(54%) определяют биохимическими методами.
11
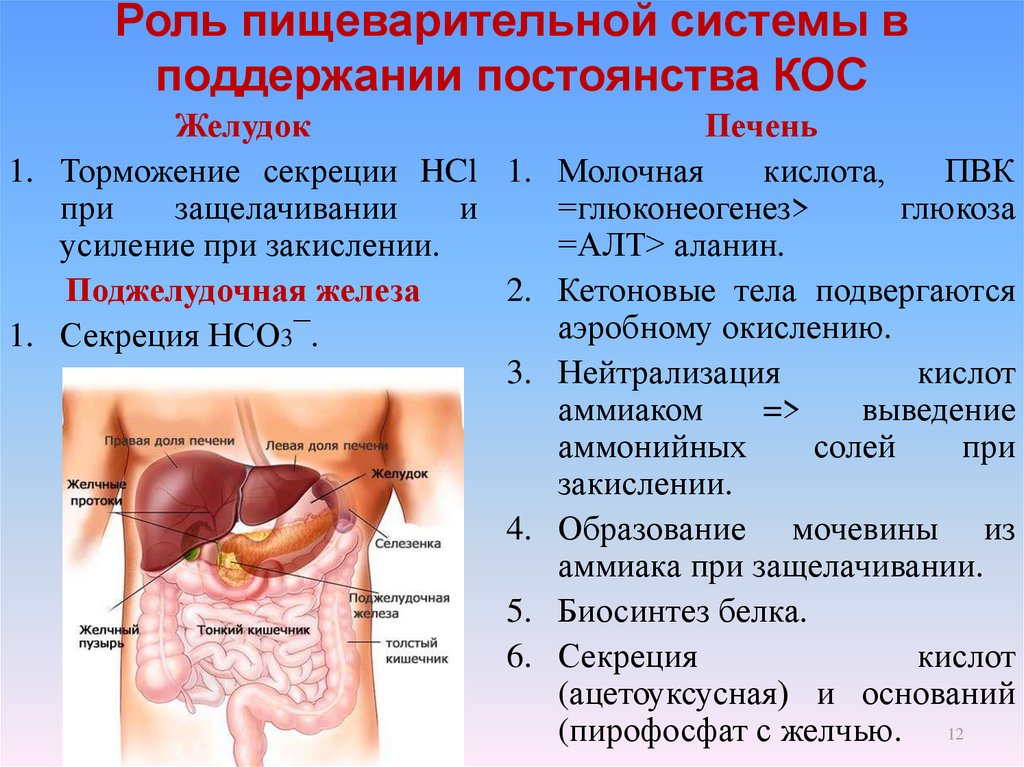
12. Роль пищеварительной системы в поддержании постоянства КОС
ЖелудокПечень
1. Торможение секреции HCl 1. Молочная
кислота,
ПВК
при
защелачивании
и
=глюконеогенез>
глюкоза
усиление при закислении.
=АЛТ> аланин.
Поджелудочная железа
2. Кетоновые тела подвергаются
аэробному окислению.
1. Секреция НСО3¯.
3. Нейтрализация
кислот
аммиаком
=>
выведение
аммонийных
солей
при
закислении.
4. Образование мочевины из
аммиака при защелачивании.
5. Биосинтез белка.
6. Секреция
кислот
(ацетоуксусная) и оснований
(пирофосфат с желчью. 12
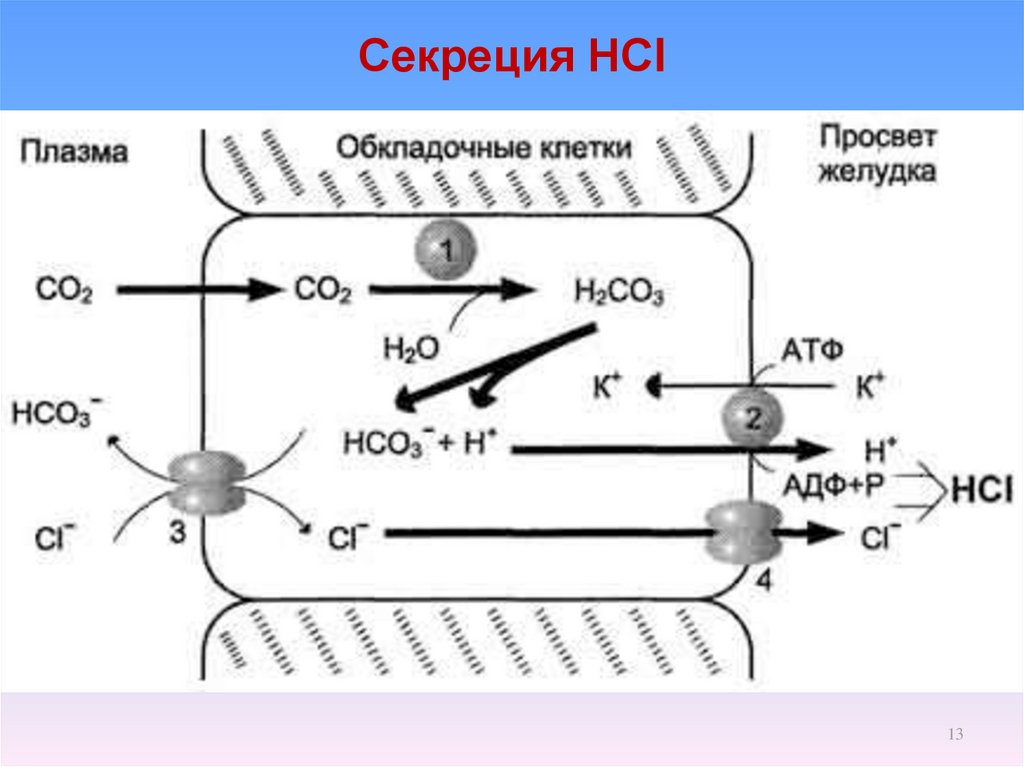
13. Секреция НСl
1314. Роль костной ткани в поддержании постоянства КОС
1. Процесс минерализации костной ткани сопряжен собразованием Н+ (физиологический ацидоз у детей).
2. При ацидозе из костной ткани в кровь поступает Са2+ и
фосфаты => деминерализация костей.
3. Костная ткань – резерв Na+ при ацидозе, необходимого
для синтеза НСО3¯ в почках.
14
15.
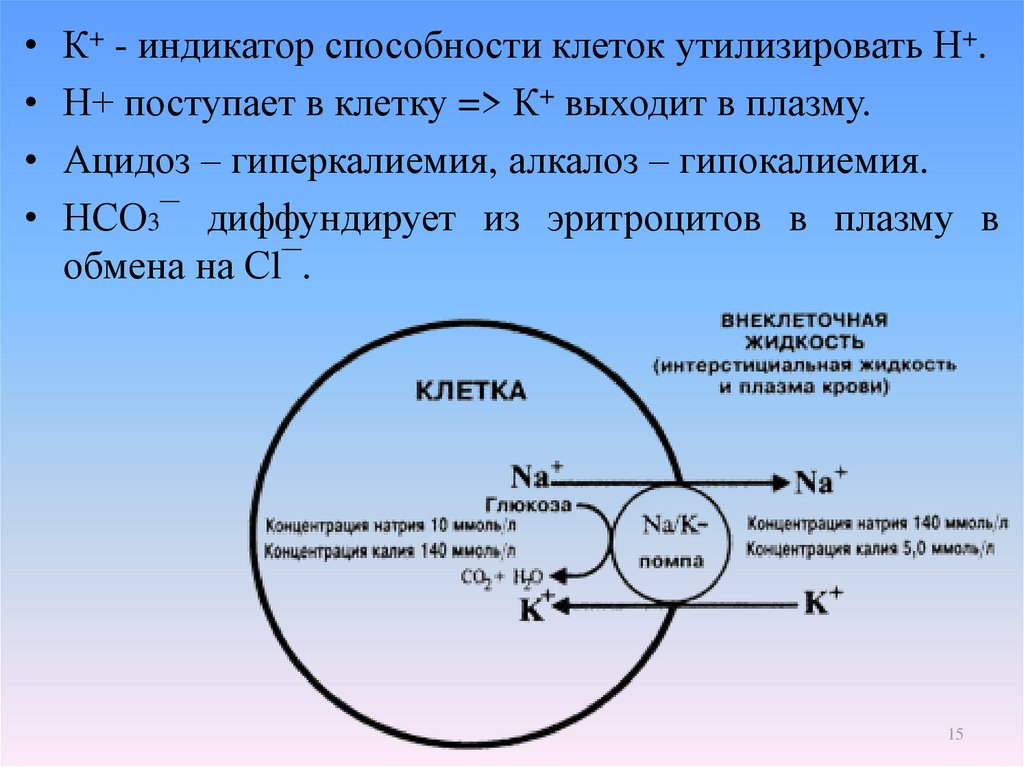
К+ - индикатор способности клеток утилизировать Н+.
Н+ поступает в клетку => К+ выходит в плазму.
Ацидоз – гиперкалиемия, алкалоз – гипокалиемия.
НСО3¯ диффундирует из эритроцитов в плазму в
обмена на Сl¯.
15
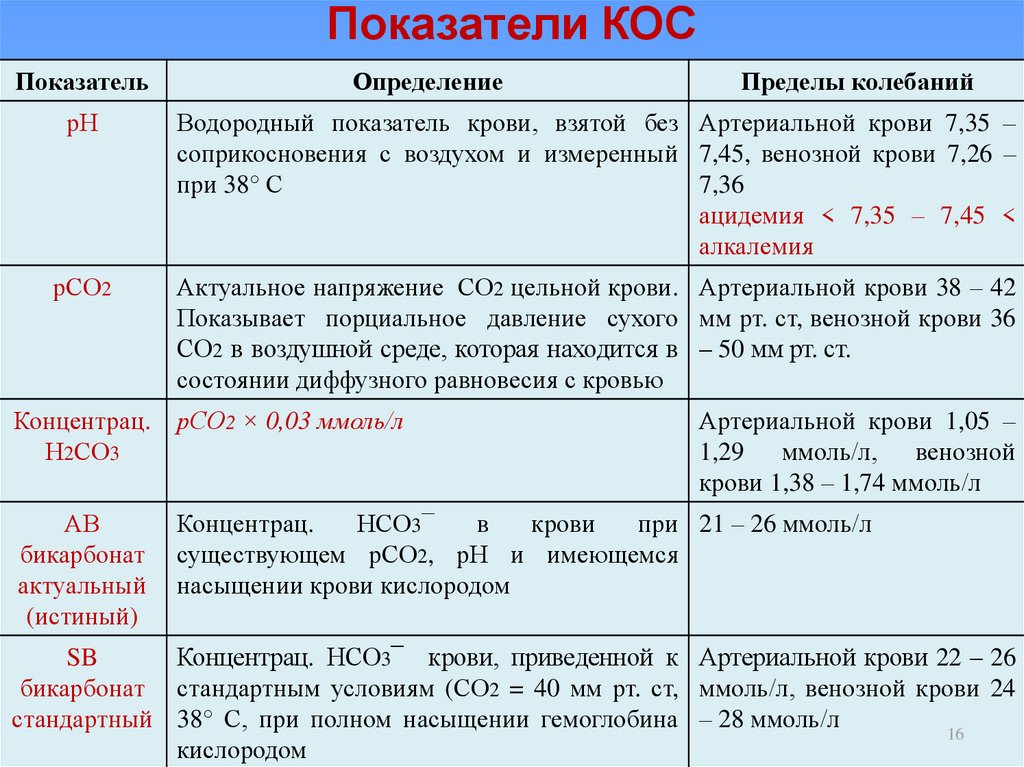
16. Показатели КОС
ПоказательОпределение
Пределы колебаний
рН
Водородный показатель крови, взятой без Артериальной крови 7,35 –
соприкосновения с воздухом и измеренный 7,45, венозной крови 7,26 –
при 38° С
7,36
ацидемия < 7,35 – 7,45 <
алкалемия
рСО2
Актуальное напряжение СО2 цельной крови. Артериальной крови 38 – 42
Показывает порциальное давление сухого мм рт. ст, венозной крови 36
СО2 в воздушной среде, которая находится в – 50 мм рт. ст.
состоянии диффузного равновесия с кровью
Концентрац.
Н2СО3
рСО2 × 0,03 ммоль/л
Артериальной крови 1,05 –
1,29 ммоль/л, венозной
крови 1,38 – 1,74 ммоль/л
АВ
бикарбонат
актуальный
(истиный)
Концентрац.
НСО3¯
в
крови
при 21 – 26 ммоль/л
существующем рСО2, рН и имеющемся
насыщении крови кислородом
SB
Концентрац. НСО3¯ крови, приведенной к Артериальной крови 22 – 26
бикарбонат стандартным условиям (СО2 = 40 мм рт. ст, ммоль/л, венозной крови 24
стандартный 38° С, при полном насыщении гемоглобина – 28 ммоль/л
16
кислородом
17.
ВВбуферные основания
крови (Buffer Bases)
Сумма всех анионов, обладающих 40 – 60 ммоль/л или 41,7 +
буферным действием при полном (0,42 × Нb г/дл)
насыщении крови кислородом, 38°
С, зависит от концентрации Нb*
NBB
Сумма всех анионов обладающих 40 – 60 ммоль/л
нормальные буферные буферным действием при полном
основания
насыщении Нb кислородом в
стандартных условиях (СО2 = 40 мм
рт. ст, 38° С, рН 7,38)
ВЕ избыток (дефицит) Разность между ВВ и NBB
буферных оснований
(Buffer Excess)
ТСО2
общее содержание
СО2
Суммарная концентрац. НСО3¯ и 23 – 33 ммоль/л или 52 – 73
Н2СО3 в физиологических условиях. об. %
ТСО2 = АВ + рСО2 × 0,03 ммоль/л
Концентрация Нb г/дл*
ВВ ммоль/л
8
45
13
47
15
48
20
± 2,5 ммоль/л
50
17
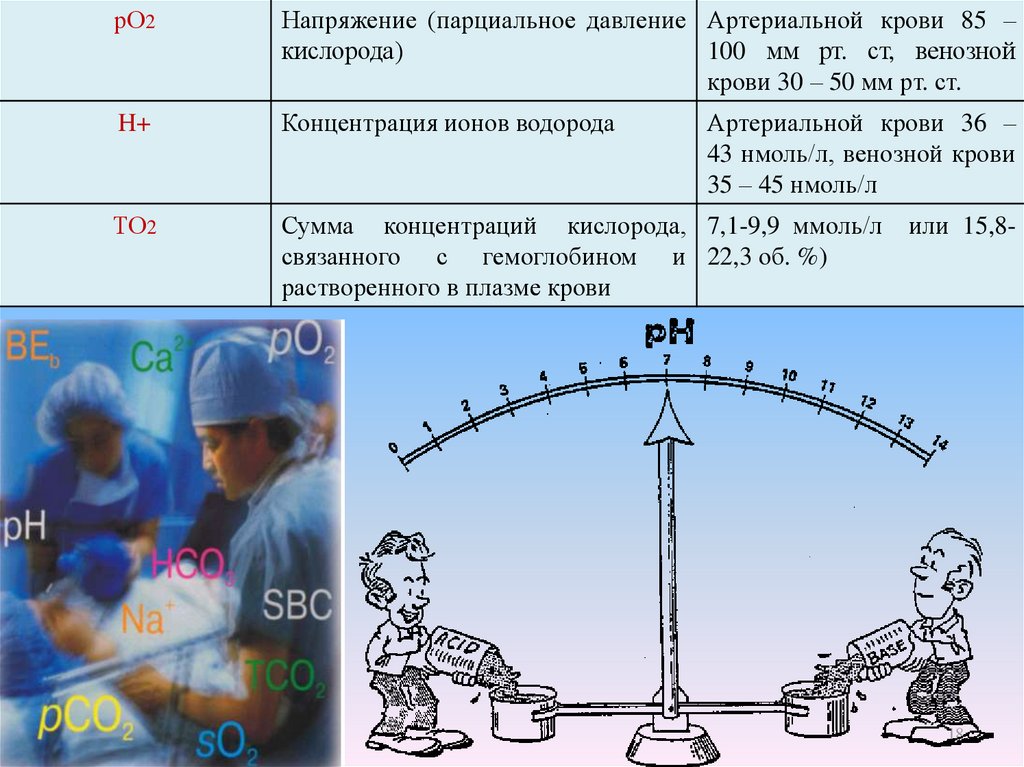
18.
рО2Напряжение (парциальное давление Артериальной крови 85 –
кислорода)
100 мм рт. ст, венозной
крови 30 – 50 мм рт. ст.
H+
Концентрация ионов водорода
ТО2
Сумма концентраций кислорода, 7,1-9,9 ммоль/л
связанного с гемоглобином и 22,3 об. %)
растворенного в плазме крови
Артериальной крови 36 –
43 нмоль/л, венозной крови
35 – 45 нмоль/л
или 15,8-
18
19. Преаналитический этап исследования показателей КОС
• Состав артериальной крови стабильнее венозной посодержанию О2 и Н2СО3.
• Лучше
использовать
артериализированную
кровь,
полученную путем глубокого прокола мякоти пальца
прогретой руки или мочки уха.
• Материал берут анаэробно (вакуумные пробирки с
гепарином (не менее 100 ЕД на 1 мл) и системой для
перемешивания).
• Анализ выполняют в течении 20 мин. после забора.
• Первые 2 капли из пробирки удаляются безворсовой
салфеткой, перед тем, как проба вводится в анализатор.
• В случае невозможности экспресс анализа крови помещают
в холодильник, не допуская замораживания крови и
гемолиза.
19
20. Анализатор критических состояний Cobas b 121 (анализатор газов крови и электролитов)
2021. Картриджный анализатор ALB800 FLEX
2122. Монитор Tina ТСМ4
Позволяет непрерывно контролировать газовый составкрови (рО2, рСО2) с помощью одного электрода,
прикрепленного к коже.
22
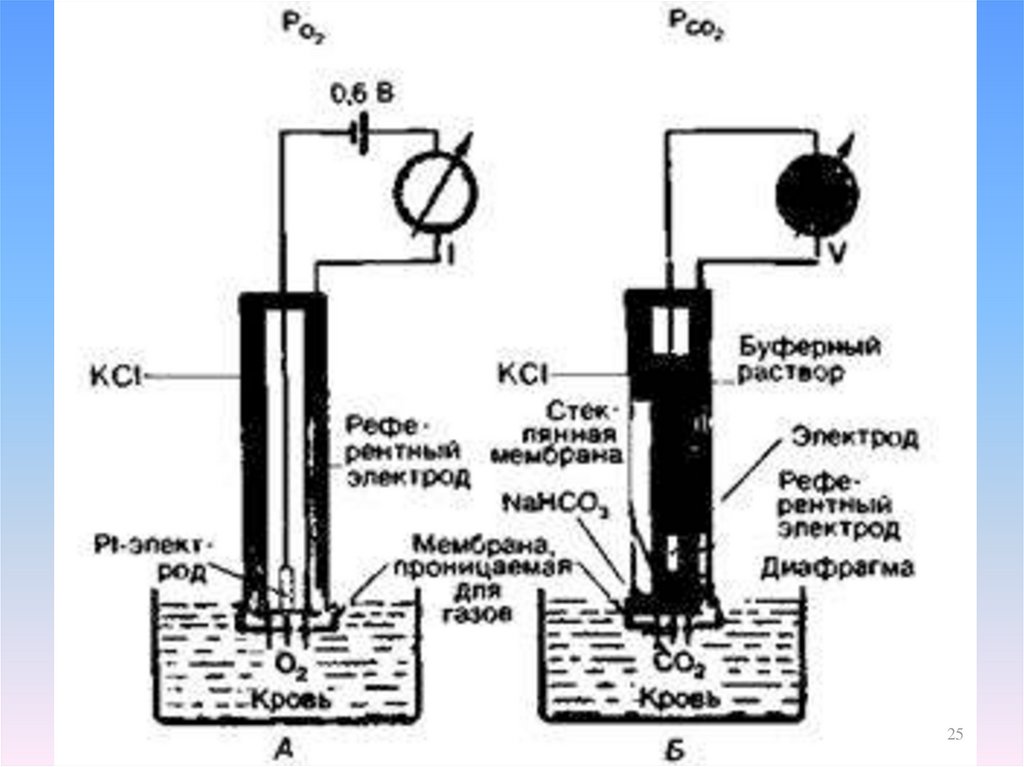
23. Анализ газов крови
• рСО2 электрод – стеклянный электрод для измерения рН,отделенный от исследуемого раствора селективно
проницаемой мембраной для СО2.
• Пространство между мембранами заполнено раствором
NaCl и NaНСО3¯.
• Растворенный СО2 диффундирует в раствор, происходит
образование Н2СО3 <=> НСО3¯ + Н+.
• рН электролитного раствора изменяется пропорционально
рСО2 и регистрируется стеклянным электродом.
23
24. Гемоксиметрия
• Измерение рО2 – амперометрический метод сприменением электрода Кларка (катод – платиновая
проволока, вплавленная в стеклянный цилиндр, анод –
Аg/AgCl проволока, погруженная в раствор Н2РО4¯,
НРО42¯, Н+ и КСl).
• О2 диффундирует через полупроницаемую мембрану в
раствор, где он восстанавливается на катоде.
• Сила образующегося при этом тока пропорциональна
рО2.
24
25.
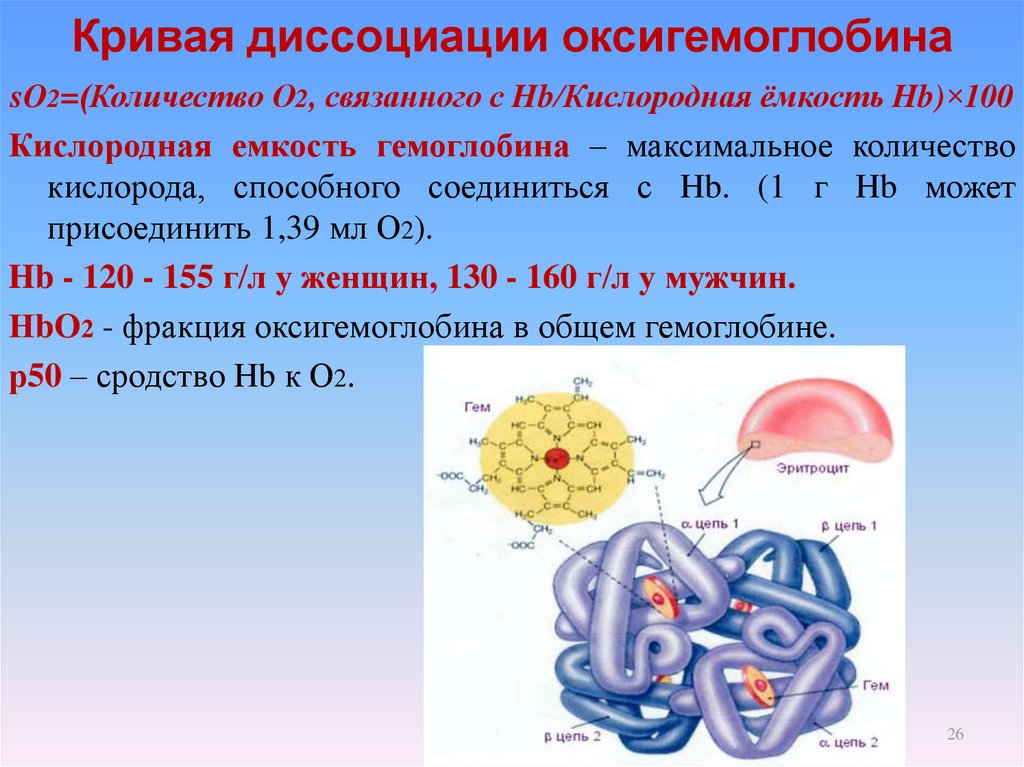
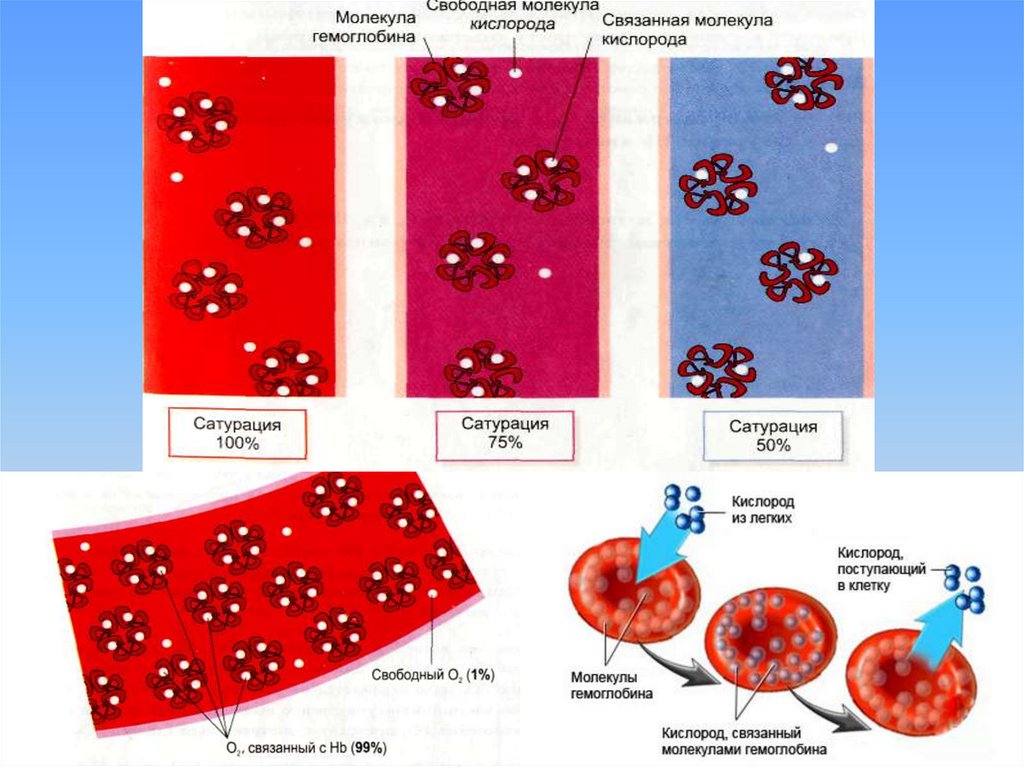
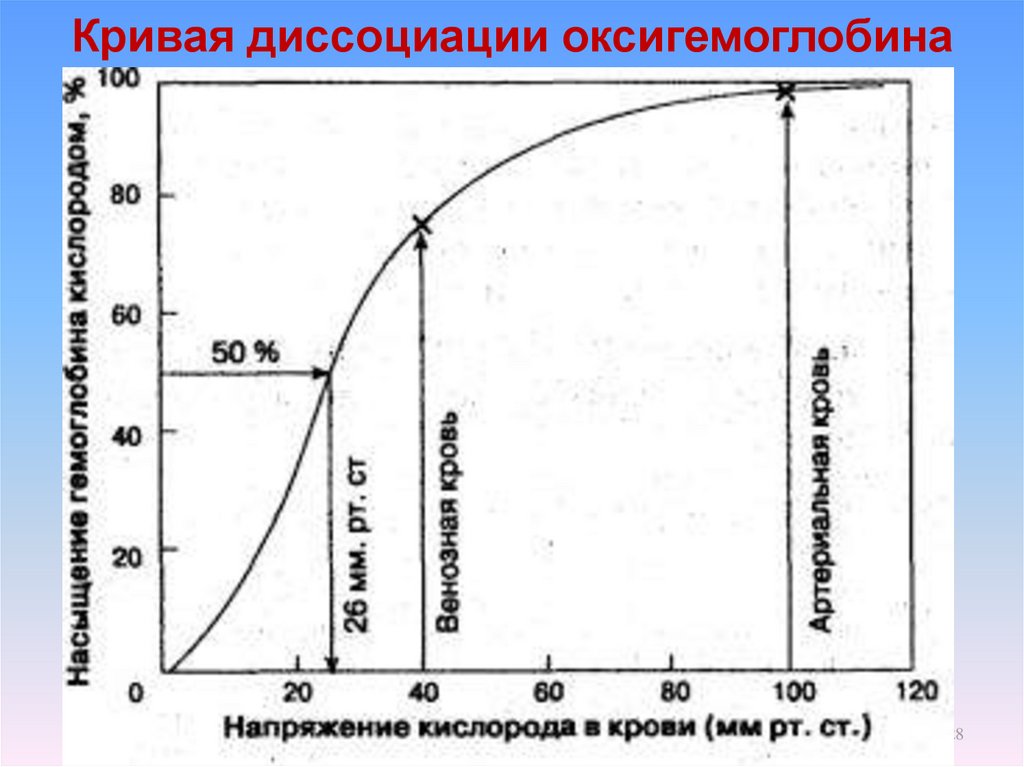
2526. Кривая диссоциации оксигемоглобина
sO2=(Количество О2, связанного с Hb/Кислородная ёмкость Hb)×100Кислородная емкость гемоглобина – максимальное количество
кислорода, способного соединиться с Hb. (1 г Hb может
присоединить 1,39 мл О2).
Hb - 120 - 155 г/л у женщин, 130 - 160 г/л у мужчин.
НbO2 - фракция оксигемоглобина в общем гемоглобине.
р50 – сродство Hb к О2.
26
27.
2728. Кривая диссоциации оксигемоглобина
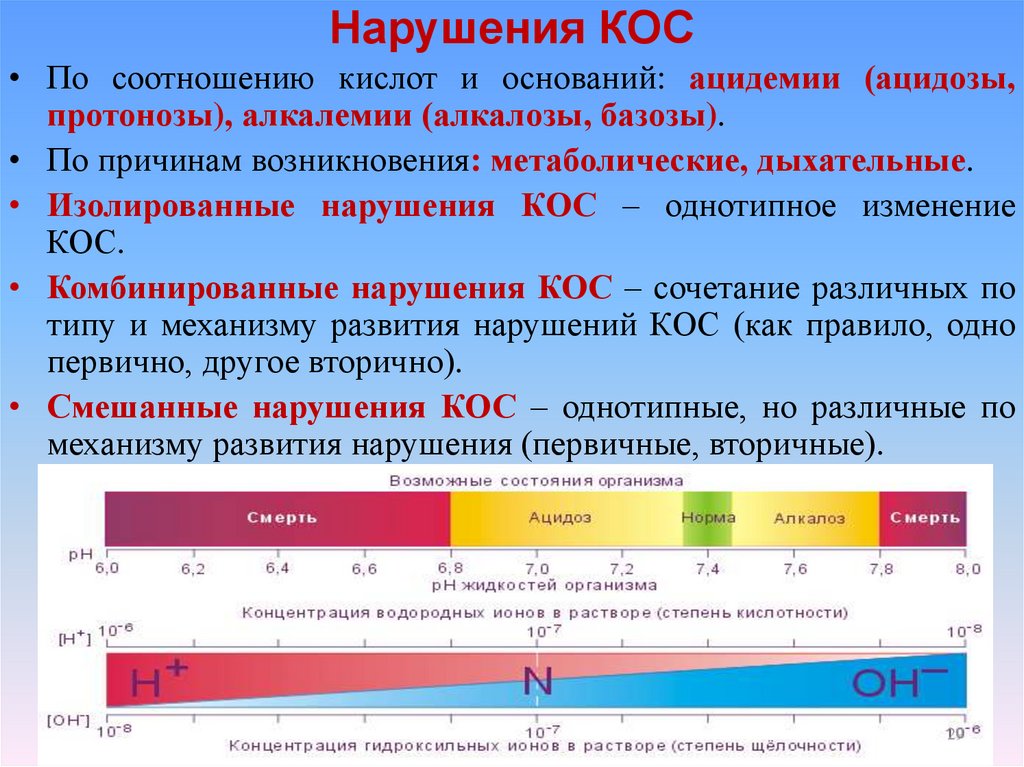
2829. Нарушения КОС
• По соотношению кислот и оснований: ацидемии (ацидозы,протонозы), алкалемии (алкалозы, базозы).
• По причинам возникновения: метаболические, дыхательные.
• Изолированные нарушения КОС – однотипное изменение
КОС.
• Комбинированные нарушения КОС – сочетание различных по
типу и механизму развития нарушений КОС (как правило, одно
первично, другое вторично).
• Смешанные нарушения КОС – однотипные, но различные по
механизму развития нарушения (первичные, вторичные).
29
30. Метаболические нарушения КОС
• Продукционные – обусловлены первичным иливторичным нарушением клеточного метаболизма,
приводящему к усиленному образованию и
накоплению в организме стойких кислот (молочная,
ацетоуксусная, серная, бетаоксимасляная).
• Ретенционные – обусловлены изменениями процесса
удаления стойких кислот из организма.
• Выделительные – усиленная потеря кислот или
оснований.
30
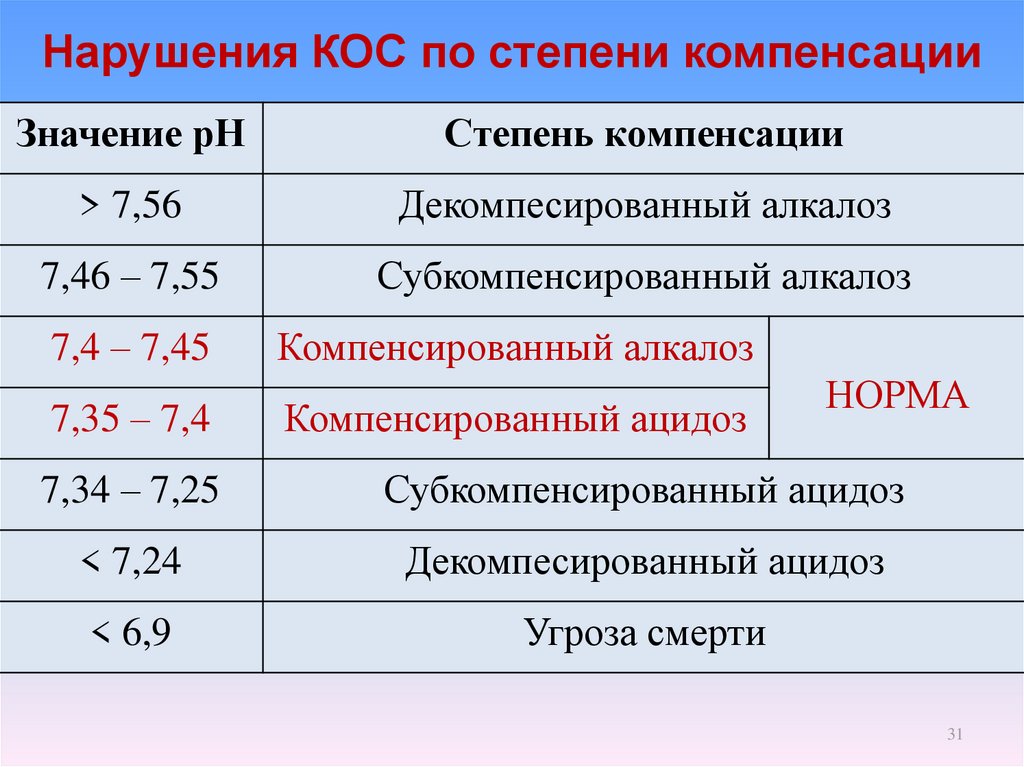
31. Нарушения КОС по степени компенсации
Значение рНСтепень компенсации
> 7,56
Декомпесированный алкалоз
7,46 – 7,55
Субкомпенсированный алкалоз
7,4 – 7,45
7,35 – 7,4
Компенсированный алкалоз
Компенсированный ацидоз
НОРМА
7,34 – 7,25
Субкомпенсированный ацидоз
< 7,24
Декомпесированный ацидоз
< 6,9
Угроза смерти
31
32.
• Дыхательная компенсация – регулирует уровеньрСО2, происходит в течение нескольких минут.
• Почечная компенсация – регулирует уровень
НСО3¯, развивается в течение 2 – 3 дней.
В случае метаболического ацидоза компенсация
происходит через дыхательный алкалоз. При
дыхательном ацидозе – через метаболический
алкалоз.
32
33. Причины метаболического ацидоза
1). Увеличение образования Н+ (первичный механизм):• кетоацидоз (диабет, алкогольная интоксикация);
• лактоацидоз (гипоксия, шок, катаболические состяния);
• интоксикация
(этанол,
метанол,
этиленгликоль,
салицилаты, антифриз).
2). Снижение экскреции Н+ (первичный механизм):
• почечная недостаточность;
• почечный канальцевый ацидоз;
• прием ингибиторов карбангидразы.
3). Потеря НСО3¯ (непрямой механизм):
• гастроинтестициальная (профузная диарея, кишечная
фистула).
• почечная.
33
34.
• Метаболический ацидоз с большим анионныминтервалом (продукционный или выделительный
ацидоз).
• Метаболический ацидоз с нормальной анионной
разностью (почечный канальцевый ацидоз, диарея,
рвота).
АИ = (Na+ + К +) – (Cl¯ + HCO3¯) = 12 ± 4 ммоль/л
34
35. Метаболический ацидоз
Избыток Н+ =>Активация дыхательного центра, буферные системы
(бикарбонатная) =>
Компенсаторная гипервентиляция =>
Н2СО3 => СО2 + Н2О =>
Выводится СО2 => Снижается рСО2 =>
Увеличивается отношение НСО3¯/ рСО2 =>
Повышается рН крови
Дыхательная компенсация не может полностью нормализовать
концентрацию Н+, т. к. дыхательный центр стимулирует
именно избыток Н+, а при работе дыхательной мускулатуры
образуется СО2.
Причина не метаболического ацидоза не устранена =>
Избыток Н+, снижение НСО3¯, снижение рСО2 =>
Экскреция Н+ с мочой (если возможно), дыхательный алкалоз.
35
36. Причины дыхательного ацидоза
Нарушение легочной вентиляции.1). Обструкция дыхательных путей:
• хронические обструктивные заболевания (бронхит,
эмфизема, опухоль);
• бронхоспазм (бронхиальная астма);
• аспирация.
2). Снижение возбудимости дыхательного центра:
• лекарственная (анальгетики, седативные препараты,
анестезирующие и наркотические препараты);
• интоксикация (ботулизм, алкогольное отравление);
• инсульт, травма, опухоль мозга;
• повышение внутричерепного давления;
• гипоксия.
36
37. Причины дыхательного ацидоза
Нарушение легочной вентиляции.3). Заболевания легких:
• пневмонии;
• фиброз легких;
• респираторный дистресс – синдром;
• гидроторакс, пневмоторакс.
4). Внелегочные причины:
• полиомиелит,
заболевания
нервов
дыхательной
мускулатуры;
• заболевания дыхательной мускулатуры, трихинеллез,
сколиоз;
• тромбоэмболия легочной артерии и её ветвей.
37
38. Дыхательный ацидоз
Нарушение легочной вентиляции =>Рост рСО2 =>
Увеличение Н2СО3 =>
НСО3¯ + Н+ =>
Активация буферных систем
(гемоглобиновая, фосфатная) =>
Экскреция Н+ с мочой
38
39. Патогенез ацидозов
1). Расстройство дыхания => Отдышка => Нарушение ритма дыхания(дыхание Куссмауля) => Гиперкапния (70 – 80 мм. рт. ст.) =>
Гипоксия тканей => Метаболические нарушения.
2). Потеря воды с выдыхаемым воздухом (Волемические
расстройства).
3). Выброс катехоламинов => Нарушение сердечной деятельности
(учащение ЧСС, увеличение минутного объема и АД) => Блокада
адренорецепторов => Нарушение сердечной деятельности
(снижение АД, экстраситолия).
4). Угнетение активности аденилатциклазной системы клеток =>
Снижение энергетического и функционального потенциала клеток.
5). Усиление парасимпатических эффектов => Бронхоспазм, усиление
моторики ЖКТ.
6). Гиперкалиемия => Повышенная возбудимость клеток =>
Гипоосмолярная гипергидратация.
7). Гиперкальциемия => Нарушение сократительной способности
39
40. Причины метаболического алкалоза
1). Потеря Н+ :• через ЖКТ (рвота, свищи и фистулы);
• через
почки
(избыток
минералкортикоидов,
гипокалиемия).
2). Избыточное поступление НСО3¯:
• отравление щелочами.
40
41. Метаболический алкалоз
Потеря Н+ и Cl¯ через ЖКТ=>
Усиление функциональной
активности обкладочных
клеток желудка =>
Синтез НСl =>
Увеличение НСО3¯ в крови
Гипокалиемии и
гипернатриемии =>
Потеря Н+ при через почки
=>
Экскреция Н+ с мочой
Компенсация затруднена из-за реабсорбции НСО3¯,
дыхательная компенсация не может быть полной из-за
быстрого повышения рСО2, что стимулирует
дыхательный центр.
41
Переход в хроническую стадию.
42. Причины дыхательного алкалоза
Гипервентиляция легких.1). Искуственная вентиляция легких.
2). Стимуляция дыхательного центра:
• инсульт, травма, опухоль мозга;
• истерия, невроз, эпилепсия;
• лекарственная (салицилаты).
3). Анемии, высотная болезнь.
4). Болевой синдром, перегревание, охлаждение.
5). Накопление аммиака (заболевания печени).
6). Перитонит, панкреатит.
7). Резкая отмена алкоголя на фоне хронического
алкоголизма.
8). Альвеолярный отек легких.
9). Стресс, перевозбуждение.
42
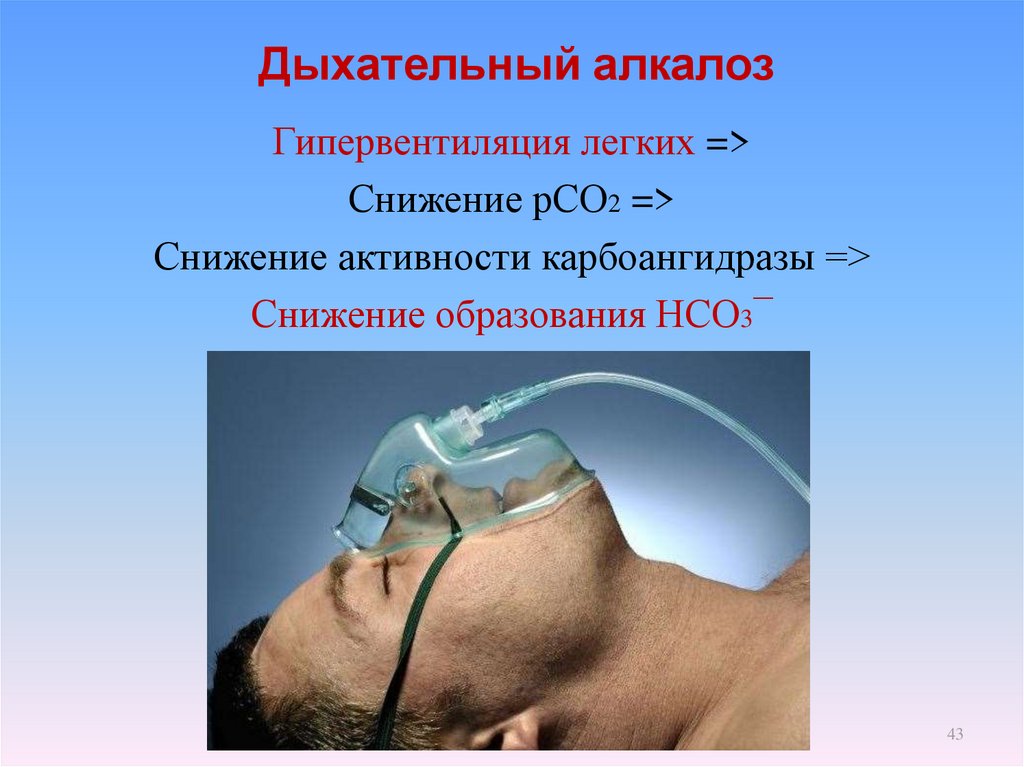
43. Дыхательный алкалоз
Гипервентиляция легких =>Снижение рСО2 =>
Снижение активности карбоангидразы =>
Снижение образования НСО3¯
43
44. Патогенез алкалозов
1). Гиповентиляция => Снижение МОД => Гипоксиятканей.
2). Калийурез => Гипокалиемия => Усиление алкалоза.
3). Гипокальциемия => Новышение нервно – мышечной
возбудимости => судорожный синдром.
4). Снижение экскреции солей аммония.
5). Гатроэнтеральные нарушения => Рвота => Потеря
воды до 34% и электролитов (Na+ до 15%, Cl¯ до 28%,
К+ до 57%) за сутки.
44
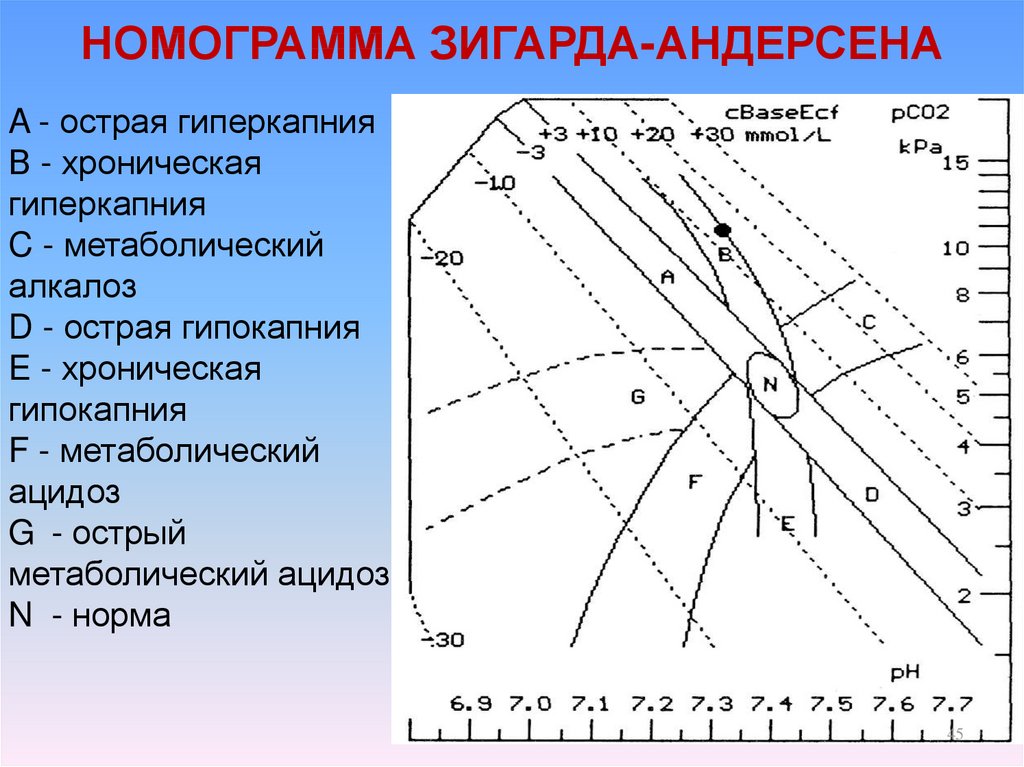
45. НОМОГРАММА ЗИГАРДА-АНДЕРСЕНА
A - острая гиперкапнияВ - хроническая
гиперкапния
C - метаболический
алкалоз
D - острая гипокапния
E - хроническая
гипокапния
F - метаболический
ацидоз
G - острый
метаболический ацидоз
N - норма
45
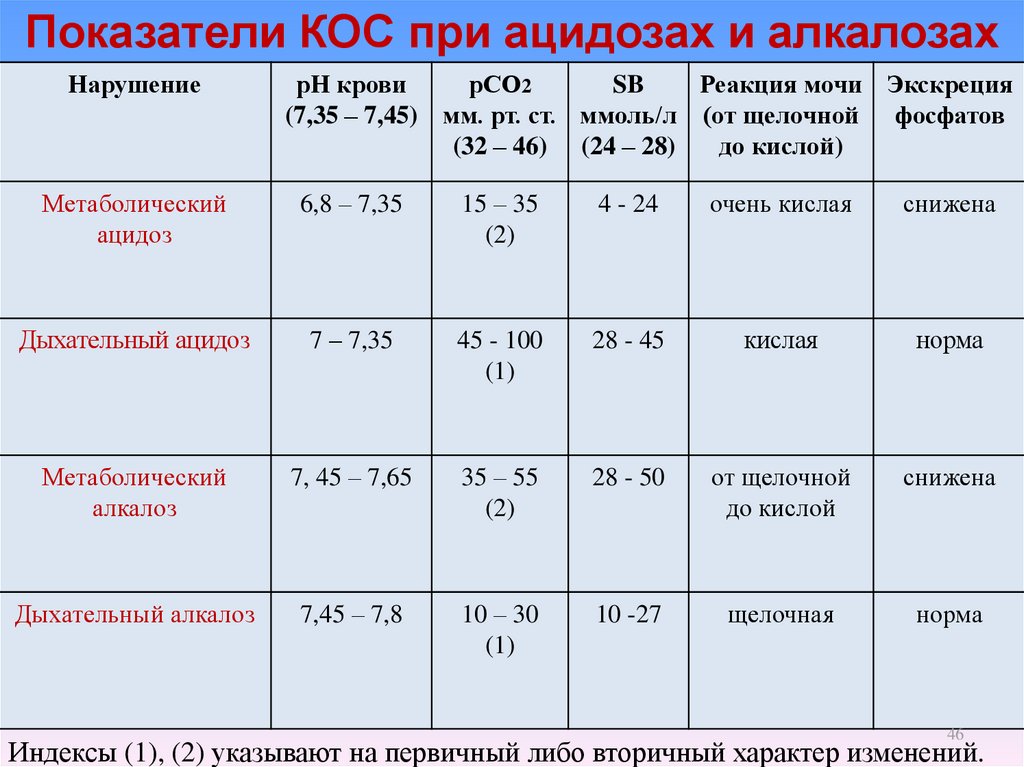
46. Показатели КОС при ацидозах и алкалозах
НарушениерН крови
рСО2
SB
Реакция мочи Экскреция
(7,35 – 7,45) мм. рт. ст. ммоль/л (от щелочной фосфатов
(32 – 46) (24 – 28)
до кислой)
Метаболический
ацидоз
6,8 – 7,35
15 – 35
(2)
4 - 24
очень кислая
снижена
Дыхательный ацидоз
7 – 7,35
45 - 100
(1)
28 - 45
кислая
норма
Метаболический
алкалоз
7, 45 – 7,65
35 – 55
(2)
28 - 50
от щелочной
до кислой
снижена
Дыхательный алкалоз
7,45 – 7,8
10 – 30
(1)
10 -27
щелочная
норма
46
Индексы (1), (2) указывают на первичный либо вторичный характер изменений.
47. Рекомендуемая литература
1. Долгов В.В., Меньшиков В.В. «Клиническаялабораторная
диагностика.
Национальное
руководство» Том 1, 2012 г.
2. Долгов
В.В.
«Клиническая
лабораторная
диагностика. Учебник в двух томах» Том 1, 2017 г.
3. Осинькин Д.В., Васильков В.Г., Кулюцина Е.Р.,
Рубцов Г.К., Безручко Н.В., Кривченкова Е.В.
«Нарушения водно-электролитного обмена и
кислотно-основного состояния в неотложной
медицине. Электронное учебное пособие», 2012 г.
4. Курашвили Л.В. «Кислотно-основное состояние.
Учебное пособие», 2014 г.
47
48.
Спасибо завнимание!
48


























 Биология
Биология








