Похожие презентации:
Бактериофаги. История открытия бактериофагов
1. Омский государственный медицинский университет, кафедра микробиологии, вирусологии и иммунологии Бактериофаги
БактериофагиЛектор: К.М.Н., доцент
Темникова Наталья
Владимировна
2017 г.
2. «Без согласованных действий всех стран многие великие открытия, сделанные учеными-медиками за последние 50 лет, могут утратить
«Без согласованных действий всех странмногие великие открытия, сделанные
учеными-медиками за последние 50 лет,
могут утратить свое значение из-за
распространения
антибиотикорезистентности»
(ВОЗ Глобальная стратегия по сдерживанию устойчивости
к противомикробным препаратам, 2002г.)
3.
Фаги — облигатныевнутриклеточные паразиты,
так как у них нет механизмов
для выработки энергии
и рибосом для синтеза белка.
Размножение фага
происходит только внутри
бактерии-хозяина.
4. Для справки………
• Бактериофаги — незримо присутствуют повсюду в нашем мире —в океане, почве, глубоководных источниках, питьевой воде
и пище. Они — наиболее представленная форма жизни на Земле
— от 1030 до 1032 фаговых частиц в биосфере, — и играют
ключевую роль в поддержании баланса всех исследованных
экосистем.
• Бактериофаги являются естественными регуляторами бактерий
и обеспечивают динамическое равновесие в природе, сохраняя
относительное постоянство микробного пейзажа в природе
и ограничивая рост популяции бактерий.
5. История открытия БФ
• В 1896 году английский бактериолог Э. Ханкин, исследуя антибактериальноедействие воды индийских рек, пришел к выводу о существовании агента,
проходящего через бактериальные фильтры и вызывающего лизис холерных
вибрионов.
• Российский микробиолог Н.Ф. Гамалея в 1897 году наблюдал лизис бацилл
сибирской язвы.
• Однако первая научная публикация о фагах — статья 1915 года английского
микробиолога Ф. Туорта, в которой он описал инфекционное поражение
стафилококков, значительно изменявшее морфологию колоний.
• Инфекционный агент свободно проходил через бактериальные фильтры,
и его можно было переносить из одной колонии в другую. Туорт выдвинул
несколько гипотез, объясняющих это явление, в частности — гипотезу
о фильтрующемся вирусе, подобном вирусам растений и животных. Однако
его работа не привлекла внимания ученых, а Туорт забросил ее из-за службы
в армии: началась Первая мировая.
6.
• В 1917 году канадский бактериолог Ф. Д’Эрелль независимо от Туорта сообщилоб открытии вируса, «пожирающего» бактерий, — бактериофага .
• Микробиологи того времени считали, что чума свиней вызывается совместным
действием микроба и вируса.
• Д’Эрелль предположил, что схожая этиология и у дизентерии(шигеллез). С помощью
Бактериальных фильтров он отфильтровал фекалии больных дизентерией и добавил
их в пробирки с культурами шигелл, намереваясь ввести смесь бактерий
и предполагаемого вируса экспериментальным животным.
• Однако на следующие сутки он обнаружил, что бульон, в котором росли шигеллы, стал
прозрачным, что свидетельствовало о гибели бактерий. Профильтровав бульон из этих
пробирок, он снова заразил полученными фильтратами культуры шигелл. И вновь
на следующие сутки он обнаружил, что бульон стал прозрачным. Полученное
«литическое начало» можно было бесконечно пассировать от одной культуры к другой,
что привело Д’Эрелля к мысли о существовании вируса, разрушающего бактерии.
• Учитывая эффективность фагов против патогенных микроорганизмов и их широкое
распространение в природе, Д’Эрелль предположил, что они играют определенную
роль в развитии иммунитета к инфекционным заболеваниям и выздоровлении.
• В СССР в ранние годы бактериофагам уделяли достаточно внимания. В 1923 грузинский
микробиолог Г.Г. Элиава, ученик Д’Эрелля, основал в Тбилиси Институт бактериофагов,
ставший впоследствии Всесоюзным центром фаготерапии, коллекция которого
на сегодняшний день составляет около 3000 фаговых штаммов.
7.
• На протяжении почти 70 лет бактериофаги, как и другие вирусы,были для биологов такими же невидимыми, как атомы для
физиков, в силу их субмикроскопических размеров.
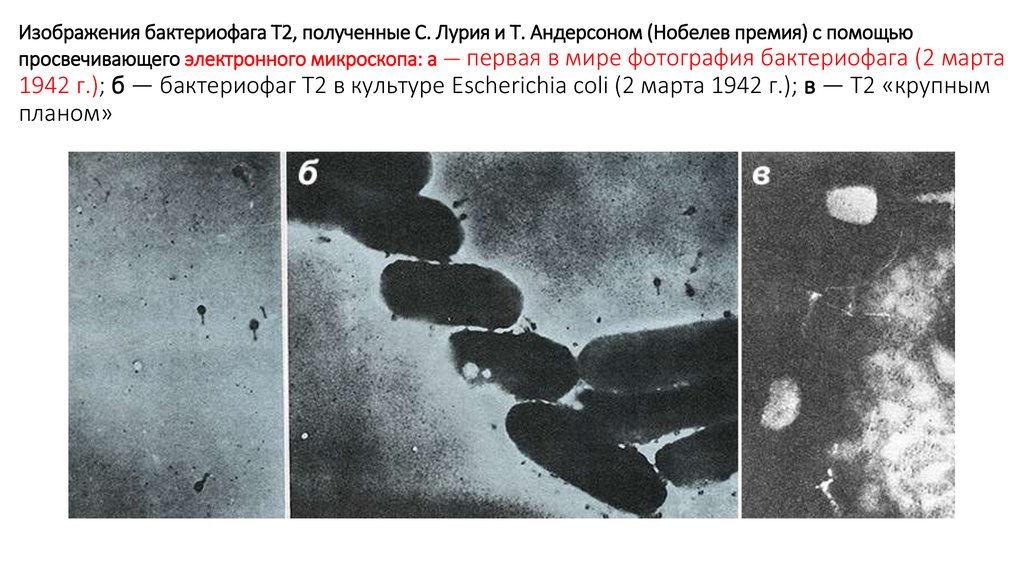
8. Изображения бактериофага Т2, полученные С. Лурия и Т. Андерсоном (Нобелев премия) с помощью просвечивающего электронного
Изображения бактериофага Т2, полученные С. Лурия и Т. Андерсоном (Нобелев премия) с помощьюпросвечивающего электронного микроскопа: а — первая в мире фотография бактериофага (2 марта
1942 г.); б — бактериофаг Т2 в культуре Escherichia coli (2 марта 1942 г.); в — Т2 «крупным
планом»
9.
• В тридцатых годах прошлого века крупный американский концерносновал даже клинику, где начали лечить фагами. Пропагандисты нового
метода сулили исцеление от всех болезней.
• Однако действительность оставляла желать лучшего: научные основы
такой терапии были ещё так скудны, что новое средство применяли
практически вслепую. Считалось, что все фаги одинаковы и побеждают
любую бактерию. Одним и тем же бактериофагом начинали лечить
разные заболевания, а болезнь всё не уходила — так метод был серьёзно
скомпрометирован.
• Однако успешное применение антибиотиков в 1960–1970-е годы
практически похоронило идеи фаготерапии. Так, например, в Большой
советской энциклопедии указано: «Антибиотики и другие
химиотерапевтические средства оказались эффективнее фагов,
в связи с чем их применение с лечебной целью сузилось».
10. Номенклатура и биологические особенности
Номенклатура основана на видовом наименовании хозяина.Например, фаги, лизирующие дизентерийные бактерии,
получили название дизентерийных бактериофагов.
● Структура. Имеют сперматозоидную форму. Состоят из головки,
которая содержит нуклеиновую кислоту и отростка.
У некоторых фагов отросток очень короткий или вовсе
отсутствует.
Размеры фаговой частицы колеблются от 20 до 200 нм.
11.
Наиболее изучены Т-фаги (англ. type - типовые). Они составляют
Т-группу коли-дизентерийных фагов: 4 нечетных (Т1, ТЗ, Т5, Т7) и 3
четных (Т2, Т4, Т6).
● Наиболее сложной структура Т-четных фагов (Т2). Он состоит из
головки гексагональной формы и отростка, который образован
полым стержнем. Снаружи стержень окружен чехлом, способным к
сокращению. На дистальном конце отростка имеется
шестиугольная базальная пластинка, в углах которой располагаются короткие зубцы. От каждого зубца отходит по одной нити
длиной 150 нм. Базальная пластинка и нити осуществляют процесс
адсорбции фага на бактериальной клетке.
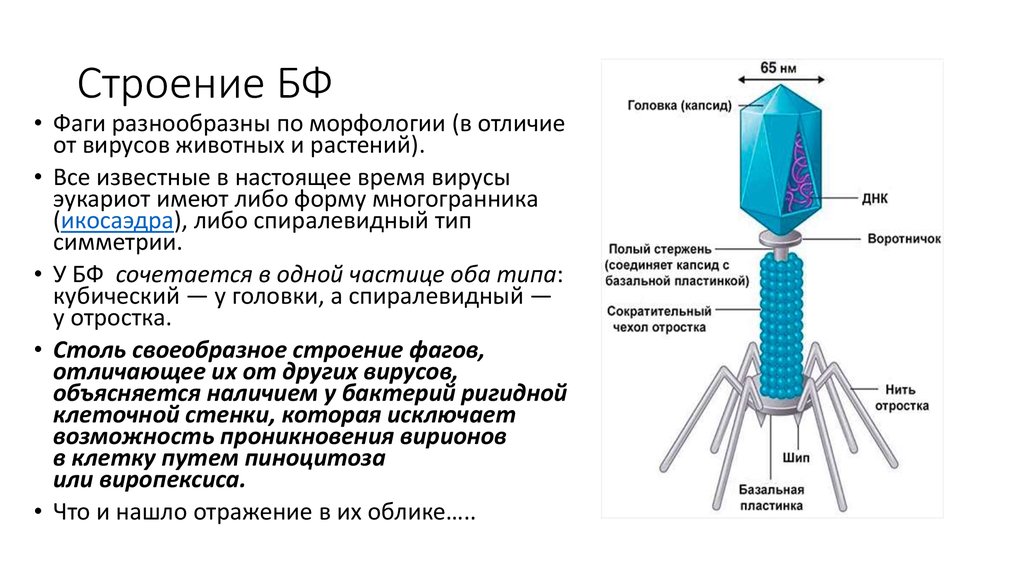
12. Строение БФ
• Фаги разнообразны по морфологии (в отличиеот вирусов животных и растений).
• Все известные в настоящее время вирусы
эукариот имеют либо форму многогранника
(икосаэдра), либо спиралевидный тип
симметрии.
• У БФ сочетается в одной частице оба типа:
кубический — у головки, а спиралевидный —
у отростка.
• Столь своеобразное строение фагов,
отличающее их от других вирусов,
объясняется наличием у бактерий ригидной
клеточной стенки, которая исключает
возможность проникновения вирионов
в клетку путем пиноцитоза
или виропексиса.
• Что и нашло отражение в их облике…..
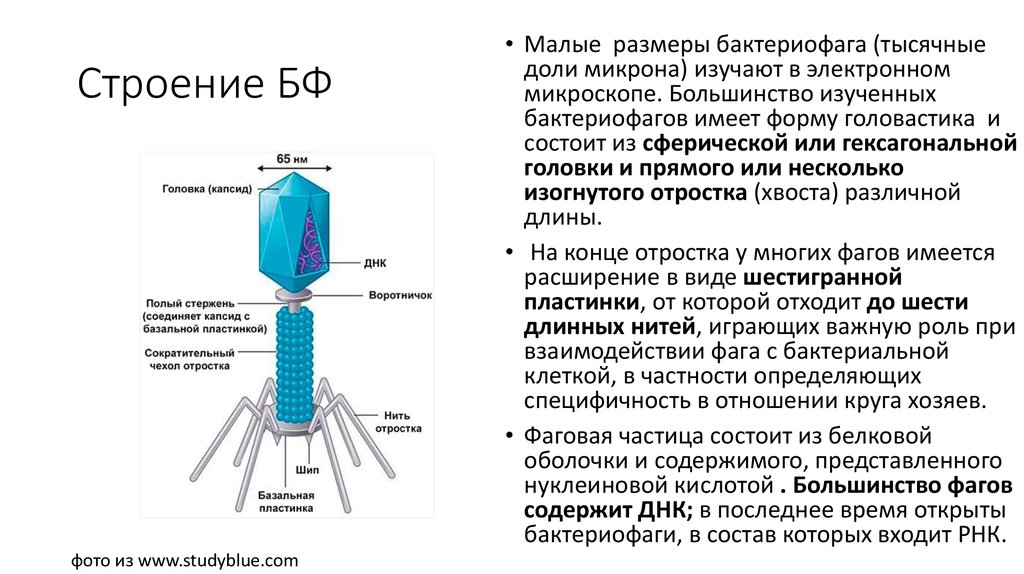
13. Строение БФ
фото из www.studyblue.com• Малые размеры бактериофага (тысячные
доли микрона) изучают в электронном
микроскопе. Большинство изученных
бактериофагов имеет форму головастика и
состоит из сферической или гексагональной
головки и прямого или несколько
изогнутого отростка (хвоста) различной
длины.
• На конце отростка у многих фагов имеется
расширение в виде шестигранной
пластинки, от которой отходит до шести
длинных нитей, играющих важную роль при
взаимодействии фага с бактериальной
клеткой, в частности определяющих
специфичность в отношении круга хозяев.
• Фаговая частица состоит из белковой
оболочки и содержимого, представленного
нуклеиновой кислотой . Большинство фагов
содержит ДНК; в последнее время открыты
бактериофаги, в состав которых входит РНК.
14. Взаимодействие БФ и клетки-хозяина
• Важным свойством бактериофагов является их специфичность:фаги могут поражать определенный вид бактерий
(моновалентные фаги) или же только избранные
штаммы/варианты внутри вида (типовые фаги, например, фаги V.
cholerae classica и El Tor), но некоторые не столь разборчивы
и поражают бактерий разных видов и даже родов
(поливалентные фаги).
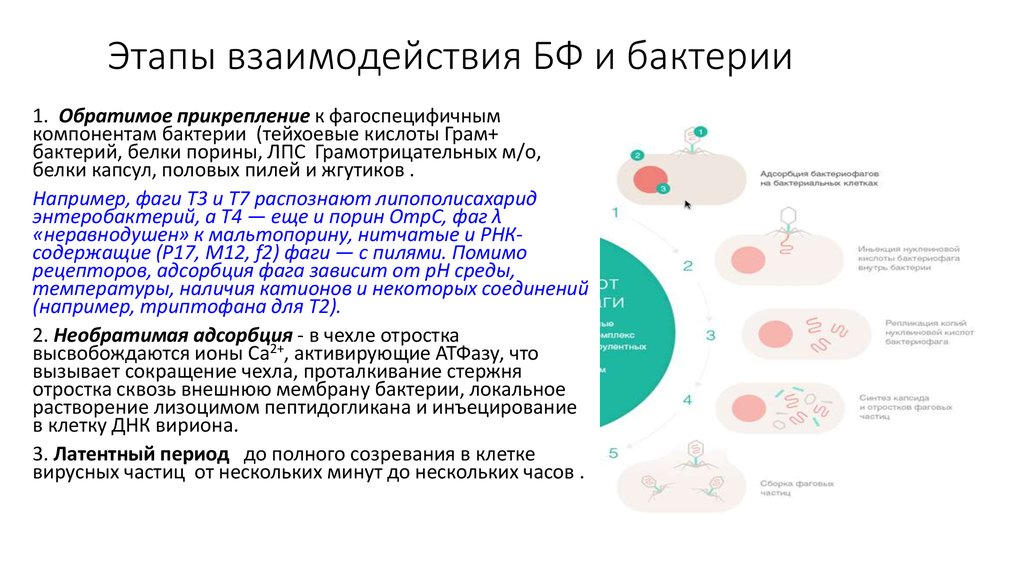
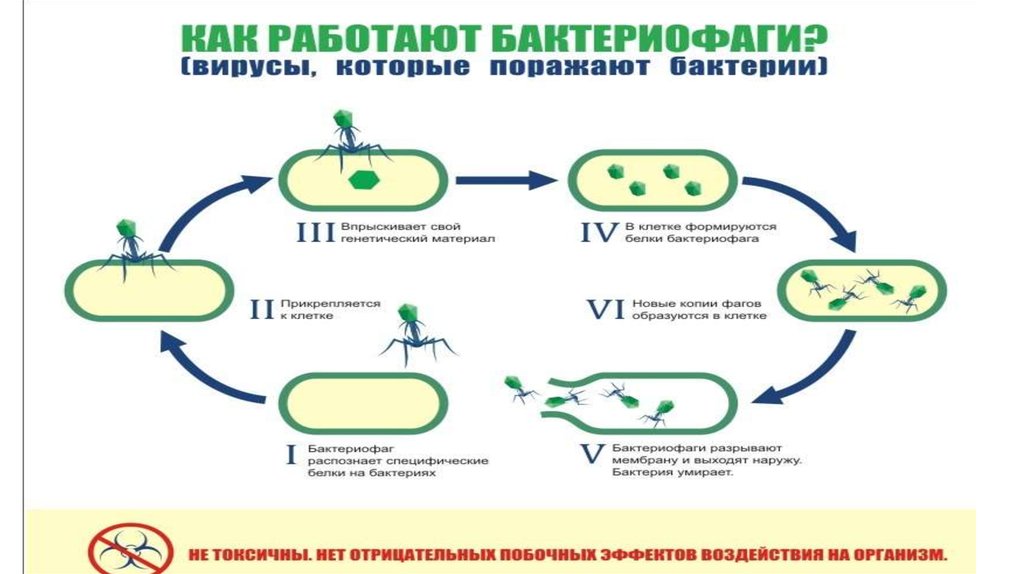
15. Этапы взаимодействия БФ и бактерии
1. Обратимое прикрепление к фагоспецифичнымкомпонентам бактерии (тейхоевые кислоты Грам+
бактерий, белки порины, ЛПС Грамотрицательных м/о,
белки капсул, половых пилей и жгутиков .
Например, фаги Т3 и Т7 распознают липополисахарид
энтеробактерий, а Т4 — еще и порин OmpC, фаг λ
«неравнодушен» к мальтопорину, нитчатые и РНКсодержащие (P17, M12, f2) фаги — с пилями. Помимо
рецепторов, адсорбция фага зависит от рН среды,
температуры, наличия катионов и некоторых соединений
(например, триптофана для Т2).
2. Необратимая адсорбция - в чехле отростка
высвобождаются ионы Са2+, активирующие АТФазу, что
вызывает сокращение чехла, проталкивание стержня
отростка сквозь внешнюю мембрану бактерии, локальное
растворение лизоцимом пептидогликана и инъецирование
в клетку ДНК вириона.
3. Латентный период до полного созревания в клетке
вирусных частиц от нескольких минут до нескольких часов .
16. Этапы взаимодействия БФ и бактерии
4.Перестройка метаболизма бактерии: прекращается синтез ее собственных ДНК, РНКи белков. ДНК бактериофага может начинать транскрибироваться его же РНКполимеразой — например, фаг Т4 впрыскивает этот фермент вместе с ДНК .
Или же, как в случае Т4, фаг впрыскивает фермент АДФ-рибозилтрансферазу (продукт
гена alt), модифицирующий хозяйскую РНК-полимеразу так, что та переключается
на транскрипцию исключительно фаговых генов .
5. Синтезирующиеся мРНК поступают на рибосомы бактерии, которые послушно
производят белки бактериофага: ранние (ДНК-полимеразу, нуклеазы) и поздние (белки
капсида, отростка, базальной пластинки и др.).
6. Репликация ДНК бактериофага осуществляется его собственной ДНК-полимеразой.
7. Образование зрелых инфекционных фаговых частиц. Поздние белки и копии фаговой
ДНК объединяются.
8. Выход вирионов. Фаговые лизины (гидролазы) и холины изнутри пробивают отверстия в
бактериальной мембране и пептидогликане, и в клетку начинает поступать вода. В итоге
бактерия лопается с выходом зрелых бактериофагов . При этом в зависимости от типа фага
количество образовавшихся вирионов будет различным — от единичных частиц
до нескольких тысяч.
17.
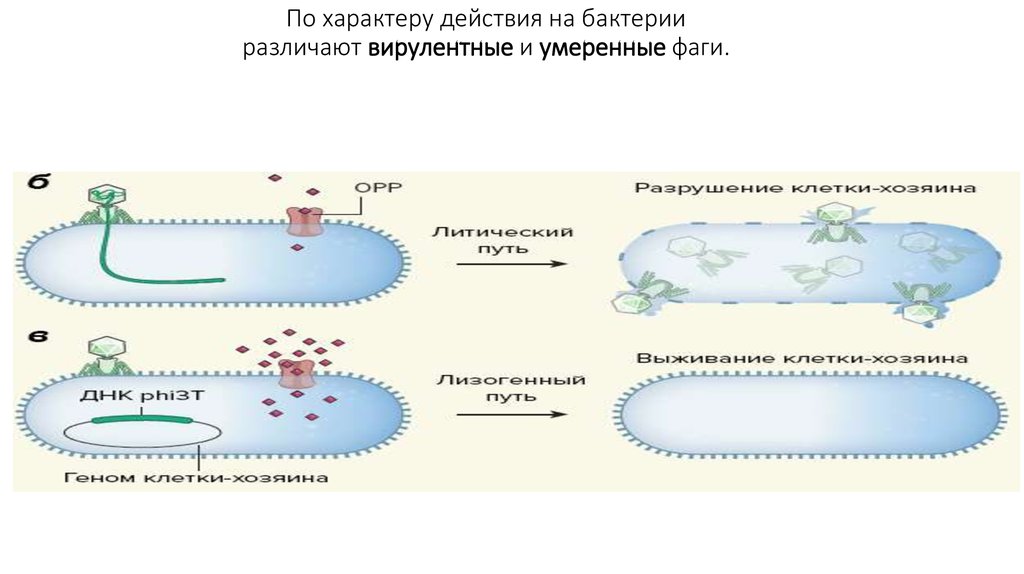
18. По характеру действия на бактерии различают вирулентные и умеренные фаги.
По характеру действия на бактерииразличают вирулентные и умеренные фаги.
19. Умеренные фаги (профаги)
• Умеренный фаг инициирует лизогенный цикл, при котором он вместо репликацииобратимо взаимодействует с геномом бактерии-хозяина, интегрируясь
в хромосому (фаг λ), либо поддерживается в клетке в виде плазмиды.
• При делении бактерии фаговый геном передается дочерним клеткам. Бактерия,
содержащая профаг, лизогенна до тех пор, пока при определенных условиях
профаг не активируется и не вступит в литический цикл.
• Переход от лизогении к лизису называется лизогенной индукцией, или индукцией
профага. На индукцию фага оказывают влияние условия внешней среды,
состояние клетки хозяина, наличие питательных веществ и т.д.
• Лизогенизация лежит в основе фаговой или лизогенной конверсии.
Она заключается в изменении свойств у лизогенных бактерий,
например приобретении способности продуцировать токсин,
изменять морфологию, антигенные свойства и другие признаки.
Механизм этого явления связан с внесением новой информации в
бактериальную клетку (КОРИНЕФАГИ)
• Умеренные фаги могут быть дефективными, т.е. неспособными
образовывать фаговое потомство, например, трансдуцирующие фаги.
Их используют в качестве векторов в генной инженерии.
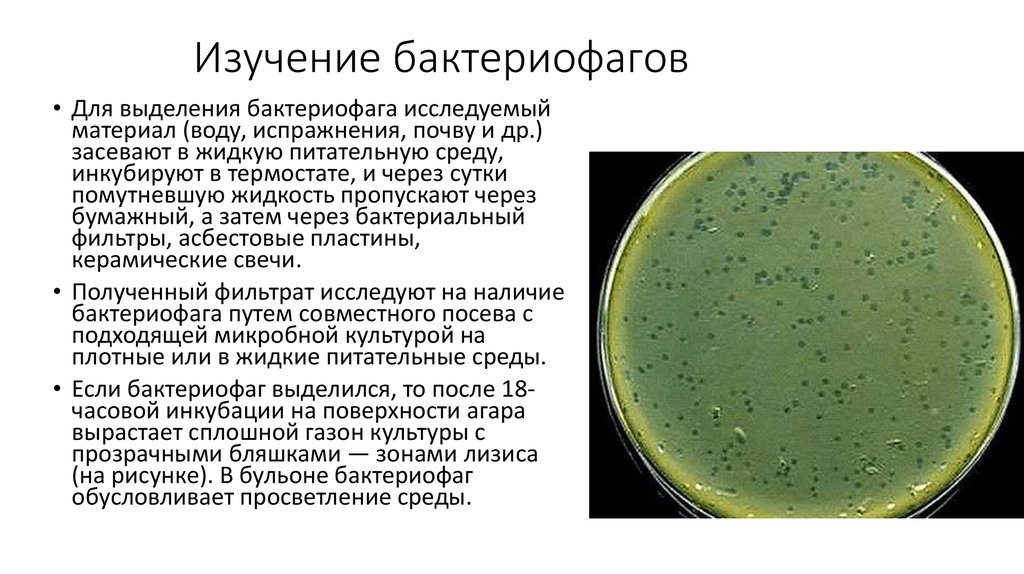
20. Изучение бактериофагов
• Для выделения бактериофага исследуемыйматериал (воду, испражнения, почву и др.)
засевают в жидкую питательную среду,
инкубируют в термостате, и через сутки
помутневшую жидкость пропускают через
бумажный, а затем через бактериальный
фильтры, асбестовые пластины,
керамические свечи.
• Полученный фильтрат исследуют на наличие
бактериофага путем совместного посева с
подходящей микробной культурой на
плотные или в жидкие питательные среды.
• Если бактериофаг выделился, то после 18часовой инкубации на поверхности агара
вырастает сплошной газон культуры с
прозрачными бляшками — зонами лизиса
(на рисунке). В бульоне бактериофаг
обусловливает просветление среды.
21. Применение БФ
• Метод фаготипирования, основанный на исключительной специфичностиопределенных фаговых штаммов, позволил распределить на фаготипы ряд штаммов
бактерий, неотличимых друг от друга по другим признакам. Фаготипирование с успехом
применяют для идентификации типов кишечной палочки, сальмонелл (включая возбудителя брюшного тифа),
стафилококков и др. Этот метод дает эпидемиологам возможность отследить цепочку
случаев заболевания и определить источник инфекции.
• Бактериофаги- маркеры прекрасно подходят для быстрого обнаружения небольших
количеств патогенных бактерий во внешней среде: появляются и множатся хозяева —
нарастает титр специфического бактериофага. Определение колифагов стало одним из
ключевых мероприятий в санитарном контроле вод, поскольку позволяет выявить фекальное
загрязнение даже при малом количестве кишечной палочки, не определяемом бактериологическими
методами.
• Лечение БФ (свободно проникают в кровь и лимфу и выводятся через почки с мочой.;не
вызывают побочных эффектов и аллергии. Не подавляют рост нормофлоры, не
ослабляют иммунитет; подходят для пациентов любого возраста, нет
противопоказаний.)
• Фаги применяются и в борьбе с бактериальными вредителями различных технических
брожений, и в производстве ферментов с помощью бактериальных культур.
22. Современные лечебные цели назначения БФ
• Элиминация бактериальных инфекций без риска развития осложнений напечень, почки и другие жизненно важные органы, подвергающиеся
повреждающему действию обычных антибактериальных средств.
• Локальность цели - уничтожают только определенные бактерии, не
вызывая дисбактериоз.
• При отсутствии эффекта от применения антибиотиков (при устойчивости
бактерий к антибиотикам) и наличии хронической, рецидивирующей
инфекции, бактериофаги являются отличным выбором в качестве
препаратов антибактериальной терапии.
23. Причины не эффективности БФ
• Каждый бактериофаг инфицирует только строго определенный видбактерий или даже определенный штамм, что требует проведения
бактериологического исследования биологического материала
больного с целью фаготипирования, а следовательно, отсрочивает
начало фаготерапии;
• Для поддержания активности бактериофаги требуют особых условий
хранения и транспортировки.
• Бактериофаги не действуют на внутриклеточных микроорганизмов.
• Многие бактериофаги инактивируются в условиях низкого рН желудка
при пероральном применении препаратов, а также ингибируются
неспецифическим действием различных факторов в жидкостях
организма.
24. Почему они до сих пор не уничтожили всех бактерий?
Почему они до сих пор не уничтожили всехбактерий?
Если бактериофаги атакуют любых бактерий и их численность настолько велика
(фаги — самые многочисленные вирусные формы в биосфере Земли, их общее
количество — 1030–1032 фаговых частиц , что примерно равно количеству бактерий, 4–
6×1030)?????????????
Почему они до сих пор не уничтожили всех бактерий?
Ответ: в процессе эволюционного соразвития бактерии выработали «иммунитет» против
фагов.
Во-первых, бактерия может быть изначально лишена рецепторов к тому или иному фагу
или лишиться их посредством мутаций.
Во-вторых, бактерия может быть иммунизирована уже «прописавшимися» в ней
профагами, которые с помощью специфических репрессоров просто не дадут вновь
прибывшим сородичам размножиться.
В-третьих, бактерия (или ее мобильные генетические элементы)
кодирует рестрикционно-модификационные системы, которые просто рубят на кусочки
нуклеиновые кислоты, не содержащие особых метильных меток — подписей «я свой».
25.
• А в-четвертых... В 2005 году стало известно, что функциональнойосновой бактериального иммунитета является система CRISPR( clustered
regularly interspaced short palindromic repeats/CRISPR-associated genes (proteins). По русскисгруппированные регулярно перемежающиеся короткие палиндромные повторы и ассоциированные
с ними гены (белки)и белок Cas, а в 2012-м уже появилась возможность
создания инженерных систем на основе CRISPR-Cas9* Streptococcus
pyogenes.
• Работа системы CRISPR-Cas основана на том, что На основе спейсеров
синтезируются молекулы РНК, комплементарные соответствующему
участку фагового (или плазмидного) генома. Эти РНК в комплексе
с белками Cas затем опознают и обезвреживают мишень — чужеродную
ДНК с комплементарной последовательностью нуклеотидов. Таким
образом, если в клетку однажды проникла фаговая ДНК, но клетка
выжила и встроила фрагмент чужеродного генома в свой нуклеоид,
то последующие попытки таких же фагов эксплуатировать клетку или
ее потомков будут неэффективны [24].
26.
• CRISPR-кассета и прилегающий к ней кластер генов cas.• Кассета — это блок прямых «зеркальных»,
взаимокомплементарных последовательностей, способных
складываться в шпильки повторов размером 24–48 пар
нуклеотидов.
• Эти повторы перемежаются спейсерами — уникальными
вставками примерно такой же длины. Спейсеры идентичны
различным участкам фагов и других мобильных элементов,
когда-либо проникавших в эту клетку или ее предков.
• Таким образом, CRISPR можно считать коллекцией
разделенных повторами «фотографий» нарушителей
клеточных границ.
• ЕШЕ РАЗ!!!! небольшой фрагмент, вырезанный из проникшей
в бактериальную клетку фаговой ДНК, вставляется
в специальный участок (локус CRISPR) генома бактерии.
Каждый локус CRISPR содержит множество таких вставок
(спейсеров, разделенных особыми короткими нуклеотидными
повторами), представляющих собой фрагменты ДНК
встреченных когда-либо фагов и плазмид.
• Составляется эта коллекция простым заимствованием
их кусочков, а чтобы противостоять новой инвазии этих же
27.
• Гены cas кодируют белки, берущие на себя всютяжесть работы по встраиванию спейсеров
и уничтожению агентов с идентичными
последовательностями (протоспейсерами)
и помогающие процессировать CRISPRтранскрипт: разделять фото-гирлянду
на отдельные портреты.
• Функцию уничтожения выполняют эффекторные
Cas-белки.
• При обнаружении комплементарной crРНК
последовательности, то есть протоспейсера,
модуль «слипается» с ней и определяет,
не помечена ли она как «своя», клеточная. Если
нет, и если к ней прилегает тот самый PAM,
то эффекторный белок, который представляет
собой эндонуклеазу и разрезает цепи ДНК.
• Ну и появляется лишняя возможность «получит »
новые спейсеры.!!!!!
28. Зачем это МНЕ??????? Можно применять у эукариот!!!!!? Будем все здоровы, генетический подход к терапии рака и
«врожденныхнаследуемых» заболеваний• Всё, что требовалось для ИСПОЛЬЗОВАНИЯ новой технологии, — это разместить на векторах
ген белка Cas и CRISPR-кассету, где спейсеры сделать идентичными местам генома, которые
нужно изменить.
• Меняя число и тип спейсеров, можно модифицировать сразу несколько разных участков
генома.
• Ну и еще потребовалось оптимизировать систему для эукариотических клеток: подправить
кодонный состав и добавить ядерный «адрес», чтобы она четко следовала к месту работы —
хромосомам.
• Когда СИСТЕМА находит комплементарный участок в геноме организма, Cas разрезает
«натупо» обе цепи ДНК. Всё, работа CRISPR-системы на этом окончена.
• Теперь эстафета передается репарационным системам самогό организма. Они решают, как
лучше залатать разрез: то ли просто сшить куски (это будет негомологичное соединение
концов, NHEJ), то ли, если есть подходящая матрица с флангами, комплементарными
участкам ДНК с двух сторон от разрыва, поставить «заплатку» (это будет гомологичная
рекомбинация).
• Первый вариант выгоден, если нужно что-то вырезать, второй — если нужно что-то вставить
или заменить дефектный участок ДНК на нормальный, который просто вводят на подходящем
векторе.
29. Примеры
• для улучшения свойств сельскохозяйственных животных и растений.Уже создали и протестировали CRISPR-системы для риса, пшеницы,
кукурузы, сорго и многих других культур.
• Помимо улучшения пищевых качеств, такими инструментами легко наделять
культуры устойчивостью к вредителям и химикалиям, а животных —
избавлять от нежелательных генов
• для контроля распространения инфекций, переносимых животными.
Например, уже всерьез размышляют о «заносе» в природные популяции
малярийных комаров генов устойчивости к малярии.
• «CRISPR — для терапии». Здесь пределов для фантазии, кажется, и вовсе
нет. Если говорить о наследственных заболеваниях, то CRISPR-Cas9 в
культурах клеток или животных моделях уже «примерили» для
серповидноклеточной анемии, миодистрофии Дюшенна, муковисцидоза…..























 Биология
Биология








