Похожие презентации:
Магнитные изотопные эффекты (миэ) в металл-зависимом ферментативном катализе и их роль в фармакологии. Нанокатиониты
1.
МАГНИТНЫЕ ИЗОТОПНЫЕ ЭФФЕКТЫ(МИЭ)
В МЕТАЛЛ-ЗАВИСИМОМ
ФЕРМЕНТАТИВНОМ КАТАЛИЗЕ И
ИХ РОЛЬ В ФАРМАКОЛОГИИ
Нанокатиониты
2. Магнитный изотопный эффект
выражается в зависимости скорости химической реакции(или вероятности рождения молекулы)
от ядерного спина,
его проекции,
магнитного момента и
энергии электро-ядерного (сверхтонкого Кулоновского)
взаимодействия.
Step E.N.// Chem. Phys. Lett. 1991. 186. P. 405.
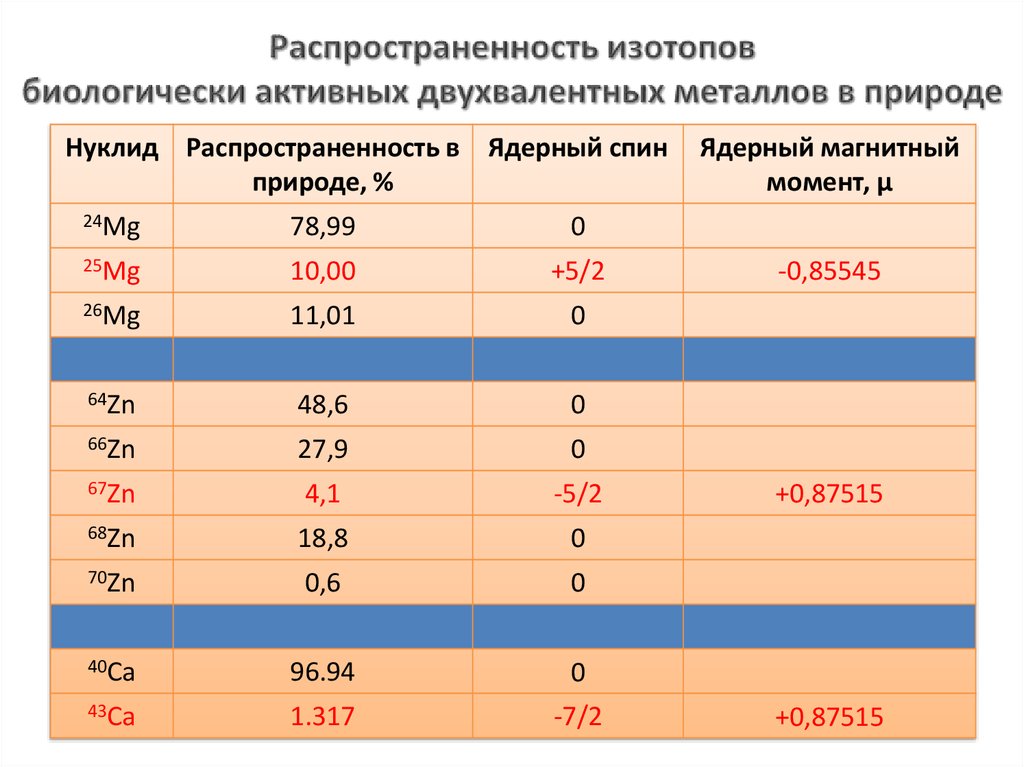
3. Распространенность изотопов биологически активных двухвалентных металлов в природе
Нуклид Распространенность в Ядерный спинприроде, %
24Mg
78,99
0
25Mg
10,00
+5/2
26Mg
11,01
0
64Zn
48,6
0
66Zn
27,9
0
67Zn
4,1
-5/2
68Zn
18,8
0
70Zn
0,6
0
40Ca
96.94
0
43Ca
1.317
-7/2
Ядерный магнитный
момент, μ
-0,85545
+0,87515
+0,87515
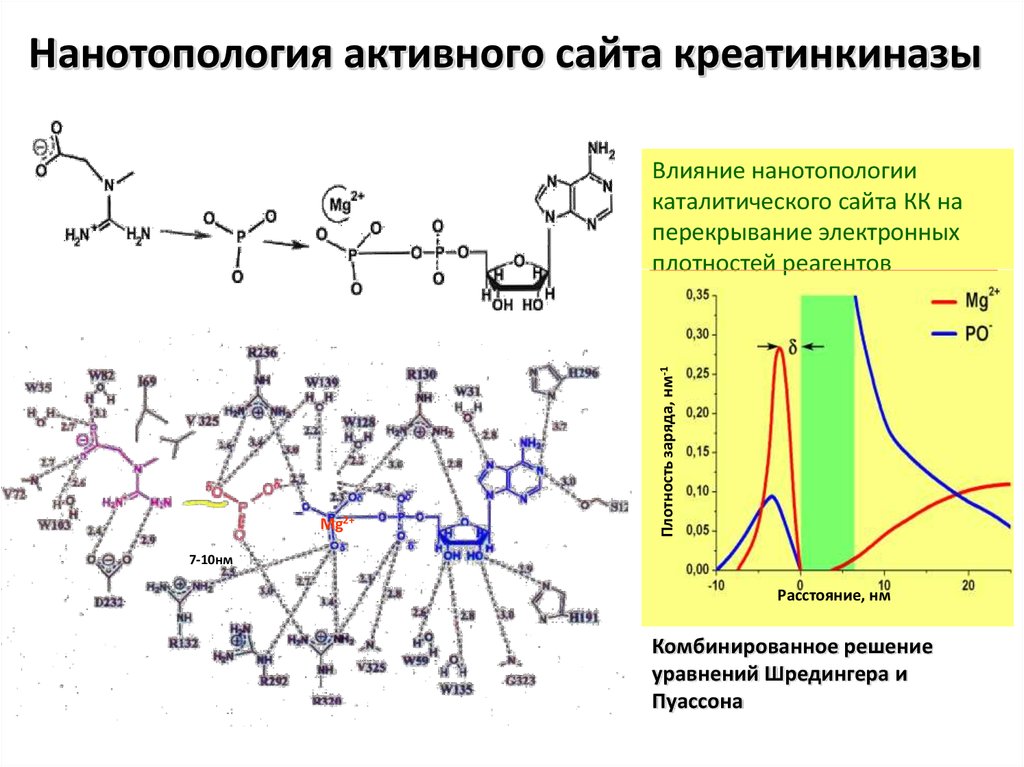
4.
Нанотопология активного сайта креатинкиназыMg2+
Плотность заряда, нм-1
Влияние нанотопологии
каталитического сайта КК на
перекрывание электронных
плотностей реагентов
7-10нм
Расстояние, нм
Комбинированное решение
уравнений Шредингера и
Пуассона
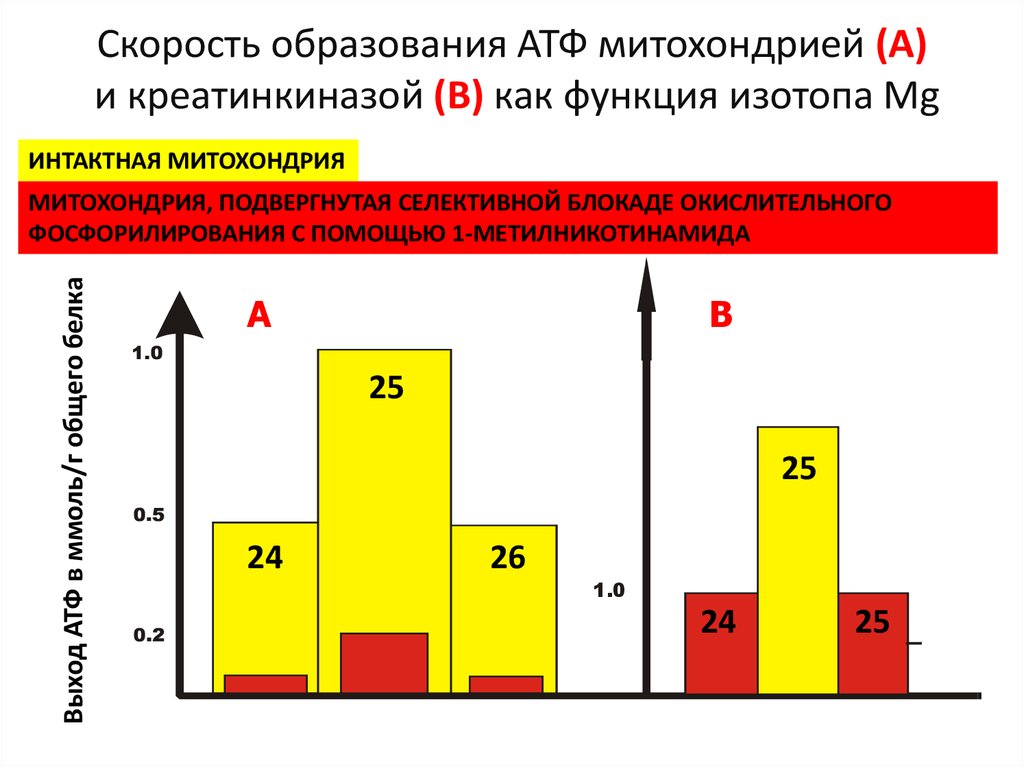
5.
Скорость образования АТФ митохондрией (А)и креатинкиназой (В) как функция изотопа Mg
ИНТАКТНАЯ МИТОХОНДРИЯ
Выход АТФ в ммоль/г общего белка
МИТОХОНДРИЯ, ПОДВЕРГНУТАЯ СЕЛЕКТИВНОЙ БЛОКАДЕ ОКИСЛИТЕЛЬНОГО
ФОСФОРИЛИРОВАНИЯ С ПОМОЩЬЮ 1-МЕТИЛНИКОТИНАМИДА
B
A
25
25
24
26
1.0
24
25
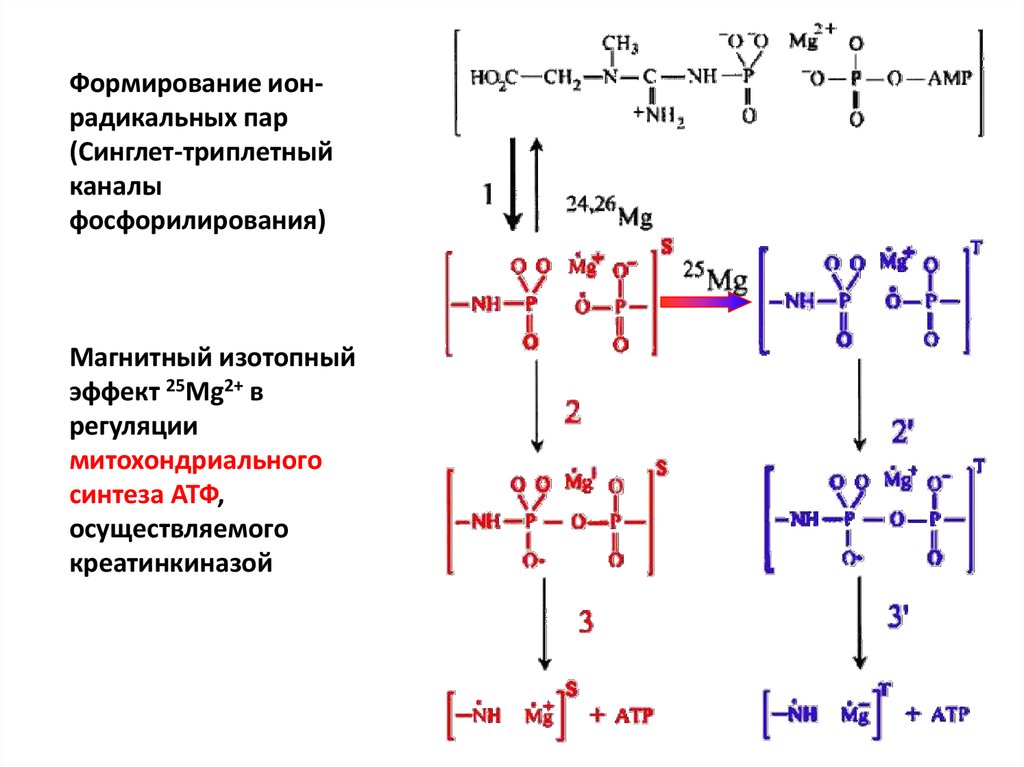
6.
Формирование ионрадикальных пар(Синглет-триплетный
каналы
фосфорилирования)
Магнитный изотопный
эффект 25Mg2+ в
регуляции
митохондриального
синтеза АТФ,
осуществляемого
креатинкиназой
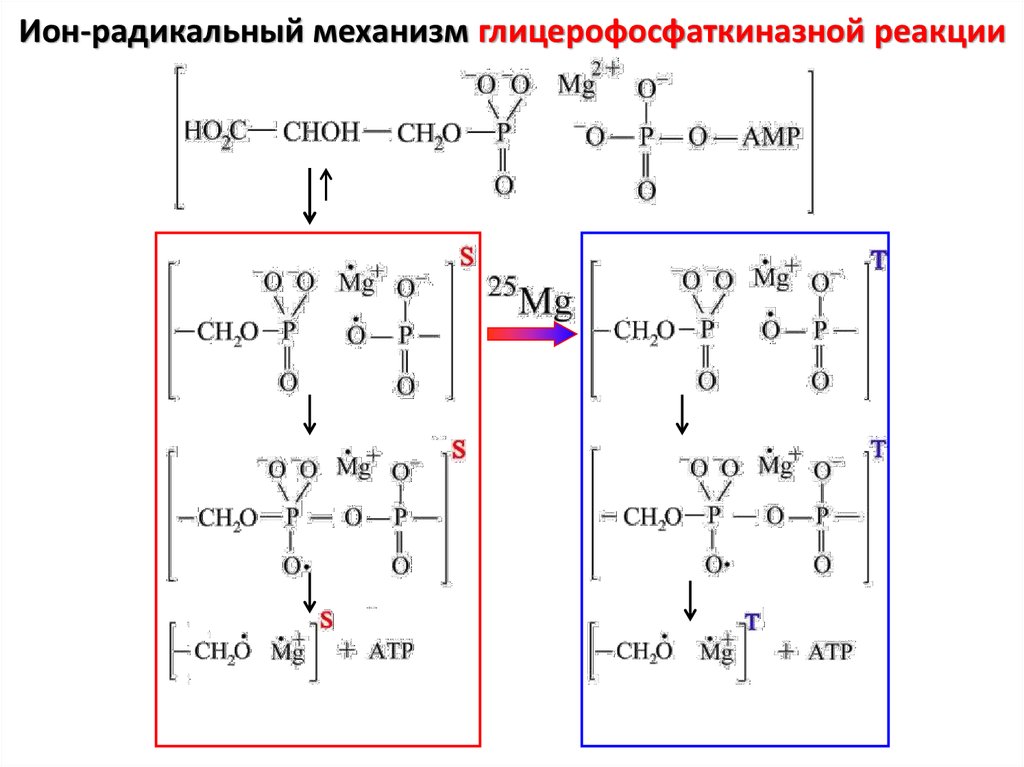
7.
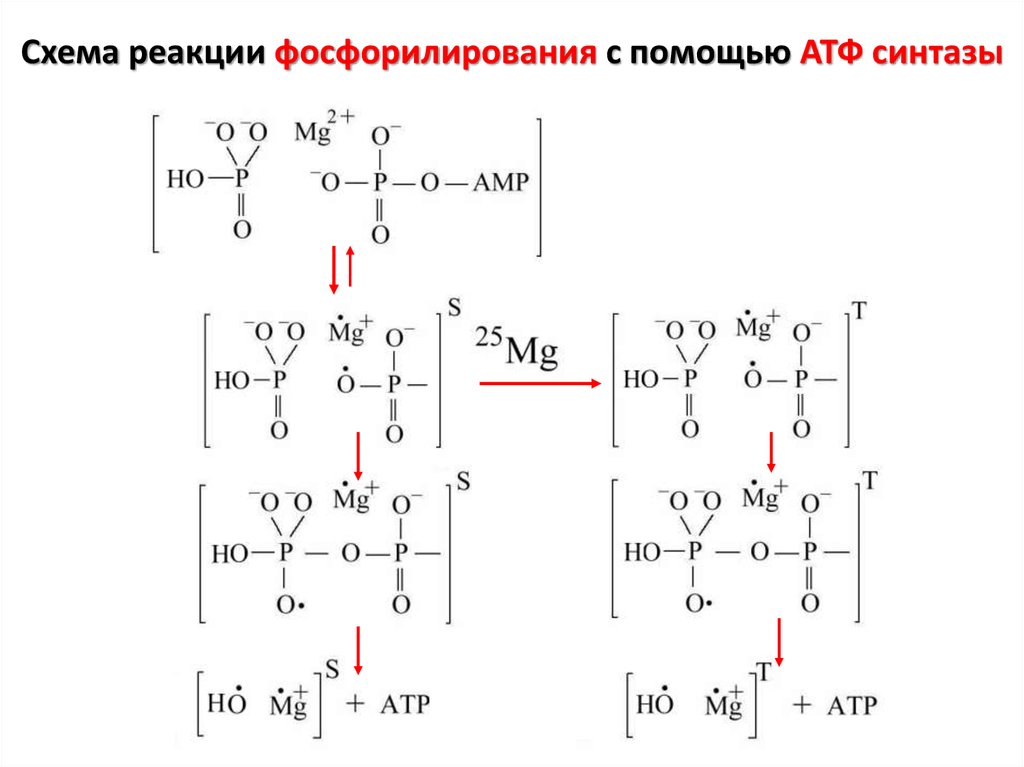
Ион-радикальный механизм глицерофосфаткиназной реакции8. Схема реакции фосфорилирования с помощью АТФ синтазы
9.
-OOCCH2
2+
2 Mg -OOC
H 2N
COO-
CH
CH2
COO-
-OOC
COO-
2 Mg
N
Fe
N
N
COO-
HC
COO-
-OOC
-OOC
COONH2
2+
2 Mg
CH 2
N
N
N
CH 2
-OOC
-OOC
COO-
N
Fe
N
2+
HC
CH
H 2N
-OOC
NH 2
CH 2
CH2
-OOC
COO-
CH 2
CH 2
2 Mg
2+
-OOC
-OOC
COO-
2+
2 Mg -OOC
COO-
2+
2 Mg -OOC
-OOC
COO-
-OOC
COO-
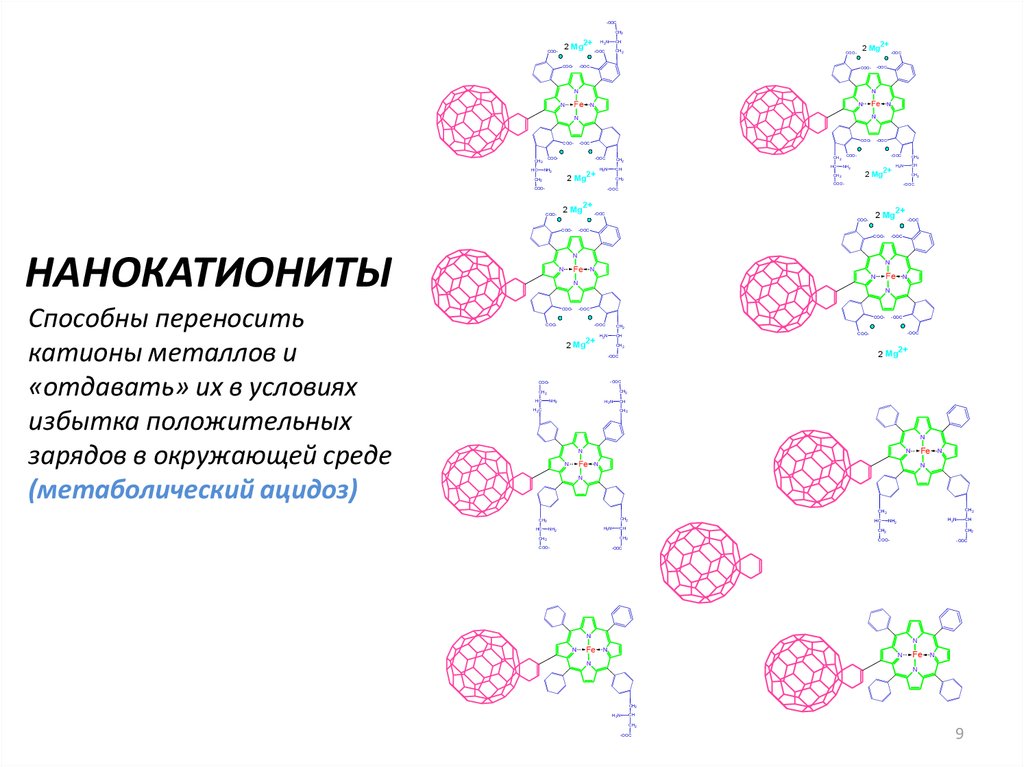
НАНОКАТИОНИТЫ
Способны переносить
катионы металлов и
«отдавать» их в условиях
избытка положительных
зарядов в окружающей среде
(метаболический ацидоз)
CH 2
COO-
COO-
CH 2
CH
H2 N
N
N
Fe
N
N
Fe
N
N
N
N
COO-
-OOC
COO-OOC
COO-
2 Mg
2+
-OOC
COO-
CH2
2+
2 Mg
-OOC
-OOC
COO-
CH2
CH 2
HC
-OOC
CH2
CH
H2N
NH2
H 2N
H2 C
CH
CH2
N
N
Fe
N
Fe
N
N
N
N
N
CH 2
CH 2
CH 2
CH2
HC
H2 N
NH2
HC
CH
COO-
COO-
-OOC
-OOC
N
N
Fe
N
N
N
Fe
N
N
N
CH2
H2 N
CH
CH2
-OOC
CH
CH 2
CH 2
CH 2
CH2
H2 N
NH 2
9
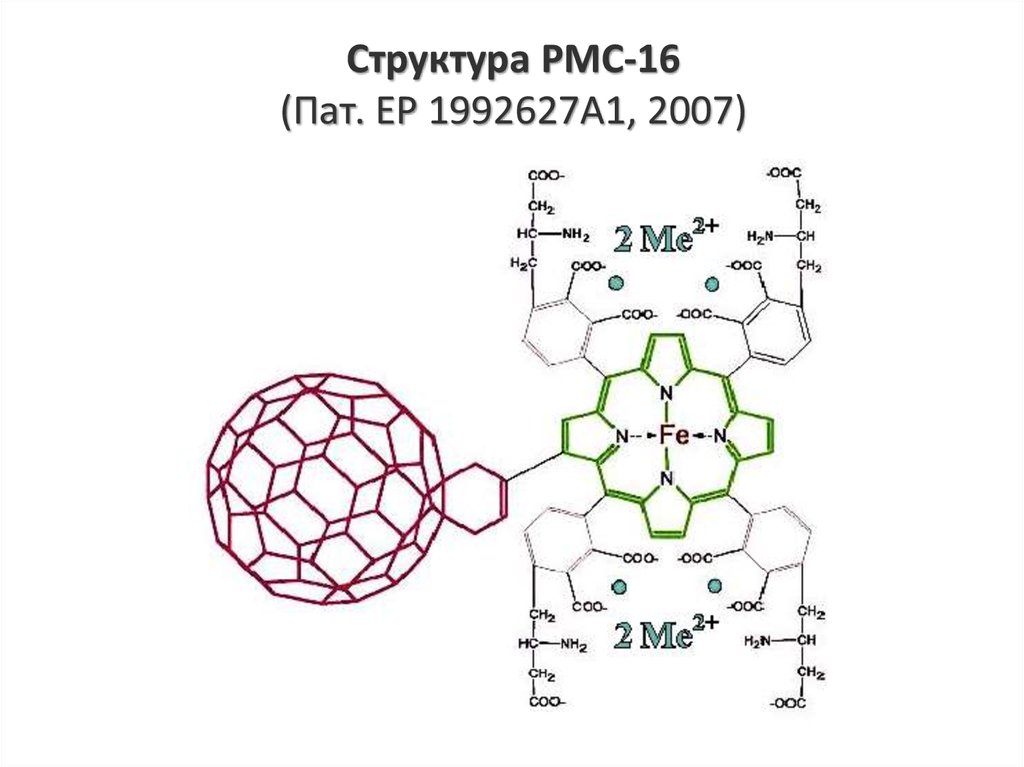
10. Структура PMC-16 (Пат. ЕР 1992627А1, 2007)
11.
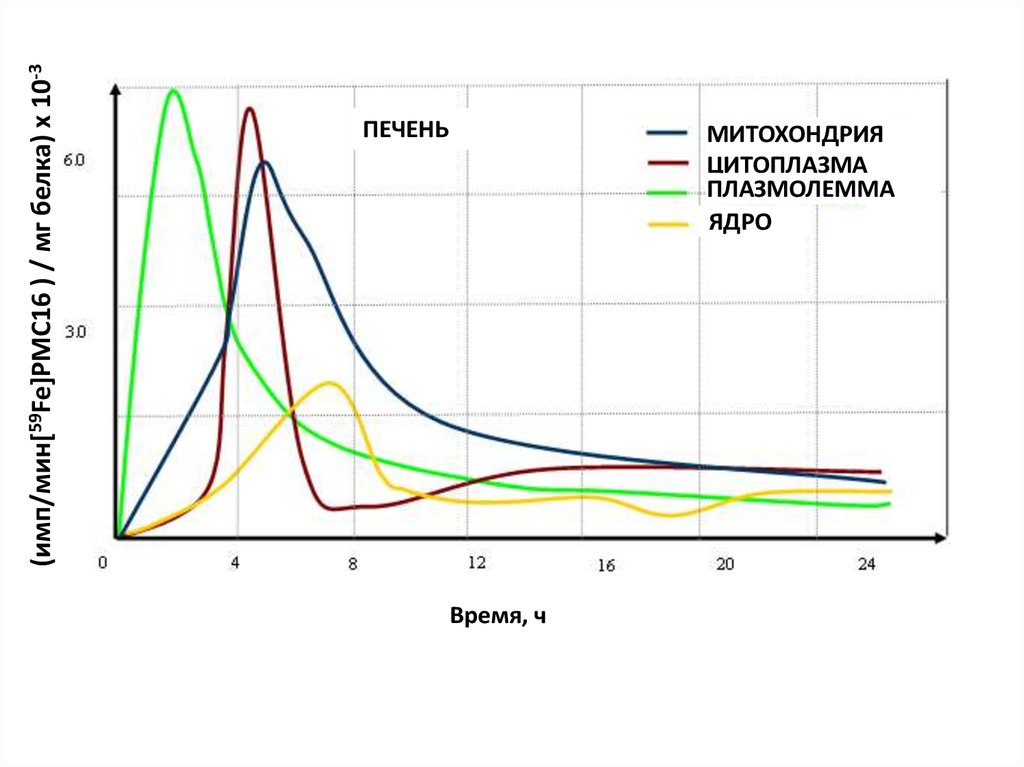
(имп/мин[59Fe]PMC16 ) / мг белка) х 10-3ПЕЧЕНЬ
МИТОХОНДРИЯ
ЦИТОПЛАЗМА
ПЛАЗМОЛЕММА
ЯДРО
Время, ч
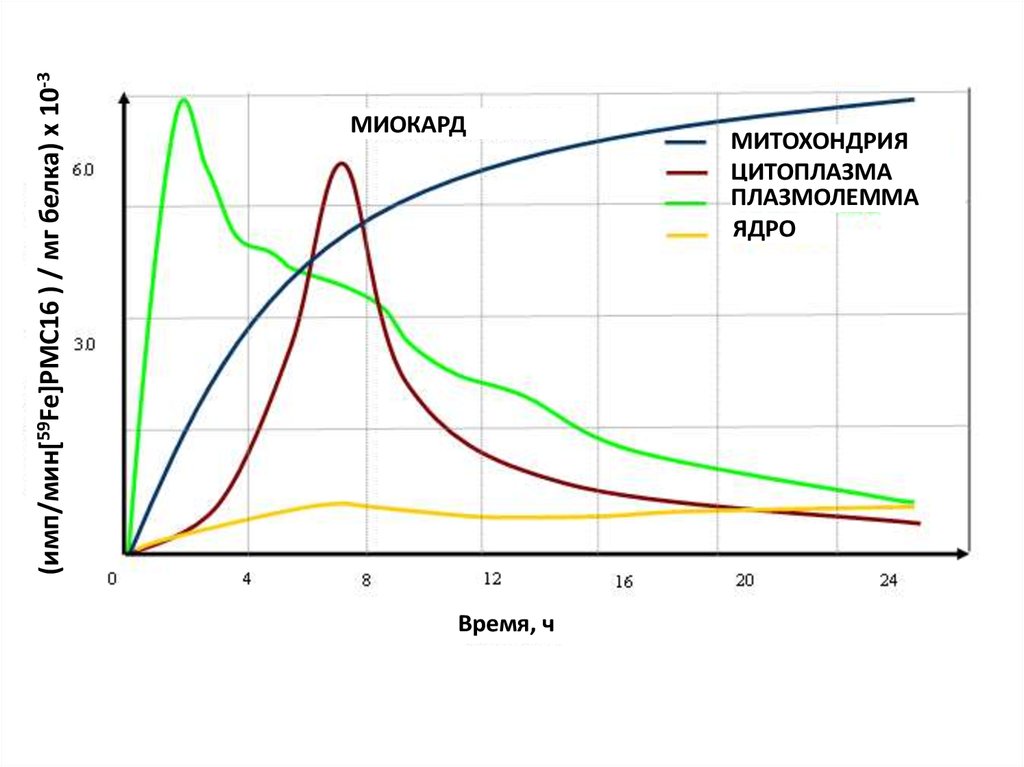
12.
(имп/мин[59Fe]PMC16 ) / мг белка) х 10-3МИОКАРД
Время, ч
МИТОХОНДРИЯ
ЦИТОПЛАЗМА
ПЛАЗМОЛЕММА
ЯДРО
13.
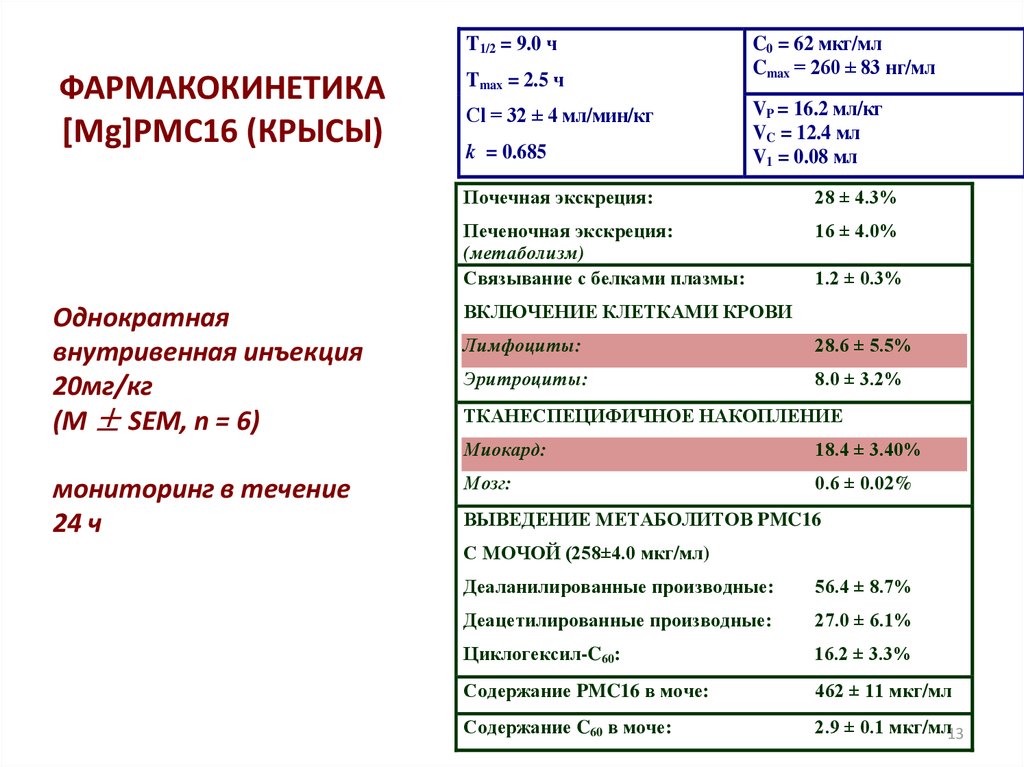
T1/2 = 9.0 чФАРМАКОКИНЕТИКА
[Mg]PMC16 (КРЫСЫ)
Однократная
внутривенная инъекция
20мг/кг
(M ± SEM, n = 6)
мониторинг в течение
24 ч
Tmax = 2.5 ч
Cl = 32 ± 4 мл/мин/кг
k = 0.685
C0 = 62 мкг/мл
Cmax = 260 ± 83 нг/мл
VP = 16.2 мл/кг
VC = 12.4 мл
V1 = 0.08 мл
Почечная экскреция:
28 ± 4.3%
Печеночная экскреция:
(метаболизм)
Связывание с белками плазмы:
16 ± 4.0%
1.2 ± 0.3%
ВКЛЮЧЕНИЕ КЛЕТКАМИ КРОВИ
Лимфоциты:
28.6 ± 5.5%
Эритроциты:
8.0 ± 3.2%
ТКАНЕСПЕЦИФИЧНОЕ НАКОПЛЕНИЕ
Миокард:
18.4 ± 3.40%
Мозг:
0.6 ± 0.02%
ВЫВЕДЕНИЕ МЕТАБОЛИТОВ PMC16
С МОЧОЙ (258±4.0 мкг/мл)
Деаланилированные производные:
56.4 ± 8.7%
Деацетилированные производные:
27.0 ± 6.1%
Циклогексил-C60:
16.2 ± 3.3%
Содержание PMC16 в моче:
462 ± 11 мкг/мл
Содержание C60 в моче:
2.9 ± 0.1 мкг/мл13
14.
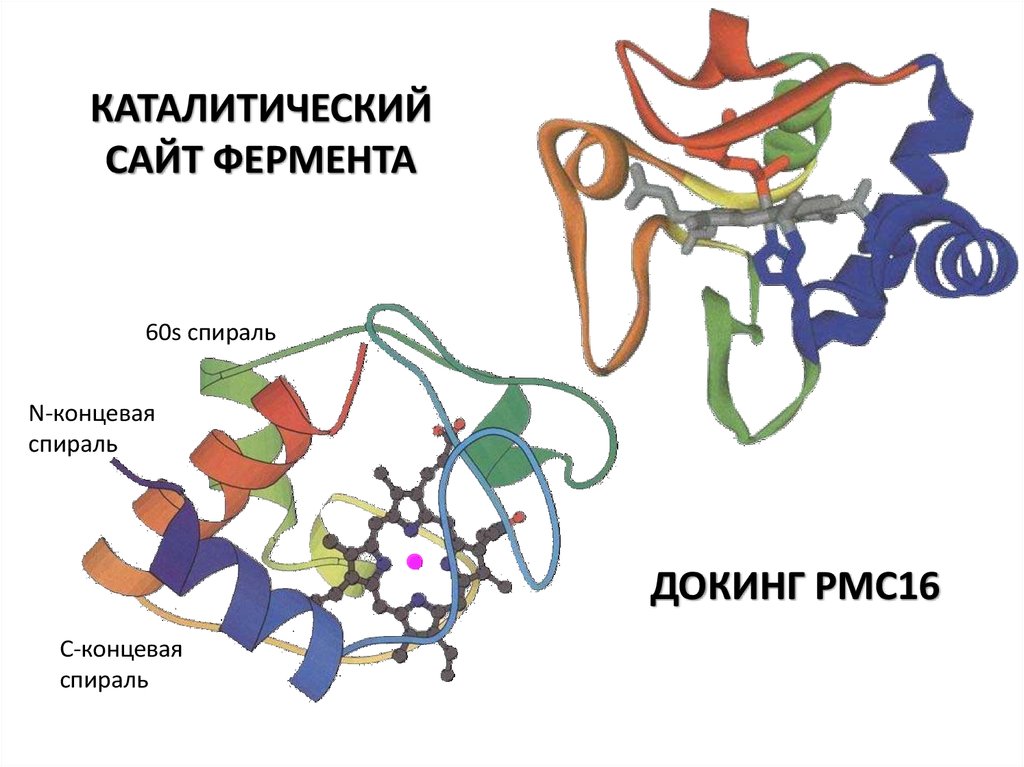
КАТАЛИТИЧЕСКИЙСАЙТ ФЕРМЕНТА
60s спираль
N-концевая
спираль
ДОКИНГ РМС16
С-концевая
спираль
15.
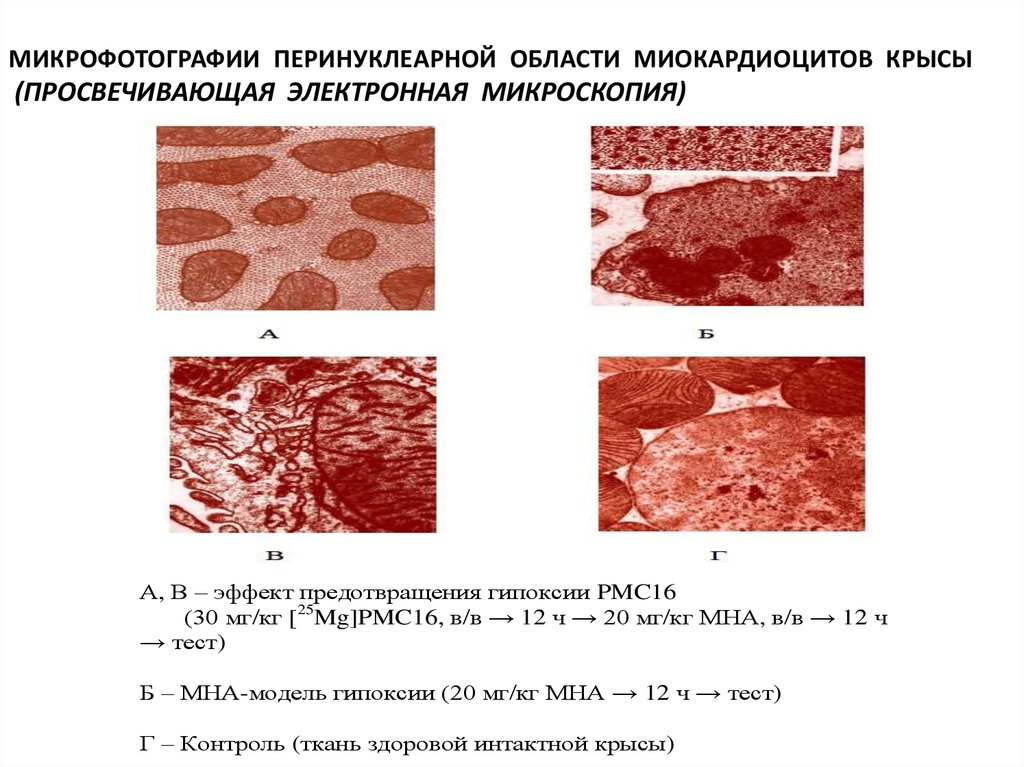
МИКРОФОТОГРАФИИ ПЕРИНУКЛЕАРНОЙ ОБЛАСТИ МИОКАРДИОЦИТОВ КРЫСЫ(ПРОСВЕЧИВАЮЩАЯ ЭЛЕКТРОННАЯ МИКРОСКОПИЯ)
А, В – эффект предотвращения гипоксии PMC16
(30 мг/кг [25Mg]PMC16, в/в → 12 ч → 20 мг/кг МНА, в/в → 12 ч
→ тест)
Б – МНА-модель гипоксии (20 мг/кг МНА → 12 ч → тест)
Г – Контроль (ткань здоровой интактной крысы)
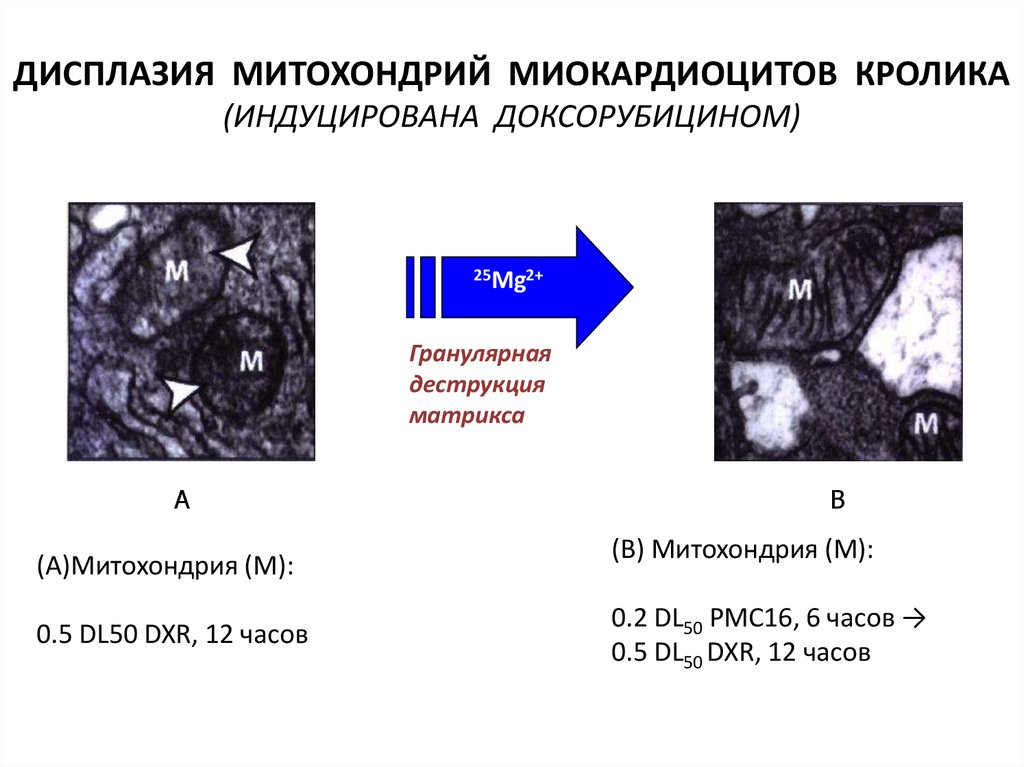
16. ДИСПЛАЗИЯ МИТОХОНДРИЙ МИОКАРДИОЦИТОВ КРОЛИКА (ИНДУЦИРОВАНА ДОКСОРУБИЦИНОМ)
25Mg2+Гранулярная
деструкция
матрикса
A
(A)Митохондрия (M):
0.5 DL50 DXR, 12 часов
B
(B) Митохондрия (M):
0.2 DL50 PMC16, 6 часов →
0.5 DL50 DXR, 12 часов
17.
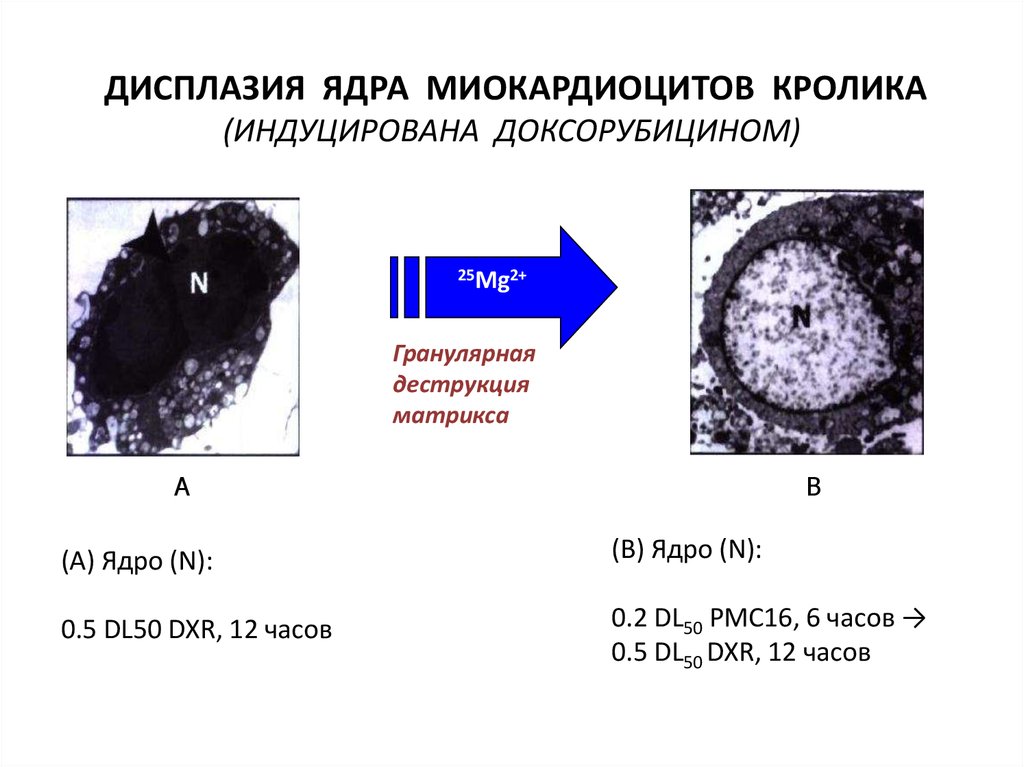
ДИСПЛАЗИЯ ЯДРА МИОКАРДИОЦИТОВ КРОЛИКА(ИНДУЦИРОВАНА ДОКСОРУБИЦИНОМ)
25Mg2+
25Mg2+
Гранулярная
деструкция
матрикса
A
B
(A) Ядро (N):
(B) Ядро (N):
0.5 DL50 DXR, 12 часов
0.2 DL50 PMC16, 6 часов →
0.5 DL50 DXR, 12 часов
18. Перспективы применения в нейробиологии «умных» нанокатионитов на основе порфириновых аддуктов фуллерена С60
Магнитные изотопные эффекты в биологии.Концепция спин-селективной биохимии
(Академик РАН А.Л. Бучаченко)
Синергизм
выхода
АТФ,
потребления
кислорода
и
высвобождения Mg2+ PMC16 в
сердечной мышце крыс
Низкая токсичность
«Умное»
высвобождение 25Mg
в условиях ацидоза
Существенное
увеличение
анаэробного синтеза
АТФ в условиях
гипоксии
Порфиллерен-МС16
(PMC16)
(Проф. Д.А.Кузнецов),
6 международных
патентов
Слева - Изотоп магния с нулевым спином (24Mg)
Справа – Магнитный изотоп (25Mg)
Применение: профилактика и терапия острой и
хронической ишемии головного мозга
(Порфириновые рецепторы в большом количестве
содержатся в митохондриях нейронов).
19.
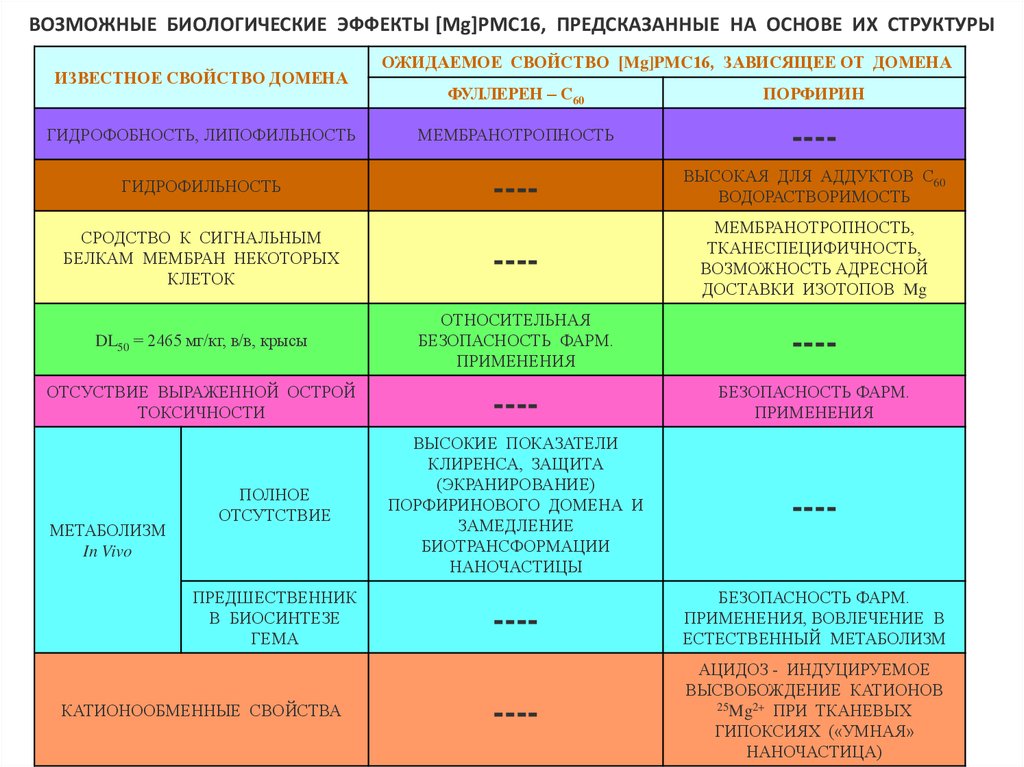
ВОЗМОЖНЫЕ БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ [Mg]PMC16, ПРЕДСКАЗАННЫЕ НА ОСНОВЕ ИХ СТРУКТУРЫИЗВЕСТНОЕ СВОЙСТВО ДОМЕНА
ОЖИДАЕМОЕ СВОЙСТВО [Mg]PMC16, ЗАВИСЯЩЕЕ ОТ ДОМЕНА
ФУЛЛЕРЕН – С60
ПОРФИРИН
ГИДРОФОБНОСТЬ, ЛИПОФИЛЬНОСТЬ
МЕМБРАНОТРОПНОСТЬ
----
ГИДРОФИЛЬНОСТЬ
----
ВЫСОКАЯ ДЛЯ АДДУКТОВ С60
ВОДОРАСТВОРИМОСТЬ
СРОДСТВО К СИГНАЛЬНЫМ
БЕЛКАМ МЕМБРАН НЕКОТОРЫХ
КЛЕТОК
----
МЕМБРАНОТРОПНОСТЬ,
ТКАНЕСПЕЦИФИЧНОСТЬ,
ВОЗМОЖНОСТЬ АДРЕСНОЙ
ДОСТАВКИ ИЗОТОПОВ Mg
DL50 = 2465 мг/кг, в/в, крысы
ОТНОСИТЕЛЬНАЯ
БЕЗОПАСНОСТЬ ФАРМ.
ПРИМЕНЕНИЯ
----
ОТСУСТВИЕ ВЫРАЖЕННОЙ ОСТРОЙ
ТОКСИЧНОСТИ
----
БЕЗОПАСНОСТЬ ФАРМ.
ПРИМЕНЕНИЯ
ВЫСОКИЕ ПОКАЗАТЕЛИ
КЛИРЕНСА, ЗАЩИТА
(ЭКРАНИРОВАНИЕ)
ПОРФИРИНОВОГО ДОМЕНА И
ЗАМЕДЛЕНИЕ
БИОТРАНСФОРМАЦИИ
НАНОЧАСТИЦЫ
----
----
БЕЗОПАСНОСТЬ ФАРМ.
ПРИМЕНЕНИЯ, ВОВЛЕЧЕНИЕ В
ЕСТЕСТВЕННЫЙ МЕТАБОЛИЗМ
----
АЦИДОЗ - ИНДУЦИРУЕМОЕ
ВЫСВОБОЖДЕНИЕ КАТИОНОВ
25Mg2+ ПРИ ТКАНЕВЫХ
ГИПОКСИЯХ («УМНАЯ»
19
НАНОЧАСТИЦА)
МЕТАБОЛИЗМ
In Vivo
ПОЛНОЕ
ОТСУТСТВИЕ
ПРЕДШЕСТВЕННИК
В БИОСИНТЕЗЕ
ГЕМА
КАТИОНООБМЕННЫЕ СВОЙСТВА
20.
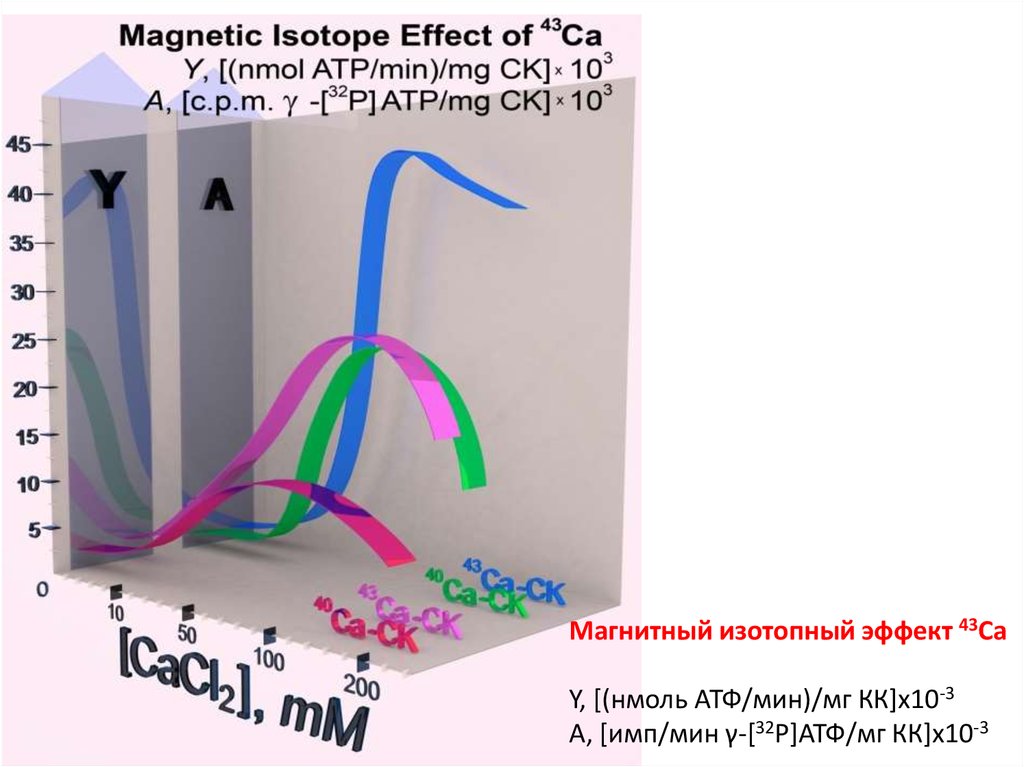
Магнитный изотопный эффект 43CaY, [(нмоль АТФ/мин)/мг КК]х10-3
A, [имп/мин γ-[32P]АТФ/мг КК]х10-3
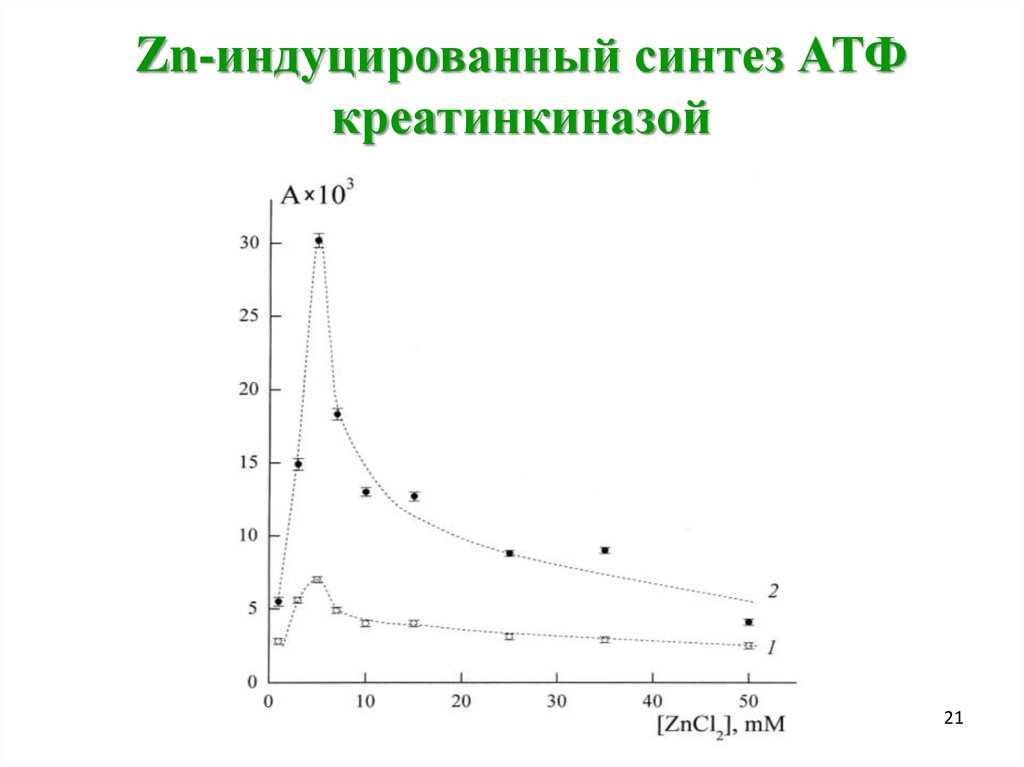
21. Zn-индуцированный синтез АТФ креатинкиназой
2122.
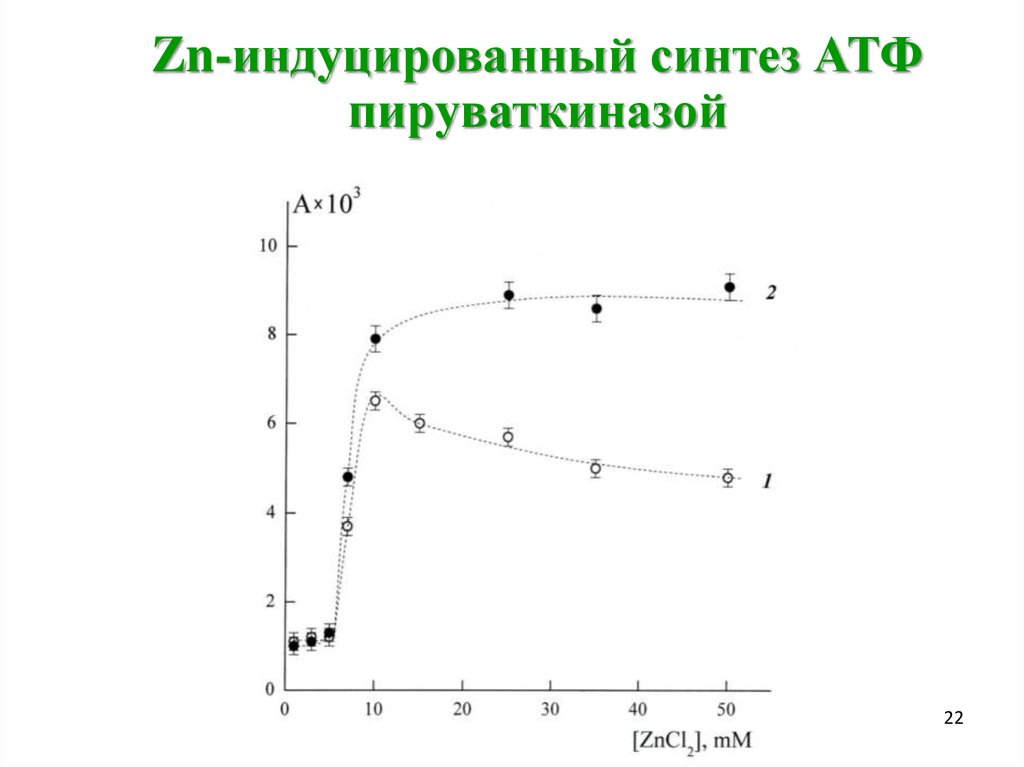
Zn-индуцированный синтез АТФпируваткиназой
22
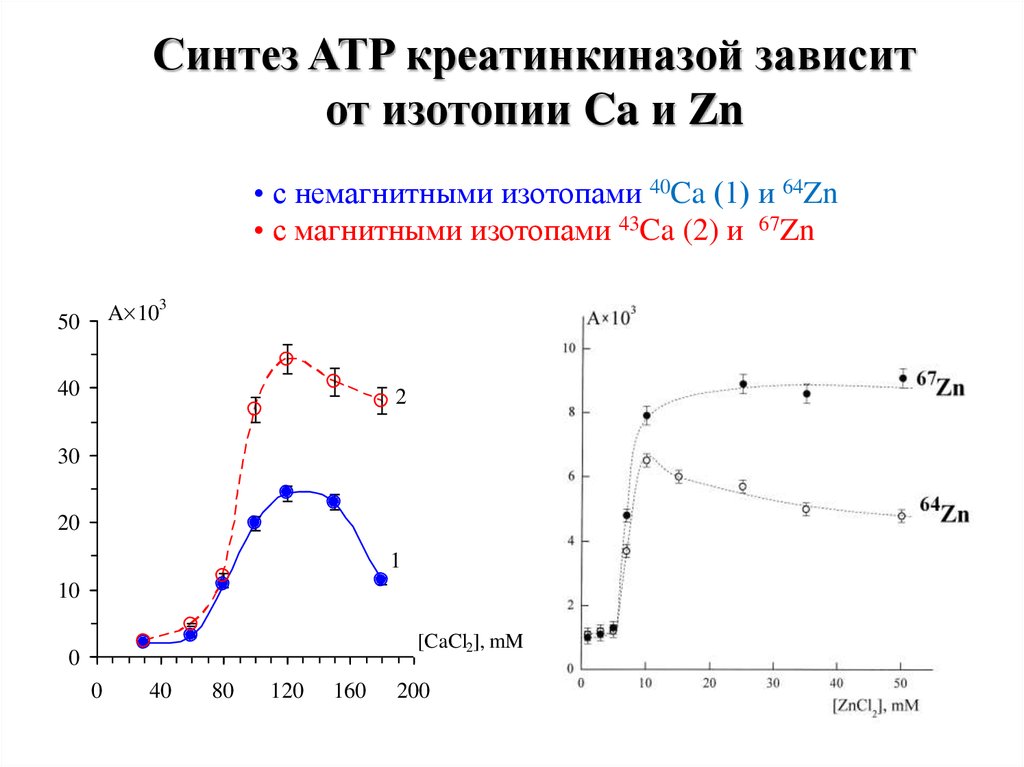
23. Синтез ATP креатинкиназой зависит от изотопии Ca и Zn • с немагнитными изотопами 40Ca (1) и 64Zn • с магнитными изотопами 43Ca
(2) и 67ZnA 10
3
50
40
2
30
20
1
10
[CaCl2], mM
0
0
40
80
120
160
200
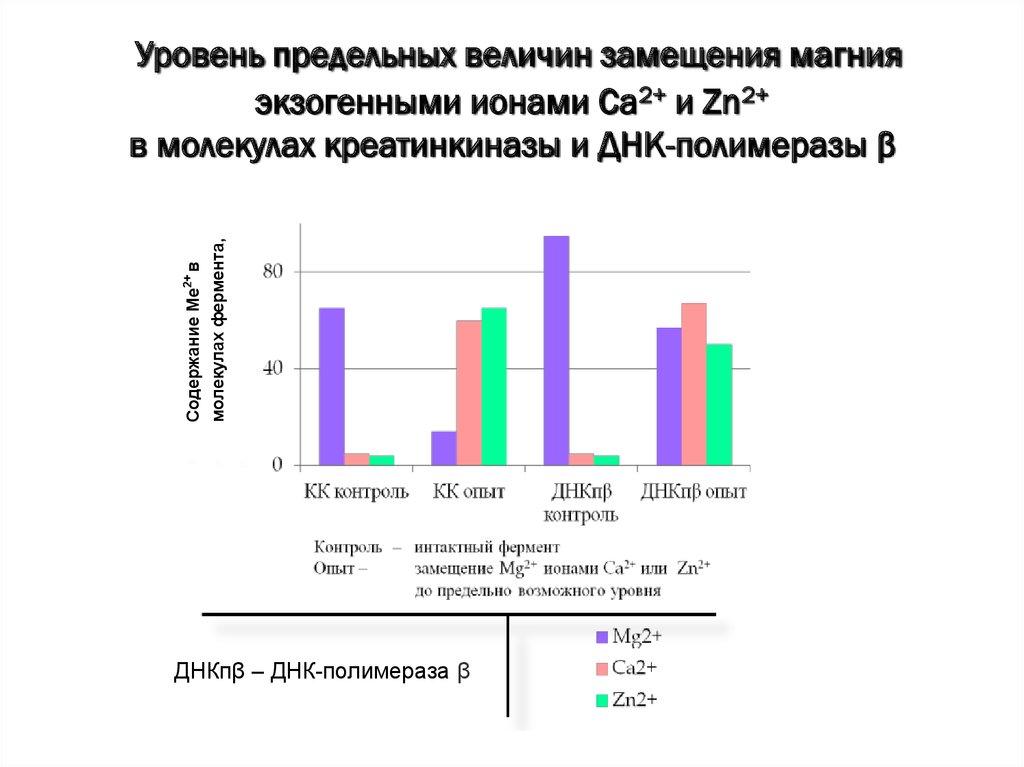
24. Уровень предельных величин замещения магния экзогенными ионами Ca2+ и Zn2+ в молекулах креатинкиназы и ДНК-полимеразы β
Содержание Me2+ вмолекулах фермента,
пг/мг белка
Уровень предельных величин замещения магния
экзогенными ионами Ca2+ и Zn2+
в молекулах креатинкиназы и ДНК-полимеразы β
ДНКпβ – ДНК-полимераза β
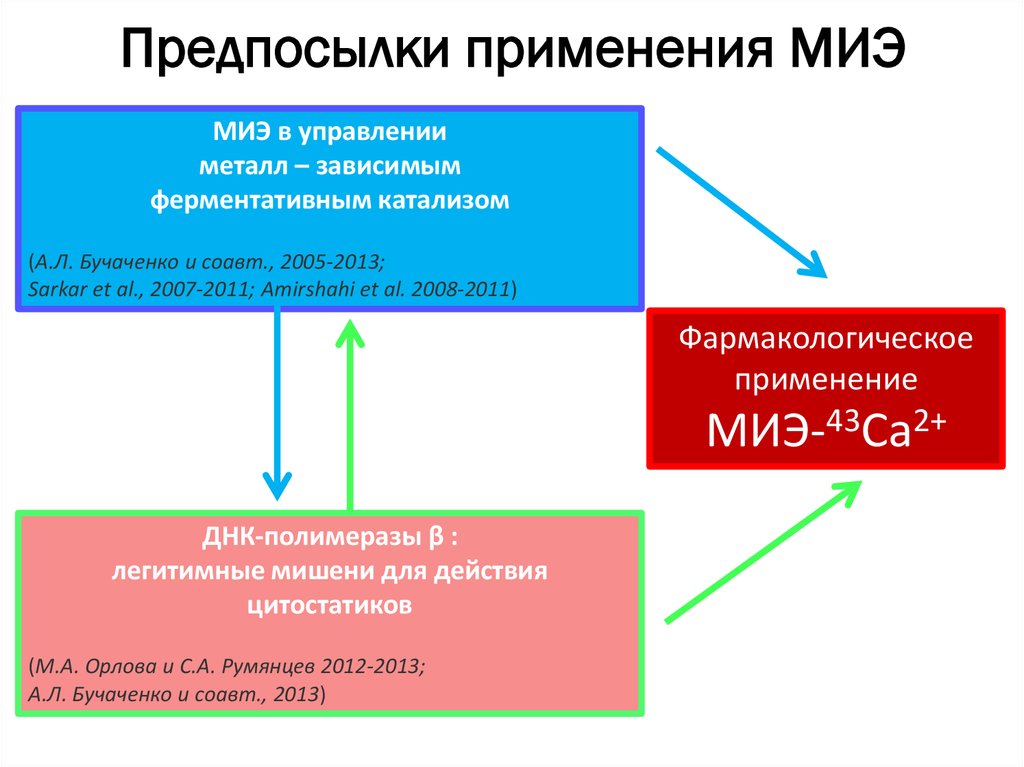
25. Предпосылки применения МИЭ
МИЭ в управленииметалл – зависимым
ферментативным катализом
(А.Л. Бучаченко и соавт., 2005-2013;
Sarkar et al., 2007-2011; Amirshahi et al. 2008-2011)
Фармакологическое
применение
МИЭ-43Ca2+
ДНК-полимеразы β :
легитимные мишени для действия
цитостатиков
(М.А. Орлова и С.А. Румянцев 2012-2013;
А.Л. Бучаченко и соавт., 2013)
26.
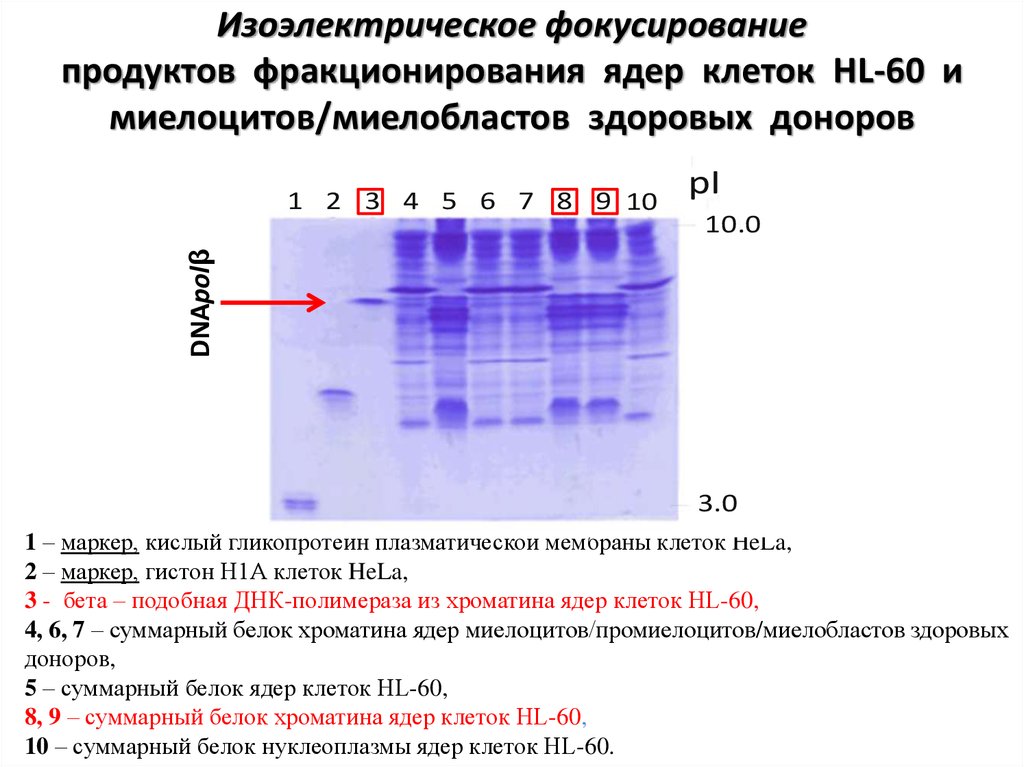
50 kDaD фокусирование
Изоэлектрическое
35 kDa
продуктов фракционирования ядер клеток HL-60 и
25 kDa
миелоцитов/миелобластов здоровых доноров
C
pI
10.0
DNApolβ
1 2 3 4 5 6 7 8 9 10
E
3.0
1 – маркер, кислый гликопротеин плазматической мембраны клеток HeLa,
2 – маркер, гистон Н1А клеток HeLa,
3 - бета – подобная ДНК-полимераза из хроматина ядер клеток HL-60,
4, 6, 7 – суммарный белок хроматина ядер миелоцитов/промиелоцитов/миелобластов здоровых
доноров,
5 – суммарный белок ядер клеток HL-60,
8, 9 – суммарный белок хроматина ядер клеток HL-60,
10 – суммарный белок нуклеоплазмы ядер клеток HL-60.
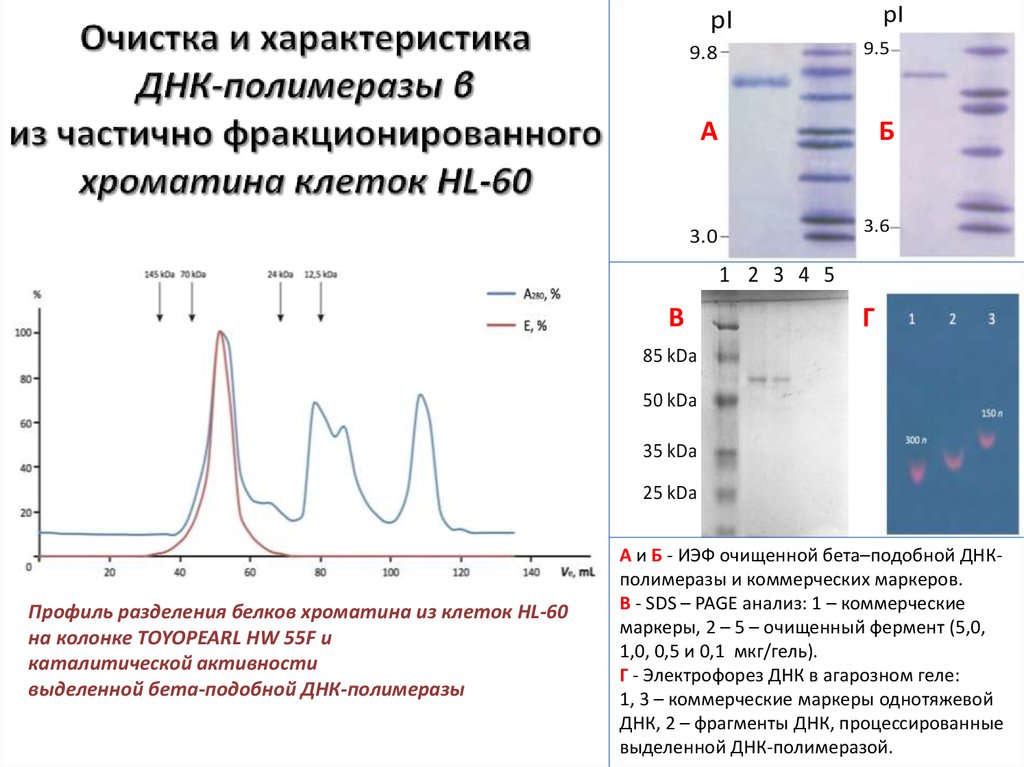
27. Очистка и характеристика ДНК-полимеразы β из частично фракционированного хроматина клеток HL-60
AB
pI 150 n
300 n
1
2
pI
C1 2 3
9.5
9.8
85 kDa
3
А
Б50 kDa
35 kDa
A
pI
9.8
1
2
3300 n
B
150 n
1 2 3 4 5
pI
100
C
В 9.5
Г
1 2 3
85 kDa
50 kDa
80
3.625 kDa
3.0
120
140
35 kDa
3.0
25 kDa
3.6
Ve, mL
D
A280,
E, %
А и Б - ИЭФ очищенной бета–подобной ДНКpI
pI C
полимеразы
1 и2коммерческих
3 4 5 6 7маркеров.
8 9 10
150 n
В - SDS – PAGE анализ: 1 – коммерческие 10.0
Профиль разделения белков хроматина из клеток
HL-60
9.5
маркеры, 2 – 5 – очищенный фермент (5,0,
на колонке300
TOYOPEARL
HW 55F и
n
1,0, 0,5 и 0,1 мкг/гель).
каталитической активности
Г - Электрофорез ДНК в агарозном геле:
выделенной бета-подобной ДНК-полимеразы
1, 3 – коммерческие маркеры однотяжевой
ДНК, 2 – фрагменты ДНК, процессированные
100
120
140
Ve, mL
E
выделенной ДНК-полимеразой.
28. Идентификационные критерии ДНК-полимераз семейства β
Молекулярная масса <110 кДаНизкая процессивность фермента
Низкая продуктивность (n<300)
Mg-зависимый фермент
Мономер
Отсутствие 3’,5’-экзонуклеазной активности
Локализация в хроматине
Резистентность к таким ингибиторам, как Афидиколин
и N-этил-меламид
ИЭТ 8.2 - 8.6
Активация фермента при высоких концентрациях KCl (200mM)
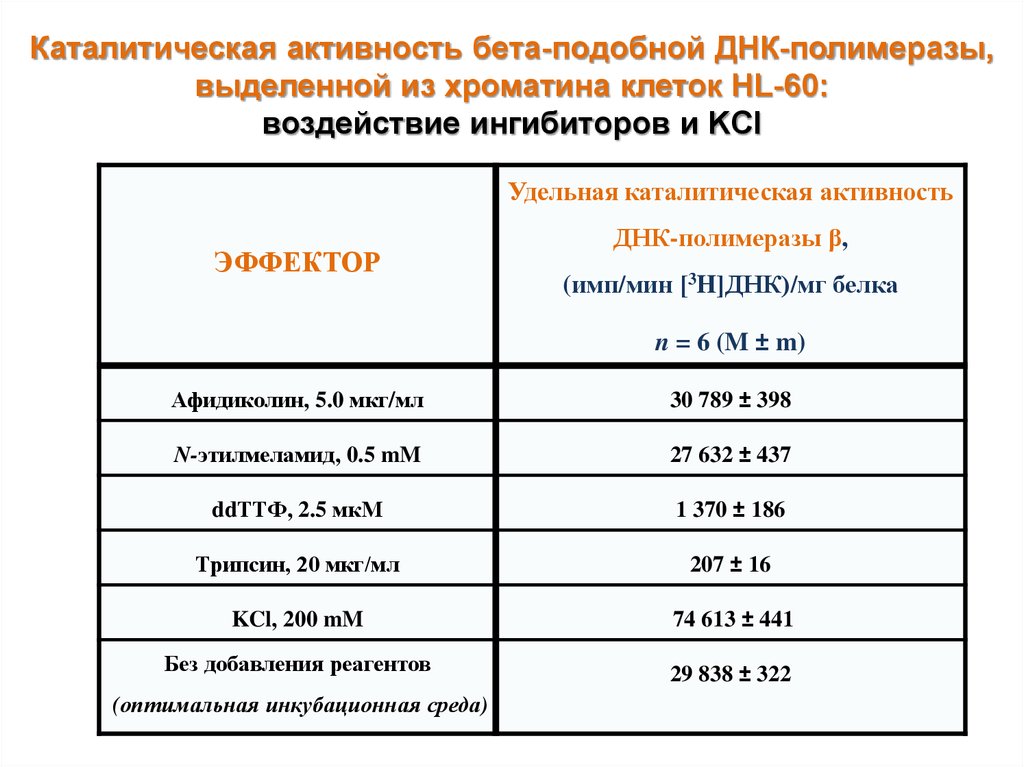
29. Каталитическая активность бета-подобной ДНК-полимеразы, выделенной из хроматина клеток HL-60: воздействие ингибиторов и KCl
Удельная каталитическая активностьЭФФЕКТОР
ДНК-полимеразы β,
(имп/мин [3H]ДНК)/мг белка
n = 6 (M ± m)
Афидиколин, 5.0 мкг/мл
30 789 ± 398
N-этилмеламид, 0.5 mM
27 632 ± 437
ddТТФ, 2.5 мкM
1 370 ± 186
Трипсин, 20 мкг/мл
207 ± 16
KCl, 200 mM
74 613 ± 441
Без добавления реагентов
29 838 ± 322
(оптимальная инкубационная среда)
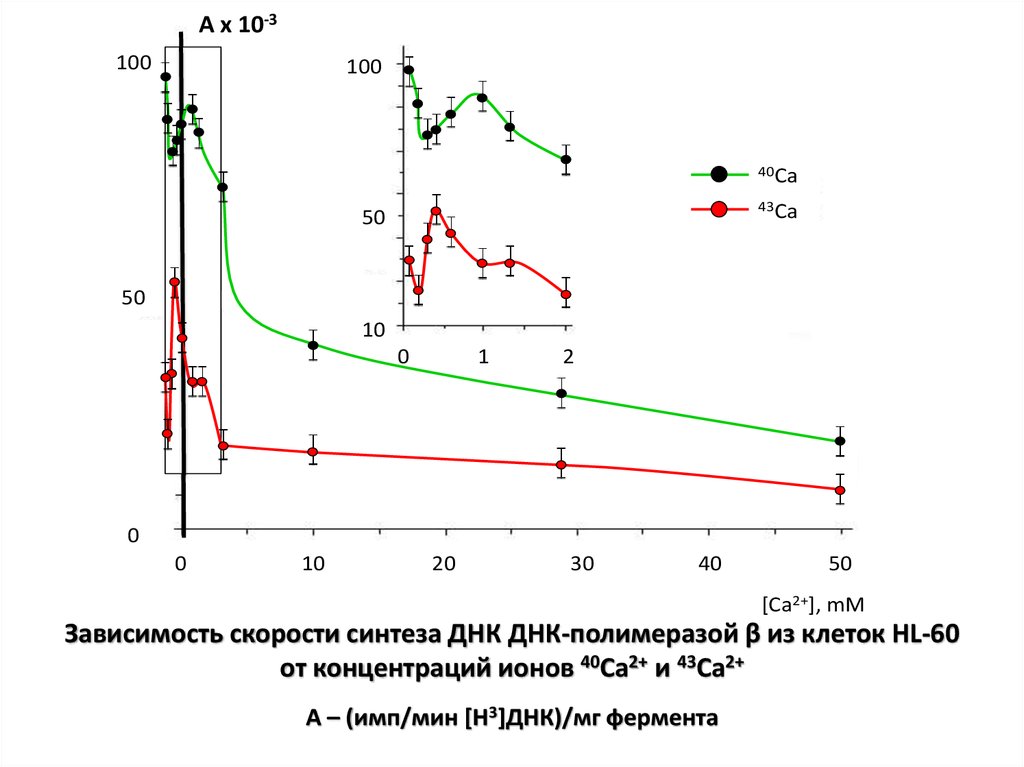
30.
3 -3А
х 10
A10
100
100
40Ca
43Ca
50
50
10
0
1
2
0
0
10
20
30
30
40
50
[Ca2+], mM
Зависимость скорости синтеза ДНК ДНК-полимеразой β из клеток HL-60
от концентраций ионов 40Ca2+ и 43Ca2+
A – (имп/мин [H3]ДНК)/мг фермента
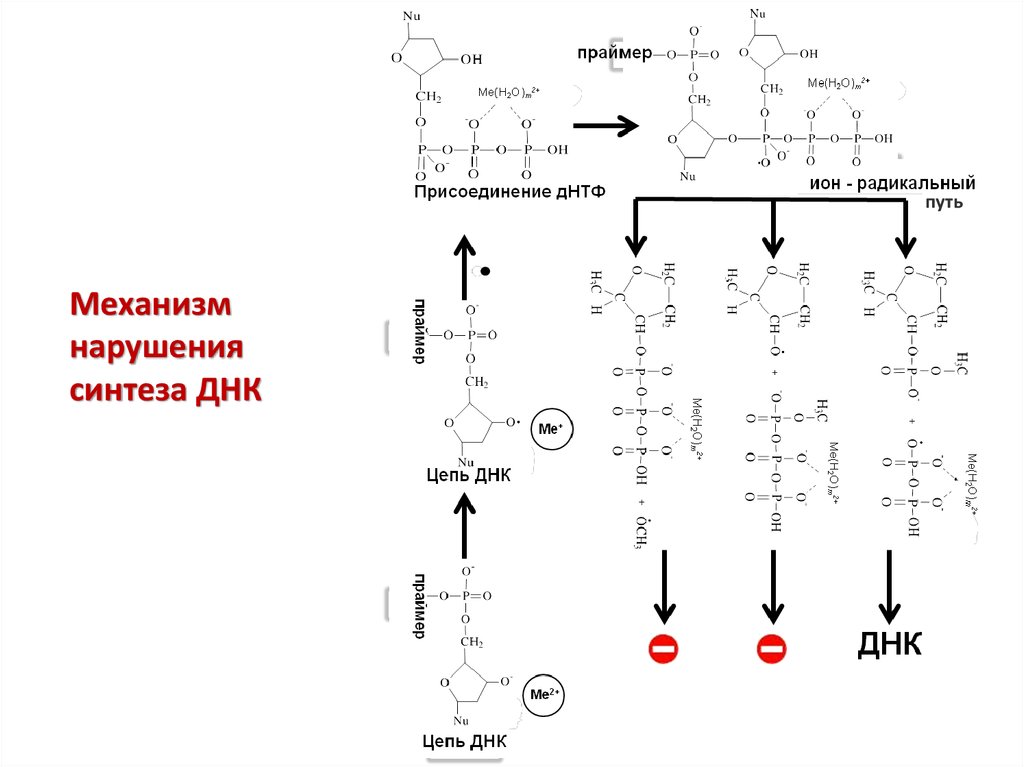
31.
путьМеханизм
нарушения
синтеза ДНК
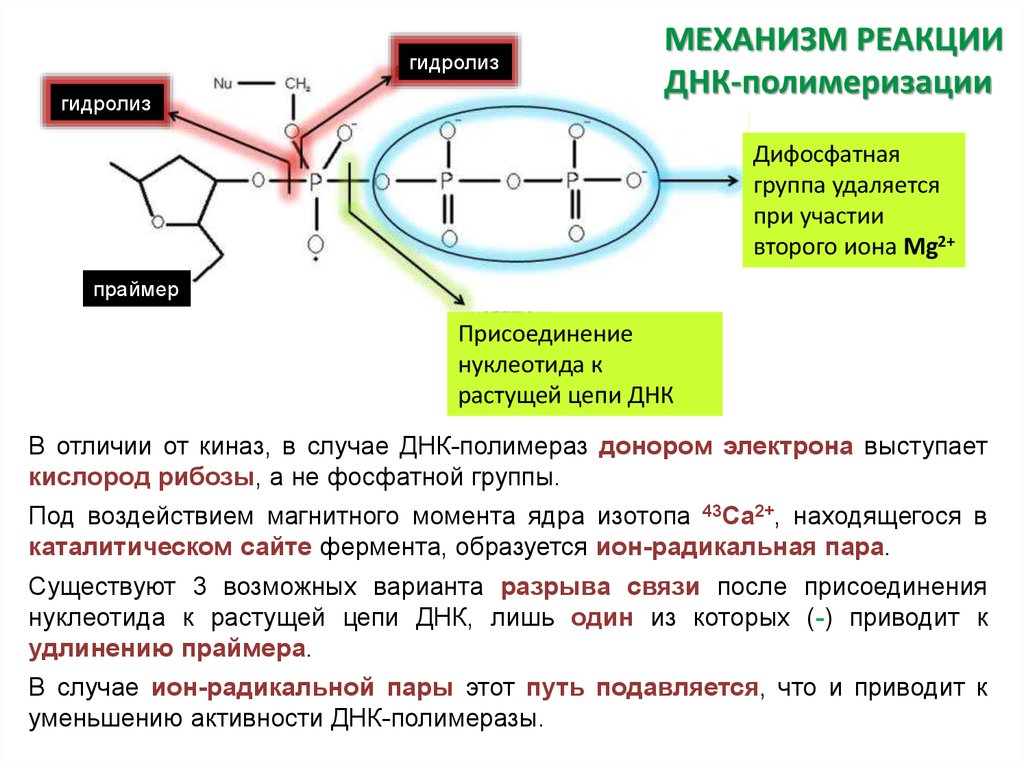
32.
гидролизгидролиз
МЕХАНИЗМ РЕАКЦИИ
ДНК-полимеризации
Дифосфатная
группа удаляется
при участии
второго иона Mg2+
праймер
Присоединение
нуклеотида к
растущей цепи ДНК
В отличии от киназ, в случае ДНК-полимераз донором электрона выступает
кислород рибозы, а не фосфатной группы.
Под воздействием магнитного момента ядра изотопа 43Ca2+, находящегося в
каталитическом сайте фермента, образуется ион-радикальная пара.
Существуют 3 возможных варианта разрыва связи после присоединения
нуклеотида к растущей цепи ДНК, лишь один из которых (-) приводит к
удлинению праймера.
В случае ион-радикальной пары этот путь подавляется, что и приводит к
уменьшению активности ДНК-полимеразы.
33. Влияние МИЭ - Ме2+ на кинетику катализа, обеспечиваемого ДНК-полимеразой β из клеток HL-60 ([Ме2+]opt=20 mM)
0,04KM, mM (M±m, n=6)
0,035
0,03
0,025
0,02
0,015
0,01
0,005
0
*Mg
*Ca 25Mg
43Ca
Kcat, (µM dTTP)/мин)/мг белка(M±m, n=6)
Влияние МИЭ - Ме2+ на кинетику катализа,
обеспечиваемого ДНК-полимеразой β из клеток HL-60
([Ме2+]opt=20 mM)
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0
*Mg
*Ca
25Mg
43Ca
34.
ВОЗДЕЙСТВИЕ ИЗОТОПИИ ИНКУБАЦИОННОЙ СМЕСИДНК-ПОЛИМЕРАЗЫ β
НА ДЛИНУ СИНТЕЗИРОВАННЫХ ФРАГМЕНТОВ ДНК
Электрофорез в 2.0%-м геле агарозы
1 – ДНК-маркеры, 110 – 489 n;
2 - 2-20 мМ 43CaCl2, без Mg;
3 - 3-20 мМ 25MgCl2, без Ca;
4 - 4-20 мМ 40CaCl2, без Mg;
5 - 5-20 мМ 24MgCl2, без Ca;
Условия инкубации фермента оптимизированы:
рН 8.0, + 37 °С, 20 мМ MeCl2, 60 мин
35.
·)
200 n
0.5
100 n
0.2
0.3
0.4
0.5
0.1
Fraction
ofкальция
Ca2+ inв the
– bound
bivalent
metal pool
Доля
пуле enzyme
двухвалентного
металла
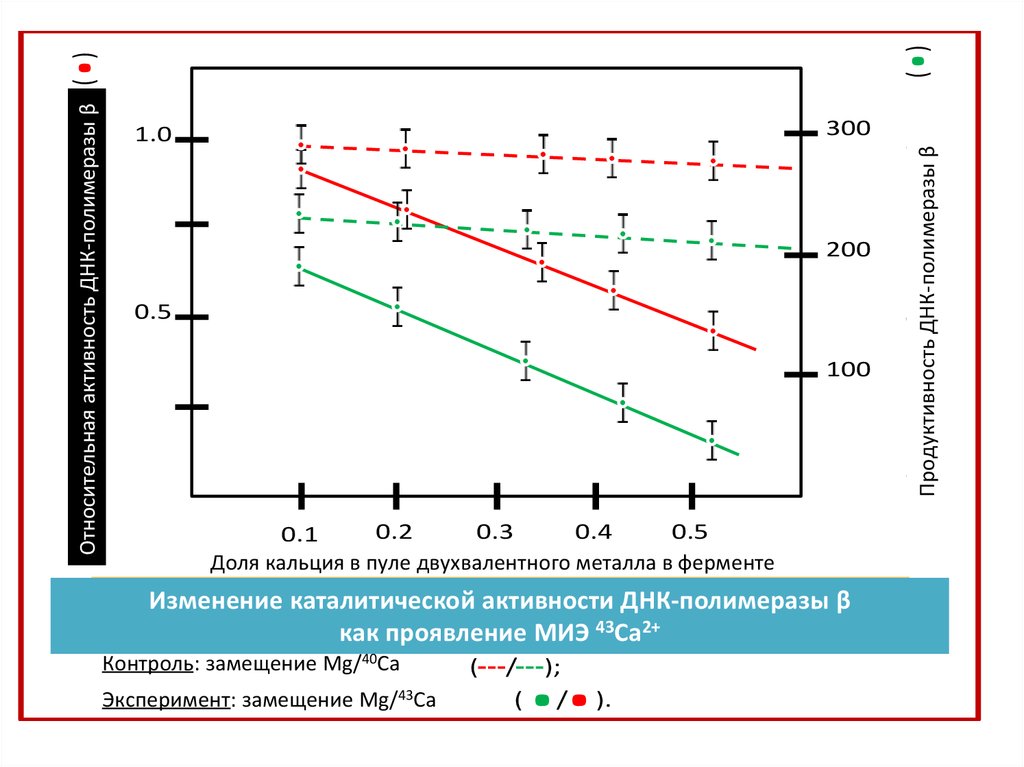
в ферменте
Изменение
ферментативнойактивности
активности ДНК-полимеразы
β,β
Изменение
каталитической
ДНК-полимеразы
43Ca-MIE
in DNApolβ
FUNCTION
43
какпроявление
проявлениеМИЭ
МИЭ 43
как
Ca2+
40Ca/Mg substitution
Контроль: замещение
Mg/40Ca
Controls:
( / );
43Ca/Mg substitution
Эксперимент: замещение
Mg/43Ca
Experiment:
( /
··
).
The nascent DNAДНК-полимеразы
fragments maximalβ size, n (
Продуктивность
·
)
relative
catalytic activity
Относительная DNApolβ
активности
ДНК-полимеразы
ДНК-полимеразы
активность
β (
300 n
1.0
36.
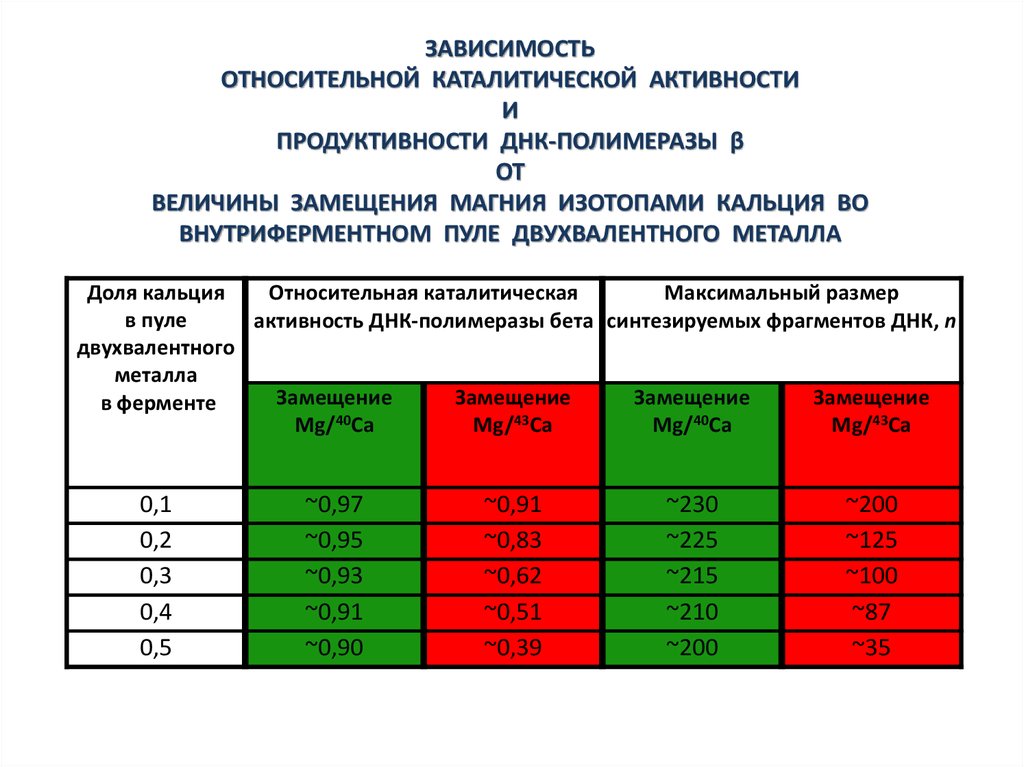
ЗАВИСИМОСТЬОТНОСИТЕЛЬНОЙ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ
И
ПРОДУКТИВНОСТИ ДНК-ПОЛИМЕРАЗЫ β
ОТ
ВЕЛИЧИНЫ ЗАМЕЩЕНИЯ МАГНИЯ ИЗОТОПАМИ КАЛЬЦИЯ ВО
ВНУТРИФЕРМЕНТНОМ ПУЛЕ ДВУХВАЛЕНТНОГО МЕТАЛЛА
Доля кальция
Относительная каталитическая
Максимальный размер
в пуле
активность ДНК-полимеразы бета синтезируемых фрагментов ДНК, n
двухвалентного
металла
Замещение
Замещение
Замещение
Замещение
в ферменте
40
43
40
Mg/ Ca
Mg/ Ca
Mg/ Ca
Mg/43Ca
0,1
0,2
0,3
0,4
0,5
~0,97
~0,95
~0,93
~0,91
~0,90
~0,91
~0,83
~0,62
~0,51
~0,39
~230
~225
~215
~210
~200
~200
~125
~100
~87
~35
37.
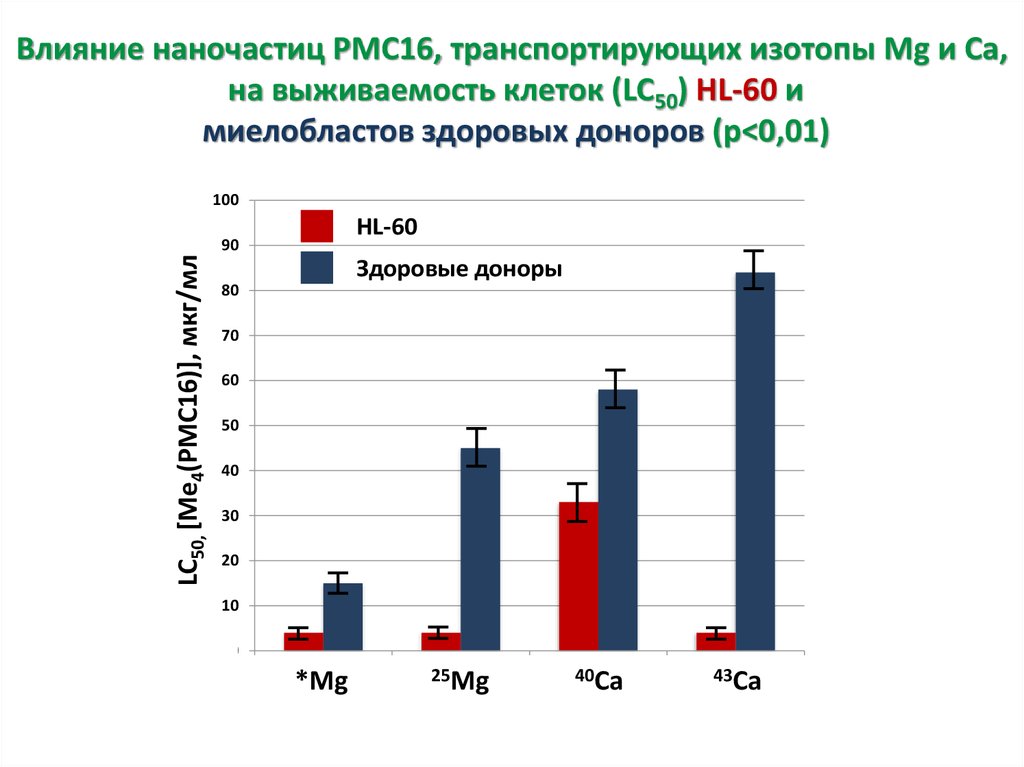
Влияние наночастиц PMC16, транспортирующих изотопы Mg и Ca,на выживаемость клеток (LC50) HL-60 и
миелобластов здоровых доноров (p<0,01)
LC50, [Me4(PMC16)], мкг/мл
100
HL-60
90
Здоровые доноры
80
70
60
50
40
30
20
10
0
*Mg
25Mg
40Ca
43Ca
38.
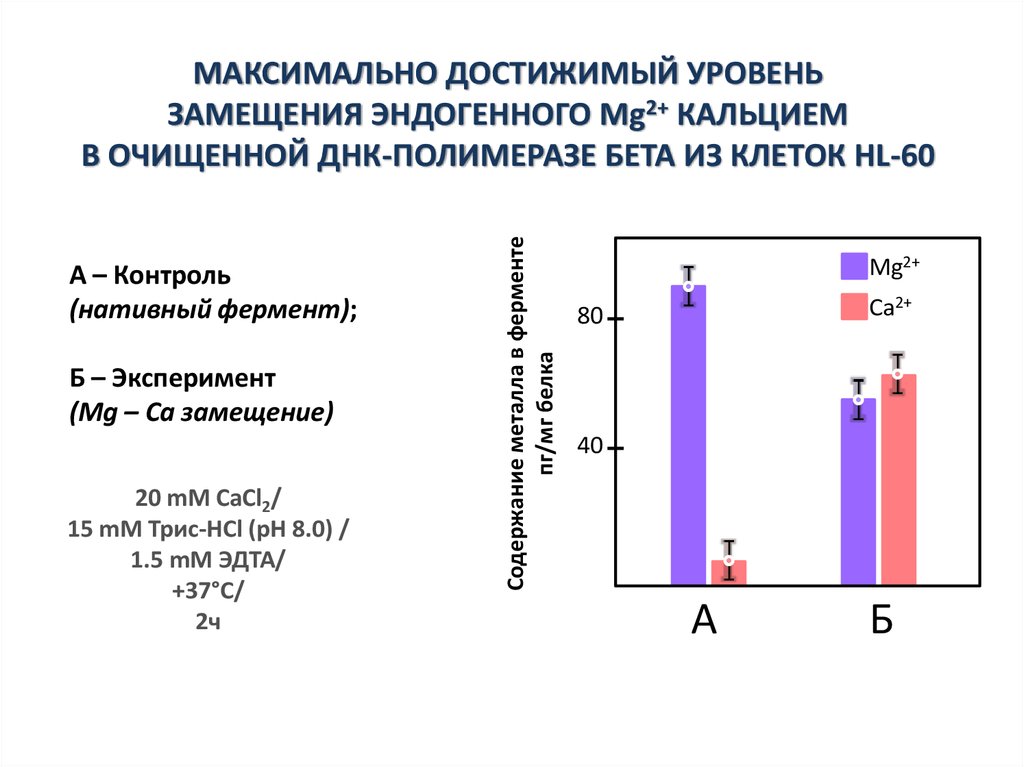
A – Контроль(нативный фермент);
Б – Эксперимент
(Mg – Ca замещение)
20 mM CaCl2/
15 mM Трис-HCl (pH 8.0) /
1.5 mM ЭДТА/
+37°C/
2ч
Содержание металла в ферменте
пг/мг белка
МАКСИМАЛЬНО ДОСТИЖИМЫЙ УРОВЕНЬ
ЗАМЕЩЕНИЯ ЭНДОГЕННОГО Mg2+ КАЛЬЦИЕМ
В ОЧИЩЕННОЙ ДНК-ПОЛИМЕРАЗЕ БЕТА ИЗ КЛЕТОК HL-60
Mg2+
Ca2+
80
40
A
Б
39. Кривые доза-эффект препаратов порфирин-фуллеренов (Ме4[PMC16]) для клеток линии HL60 (миелобластный лейкоз)
120,0110,0
100,0
90,0
80,0
70,0
60,0
50,0
40,0
30,0
20,0
10,0
0,0
0,01
0,1
E(м)
Zn(м)
1
Zn*(м)
Mg(м)
10
Mg*(м)
100
Ca(м)
Ca*(м)
Цитотоксический эффект магнитных изотопов проявляется во всех исследованных концентрациях,
начиная с минимальных. Это может говорить о высоком потенциальном противоопухолевом эффекте,
однако требуются дополнительные эксперименты, направленные на выявление потенциальных
механизмов действия, механизмов гибели клетки, взаимодействия с традиционными химиопрепаратами
(возможно как усиление их действия, так и цитопротекторный эффект, в первую очередь в отношении
здоровых клеток.
Наиболее классическая кривая дозо-зависимого эффекта в отношении бластных клеток отмечается у
немагнитных изотопов магния и кальция, что совпадает с результатами более ранних экспериментов на
клетках пациентов с ОЛЛ.
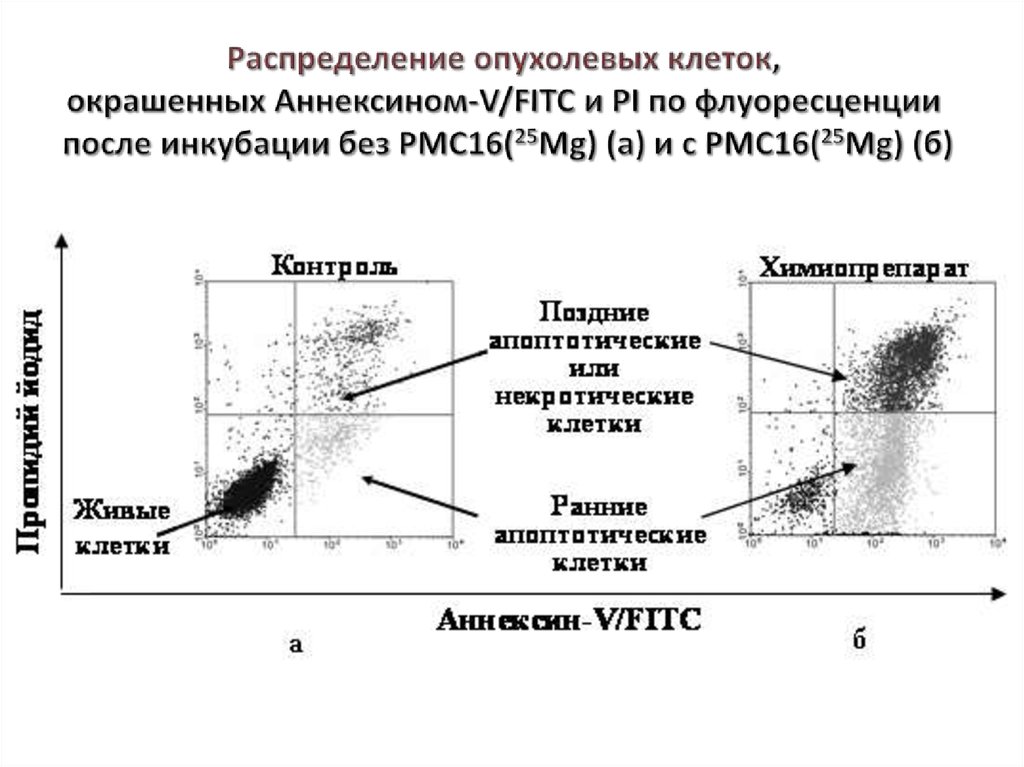
40. Распределение опухолевых клеток, окрашенных Аннексином-V/FITC и PI по флуоресценции после инкубации без PMC16(25Mg) (а) и с
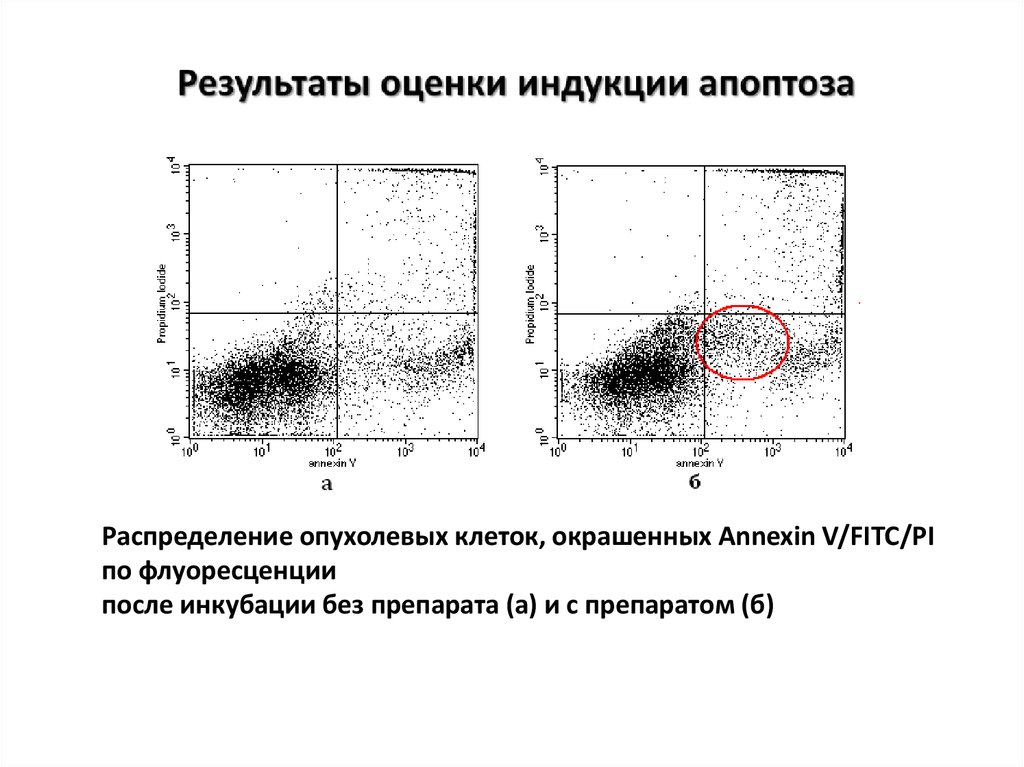
41. Результаты оценки индукции апоптоза
Распределение опухолевых клеток, окрашенных Annexin V/FITC/PIпо флуоресценции
после инкубации без препарата (а) и с препаратом (б)
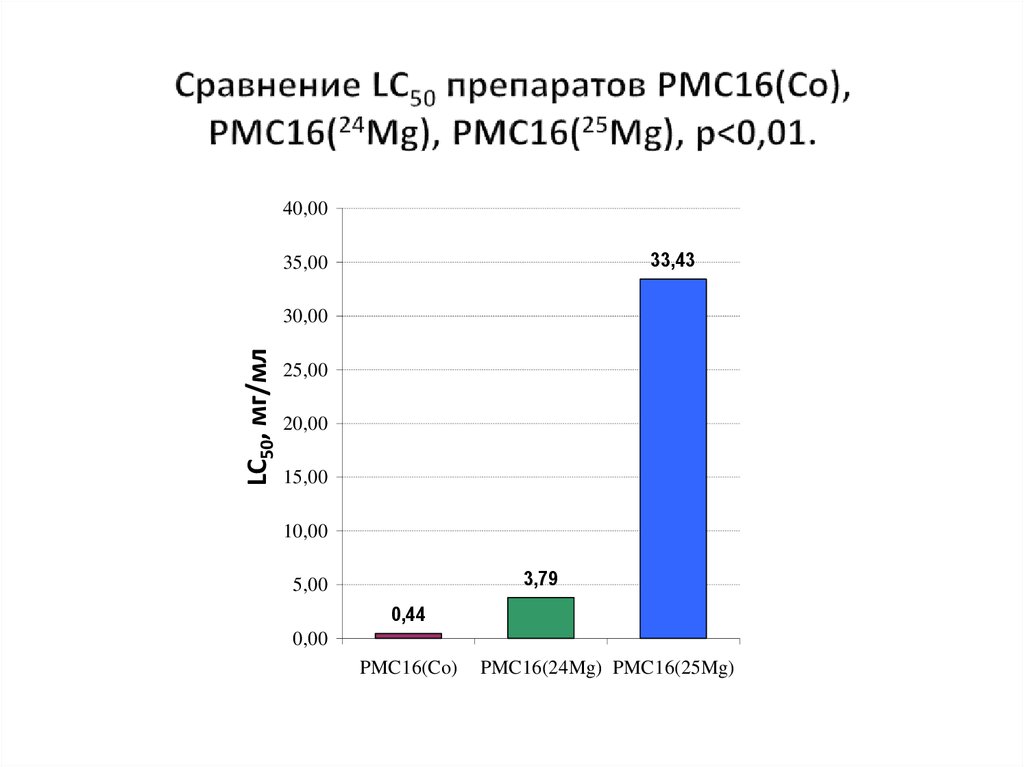
42. Сравнение LС50 препаратов PMC16(Co), PMC16(24Mg), PMC16(25Mg), p<0,01.
40,0033,43
35,00
LC50, мг/мл
LC50,
мг/мл
30,00
25,00
20,00
15,00
10,00
3,79
5,00
0,44
0,00
PMC16(Co)
PMC16(24Mg) PMC16(25Mg)
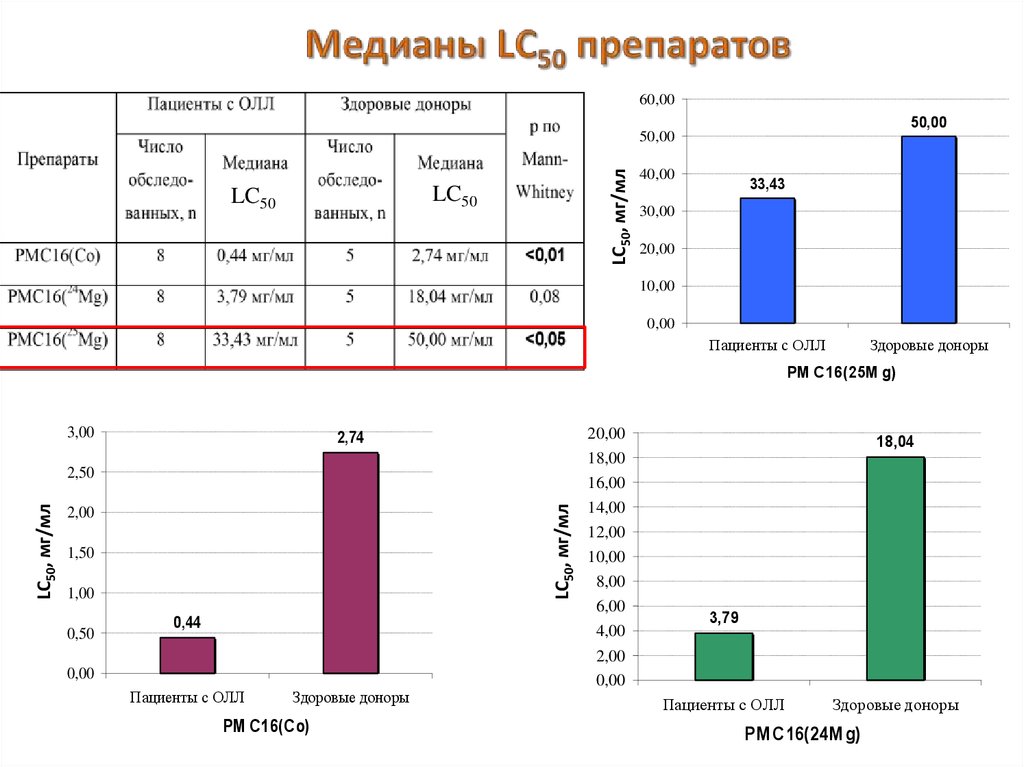
43. Медианы LС50 препаратов
60,0050,00
LCLC50,
мг/мл
50, мг/мл
50,00
LC50
LC50
40,00
33,43
30,00
20,00
10,00
0,00
Пациенты с ОЛЛ
Здоровые доноры
PM C16(25M g)
3,00
2,74
LC50, мг/мл
LC50,
мг/мл
LC
50, мг/мл
LC50,
мг/мл
2,50
2,00
1,50
1,00
0,50
0,44
0,00
Пациенты с ОЛЛ
Здоровые доноры
PM C16(Co)
20,00
18,00
16,00
14,00
12,00
10,00
8,00
6,00
4,00
2,00
0,00
18,04
3,79
Пациенты с ОЛЛ
Здоровые доноры
PM C16(24M g)
44.
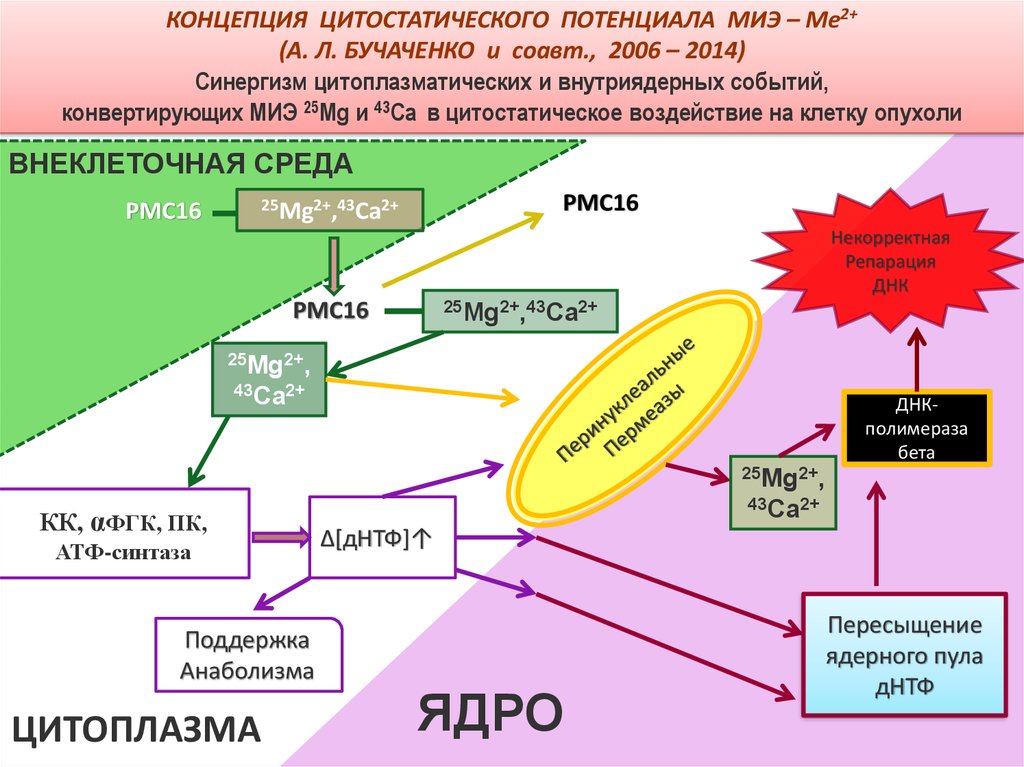
КОНЦЕПЦИЯ ЦИТОСТАТИЧЕСКОГО ПОТЕНЦИАЛА МИЭ – Me2+(А. Л. БУЧАЧЕНКО и соавт., 2006 – 2014)
Синергизм цитоплазматических и внутриядерных событий,
конвертирующих МИЭ 25Mg и 43Ca в цитостатическое воздействие на клетку опухоли
ВНЕКЛЕТОЧНАЯ СРЕДА
PMC16
PMC16
25Mg2+,43Ca2+
Некорректная
Репарация
ДНК
PMC16
25Mg2+,43Ca2+
25Mg2+,
43Ca2+
ДНКполимераза
бета
25Mg2+,
КК, αФГК, ПК,
АТФ-синтаза
Поддержка
Анаболизма
ЦИТОПЛАЗМА
43Ca2+
∆[дНТФ]↑
ЯДРО
Пересыщение
ядерного пула
дНТФ
45. Спасибо
Будьте здоровы илюбимы…
45




![Влияние МИЭ - Ме2+ на кинетику катализа, обеспечиваемого ДНК-полимеразой β из клеток HL-60 ([Ме2+]opt=20 mM) Влияние МИЭ - Ме2+ на кинетику катализа, обеспечиваемого ДНК-полимеразой β из клеток HL-60 ([Ме2+]opt=20 mM)](https://cf2.ppt-online.org/files2/slide/a/a1NAIYW5SoFVgG9QhsKUuxCk4jDizLfRp2wPmeMbT/slide-32.jpg)

![Кривые доза-эффект препаратов порфирин-фуллеренов (Ме4[PMC16]) для клеток линии HL60 (миелобластный лейкоз) Кривые доза-эффект препаратов порфирин-фуллеренов (Ме4[PMC16]) для клеток линии HL60 (миелобластный лейкоз)](https://cf2.ppt-online.org/files2/slide/a/a1NAIYW5SoFVgG9QhsKUuxCk4jDizLfRp2wPmeMbT/slide-38.jpg)

 Биология
Биология








