Похожие презентации:
Оксиды. Классификация оксидов
1. Оксиды
8 классБазовый уровень
2. Что такое оксиды?
Оксиды – сложные неорганические вещества,состоящие из атомов двух химических
элементов, одним из которых является
кислород
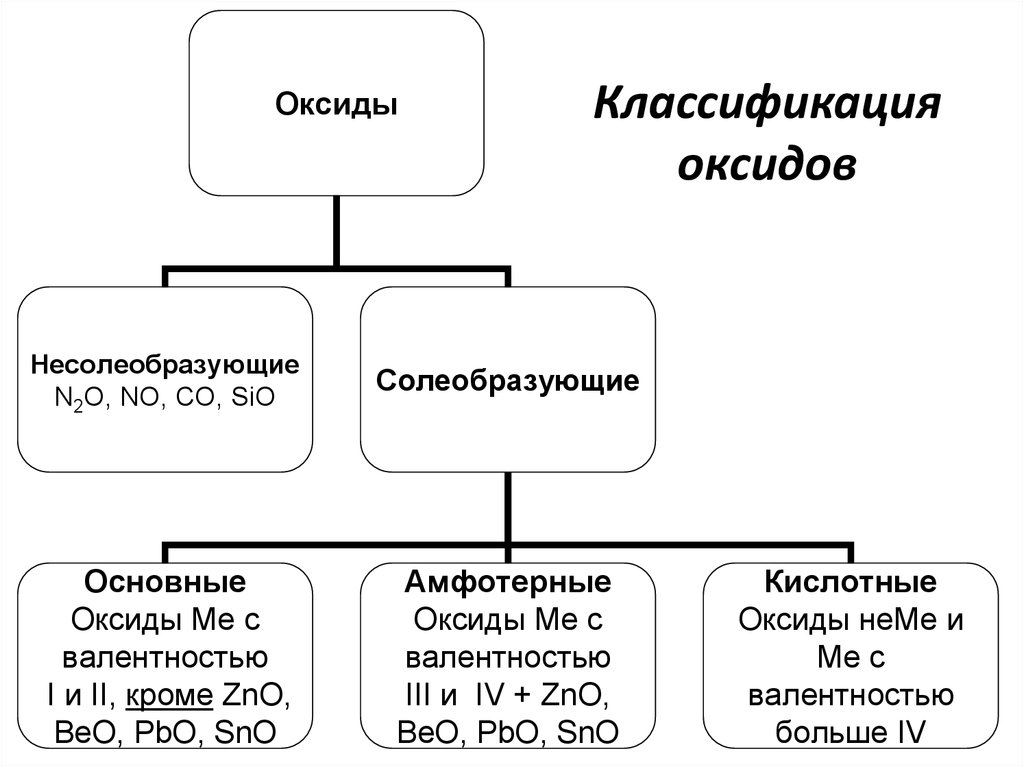
3. Классификация оксидов
ОксидыКлассификация
оксидов
Несолеобразующие
N2O, NO, CO, SiO
Солеобразующие
Основные
Оксиды Ме с
валентностью
I и II, кроме ZnO,
BeO, PbO, SnO
Амфотерные
Оксиды Ме с
валентностью
III и IV + ZnO,
BeO, PbO, SnO
Кислотные
Оксиды неМе и
Ме с
валентностью
больше IV
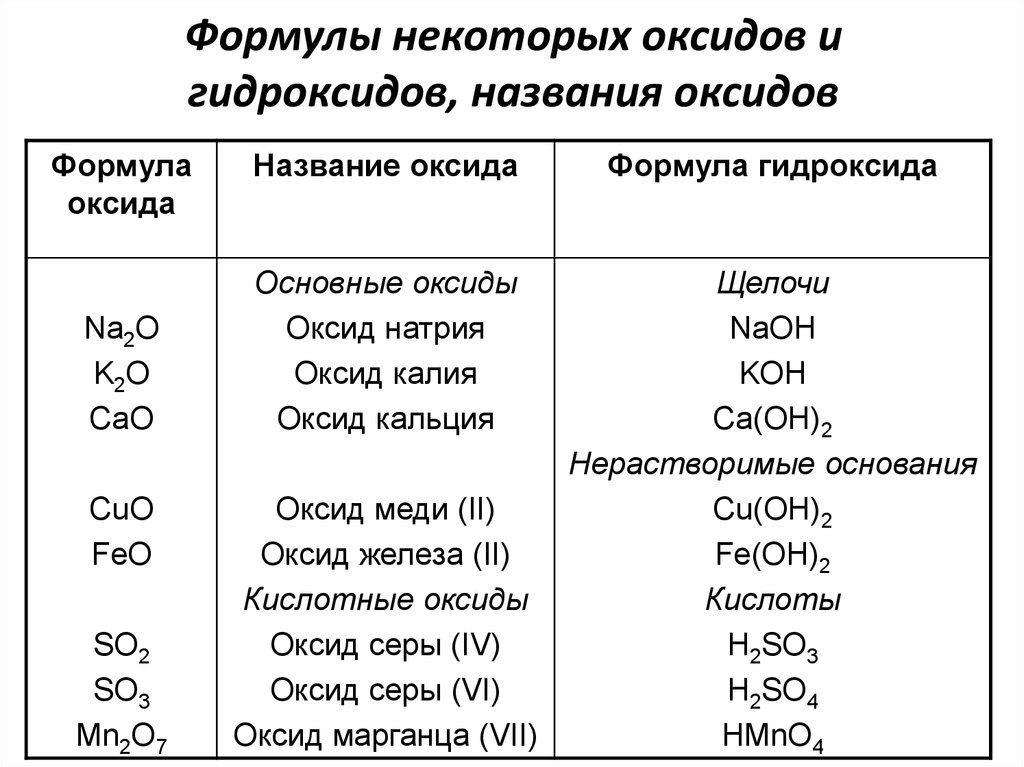
4. Формулы некоторых оксидов и гидроксидов, названия оксидов
Формулаоксида
Na2O
K2O
CaO
CuO
FeO
SO2
SO3
Mn2O7
Название оксида
Основные оксиды
Оксид натрия
Оксид калия
Оксид кальция
Формула гидроксида
Щелочи
NaOH
KOH
Ca(OH)2
Нерастворимые основания
Оксид меди (II)
Cu(OH)2
Оксид железа (II)
Fe(OH)2
Кислотные оксиды
Кислоты
Оксид серы (IV)
H2SO3
Оксид серы (VI)
H2SO4
Оксид марганца (VII)
HMnO4
5. Способы получения оксидов
• Горение веществ: простых, сложных• Разложение сложных веществ:
нерастворимых оснований, кислот,
солей
6. Физические свойства оксидов
7. Химические свойства оксидов
• Основный оксид + вода = щелочь (дляоксидов металлов Iа и IIа групп, кроме Be и
Mg)
• Кислотный оксид + вода = кислота (кроме
SiO2)
Амфотерные оксиды и основные оксиды, не
упомянутые ранее, с водой не
взаимодействуют
8. Химические свойства оксидов
Основный оксид + кислота = соль + вода
Кислотные оксид + щелочь = соль + вода
Основный оксид + кислотный оксид = соль
Менее летучие кислотные оксиды
вытесняют более летучие из их солей
9. Применение оксидов
• Fe2O3, Fe3O4 – руда для получения стали ичугуна
• CaO используется для получения гашеной
извести, которая применяется в
строительстве
• Некоторые оксиды применяются для
производства красок







 Химия
Химия








