Похожие презентации:
Строение и химические свойства кислот
1. СТРОЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
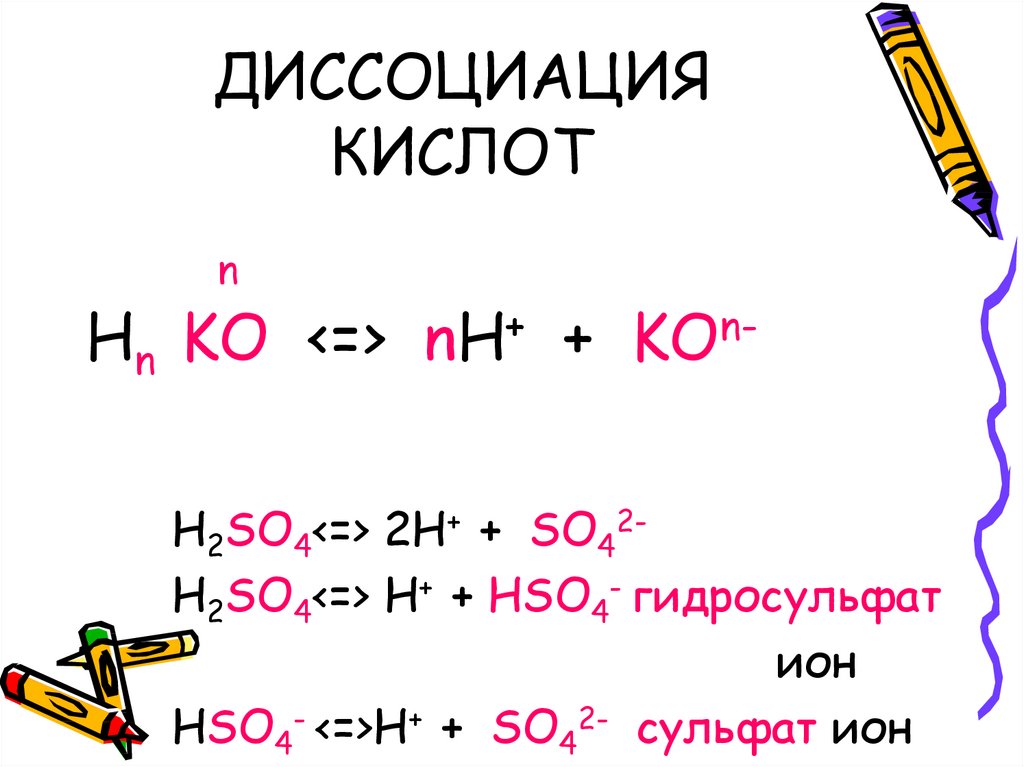
2. ДИССОЦИАЦИЯ КИСЛОТ
nHn KO <=>
+
nH
+
nKO
H2SO4<=> 2H+ + SO42H2SO4<=> H+ + HSO4- гидросульфат
ион
HSO4- <=>H+ + SO42- сульфат ион
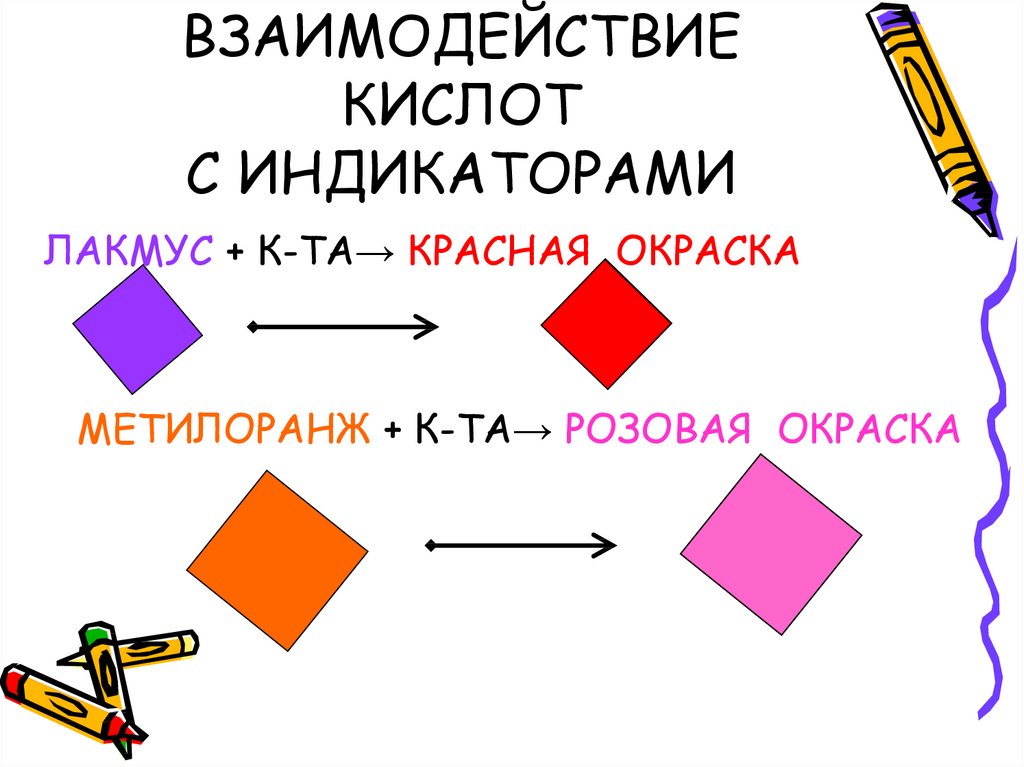
3. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С ИНДИКАТОРАМИ
ЛАКМУС + К-ТА→ КРАСНАЯ ОКРАСКАМЕТИЛОРАНЖ + К-ТА→ РОЗОВАЯ ОКРАСКА
4. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С МЕТАЛЛАМИ
С растворами кислот сполучением соли и
выделением водорода
реагируют металлы,
стоящие в ряду
напряжений до
водорода.
Zn + 2 HCl = ZnCl2 + H2↑
Zn0 + 2H+ + 2Cl- = Zn2+ + 2Cl- + H2↑
Zn0 + 2H+ = Zn2+ + H2↑
5. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С ОСНОВНЫМИ ОКСИДАМИ
Кислоты вступают вреакции со всеми
основными оксидами
с получением соли и
воды.
HCl
CuO
CuCl2
CuO + 2HCl хлорид
= CuCl
+
H
O
2
2
меди II
CuO + 2H+ +2Cl- = Cu2+ +2Cl- + H2O
CuO + 2H+ = Cu2+ + H2O
6. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С ОСНОВАНИЯМИ
Все кислоты вступают в реакции со всемиоснованиями с получением солей и воды.
2KOH + H2SO4= K2SO4 + 2H2O
2K+ +2OH- + 2H+ + SO42- = 2K+ + SO42- + 2H2O
OH- + H+ = H2O
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ +2Cl- = Cu2+ +2Cl- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ +2H2O
7. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С СОЛЯМИ
Более сильные кислотывытесняют слабые из
растворов их солей.
2HCl + CaCO3 = CaCl2 + H2CO3
CO2 ↑
хлорид кальция
Н2О
2H+ +2Cl─ + CaCO3 = Ca2+ + 2Cl─ +CO2↑+ Н2О
2H+ + CaCO3 = Ca2+ +CO2↑+ Н2О
8. С какими из перечисленных веществ реагирует разбавленная серная кислота:
Подумай!С какими из перечисленных
веществ реагирует разбавленная
серная кислота:
магний;
гидроксид железа III;
соляная кислота;
медь;
оксид азота II;
карбонат калия;
хлорид меди II.
оксид натрия;






 Химия
Химия








