Похожие презентации:
Жидкий аммиак
1. Жидкий аммиак
2. Жидкий аммиак
Жидкий аммиак
Вода и аммиак близки по свойствам. Это гидриды двух элементовнеметаллов – кислорода и азота, характеризующихся высокой
электроотрицательностью. В связи с этим молекулы аммиака, как и
молекулы воды, склонны к ассоциации вследствие их полярности
и способности образовывать водородные связи. Однако процесс
ассоциации молекул в жидком аммиаке протекает в меньшей
степени, чем в жидкой воде, коэффициент n в формуле ассоциата
(NH3)n, как правило, не превышает 2, т.е. образуются главным
образом димеры. Диэлектрическая проницаемость жидкого
аммиака ( = 22) значительно ниже, чем у воды ( = 81), что
указывает на его меньшую полярность.
Димеры (NH3)2, существующие в жидком аммиаке, склонны к
диссоциации:
(NH3)2 ⇄ NH2 + NH4+, KРАВН = 10−33.
При этом образуются однозарядные амидо- и аммонийные группы
[сравните с реакцией (Н2О)2 ⇄ Н3О+ + ОН⎺]. Присутствие ионов
NH2⎺ и NH4+ в жидком аммиаке обусловливает его
электропроводность, хотя благодаря низкой константе равновесия
диссоциации (NH3)2 она невелика, для ее обнаружения
необходимы очень чувствительные приборы.
3. Жидкий аммиак
В жидком аммиаке растворимы не только соли, но и активные
металлы, такие как натрий и другие ЩМ, а также ЩЗМ.
Чтобы убедиться в этом экспериментально, нужно приготовить
жидкий аммиак, например, пропуская ток газообразного NH3
через змеевик, охлаждаемый жидким азотом или смесью
ацетона с твердым СО2.
Сжижение аммиака происходит легко. Жидкий аммиак –
легкоподвижная бесцветная жидкость.
Для испытания электропроводности жидкого аммиака (до
растворения в нем активного металла) следует опустить в него
электроды, соединенные в цепь с лампочкой накаливания и
источником тока. Контрольная лампочка при этом не
загорается (то же наблюдается и в случае чистой воды,
электропроводность которой также очень мала).
4. Жидкий аммиак
Если растворить в жидком аммиаке кусочек металлического
натрия, появляется ярко-синяя, с металлическим блеском,
окраска раствора, обусловленная частичной диссоциацией
металлического натрия с образованием сольватированных
ионов Na+ и сольватированных электронов:
NaTB + nNH3 ⇄ Na+ (n–x)NH3 + ē·xNH3.
2Na + 2NH3 2NaNH2 + H2
При погружении в аммиачный раствор натрия электродов
соединенная с ними контрольная лампочка ярко вспыхивает,
что доказывает электропроводность полученного раствора.
Растворение натрия в жидком NH3 – один из первых процессов,
изучение которого позволило обнаружить «свободные»
электроны в растворе. Конечно, это относительная свобода. На
самом деле электроны, потерянные натрием при растворении,
сольватируются растворителем.
Металлоаммиачные растворы, в которых содержатся
свободные электроны, являются сильнейшими
восстановителями.
5. Жидкий аммиак
Растворимость щелочных металлов в жидком NH3 составляет
несколько десятков процентов. В жидком аммиаке NH3 также
растворяются некоторые интерметаллиды, содержащие
щелочные металлы, например Na4Pb9. Разбавленные растворы
металлов в жидком аммиаке окрашены в синий цвет,
концентрированные растворы имеют металлический блеск и
похожи на бронзу. При испарении аммиака щелочные металлы
выделяются в чистом виде, а щелочноземельные – в виде
комплексов с аммиаком [Э(NH3)6] обладающих металлической
проводимостью. При слабом нагревании эти комплексы
разлагаются на металл и NH3.
Получающиеся в результате реакции с аммиаком амиды
металлов содержат отрицательный ион NH2⎺, который также
образуется при самоионизации аммиака. Таким образом, амиды
металлов являются аналогами гидроксидов. Скорость реакции
возрастает при переходе от Li к Cs. Реакция значительно
ускоряется в присутствии даже небольших примесей H2O.
6. Жидкий аммиак
Впервые растворы натрия и калия в жидком аммиаке были
получены в 1864. Спустя несколько лет было обнаружено, что
если дать аммиаку спокойно испариться, то в осадке останется
чистый металл, как это бывает с раствором соли в воде. Такая
аналогия, однако, не совсем точна: щелочные металлы, хотя и
медленно, с аммиаком все же реагируют с выделением
водорода и образованием амидов: 2K + 2NH3 2KNH2 + H2.
Амиды – стабильные кристаллические вещества, энергично
взаимодействующие с водой с выделением аммиака:
KNH2 + H2O NH3 + KOH.
При растворении металла в жидком аммиаке объем раствора
всегда больше суммарного объема компонентов. В результате
такого разбухания раствора его плотность непрерывно падает
с увеличением концентрации (чего не бывает у водных
растворов солей и других твердых соединений).
Концентрированный раствор лития в жидком аммиаке – самая
легкая при обычных условиях жидкость, ее плотность при 20°C
– всего лишь 0,48 г/см3 (легче этого раствора только
сжиженные при низких температурах водород, гелий и метан).
7. Жидкий аммиак
Свойства растворов щелочных металлов в жидком аммиаке сильно
зависят от концентрации. В разбавленных растворах находятся катионы
металла, а вместо анионов – электроны, которые, однако, не могут
свободно передвигаться, так как связаны с молекулами аммиака. Именно
такие связанные (сольватированные) электроны придают разбавленным
растворам щелочных металлов в жидком аммиаке красивый синий цвет.
Электрический ток такие растворы проводят плохо. Но с повышением
концентрации растворенного металла, когда электроны приобретают
способность перемещаться в растворе, электропроводность
увеличивается исключительно сильно – иногда в триллионы раз,
приближаясь к электропроводности чистых металлов! Разбавленные и
концентрированные растворы щелочных металлов в жидком аммиаке
сильно различаются и по другим физическим свойствам. Так, растворы с
концентрацией более 3 моль/л называют иногда жидкими металлами: они
имеют отчетливый металлический блеск с золотисто-бронзовым отливом.
Иногда даже трудно поверить, что это растворы одного и того же
вещества в одном и том же растворителе. И здесь литию принадлежит
своеобразный рекорд: его концентрированный раствор в жидком аммиаке
– самый легкоплавкий «металл», который замерзает лишь при –183°C, то
есть при температуре сжижения кислорода.
8. Жидкий аммиак
Внешне жидкий аммиак похож на воду. Сходство этим не
ограничивается.
Как и вода, жидкий аммиак – прекрасный растворитель как для
ионных, так и для неполярных неорганических и органических
соединений.
Поскольку жидкий аммиак имеет все свойства полярных
жидкостей, он способен растворять многие соли.
Соотношение растворимостей различных солей в воде и жидком
аммиаке часто бывает обратным.
Например, в воде лучше растворяется СаСl2, чем NaCl, а в жидком
аммиаке, напротив, лучше растворяется NaCl, чем СаСl2. В жидком
аммиаке легко растворяются многие соли, которые, как и в водных
растворах, диссоциируют на ионы.
9. Жидкий аммиак
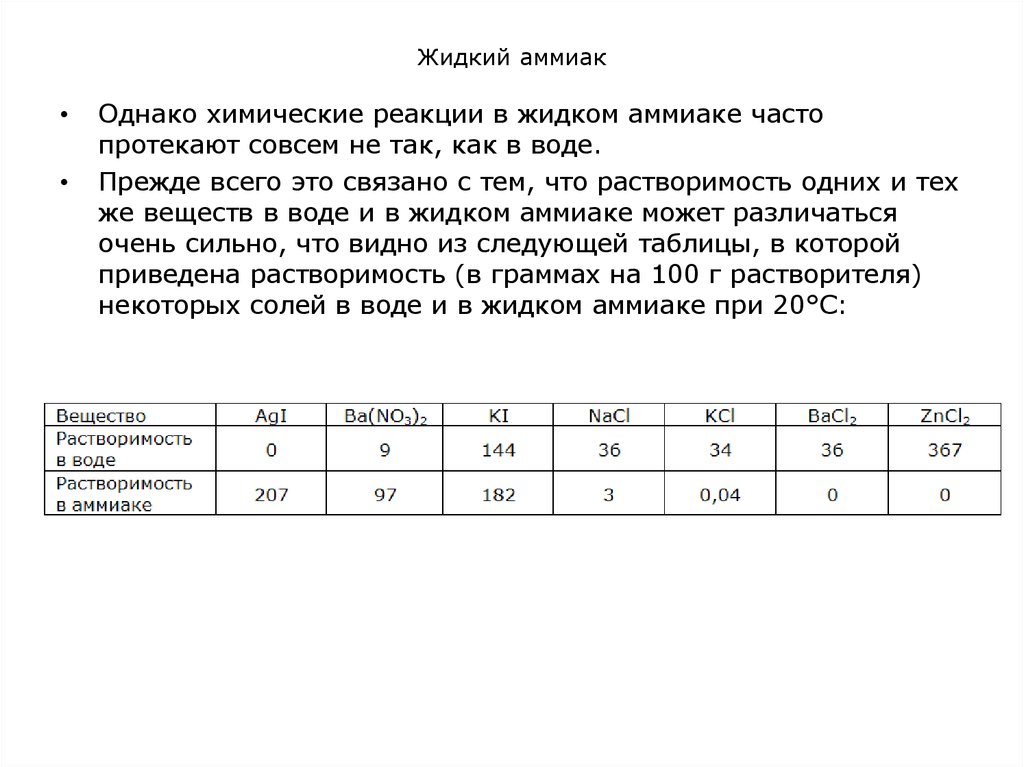
Однако химические реакции в жидком аммиаке часто
протекают совсем не так, как в воде.
Прежде всего это связано с тем, что растворимость одних и тех
же веществ в воде и в жидком аммиаке может различаться
очень сильно, что видно из следующей таблицы, в которой
приведена растворимость (в граммах на 100 г растворителя)
некоторых солей в воде и в жидком аммиаке при 20°С:
10. Жидкий аммиак
Поэтому в жидком аммиаке легко протекают такие обменные
реакции, которые невозможны для водных растворов,
например,
Ba(NO3)2 + 2AgCl = BaCl2 + 2AgNO3.
Молекула NH3 – сильный акцептор ионов водорода, поэтому
если в жидком аммиаке растворить слабую (в случае водных
растворов) уксусную кислоту, то она будет диссоциировать
полностью, то есть станет очень сильной кислотой:
CH3COOH + NH3 = NH4+ + CH3COO⎺.
В среде жидкого аммиака значительно усиливаются (по
сравнению с водными растворами) и кислотные свойства солей
аммония.
Ион аммония в жидком аммиаке обладает многими свойствами,
характерными для иона водорода в водных растворах. Поэтому
в жидком аммиаке нитрат аммония легко реагирует, например,
с магнием с выделением водорода или с пероксидом натрия:
2NH4NO3 + Mg = Mg(NO3)2 + 2NH3 + H2;
Na2O2 + 2NH4NO3 = 2NaNO3 + H2O2 + 2NH3.
11. Жидкий аммиак
С помощью реакций в жидком аммиаке впервые были выделены
пероксиды магния, кадмия и цинка:
Zn(NO3)2 + 2KO2 = ZnO2 + 2KNO3 + O2,
получен в чистом виде кристаллический нитрит аммония:
NaNO2 + NH4Cl = NH4NO2 + NaCl,
проведены многие другие необычные превращения, например,
2K + 2CO = K2C2O2.
Последнее соединение содержит тройную ацетиленовую связь и имеет
строение K+−OС≡CO−K+.
Таким образом, в жидком NH3 вещества, содержащие ионы NH4+, ведут
себя как кислоты, а вещества, содержащие группы NH2⎺, – как
основания.
Реакции в Н2О
Реакции в NH3
HCl + KOH = KCl + H2O
NH4Cl + KNH2 = KCl + 2NH3
9HNO3 + 4Mg = 4Mg(NO3)2 + NH3+3H2O
2NH4NO3 + Mg = Mg(NO3)2 + 2NH3 + H2
CaO + 2HCl = CaCl2 + H2O
Ca3N2 + 6NH4Cl = 3CaCl2 + 8NH3
2KOH + CO2 = K2CO3 + H2O
6KNH2 + C3N4 = 3K2CN2 + 4NH3
2KOH + Zn(OH)2 = K2[Zn(OH)4]
2KNH2 + Zn(NH2)2 = K2[Zn(NH2)4]
PCl5 + 9H2O = PO(OH)3 + 5HCl
PCl5 + 8NH3 = PN(NH2)2 + 5NH4Cl
12. Жидкий аммиак
Большое сродство жидкого аммиака к ионам Н+ позволяет провести
эффектный опыт по «пластификации» дерева.
Дерево в основном состоит из целлюлозы: длинные полимерные цепи
молекул целлюлозы соединяются между собой с помощью водородных
связей между гидроксильными группами −OH (иногда их называют
водородными мостиками). Одна водородная связь довольно слабая, но
так как молекулярная масса целлюлозы достигает 2 миллионов, а
мономерных звеньев (глюкозных остатков) в молекуле свыше 10 000,
длинные молекулы целлюлозы сцеплены друг с другом очень прочно.
Жидкий аммиак с легкостью разрушает водородные мостики, связывая
атомы водорода в ионы NH4+, и в результате молекулы целлюлозы
приобретают способность скользить относительно друг друга.
Если деревянную палочку опустить на некоторое время в жидкий
аммиак, то ее можно гнуть как угодно, как будто она сделана не из
дерева, а из алюминия. На воздухе аммиак через несколько минут
испарится, и водородные связи снова восстановятся, но уже в другом
месте, а деревянная палочка вновь станет жесткой и при этом
сохранит ту форму, которую ей придали.
13. Жидкий аммиак
Сейчас в радиационной химии большое внимание уделяется
изучению «гидратированных электронов» в связи с
радиолизом воды при работе АЭС. Водные растворы,
содержащие гидратированные электроны ē·Н2О, как и
аммиачный раствор натрия, окрашены в синий цвет.
Сильные водородные связи приводят к сравнительно высокой
(по сравнению с другими газами) теплоте испарения аммиака –
23,3 кДж/моль. Это в 4 раза больше теплоты испарения
жидкого азота и в 280 раз больше, чем у жидкого гелия.
Поэтому жидкий гелий вообще невозможно налить в обычный
стакан – он немедленно испарится. С жидким азотом такой
опыт провести можно, но значительная его часть испарится,
охлаждая сосуд, а оставшаяся жидкость тоже выкипит
довольно быстро. Поэтому обычно сжиженные газы в
лабораториях хранят в специальных сосудах Дьюара с
двойными стенками, между которыми – вакуум.
14. Жидкий аммиак
Жидкий аммиак, в отличие от других сжиженных газов, можно
держать в обычной химической посуде – стаканах, колбах, он
при этом испаряется не слишком быстро. Если же налить его в
сосуд Дьюара, то в нем он будет храниться очень долго. И еще
одно удобное свойство жидкого аммиака: при комнатной
температуре давление пара над ним сравнительно невелико,
поэтому при длительных экспериментах с ним можно работать
в запаянных стеклянных ампулах, которые такое давление
легко выдерживают (попытка проделать подобный
эксперимент с жидким азотом или кислородом неминуемо
привела бы к взрыву).
Большая теплота испарения жидкого аммиака позволяет
использовать это вещество в качестве хладагента в различных
холодильных установках; испаряясь, жидкий аммиак очень
сильно охлаждается. В домашних холодильниках раньше тоже
был аммиак (теперь в основном – фреоны). Хранят жидкий
аммиак в герметичных баллонах.














 Химия
Химия








