Похожие презентации:
Общая характеристика элементов главной подгруппы второй группы
1. Общая характеристика элементов главной подгруппы второй группы.
2.
Ко II группе главной подгруппыпериодической системы элементов
относятся бериллий, магний
щелочноземельные металлы:
кальций, стронций, барий и радий
(главная подгруппа). Своим
названием щелочноземельные
металлы обязаны тому, что их
оксиды (земли) при растворении в
воде образуют щелочные растворы.
3. Берилий
Был открыт Л. Н. Вокленом в 1798 г.Металлический бериллий применяется для
изготовления окон к рентгеновским
установкам, так как поглощает
рентгеновские лучи в 17 раз слабее
алюминия. Добавка бериллия к сплавам
увеличивает их твердость
и электропроводность.
Соединения бериллия могут
вызывать очень тяжелое
заболевание легких.
4. Магний
Впервые был выделен в чистом виде сэром Г.Дэви в 1808 г. дистилляцией ртути из
магниевой амальгамы, которую он
получил электролизом полужидкой
смеси оксида магния и ртути. Применяется
для получения металлического титана.
Используется для получения
лёгких и сверхлёгких сплавов
(самолётостроение,
производство автомобилей),
а также для изготовления
осветительных и
зажигательных ракет.
5. Кальций
Название элемента происходит от лат. calx (вродительном падеже calcis) — «известь»,
«мягкий камень». Оно было предложено
английским химиком Г. Дэви, в 1808
г. выделившим металлический кальций
электролитическим методом. Главное
применение металлического кальция — это
использование его как
восстановителя при
получении металлов,
особенно никеля, меди и
нержавеющей стали.
6. Стронций
Впервые был выделен в виде оксида А.Крофордом в 1790 г., а в чистом
виде получен Г. Дэви в 1808 г.
Нитрат стронция применяют в
пиротехнике, а его карбонат и оксид
– в сахарной промышленности. При
ядерных взрывах
образуется стронций-90,
излучение которого очень
опасно, так как вызывает
лучевую болезнь, лейкоз и
саркому костей.
7. Барий
Был открыт К. В. Шееле в 1774 г. и Г. Деви в1808 г. Из соединений бария наиболее
широко применяются его гидроксид,
пероксид и некоторые соли. Гидроксид и
хлорид бария используются в лабораторной
практике, пероксид бария - для получения
пероксида водорода, нитрат
и хлорат - в пиротехнике,
сульфат бария - в
рентгеноскопии органов
пищеварения.
Соединения бария ядовиты.
8. Строение атомов щелочноземельных металлов:
Be +4 )2)2 1s22s2Mg +12)2)8)2 1s22s22p63s2
Ca +20)2)8)8)2 1s22s22p63s23p64s2
Sr +38)2)8)18)8)2
1s22s22p63s23p63d104s24p65s2
Ba +56)2)8)18)18)8)2
1s22s22p63s23p63d104s24p64d105s25p66s2
9. Химические свойства ЩЗМ:
Me +O2
H2
Cl2
H 2O
HCl
MeO
MeH2
MeCl2
Me(OH)2 + H2
MeCl2 + H2
10. Взаимодействие с неметаллами:
С кислородом:2Ca + O2
2CaO
Ca0 – 2eCa+2 2
4 2 В-ль
O20 + 4e2O-2 4
1 Ок-ль
С водородом:
Ca + H2
CaH2
Ca0 – 2eCa+2 2
1 В-ль
2
0
-1
H2 + 2e
2H
2
1 Ок-ль
С хлором:
Mg + Cl2
MgCl2
Mg0 – 2eMg+2
2
1 В-ль
2
0
-1
Сl 2 + 2e
2Cl 2
1 Ок-ль
11. Взаимодействие со сложными веществами:
С водой:2Ca + H2O
Ca(OH)2 + H2
Ca0 – 2eCa+2 2
1 В-ль
2
+1
0
2H + 2e
H2 2
1 Ок-ль
C кислотами:
2Mg + HCl
MgCl2 + H2
Mg0 – 2eMg+2 2
1 В-ль
2
+1
0
2H + 2e
H2 2
1 Ок-ль
12. Mg и Ca восстанавливают металлы из их оксидов:
Магниетермия:Mg + TiO2 t 2MgO + Ti
Кальциетермия:
5Ca + V2O5 t 5CaO + 2V
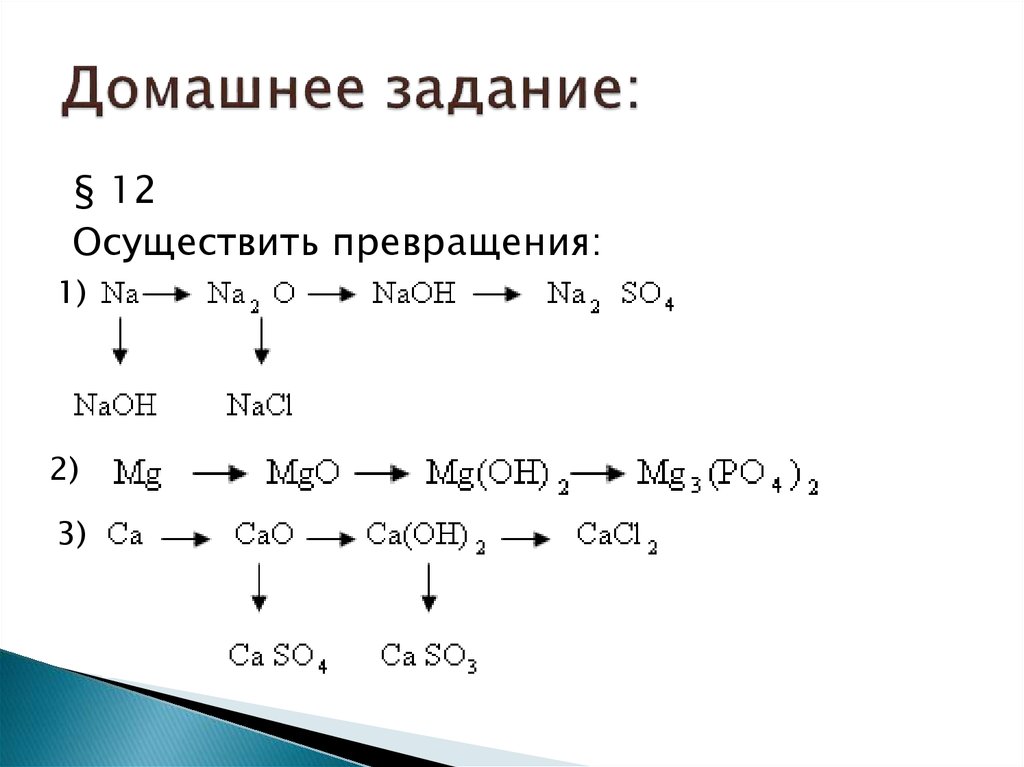
13. Домашнее задание:
§ 12Осуществить превращения:
1)
2)
3)












 Химия
Химия








