Похожие презентации:
Бионеорганическая химия. Особенности биохимический процессов. (Лекция 1)
1. Бионеорганическая химия
Лекция №1Особенности биохимический процессов
2014
2.
Вместо предисловияНеорганическая биохимия (в 2 томах)
Ред. Эйхгорн Гюнтер, 1978
Биометаллоорганическая химия
Ред. Жерар Жауен, 2010
Основы химии живого
Слесарев В.И., 2000
Бионеорганическая химия
http://vk.com/club66508377
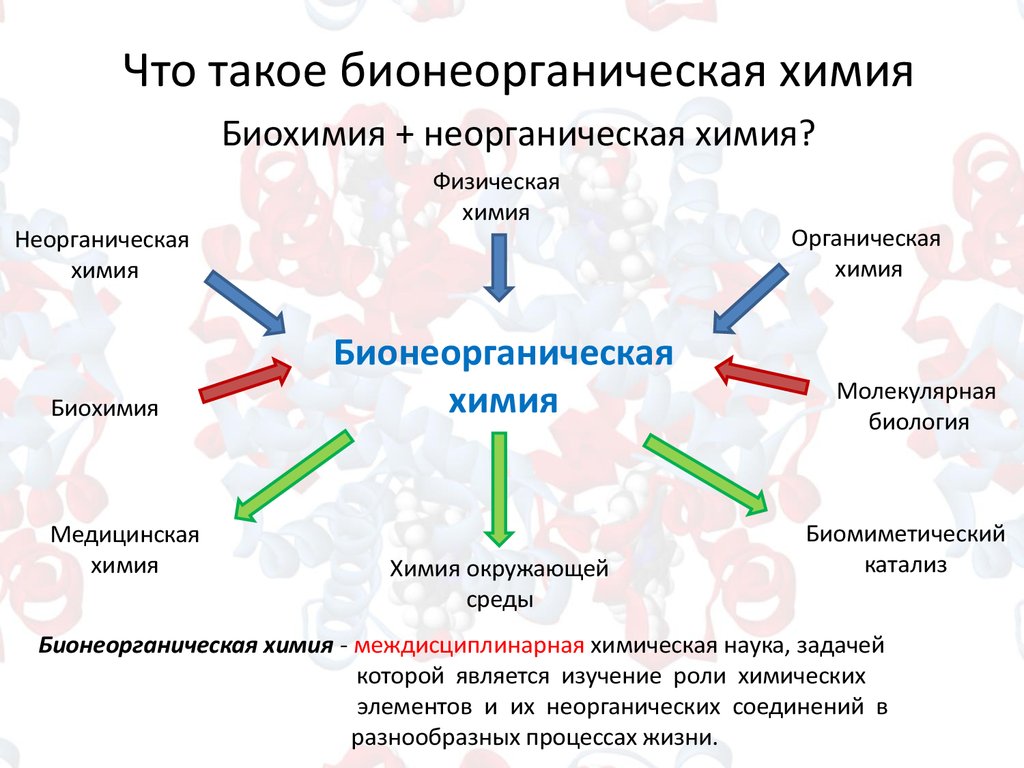
3. Что такое бионеорганическая химия
Биохимия + неорганическая химия?Неорганическая
химия
Биохимия
Медицинская
химия
Физическая
химия
Бионеорганическая
химия
Химия окружающей
среды
Органическая
химия
Молекулярная
биология
Биомиметический
катализ
Бионеорганическая химия - междисциплинарная химическая наука, задачей
которой является изучение роли химических
элементов и их неорганических соединений в
разнообразных процессах жизни.
4. Что такое бионеорганическая химия
Задачи бионеорганической химии• Изучение роли металлов и их соединений в живых организмах
и окружающей среде
• Изучение реакционной способности ионов металлов и их соединений
по отношению к биологическим субстратам
• Моделирование металл-содержащих ферментов (металлопротеинов)
и процессов с их участием
• Направленный синтез биологически активных соединений металлов
• Создание фармакологических препаратов и биоматериалов
5. Биоэнергетика
Организм – открытая системаΔm≠0 ΔE≠0
Процессы в организме
изобарные
изотермические
Термодинамический критерий
протекания процессов в организме
• Синтез метаболитов (химическая работа)
• Сокращение мышц (механическая работа)
• Перенос веществ через мембраны
против градиента концентрации
(активный транспорт)
• Передача информации (нервные импульсы)
р = const
T = const
ΔG < 0
экзэргонические реакции
ΔG > 0!
эндэргонические реакции
Выход: энергетическое сопряжение биохимических реакций
6. Биоэнергетика
«Источники» энергиикреатинфосфат
АТФ
АТФ + Н2О
АТФ + Н2О
АДФ + Ф
АМФ + 2Ф
фосфоенолпируват
ΔG0 = -30,5 кДж/моль
ΔG0 = -61 кДж/моль
Принцип энергетического сопряжения
глюкоза + фруктоза
глюкоза + фруктоза + АТФ
сахароза + Н2О
сахароза + Н2О + АДФ + Ф
АТФ
АДФ
ΔG0 = +20,9 кДж/моль
ΔG0 = -9,6 кДж/моль
7. Биоэнергетика
Химическое равновесие и стационарное состояниеΔG = 0
Процессы не протекают
Химическое равновесие
«Transactions of the Connecticut Academy of Sciences»
Нобелевская премия по химии, 1901
Джозайя Гиббс
(Gibbs)
Изотерма Вант-Гоффа
Якоб Вант-Гофф
(van't Hof)
G
ΔrG
Gmin
реагенты
продукты
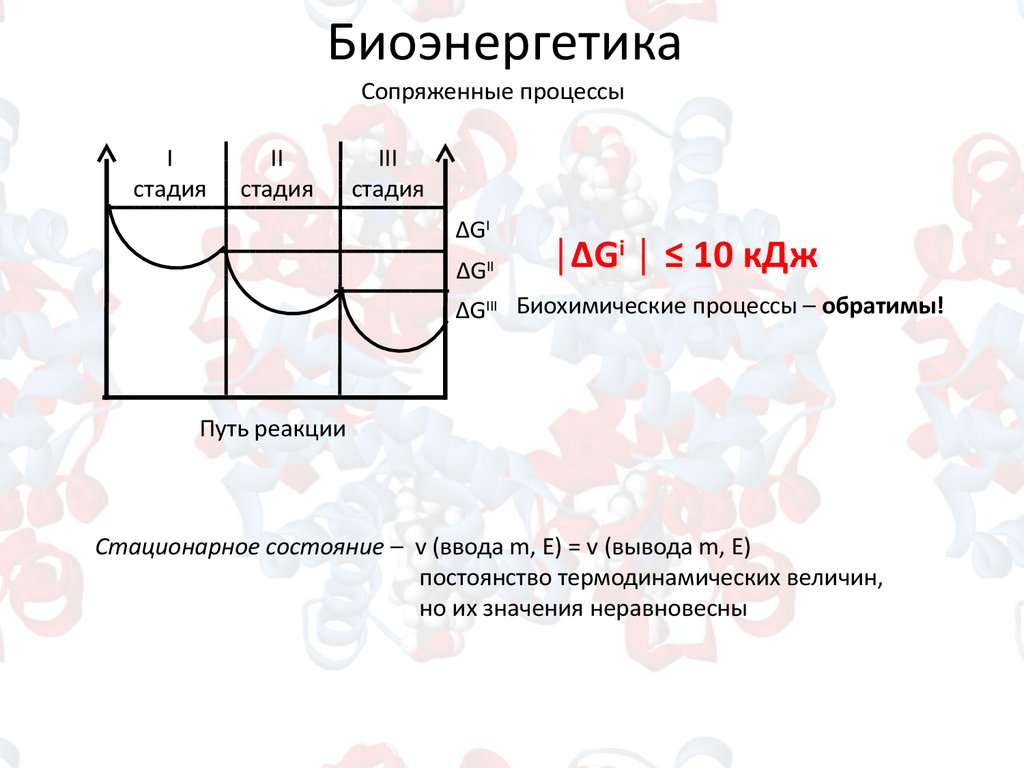
8. Биоэнергетика
Сопряженные процессыI
стадия
II
стадия
III
стадия
ΔGI
ΔG
II
│ΔGi │ ≤ 10 кДж
ΔGIII Биохимические процессы – обратимы!
Путь реакции
Стационарное состояние – v (ввода m, E) = v (вывода m, E)
постоянство термодинамических величин,
но их значения неравновесны
9.
БиоэнергетикаНобелевская премия по химии, 1977
Теорема Пригожина (1947) – стационарному состоянию системы в
условиях, препятствующих достижению
равновесия, соответствует минимальное
значение энтропии
Пригожин И. Р.
Гомеостаз – относительное динамическое постоянство состава и свойств
внутренней среды организма, обуславливающее устойчивость
его физиологических функций
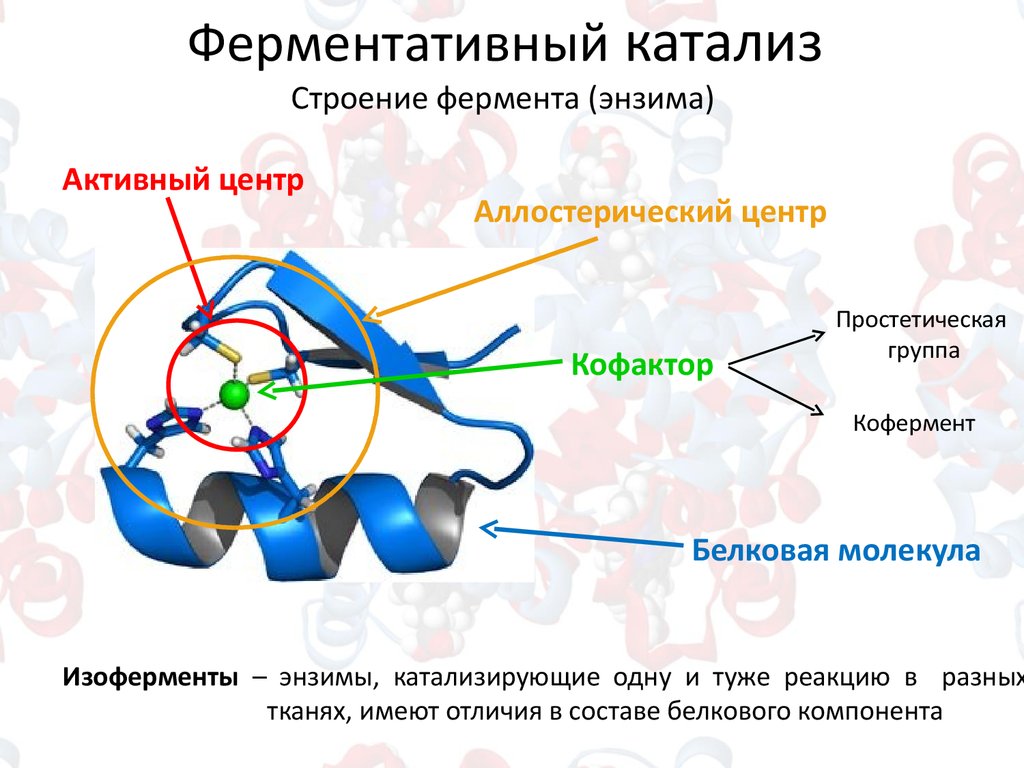
10.
Ферментативный катализСтроение фермента (энзима)
Активный центр
Аллостерический центр
Кофактор
Простетическая
группа
Кофермент
Белковая молекула
Изоферменты – энзимы, катализирующие одну и туже реакцию в разных
тканях, имеют отличия в составе белкового компонента
11.
Ферментативный катализОсобенности ферментативного катализа
Размер. М(фермента) = 105÷107 г/моль → коллоидные системы, микрогетерогенность
Высокая каталитическая эффективность. Скорость процессов возрастает в ~1010
Строго определенные условия: pH (изменение конформации, ионизация отдельных групп)
T (изменение конформации, вязкости)
Активаторы ферментов – Mg2+, Zn2+, K+
Ингибиторы ферментов – Pb2+, Cd2+, As3+, белки
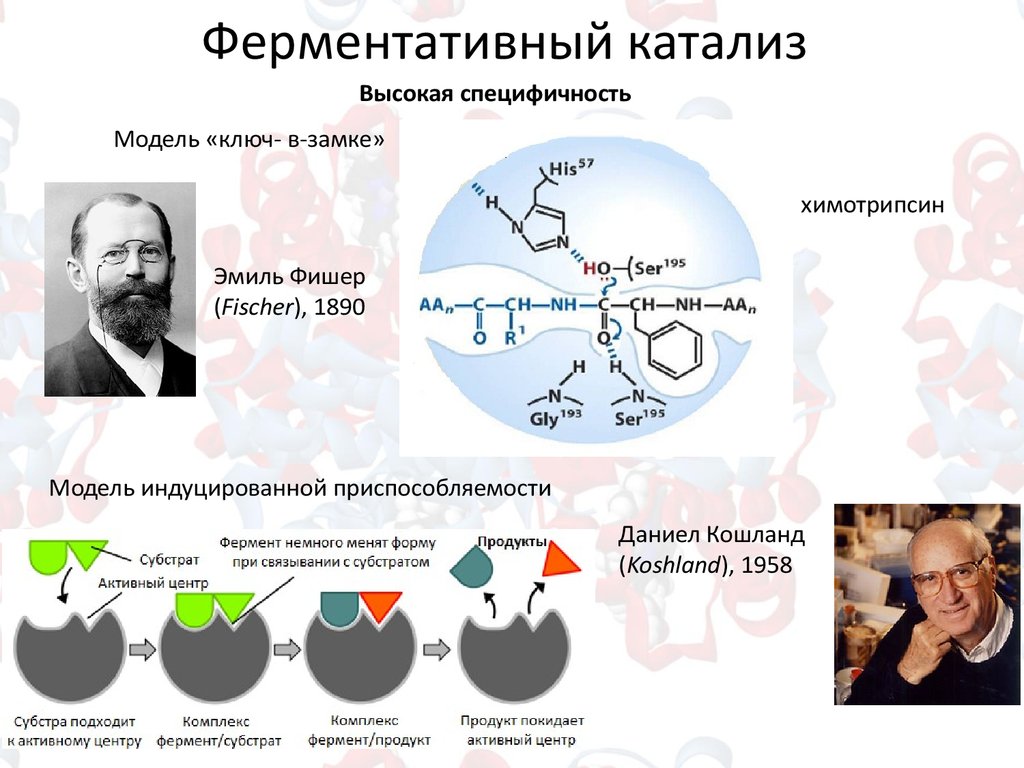
12.
Ферментативный катализВысокая специфичность
Модель «ключ- в-замке»
химотрипсин
Эмиль Фишер
(Fischer), 1890
Модель индуцированной приспособляемости
Даниел Кошланд
(Koshland), 1958
13.
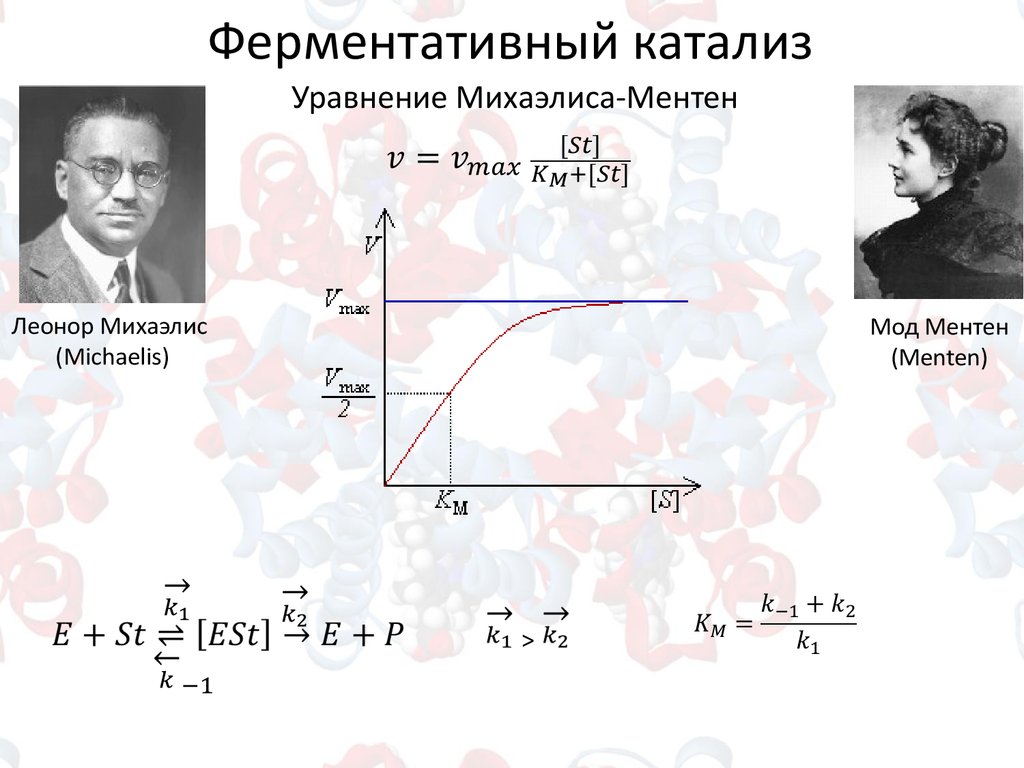
Ферментативный катализУравнение Михаэлиса-Ментен
Леонор Михаэлис
(Michaelis)
Мод Ментен
(Menten)
>
14. Автоколебательные процессы
Автокатализ – самоускорение реакции из-за каталитического действия промежуточногоили конечного продукта
MnO4 + C2O4
-
2-
Mn2+
Mn2+ + CO2
Всегда есть автоингибирование!
Реакция Белоусова-Жаботинского
автокатализ
Б.П. Белоусов
А.М. Жаботинский
15.
Реакция Белоусова-Жаботинского1. LA + Ce4+ ADCA + Ce3+ (медленно)
2. Сe3+ + BrO3- Ce4+ + Br- (оч. медленно, НО
автокатализ!)
3. Br- + BrO3- Br2 (быстро)
4. Br2 + ADCA Br- + другие продукты (быстро)
NB!
Br- ингибирует реакцию (2)
ADCA «нейтрализует» бром
16. Автоколебательные процессы
I стадия: S → XII стадия: X + Y → 2Y
автокатализ
III стадия: Y → P
Большинство биохимических процессов - сопряженные
Биохимическая система – стационарное состояние, [S]=const
C(P)
τ











 Биология
Биология Химия
Химия








