Похожие презентации:
Титан, цирконий, гафний
1. IVB группа Титан. Цирконий, гафний.
Презентацию подготовилистудентки группы Х-11 БО
Пасечник Наталья и
Воробьева Анна
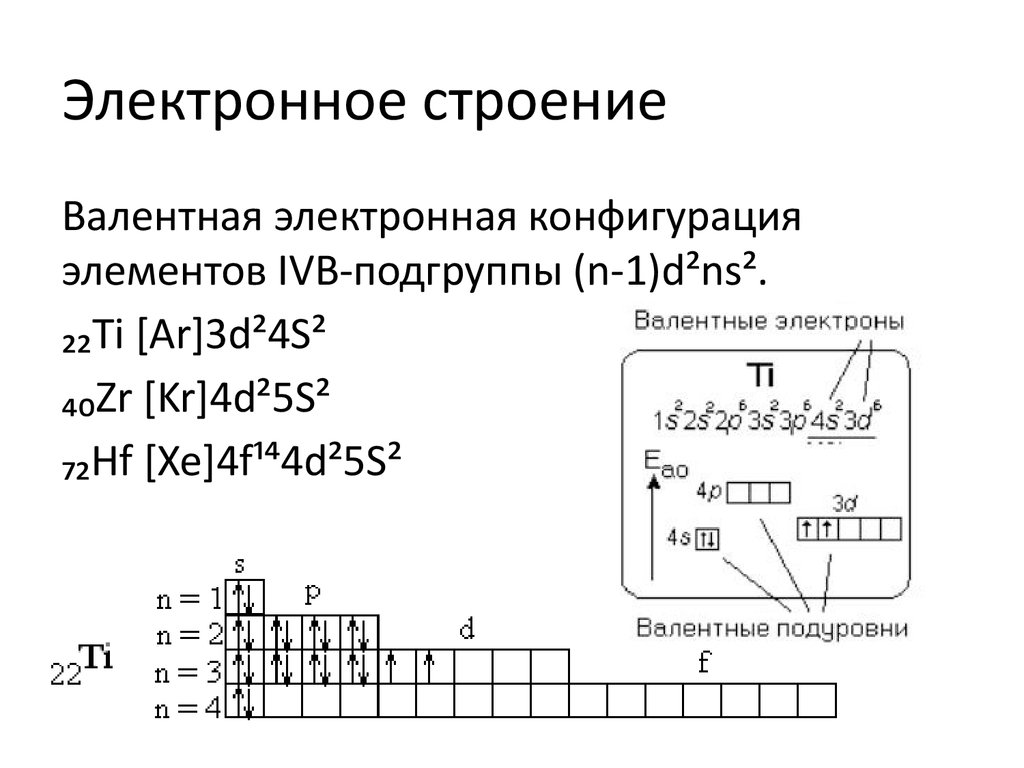
2. Электронное строение
Валентная электронная конфигурацияэлементов IVB-подгруппы (n-1)d²ns².
₂₂Ti [Ar]3d²4S²
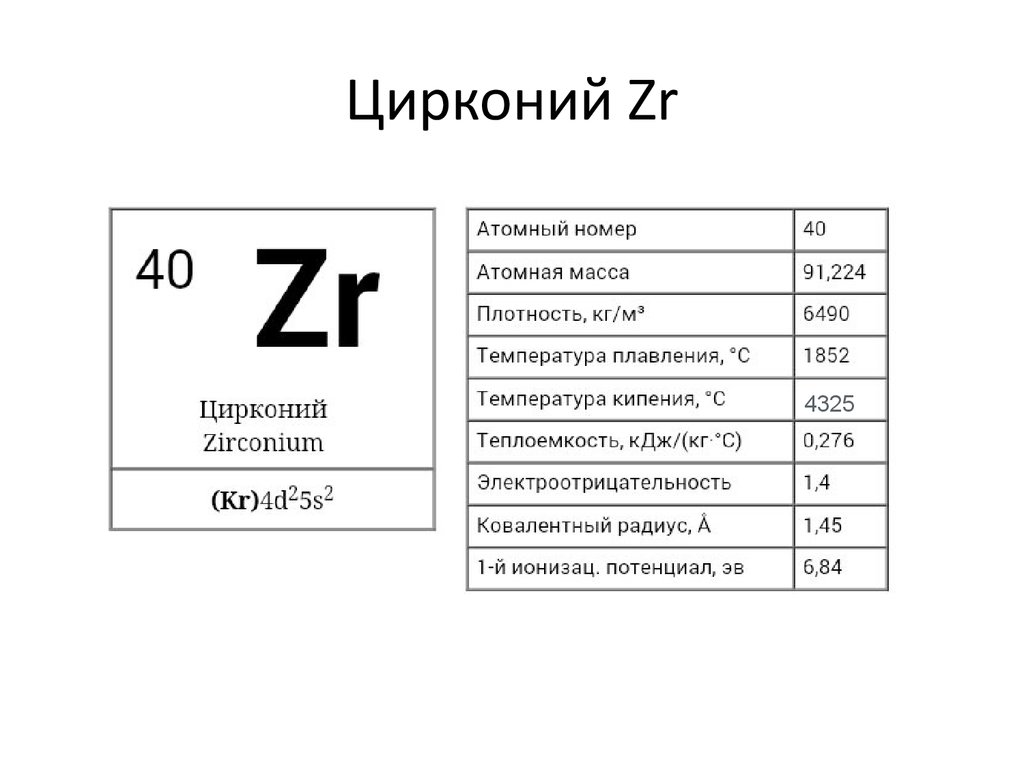
₄₀Zr [Kr]4d²5S²
₇₂Hf [Xe]4f¹⁴4d²5S²
3. Степень окисления
Наличие четырех валентных электроновпредопределяет возможность реализации
высшей с.о. +4, а энергетическая
неравноценность этих электронных
состояний служит причиной проявления
переменных низших степеней окисления (+3
и +2), что характерно для титана. Цирконий и
гафний преимущественно проявляют с.о. +4
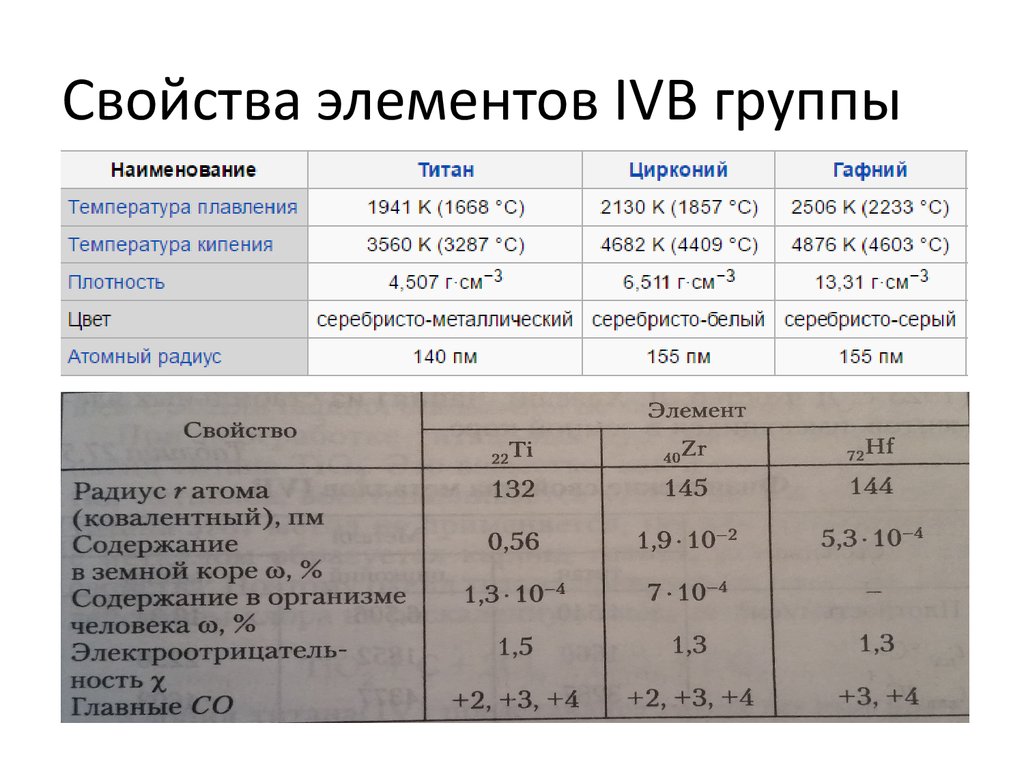
4. Свойства элементов IVB группы
5.
6. Особенность IVB группы
В главных подгруппах и в подгруппе скандиясверху вниз нарастают металлические
свойства, а начиная именно с подгруппы
титана наблюдается обратная
закономерность. С этой точки зрения,
элементы IVВ-группы, так же как и элементы
IVА-группы, являются своеобразной
границей, разделяющей две
противоположные тенденции.
7. Физические свойства
В свободном состоянии титан и его аналоги –типичные металлы, по внешнему виду
похожие на сталь. Представляют собой
тугоплавкие серебристо-белые металлы,
обладающие высокой пластичностью,
ковкостью, износоустойчивостью. Устойчивы
по отношению к воздуху и воде.
Характерной особенностью всех трех
металлов является полиморфизм.
8. Физические свойства
Следует также отметить высокие температурыплавления титана и его аналогов, что
свидетельствует о металлоковалентном (а не
чисто металлическом) характере связей в
кристаллах. При этом температура плавления в
ряду Тi—Zr—Hf возрастает в
противоположность закономерности,
наблюдающейся в главной подгруппе (в ряду С
— Si—Gе—Sn—Pb).
9. Химические свойства
• Ti, Zr, Hf взаимодействуют с неметаллами –кислородом, галогенами, азотом:
Э + О₂ = ЭО₂ (t);
Э + 2Г₂ = ЭГ₄;
2Э + N₂ = 2ЭN (t)
10. Химические свойства
В ряду стандартных электродных потенциаловвсе три элемента расположены до водорода.
Однако они вполне устойчивы по отношению к
воде и минеральным кислотам, за исключением
HF и горячей H2SO4.
• Концентрированной серной кислотой Ti, Zr, Hf
окисляются до Э(IV):
Ti + 5H₂SO₄(конц) = H₂[Ti(SO₄)₃] + 2SO₂↑ + 4H₂O
11. Химические свойства
• На холоду кислоты-окислители пассивируют титани его аналоги, уплотняя на их поверхности тонкую
пленку диоксидов.
• Такие кислоты, как НF, Н2С2О4, являющиеся
источниками кислотных остатков для образования
прочных ацидокомплексов, растворяют
пассивирующую пленку:
ЭO₂ + 6HF = H₂[ЭF₆] + 2H₂O
ЭO₂ + 3H₂C₂O₄ = H₂[Э(C₂O₄)₃] + 2H₂O
Поскольку радиусы циркония и гафния больше, чем титана, для них
возможны комплексы H3[ZrF7] и H4[HfF8]
12. Химические свойства
• Все металлы растворяются в смеси азотной иплавиковой кислот:
3Э + 4HNO₃ + 18HF = 3H₂[ЭF₆] + 4NO + 8H₂O
В случае титана образуется только комплекс H₂[TiF₆], для
циркония и гафния возможны H₃[ZrF₇] и H₄[HfF₈].
• В смеси азотной и соляной кислот («царской
водке») цирконий и гафний растворяются с
образованием хлоридных комплексов,
аналогичных по формулам фторидным. Титан с
царской водкой практически не взаимодействует.
13. Химические свойства
• По отношению к растворам щелочей металлыподгруппы титана устойчивы. Это объясняется
слабо выраженными кислотными свойствами
оксидов ЭО2. Поэтому гидроксокомплексы для них
не характерны.
Э + 4NaOH → Na₄ЭO₄ + 2H₂
• Однако в расплавах щелочей и хлоридов
щелочных металлов на воздухе (в присутствии
кислорода) металлы сильно корродируют за счет
образования титанатов, цирконатов и гафнатов.
3Э + 4NaCl + 3O₂ → Na₄ЭO₄ + 2ЭOCl₂
14. Титан
15. Титан ₂₂Ti
Титан — элемент побочной подгруппыIVгруппы.
Электронная формула: ₂₂Ti [Ar]3d²4S²
Как и у многих других d-элементов, в атоме
титана Тi подвижными являются не только
электроны наружного энергетического уровня,
но и два электрона d-подуровня. Поэтому
титан в соединениях проявляет с.о. + 2 и +4
(реже +3)
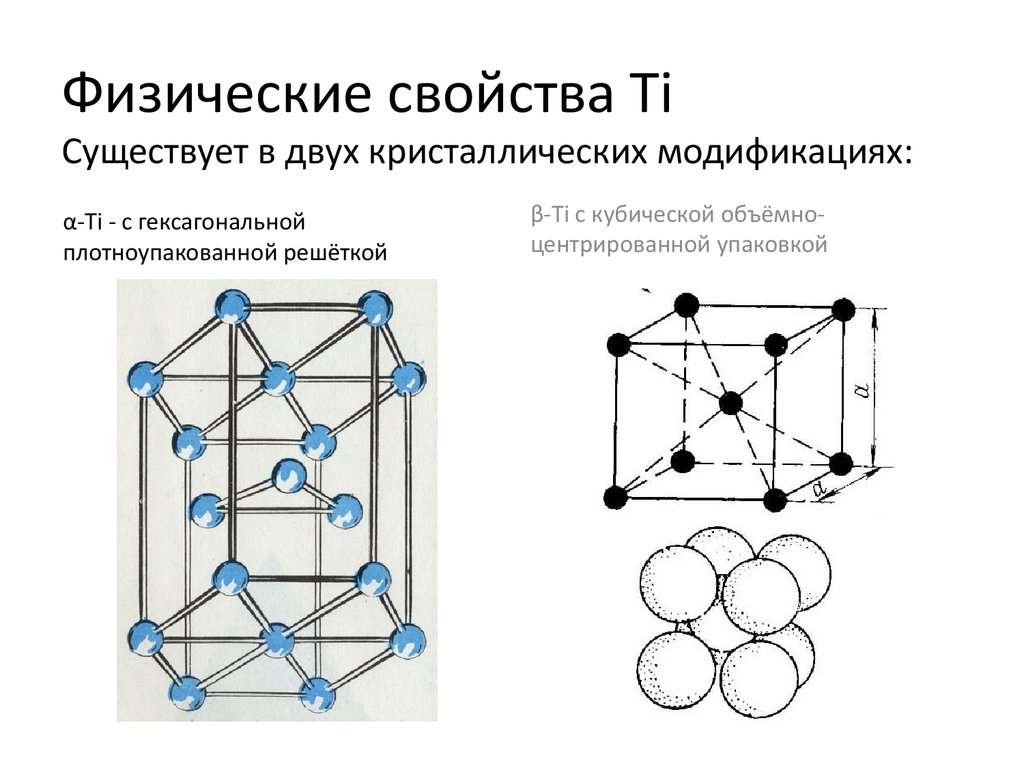
16. Физические свойства Ti
17. Физические свойства Ti Существует в двух кристаллических модификациях:
α-Ti - с гексагональнойплотноупакованной решёткой
β-Ti с кубической объёмноцентрированной упаковкой
18. Коррозионные свойства Ti
При комнатной температуре покрываетсяпассивирующей пленкой оксида TiO2, благодаря
этому имеет стойкость к коррозии в
большинстве агрессивных сред, кроме щелочей.
Небольшие добавки металлов платиновой
группы, а также легирование молибденом
повышают коррозионную стойкость титана и
расширяют возможности его использования как
коррозионностойкого материала.
19. Нахождение Ti в природе
Титан по относительному содержанию в земнойкоре стоит на 10-м месте, а среди d-элементов
оказывается на 2-м месте после железа.
Важнейшими минералами титана являются:
• титаномагнетиты FeTiO₃ ▪ nFe₃O₄;
• ильменит FeTiO₃;
• сфен CaTiSiO₅;
• рутил TiO₂
Титановые руды распространены относительно
широко, но содержание в них титана небольшое.
20.
21. Получение титана
• При переработке титановых руд сначалаполучается оксид титана ТiO₂.
• ТiO₂ превращают в хлорид TiCl₄ действием
хлора на раскаленную смесь оксида и угля:
TiO₂ + C + 2Cl₂ = TiCl₄ + CO₂
• Хлорид титана(IV) восстанавливают в
атмосфере аргона до металла магнием:
22. Химические свойства Ti
При обычных t хим.активность Tiчрезвычайно мала. С повышением t
хим.активность Ti растет, и при Tпл=1668°С
он является одним из самых активных
металлов, но его реакционная способность
меньше, чем у циркония и гафния при их Тпл.
23. X.C.
24. X.C.
25. X.C.
26. Х.C.
• Взаимодействие с водородом:Ti + Н₂ = TiН₂ (T≈400-500°C)
• С углеродом:
Ti + C = TiC (t)
• При высокой t способен реагировать
одновременно с углеродом и азотом с
образованием карбонитрида титана:
5Ti + C + 2N₂ = Ti₅CN₄ (t)
• При t взаимодействует с Si, Ge, Sn, Pb и B
27. Х.C.
• Взаимодействие с металлами:Титан почти или совершенно НЕ
взаимодействует со щелочными, щелочно- и
редкоземельными (кроме скандия)
металлами.
С остальными МЕ образует сплавы (Al, Cr, Co,
Ni, Cu, Ag, Au, Fe, Mg)
28. X.C.
• Взаимодействие с галогеноводородами:Ti + 4HГ = TiГ₄ + 2Н₂ (t)
В водных растворах:
2Ti + 6HГ = 2TiГ₃ + 3Н₂
2Ti + 6HСl = 2TiCl₃ + 3Н₂
(фиолетовый трихлорид титана)
29. Х.C.
• Взаимодействие с H₂O:Ti + 4H₂O = Ti(OH)₄ + 2H₂ (кипящая вода, свечение);
Ti + 2H₂O = TiO₂ + 2H₂ (Т=700-800°С)
• Взаимодействие с H₂O₂:
Ti + 3H₂O₂ = Ti(OH)₂O₂ + 2H₂O (при обычной t)
В аммиачной среде:
Ti + 5H₂O₂ + 2NH₃ = Ti(OH)₂O + 7H₂O + N₂
• Взаимодействие с H₂S:
Ti + 2H₂S = TiS₂ + 2H₂ (t)
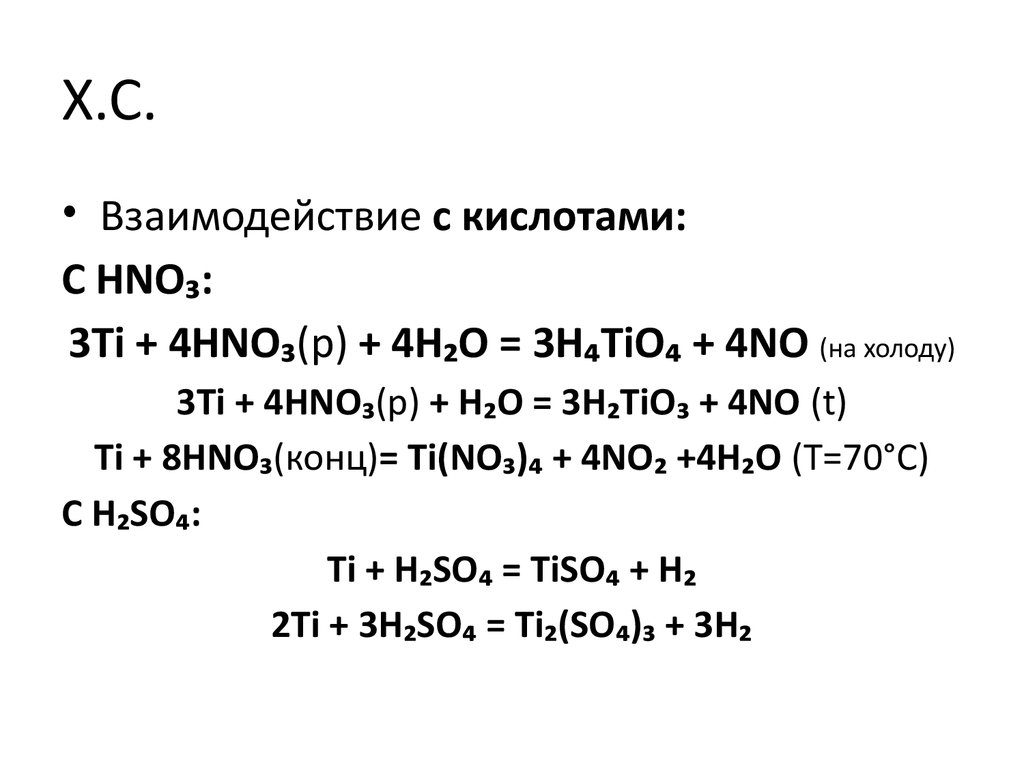
30. X.C.
• Взаимодействие с кислотами:С HNO₃:
3Ti + 4HNO₃(р) + 4H₂O = 3H₄TiO₄ + 4NO (на холоду)
3Ti + 4HNO₃(р) + H₂O = 3H₂TiO₃ + 4NO (t)
Ti + 8HNO₃(конц)= Ti(NO₃)₄ + 4NO₂ +4H₂O (Т=70°С)
С H₂SO₄:
Ti + H₂SO₄ = TiSO₄ + H₂
2Ti + 3H₂SO₄ = Ti₂(SO₄)₃ + 3H₂
31. Х.С.
• Взаимодействие с оксидами Me:• Взаимодействие с сульфидами Me:
32. X.C.
33. Специальные реакции на Ti(IV)
• Перекись водорода окрашиваетнейтральный или кислый раствор
соединений Ti(IV) в оранжево-красный
цвет, а в малом кол-ве – в светло-желтый;
34. Цирконий Zr
432535. Гафний Hf
522736. Физические свойства Zr и Hf
Чистый цирконий – блестящий,серебристобелый металл, невероятно пластичный, но
достаточно плотного.
Гафний - тяжёлый тугоплавкий серебристобелый металл.
37. Кристаллические модификации Zr и Hf
Цирконий существует в двух кристаллическихмодификациях: α-формы с гексагональной
плотноупакованной решёткой и β-формы с
кубической объёмноцентрированной решёткой.
Переход α в β происходит при 862 °C.
У гафния две модификации. При обычной
температуре гафний имеет гексагональную решетку.
Выше 1740 °C устойчив β-Hf с кубической объемноцентрированной решеткой типа a-Fe (а = 0,3615 нм).
38. Химические свойства Zr и Hf
Внешняя электронная конфигурация атома Zr4d25s2. Для Циркония характерна степень
окисления +4. Более низкие степени окисления +2
и +3 известны для Циркония только в его
соединениях с хлором, бромом и иодом.
По химические свойствам Гафний очень похож
на цирконий вследствие почти одинаковых
размеров ионов этих элементов и полного
сходства электронной структуры. Однако
химическая активность Гафния несколько меньше,
чем Zr. Основная валентность Гафния равна 4.
Известны также соединения 3-, 2- и 1-валентного
Гафния.
39. Х.С.
• Взаимодействие с неметаллаС кислородом (взаимодействуют при нагревании из-за
наличия оксидной пленки на металлах)
Zr + O2 = ZrO2 (t выше 800 C)
Hf + O2 = HfO2 (t выше 700 C)
С водородом
Zr(Hf) + H2 = Zr(Hf)H2 (t=300-400 C)
С азотом
2Zr(Hf) + N2 = 2Zr(Hf)N (t=700-800 C)
40. Х.С.
С углеродомZr + C = ZrC (t выше 900 C)
При высокой температуре Hf взаимодействует с C, B и Si,
образуя металлоподобные, тугоплавкие, весьма
устойчивые по отношению к химические реагентам
соединения: HfB, HfB2 (tпл 3250 °С), HfC (tпл 3887 °С),
Hf2Si, HfSi, HfSi2
С галогенами
Цирконий вступает в реакцию с фтором при обычной
температуре, а с хлором, бромом и иодом при
температуре выше 200 °С, образуя высшие галогениды
ZrX4 (где X - галоген). С галогенами гафний реагирует при
нагревании, образуя соединения типа HfX4.
Zr(Hf) + X2 = Zr(Hf)X4
41. Х.С.
• Взаимодействие с кислотами и щелочами– Мелкораздробленный Zr растворяется в плавиковой
кислоте, смеси азотной и плавиковой, в царской водке:
Zr + 6HF = H2[ZrF6] + 2H2
3Zr + 4HNO3 + 18HF = 3H2[ZrF6] + 4NO + 8H2O
3Zr + 4HNO3 + 18HCl = 3H2[ZrCl6] + 4NO + 8H2O
– Также как и цирконий, гафний взаимодействует с
кислотами, только если создаются условия окисления и
образования анионных комплексов Hf(IV). Мелко
раздробленный гафний растворяется в плавиковой
кислоте:
Hf + 6HF = H2[HfF6] + 2H2
В смеси азотной и плавиковой кислот и в царской водке
реакции Hf аналогичны с Zr.
42. Х.С.
– С концентрированной серной кислотой гафнийвзаимодействует только при кипячении:
Hf + 5H2SO4 = H2[Hf(SO4)3] + 2SO2– + 4H2O
–Цирконий и гафний устойчивы к растворам щелочей.
43. Получение Zr
• Обогащенную циркониевую руду спекают при 600—700°C с фторсиликатом калия K2SiF6 (фторидныйспособ):
K2SiF6 + ZrSiO4 = K2ZrF6 + 2SiO2
Восстановление фторцирконата калия металлическим
натрием.
К2ZrF6 + 4Na = Zr + 2NaF+2KF
• При хлоридном способе руду хлорируют в присутствии кок
са, полученный тетрахлорид циркония
ZrCl4очищают сублимационнодесублимационным методом, затем восстанавливают маг
нием:
ZrCl4 + 2Mg = Zr + 2MgCl2






































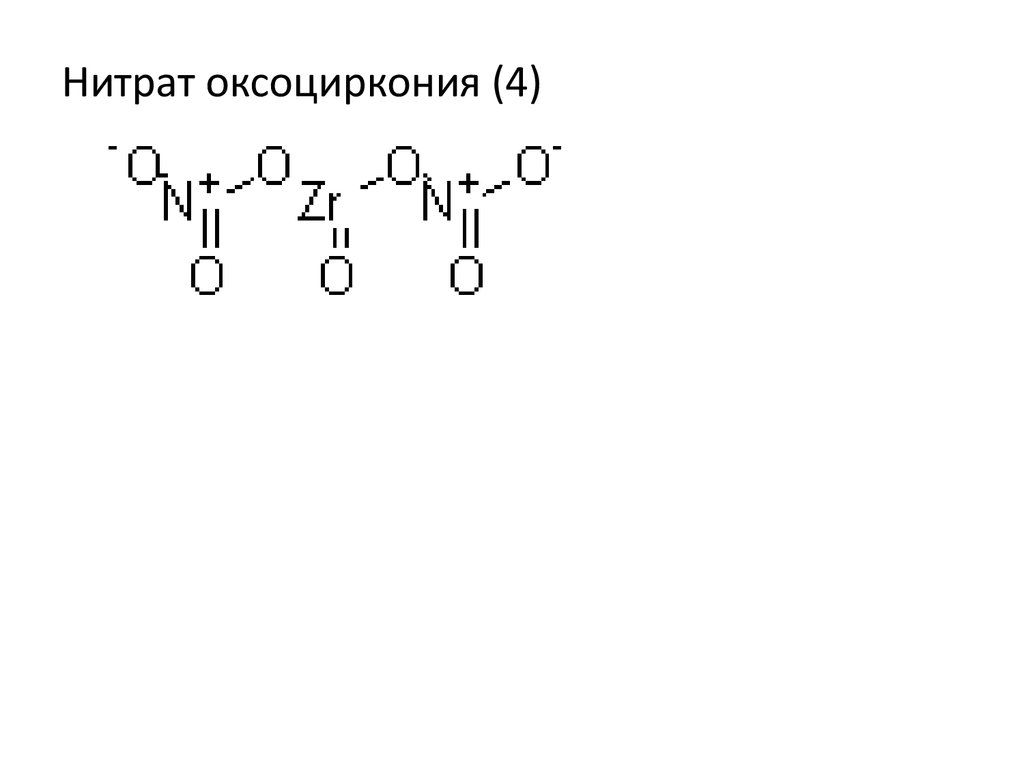
 Химия
Химия








