Похожие презентации:
Значение биохимии в фармацевтической практике. Принципы структурной и функциональной организации белков. Ферменты
1.
Лекция 1Значение биохимии
в фармацевтической практике.
Принципы структурной и
функциональной организации белков.
Ферменты: общая характеристика,
особенности функционирования и
использования в медицинской
практике. Регуляция активности
ферментов. Коферментные функции
отдельных витаминов.
2.
Что является предметомбиохимии?
Молекулярный уровень процессов
рождения, развития и функционирования
живых организмов.
Биохимия изучает структуру молекул,
вовлеченных в эти процессы, их
взаимодействие и организацию во времени
и пространстве.
3.
1.Статическая биохимия изучает химический составживых организмов и структуру биомолекул (белков,
аминокислот,нуклеиновых кислот, нуклеотидов,
углеводов, липидов, витаминов, гормонов и т.д.)
2.Динамическая биохимия изучает метаболизм
живых организмов (химические реакции обмена
веществ)
3.Функциональная биохимия изучает реакции,
лежащие в основе физиологических функций
организма
4.Биохимия человека (медицинская) биохимия
изучает закономерности обмена веществ и их
нарушения в организме человека.
Клиническая биохимия изучает диагностику
биохимических нарушений.
4.
5.
Обмен веществ невозможенбез резкого ускорения реакций,
на
которых
он
основан,
без согласования во времени и
в
пространстве
множества
биохимических процессов, т.е.
без участия ферментов.
6.
Энзимология – это наука, котораяизучает структуру, свойства и механизм
действия ферментов.
Ферменты – это биологические
катализаторы белковой природы. Они
синтезируются в клетках живых
организмов и обеспечивают
необходимые скорость и координацию
биохимических реакций, которые
составляют метаболизм.
7.
8.
9.
10.
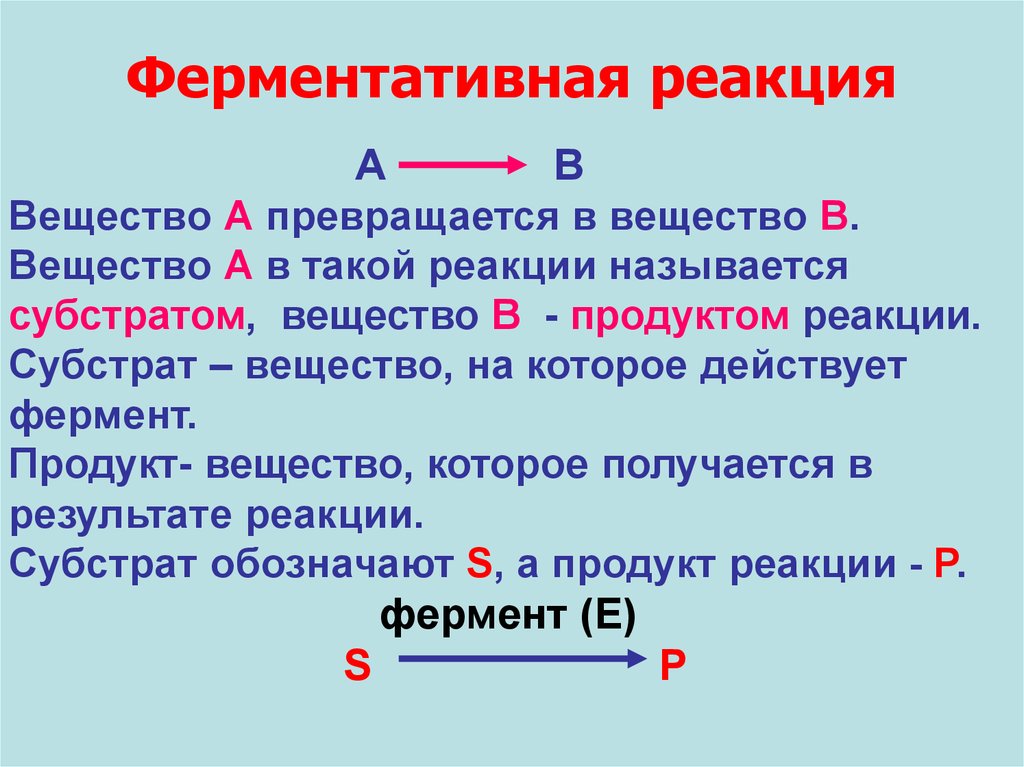
Ферментативная реакцияА
В
Вещество А превращается в вещество В.
Вещество А в такой реакции называется
субстратом, вещество В - продуктом реакции.
Субстрат – вещество, на которое действует
фермент.
Продукт- вещество, которое получается в
результате реакции.
Субстрат обозначают S, а продукт реакции - P.
фермент (Е)
S
P
11.
Ферментативная реакцияпротекает внутри специальной
полости в ферменте. Эта
полость – главный
функциональный участок
фермента -активный центр,
который обеспечивает
присоединение субстрата к
ферменту и катализ реакции.
12.
Активный центр – это участок молекулы фермента,который взаимодействует с субстратом во время
ферментативной
реакции
и
необходимый
для
превращения субстрата в каталитическом процессе.
В структуре активного центра находятся 2 зоны:
1 – контактная зона связывает субстрат за счёт водородных,
дипольных или неполярных взаимодействий.
2 – каталитическая зона содержит химические группы,
которые участвуют в непосредственном превращении
субстрата.
Участок
связывания
Активный
центр
фермента
Каталитический
участок
13.
Согласно гипотезе Фишера субстрат взаимодействуетс
активным
центром
фермента
по
принципу
«ключ-замок» и затем химически превращается
в продукт. Активный центр рассматривается как
стабильная, жёсткая структура.
Субстрат- вещество
на которое действует
фермент
14.
Согласно гипотезе Кошланда («индуцированногосоответствия») субстрат, взаимодействуя с
активным
центром
фермента,
вызывает
изменение его конформации и образование
комплекса
фермент-субстрат.
При
этом
молекула
субстрата
также
меняет
конформацию.
15.
Стадии ферментативного катализаI - сближение и ориентация субстрата относительно активного
центра фермента,
II - образование комплекса фермент-субстрат (ES),
III - деформация субстрата и образование нестабильного
комплекса фермент-продукт (EP),
IV - распад комплекса EP с высвобождением фермента и продукта.
16.
Ферменты ускоряют реакцию за счетпонижения энергии активации субстрата
1.Для взаимодействия молекул нужна
энергия. Молекулы взаимодействуют друг с
другом, если они обладают дополнительной
энергией для реакции. Такое состояние
молекулы называется активированным
состоянием, а энергия – энергией
активации.
2.За счет сближения субстратов в активном
центре фермента и деформации связей для
реакции нужно меньше энергии и реакция
идет быстрее.
17.
Ферменты имеют свойства, характерныетолько для биологических катализаторов:
1.Высокую эффективность действия. Ускоряют
реакции в тысячи и миллионы раз.
2.Высокую специфичность действия. Выбирают
определенный субстрат и катализируют
специфическую реакцию.Благодаря действию
ферментов реакции в клетке не беспорядочны, не
перепутываются, а образуют строго определенные
метаболические пути.
3.Способность действовать в мягких условиях
при нормальном атмосферном давлении, близким к
нейтральному рН, низкой температуре – 37оС.
4.Способность к регуляции. Активность фермента
может изменяться.
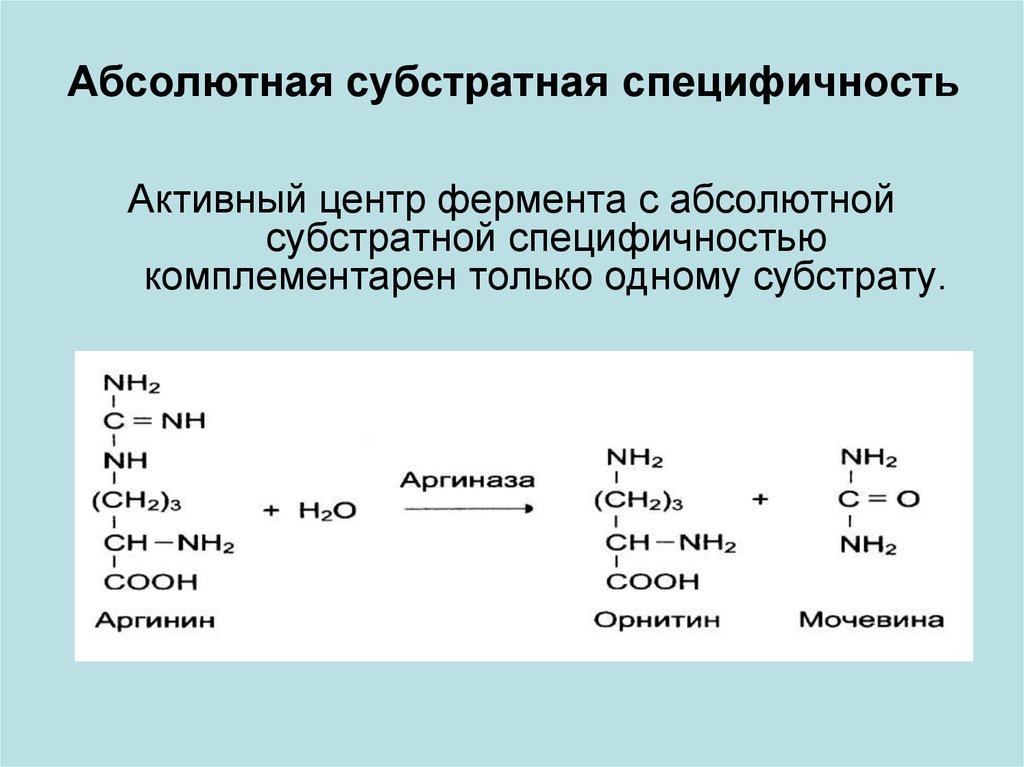
18. Абсолютная субстратная специфичность
Активный центр фермента с абсолютнойсубстратной специфичностью
комплементарен только одному субстрату.
19.
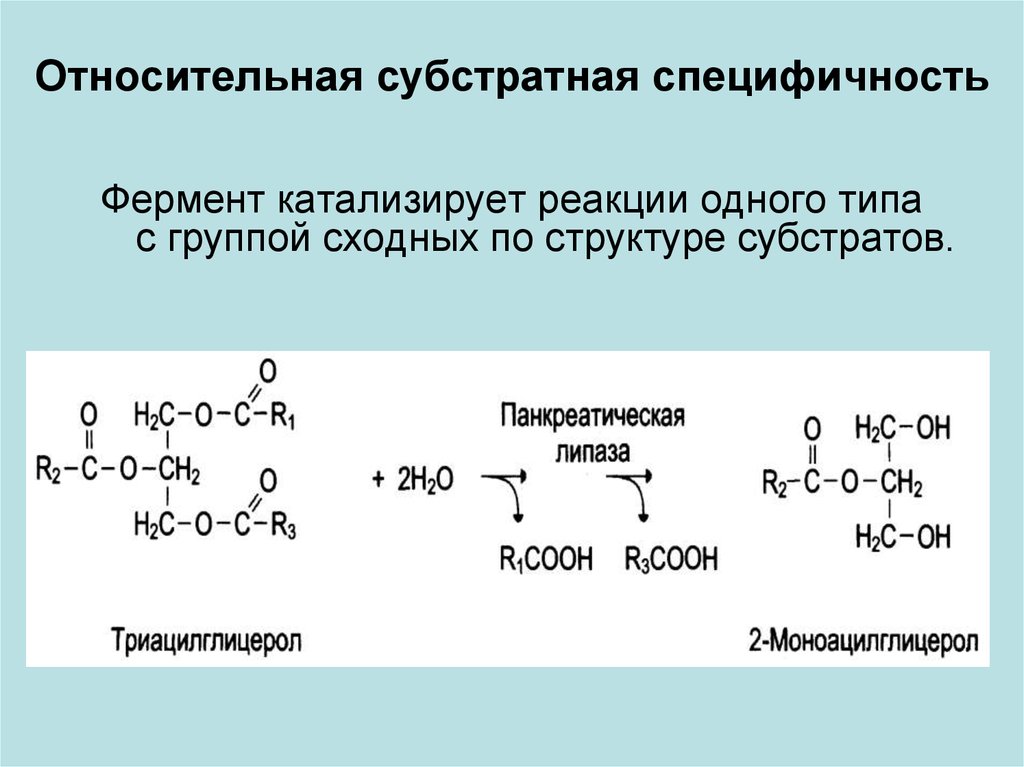
Относительная субстратная специфичностьФермент катализирует реакции одного типа
с группой сходных по структуре субстратов.
20.
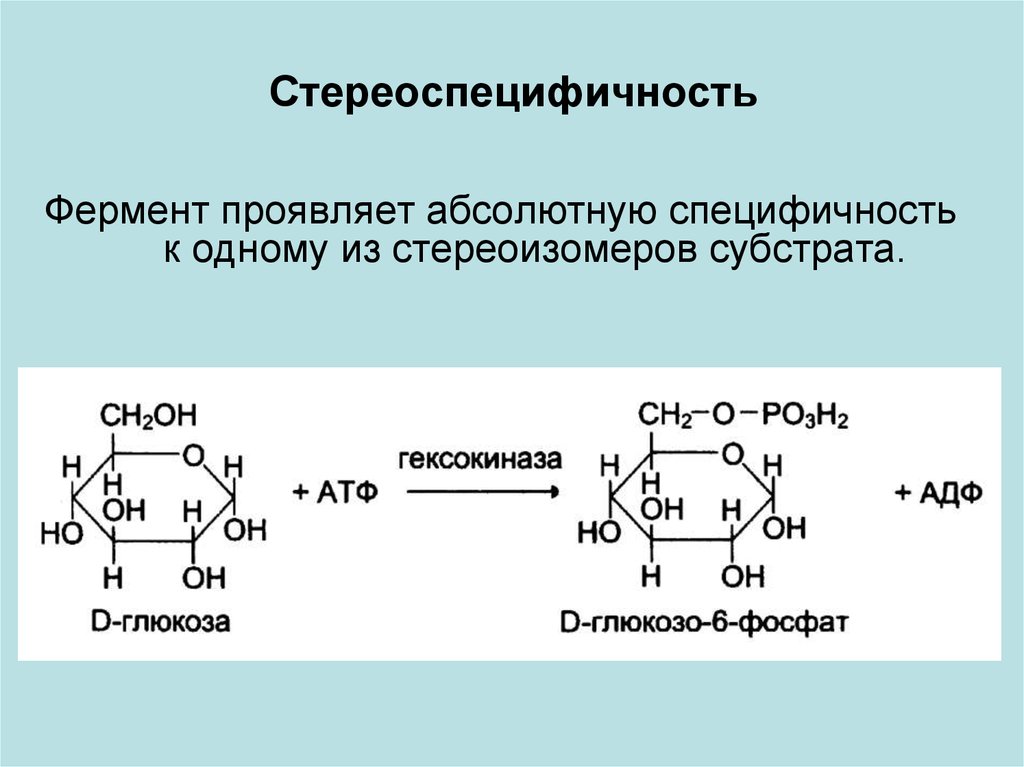
СтереоспецифичностьФермент проявляет абсолютную специфичность
к одному из стереоизомеров субстрата.
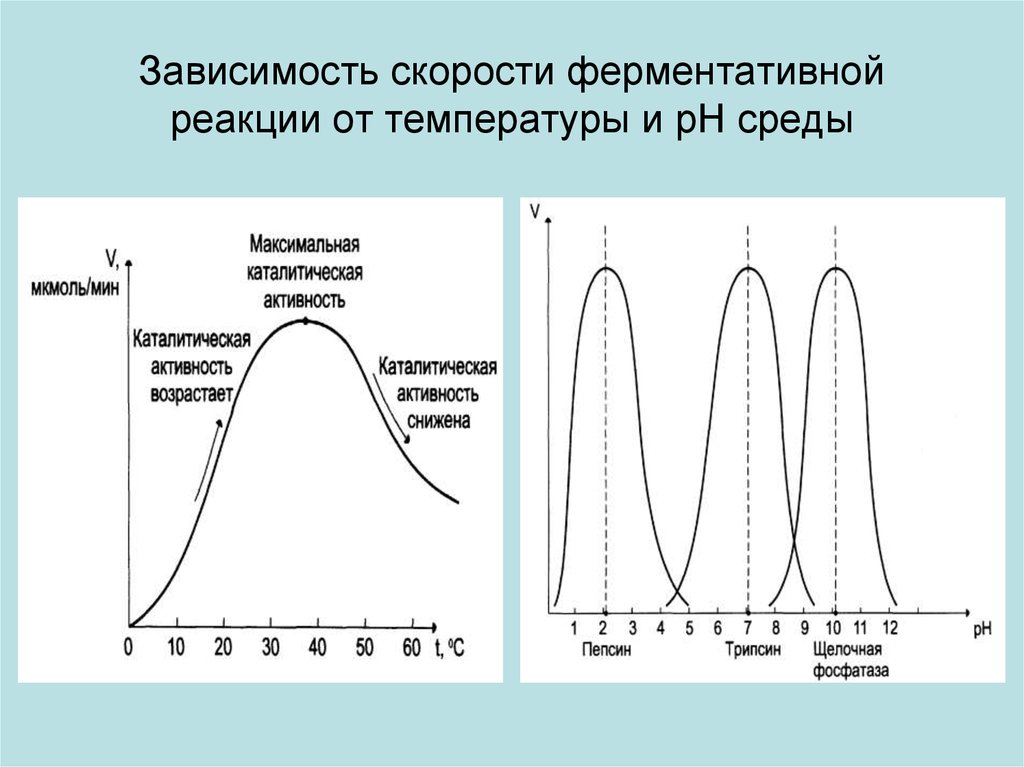
21. Зависимость скорости ферментативной реакции от температуры и рН среды
22. Зависимость скорости реакции от концентрации субстрата
Уравнение зависимости Vот [S]
называется уравнением
Михаэлиса-Ментен,
где Vmax-максимальная
скорость реакции, [S] –
концентрация субстрата,
Km- константа Михаэлиса.
23.
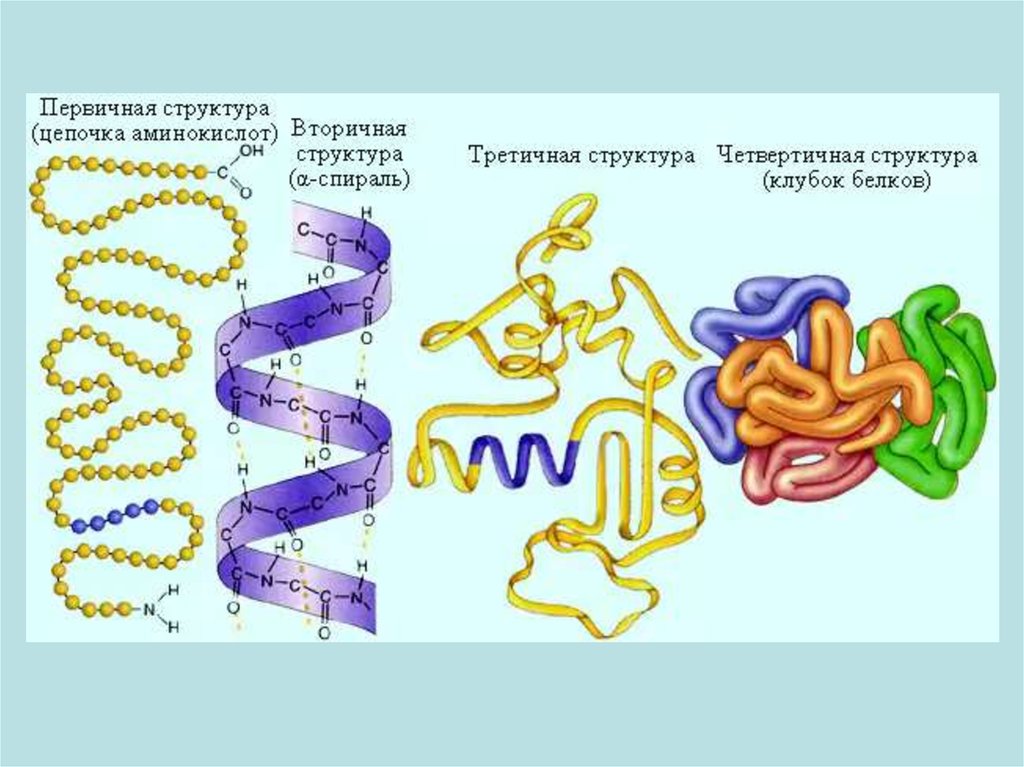
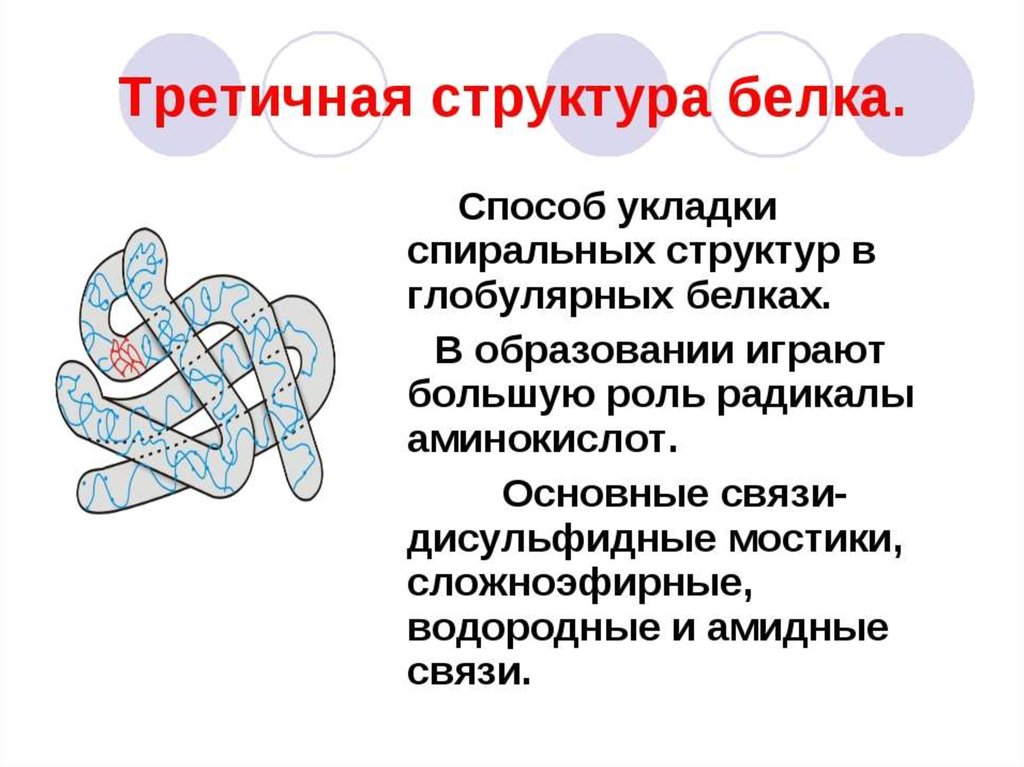
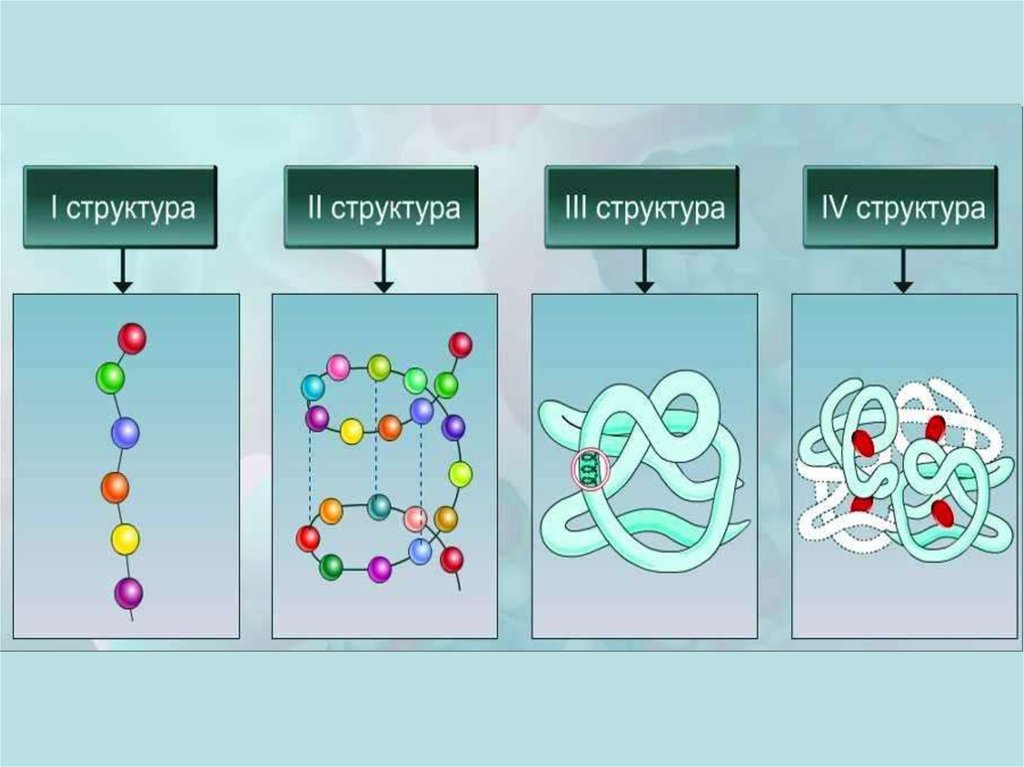
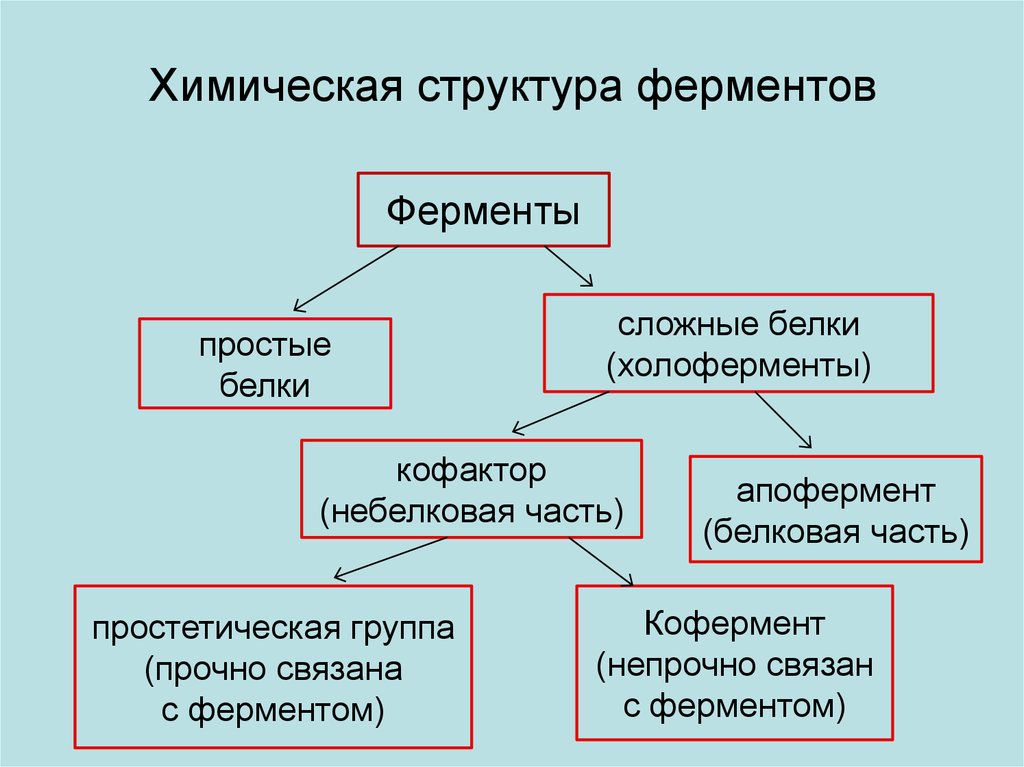
Химическая структура ферментовФерменты
простые
белки
сложные белки
(холоферменты)
кофактор
(небелковая часть)
простетическая группа
(прочно связана
с ферментом)
апофермент
(белковая часть)
Кофермент
(непрочно связан
с ферментом)
24.
Классификация кофакторов по химической природе:1) производные витамина В1 – тиаминдифосфат (ТДФ);
2) производные витамина В2 – флавинадениндинуклеотид (ФАД),
флавинмононуклеотид (ФМН);
3) производные витамина В3 (РР) –
никотинамидадениндинуклеотид (НАД),
никотинамидадениндинуклеотидфосфат (НАДФ);
4) производные витамина В5 – коэнзим А;
5) производные витамина В6 – пиридоксальфосфат (ПАЛФ),
пиридоксамин фосфат;
6) производные фолиевой кислоты – тетрагидрофолиевая
кислота (ТГФК);
7) производные витамина В12 – метилкобаламин,
дезоксиаденозилкобаламин;
8) производные витамина Н – карбоксибиотин;
9) ионы металлов и др.
25.
Классификация ферментовНомер
класса
1
Класс
Катализируемые реакции
Оксидоредуктазы Окислительно-восстановительные
2
3
4
Трансферазы
Гидролазы
Лиазы
5
Изомеразы
6
Лигазы
(синтетазы)
Перенос групп
Гидролиз
Расщепление негидролитическим
связей
С-С,
отщепление
с
образованием
двойной
присоединение по двойной связи
Изомерные превращения
путём
групп
связи,
Присоединение друг к другу двух молекул
с
использованием
энергии
высокоэнергетических связей АТФ (других
высокоэнергетических соединений)
26.
Шифр фермента – четырёхзначное цифровоеобозначение, где первая цифра обозначает класс
фермента,
вторая
цифра
(подкласс)
уточняет
преобразуемую группировку, третья цифра (подподкласс)
уточняет дополнительных участников реакции, например,
донора или акцептора, четвёртая цифра обозначает
порядковый
номер
фермента
(Например,
алкогольдегидрогеназа -1.1.1.1.).
Номенклатура ферментов:
1) согласно систематической номенклатуре название
фермента включает название субстрата, тип
катализируемой реакции и окончание –аза
(лактатдегидрогеназа);
2) тривиальная номенклатура включает название
субстрата и окончание –аза (сахараза), а также
общепринятые, исторически сложившиеся названия
(пепсин, химотрипсин).
27.
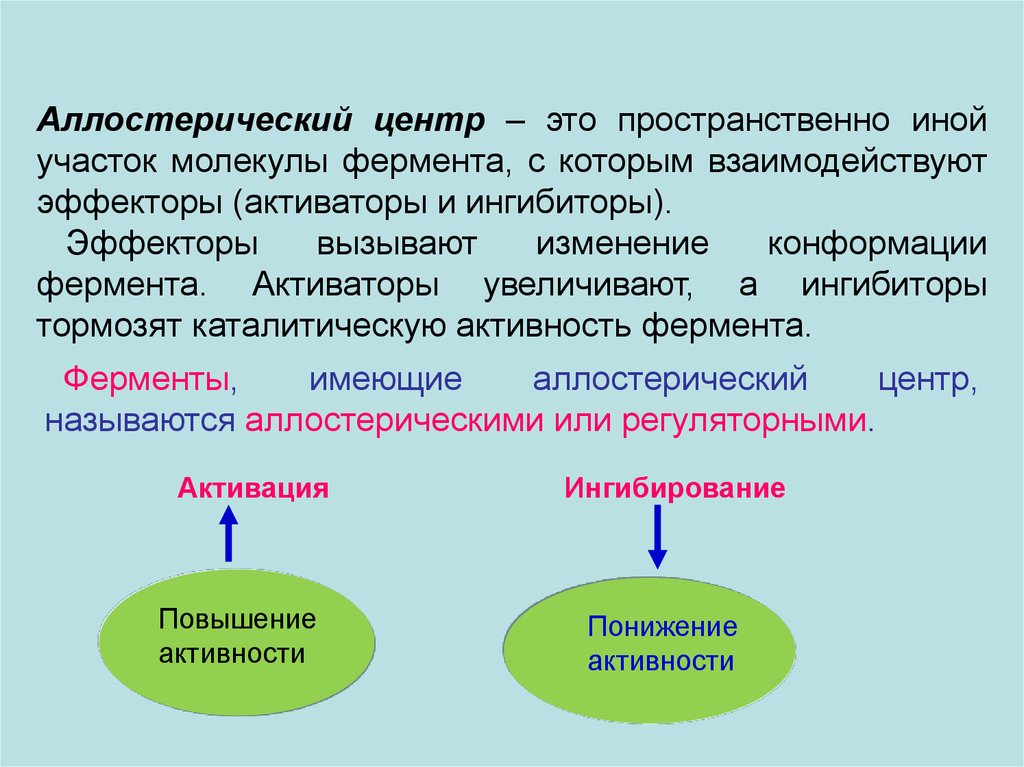
Аллостерический центр – это пространственно инойучасток молекулы фермента, с которым взаимодействуют
эффекторы (активаторы и ингибиторы).
Эффекторы
вызывают
изменение
конформации
фермента. Активаторы увеличивают, а ингибиторы
тормозят каталитическую активность фермента.
Ферменты,
имеющие
аллостерический
центр,
называются аллостерическими или регуляторными.
Активация
Повышение
активности
Ингибирование
Понижение
активности
28.
Ингибированиенеобратимое
обратимое
конкурентное
неконкурентное
29.
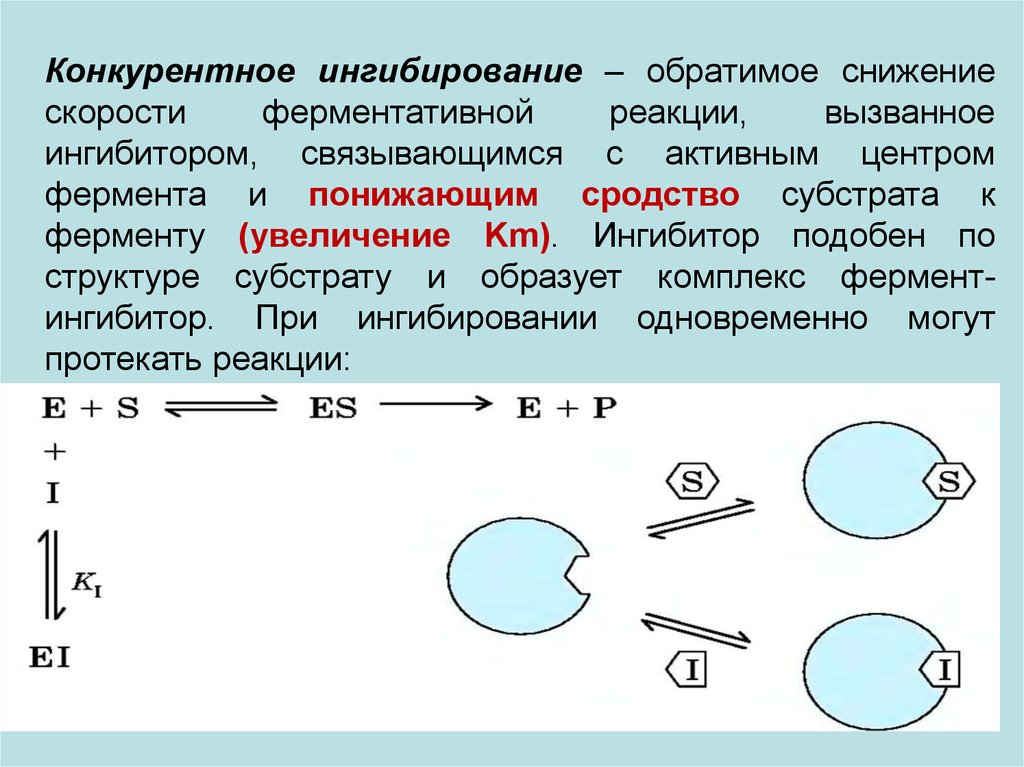
Конкурентное ингибирование – обратимое снижениескорости
ферментативной
реакции,
вызванное
ингибитором, связывающимся с активным центром
фермента и понижающим сродство субстрата к
ферменту (увеличение Km). Ингибитор подобен по
структуре субстрату и образует комплекс ферментингибитор. При ингибировании одновременно могут
протекать реакции:
30.
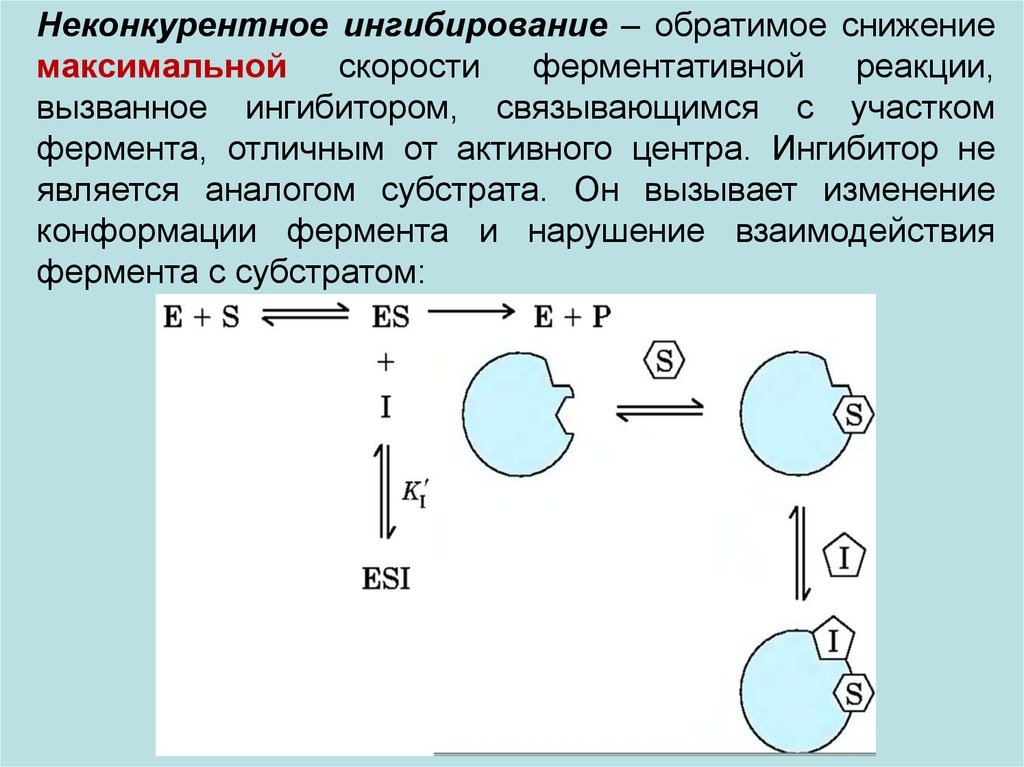
Неконкурентное ингибирование – обратимое снижениемаксимальной
скорости
ферментативной
реакции,
вызванное ингибитором, связывающимся с участком
фермента, отличным от активного центра. Ингибитор не
является аналогом субстрата. Он вызывает изменение
конформации фермента и нарушение взаимодействия
фермента с субстратом:
31.
Необратимое ингибирование наблюдаютв
случае
образования
стабильных
ковалентных связей между ингибитором и
ферментом. Чаще всего модификации
подвергается активный центр. Фермент
теряет каталитическую функцию:
E+I
EI.
32.
Регуляция активностиферментов
1. Аллостерическая
2. Частичный протеолиз
3. Ковалентная модификация (фосфорилированиедефосфорилирование, метилирование, аденилирование,
АДФ-рибозилирование)
4. Белками-регуляторами (кальмодулин, ингибиторы
протеиназ)
33.
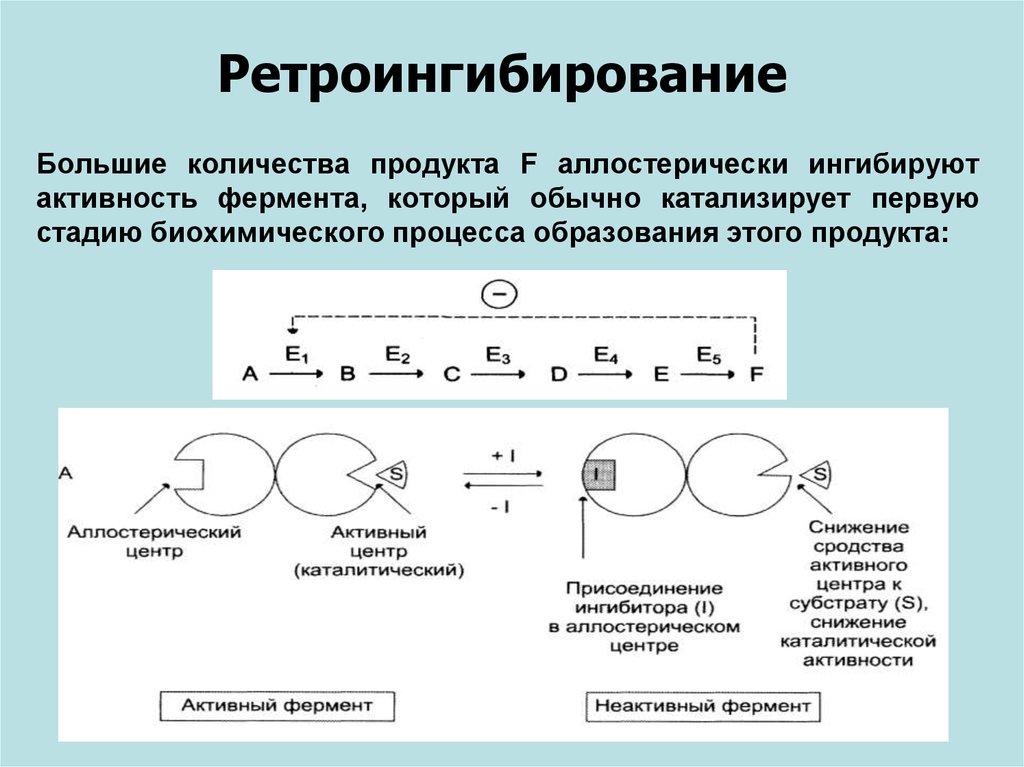
РетроингибированиеБольшие количества продукта F аллостерически ингибируют
активность фермента, который обычно катализирует первую
стадию биохимического процесса образования этого продукта:
34.
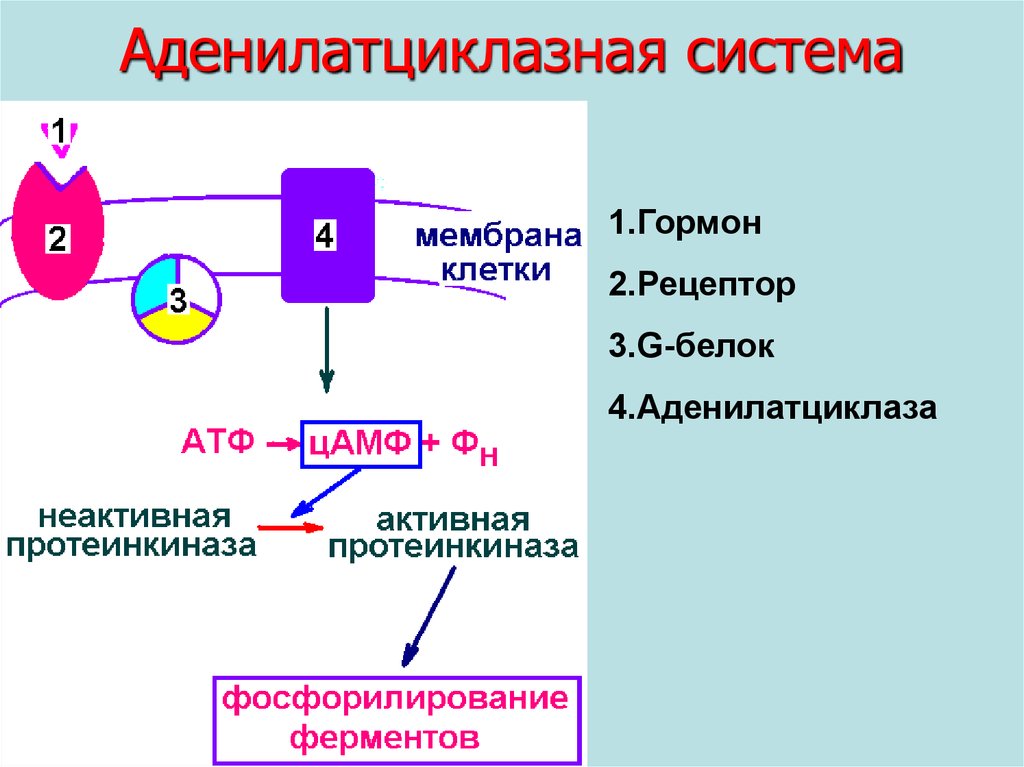
Аденилатциклазная системаПередает сигнал от гормона, который не
может проникнуть внутрь клетки, на внутриклеточные ферменты.
Гормон (глюкагон) связывается с рецептором.
Рецептор передает сигнал на G-белок.
G-белок
передает
сигнал
ферменту
аденилатциклазе. Она катализирует синтез
цАМФ,
который
активирует
фермент
протеинкиназу.
Протеинкиназа фосфорилирует ферменты.
35.
Аденилатциклазная система1.Гормон
2.Рецептор
3.G-белок
4.Аденилатциклаза
36.
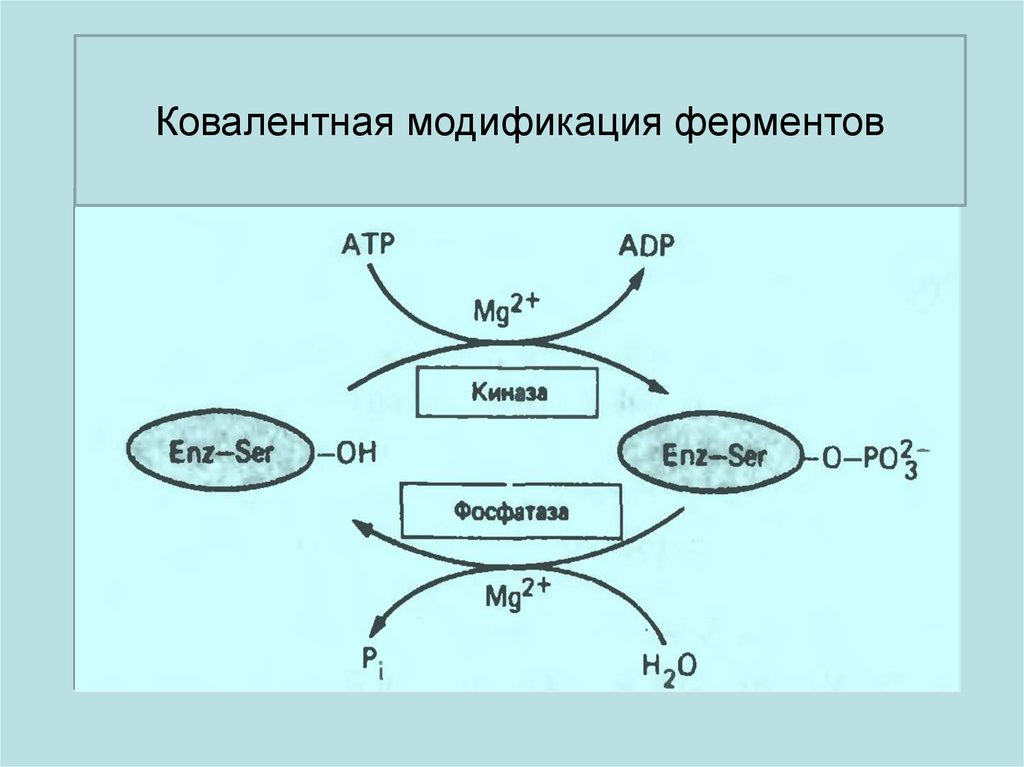
Фосфорилирование ферментовизменяет их активность.
Одни ферменты становятся
активными, а другие ферменты
становятся неактивными.
37.
Ковалентная модификация ферментов38.
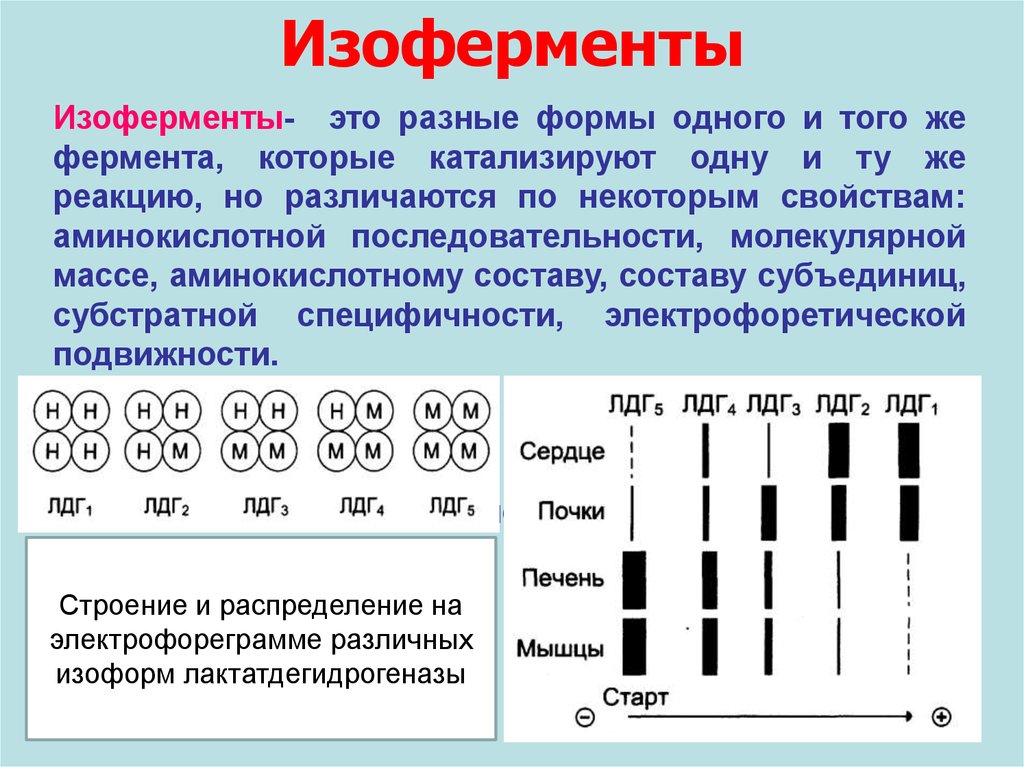
ИзоферментыИзоферменты- это разные формы одного и того же
фермента, которые катализируют одну и ту же
реакцию, но различаются по некоторым свойствам:
аминокислотной последовательности, молекулярной
массе, аминокислотному составу, составу субъединиц,
субстратной специфичности, электрофоретической
подвижности.
Изоферменты
разных генов.
являются
продуктами
экспрессии
В разных тканях могут присутствовать разные формы
изоферментов.
Строение и распределение на
электрофореграмме различных
изоформ лактатдегидрогеназы
39.
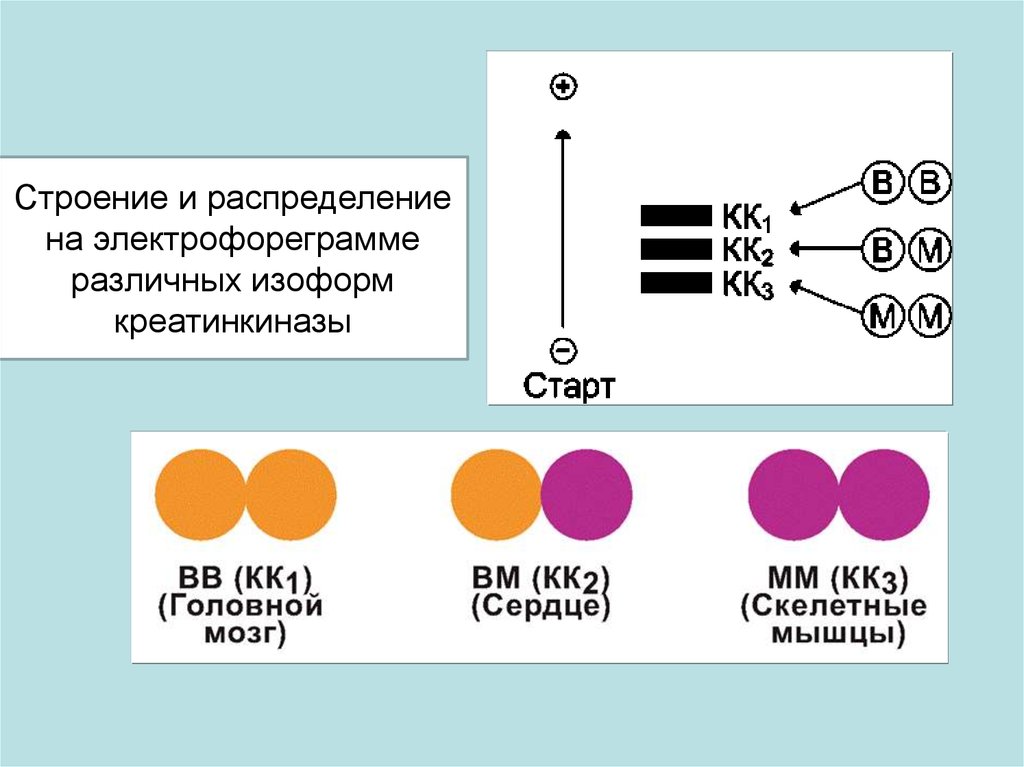
Строение и распределениена электрофореграмме
различных изоформ
креатинкиназы
40.
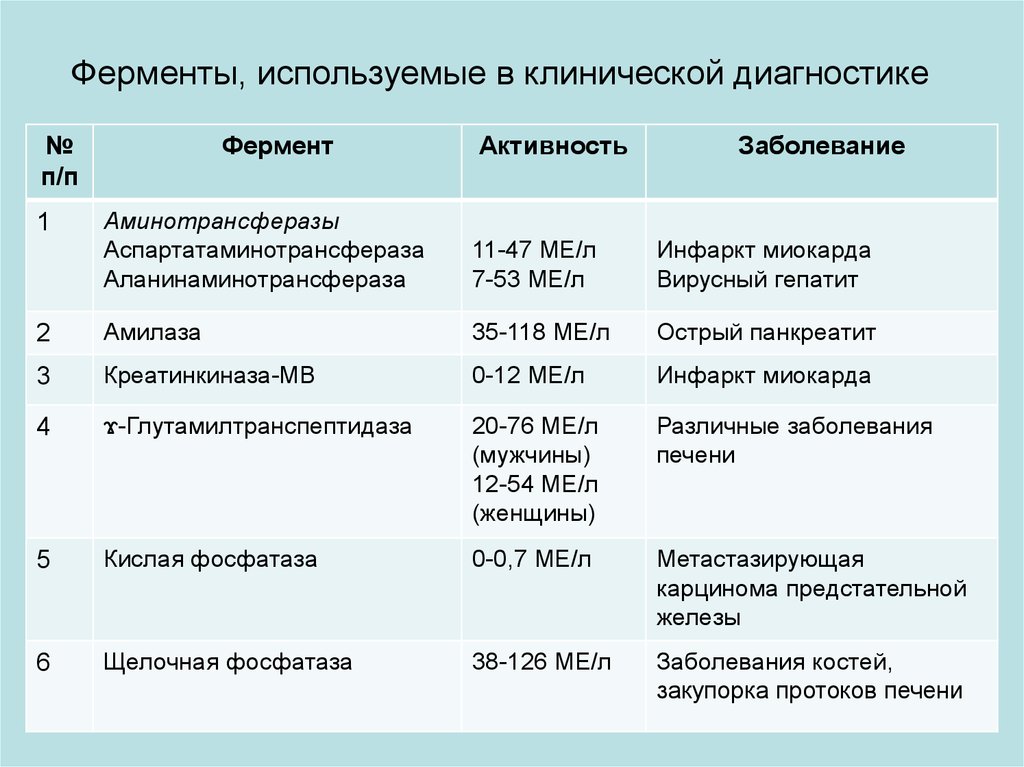
Ферменты, используемые в клинической диагностике№
п/п
Фермент
Активность
Заболевание
Аминотрансферазы
Аспартатаминотрансфераза
Аланинаминотрансфераза
11-47 МЕ/л
7-53 МЕ/л
Инфаркт миокарда
Вирусный гепатит
2
Амилаза
35-118 МЕ/л
Острый панкреатит
3
Креатинкиназа-МВ
0-12 МЕ/л
Инфаркт миокарда
4
ϫ-Глутамилтранспептидаза
20-76 МЕ/л
(мужчины)
12-54 МЕ/л
(женщины)
Различные заболевания
печени
5
Кислая фосфатаза
0-0,7 МЕ/л
Метастазирующая
карцинома предстательной
железы
6
Щелочная фосфатаза
38-126 МЕ/л
Заболевания костей,
закупорка протоков печени
1
41.
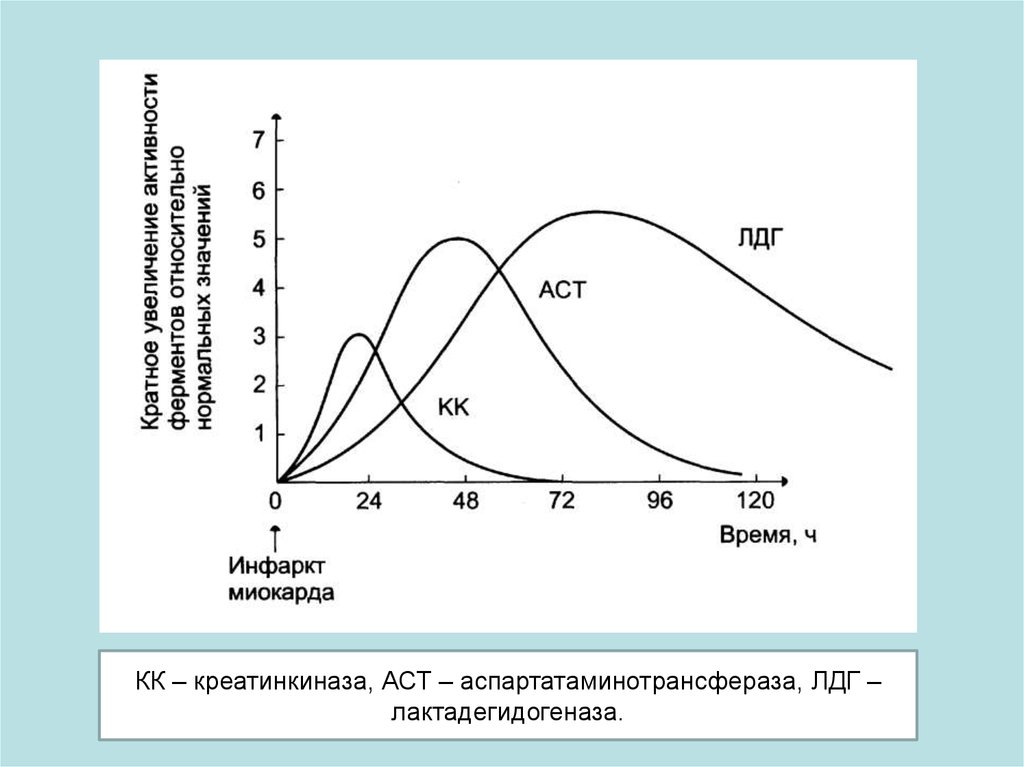
КК – креатинкиназа, АСТ – аспартатаминотрансфераза, ЛДГ –лактадегидогеназа.
42.
Ферментные средства1. Пептидазы: ацидин-пепсин.
2. Протеазы: химотрипсин, химопсин.
3. Нуклеазы: рибонуклеаза, дезоксирибонуклеаза.
4. Фибринолитические ферменты: альтеплаза (актилизе),
фибринолизин.
5. Гиалуронидазы: лидаза, коллагеназа.
6. Полиферментные средства: панкреатин, фестал,
фобензим, панзинорм, мезим форте.
7. Другие ферментные средства: аспарагиназа,
пенициллиназа, цитохром С.
43.
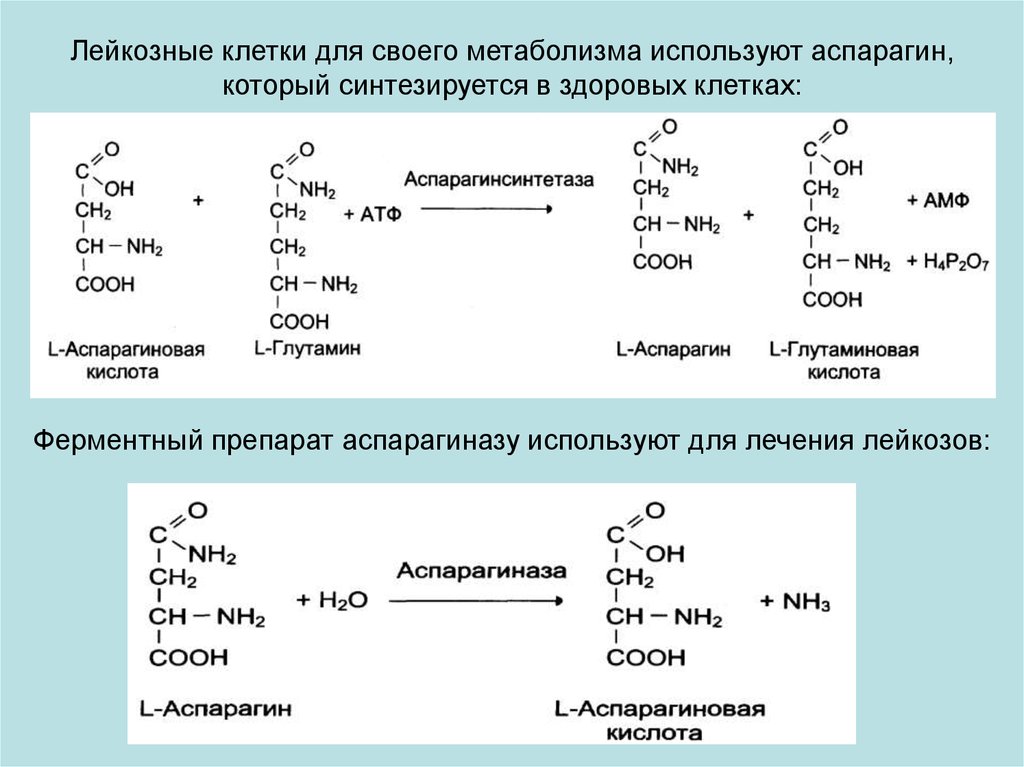
Лейкозные клетки для своего метаболизма используют аспарагин,который синтезируется в здоровых клетках:
Ферментный препарат аспарагиназу используют для лечения лейкозов:























 Биология
Биология








