Похожие презентации:
Открытие электрона
1. Открытие электрона
1874 г. Дж.Стоуни. Электричество состоит из элементарныхзарядов, связанных с атомами. Ввел термин «электрон».
1869-1875 гг. У.Крукс. Катодные лучи.
1895 г. Ж.Перрен. Отклонение катодных лучей в
электрическом поле. Отрицательные частицы.
© К.К.Боярский 2009
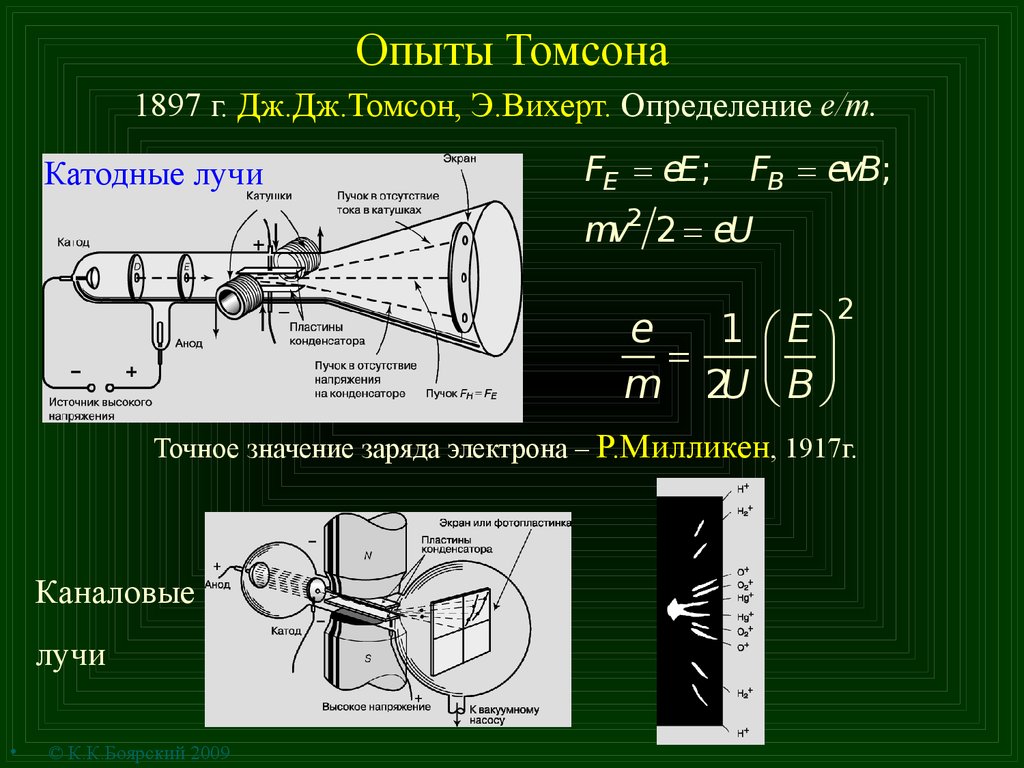
2. Опыты Томсона
1897 г. Дж.Дж.Томсон, Э.Вихерт. Определение e/m.Катодные лучи
FE = eE;
FB = evB;
mv2 2 = eU
e
1 æEö
=
m 2U çè B ÷ø
2
Точное значение заряда электрона – Р.Милликен, 1917г.
Каналовые
лучи
© К.К.Боярский 2009
3. Классическая модель атома
1902 г. У.© К.К.Боярский 2009
Томсон
1904 г. Дж.Дж.Томсон
4. Спектр атома водорода
1885 г. Формула Бальмера© К.К.Боярский 2009
1 n
æ1 1 ö
= = RH ç - 2 ÷ , n = 3,4,5K
l c
è4 n ø
l ³ 364,56 í ì
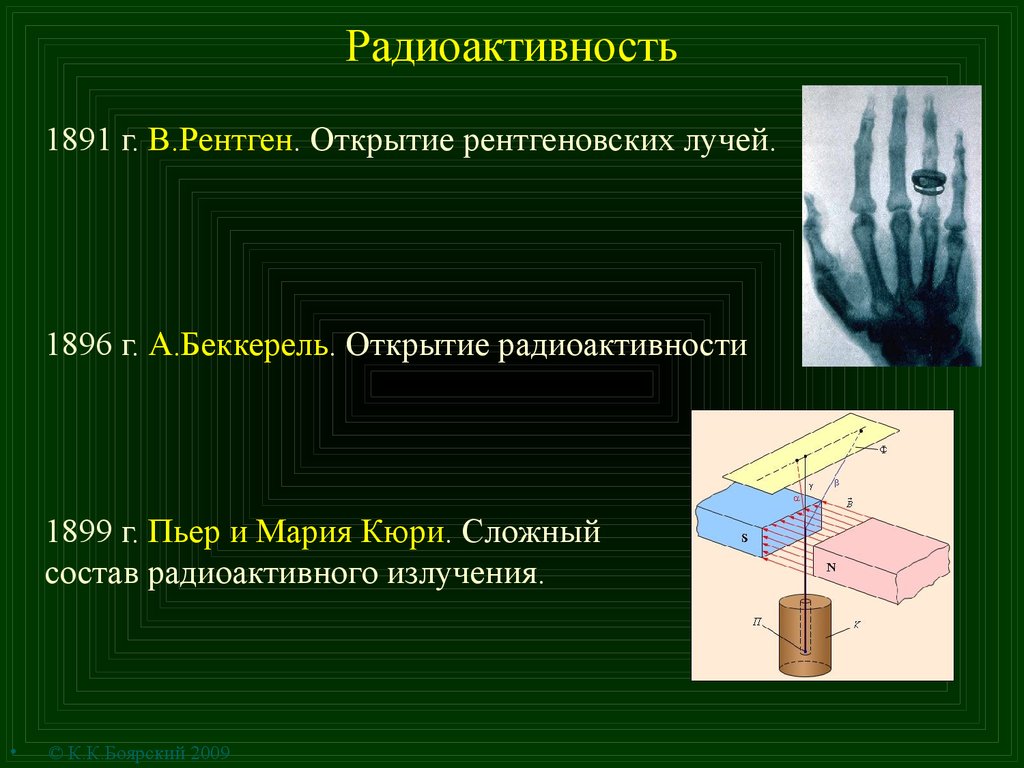
5. Радиоактивность
1891 г. В.Рентген. Открытие рентгеновских лучей.1896 г. А.Беккерель. Открытие радиоактивности
1899 г. Пьер и Мария Кюри. Сложный
состав радиоактивного излучения.
© К.К.Боярский 2009
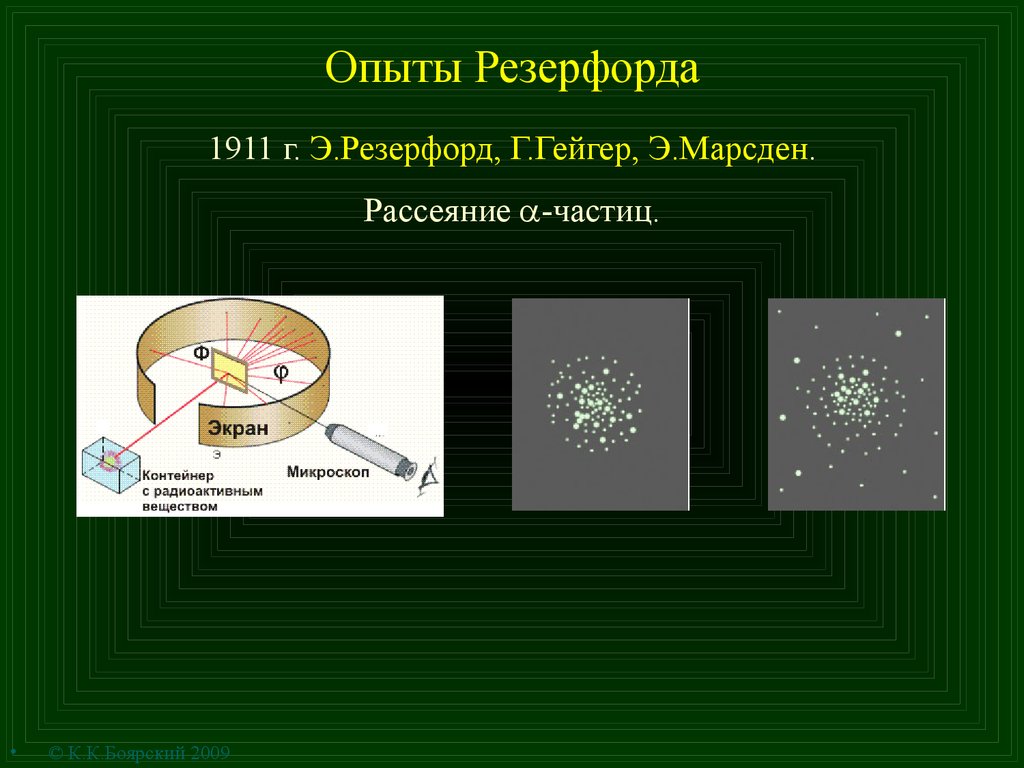
6. Опыты Резерфорда
1911 г. Э.Резерфорд, Г.Гейгер, Э.Марсден.Рассеяние -частиц.
© К.К.Боярский 2009
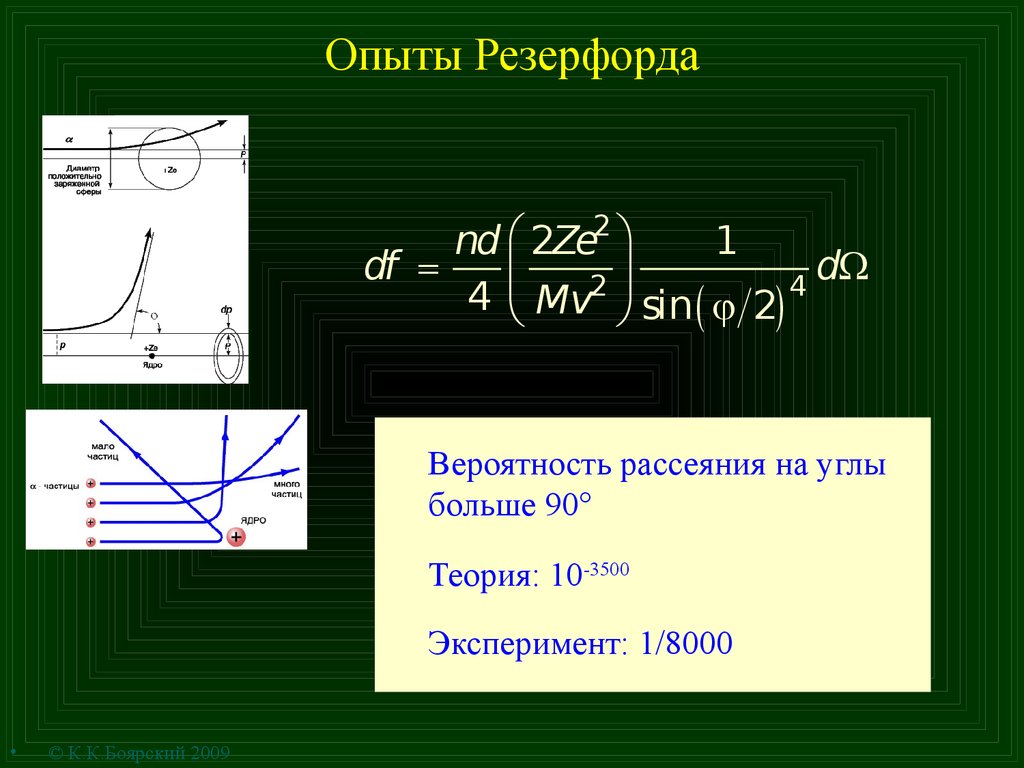
7. Опыты Резерфорда
nd æ 2Ze2 ö1
df =
dW
ç
2÷
4
4 è Mv ø sin ( j 2)
Вероятность рассеяния на углы
больше 90
Теория: 10-3500
Эксперимент: 1/8000
© К.К.Боярский 2009
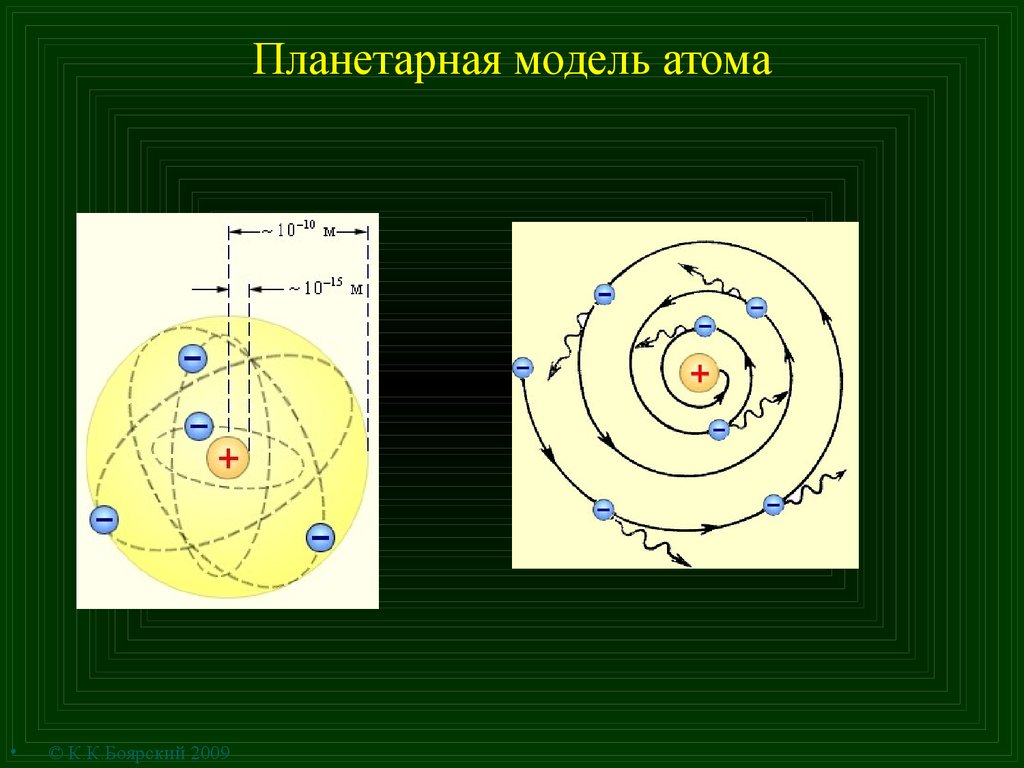
8. Планетарная модель атома
© К.К.Боярский 2009
9. Постулаты Бора
1913 г. Нильс Бор1. Разрешены только такие круговые орбиты, для
которых момент импульса равен целому числу в
единицах постоянной Планка. Двигаясь по таким
орбитам электроны не излучают.
2. Излучение возникает только при переходе
электрона с одной разрешенной орбиты на другую.
Частота этого излучения определяется
разностью энергий атома в начальном и конечном
состояниях.
© К.К.Боярский 2009
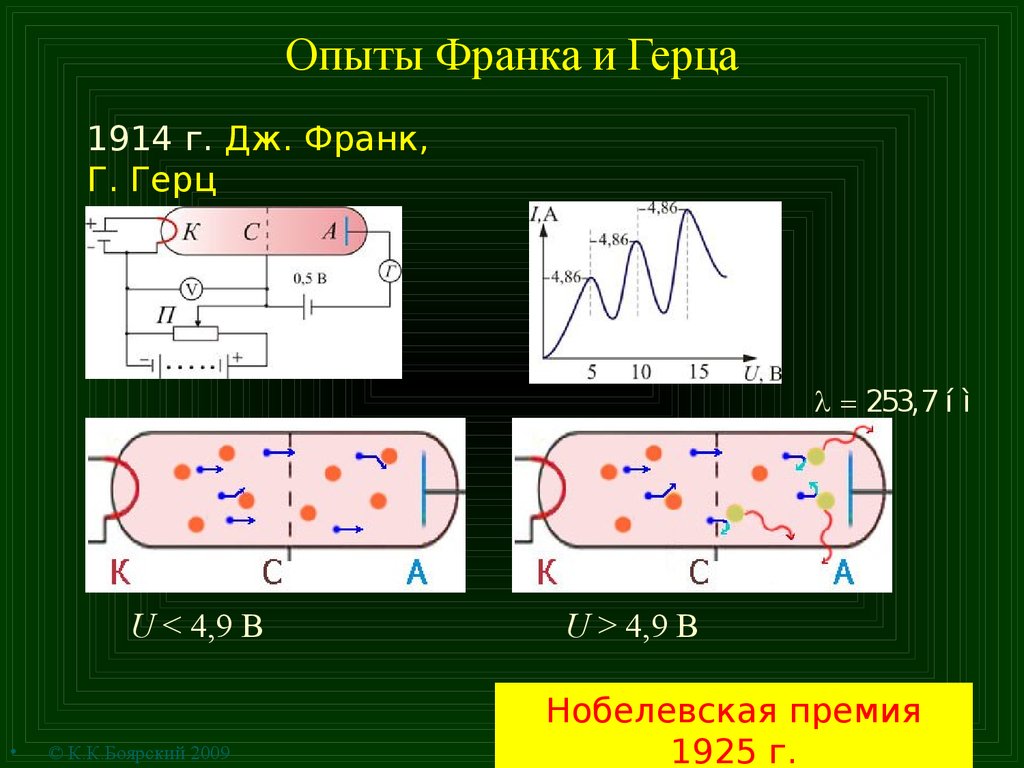
10. Опыты Франка и Герца
1914 г. Дж. Франк,Г. Герц
l = 253,7 í ì
U < 4,9 B
© К.К.Боярский 2009
U > 4,9 B
Нобелевская премия
1925 г.
11. Теория Бора
Гармонический осциллятор2
2 2
p
mw q
En =
+
= nhw
2m
2
2
2
q
p
+
=1
2nh mw 2mnhw
S = pab = 2pnh =
ò pdq
Ñ
ò Ldj = 2pnh
Ñ
Фазовая траектория
Квантование момента импульса
© К.К.Боярский 2009
L = mvr = nh
12. Теория Бора
Движение электрона по круговой орбитеmv2
Ze2
=
2
r
4pe0r
L = mvr = nh
4pe0h2 2
rn =
n
2
mZe
Боровский радиус
a0 = 4pe0h2 me2 = 0,529A
© К.К.Боярский 2009
2
a0n
rn =
Z
13. Энергия атома водорода
22
mv
1 Ze
=
2
2 4pe0r
mv2 æ Ze2 ö
Ze2
E=
+ ç÷=2
8pe0r
è 4pe0r ø
4 2
me Z
1
En = 32p2e20h2 n2
n = 1, 2, … – главное квантовое
число
© К.К.Боярский 2009
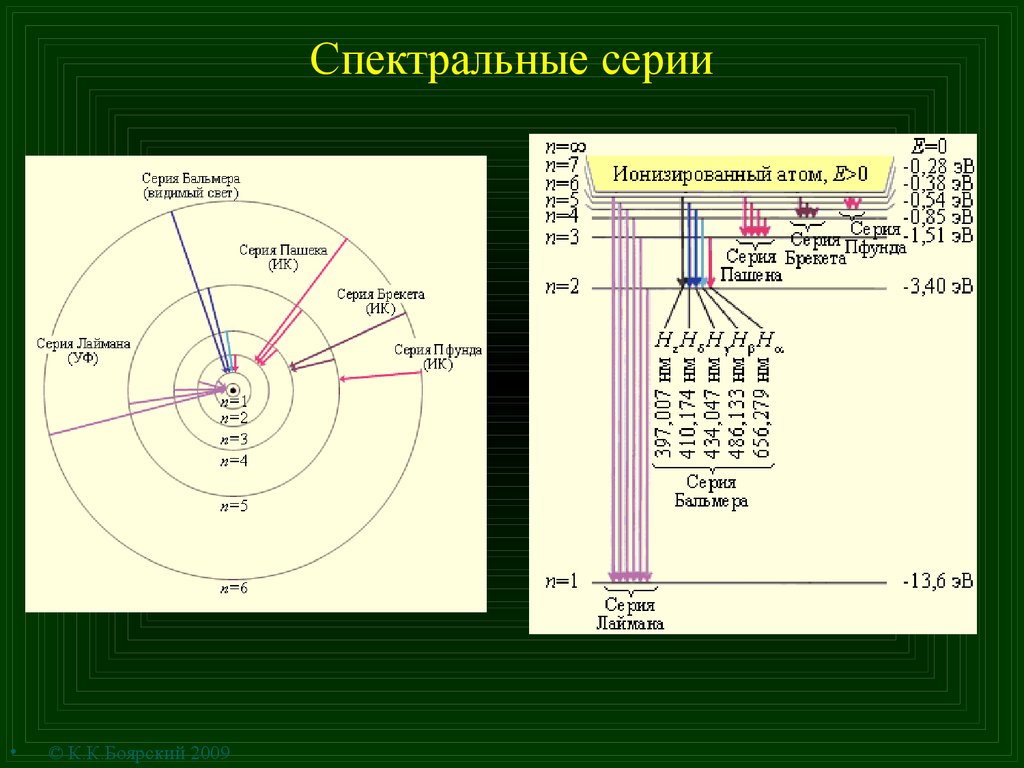
14. Спектральные серии
© К.К.Боярский 2009
15. Спектральные серии
Комбинационныйпринцип Ритца
Tn =
Термы
n%=
1 n
= = Tm - Tn;
l ñ
m<n
R
n2
Постоянная Ридберга
R¥ =
me4
2 3
4
p
e
( ) 0ch
3
= 109737ñì
-1
;
Для водорода RH = 109678 см–
1
© К.К.Боярский 2009
R¥ c = 3,288 × 1015 ñ-1








 Физика
Физика








