Похожие презентации:
Гармонизация стандартов СМК и GMP, их особенности и различия
1. ГОРМОНИЗАЦИЯ СТАНДАРТОВ СМК И GMP ИХ ОСОБЕННОСТИ И РАЗЛИЧИЯ
Студент 5-курса Маметова И.Т.Алматы, 2015
2.
Гармонизация стандарта — этоприведение его содержания в
соответствие с другим стандартом
для обеспечения взаимозаменяемости
продукции (услуг), взаимного
понимания результатов испытаний и
информации, содержащейся в
стандартах.
3.
Гармонизация стандартов имеет важнейшеезначение для расширения взаимовыгодного
обмена товарами (услугами), заключения
соглашений по сертификации, развития и
углубления промышленного сотрудничества и
совместного решения научно-технических
проблем, повышения и обеспечения качества
продукции, оптимизации затрат материальных
и энергетических ресурсов, повышения
эффективности мер по безопасности труда и
защите окружающей среды.
4. Системы менеджмента качества на основе международных стандартов ИСО серии 9000
Современные организационные основы формированиямеханизма менеджмента качества заложены в
международных стандартах ISO (ИСО) серии 9000,
определяющих требования к системам менеджмента
качества (CMK) на предприятиях. MC ИСО серии 9000
разработаны и утверждены в 1987 г. международной
организацией по стандартизации ИСО (ISO - International
Standart Organization). Идея создания этих стандартов
изначально принадлежала Европейской организации по
качеству (EOQ). В основу был положен стандарт
Великобритании на обеспечение качества 55 5750:1979.
Кроме того, во внимание были приняты стандарты на
системы качества для оборонной промышленности США
(ML-Q-9858, ML-/-45208), а также стандарты на системы
управления качеством других стран, в том числе СССР
(КС УКП).
5.
В соответствии с терминологией MC ИСО"система менеджмента качества - это
система менеджмента для руководства и
управления организацией применительно
к качеству".
В настоящее время 180 стран признали
MC ИСО 9000 в качестве национальных
или гармонизировали в соответствии с
ними национальные стандарты в этой
области
6. Структура стандарта МС ИСО 9001 включает следующие разделы.
1. Область применения. Требования к СМК. Стандарт охватывает все стадии жизненногоцикла продукции, при необходимости отдельные положения стандарта можно исключить
(например, для тортовых предприятий - стадию производства продукции).
2. Нормативные ссылки (например, ИСО 9000:2005. Системы менеджмента качества.
Основные положения и словарь).
3. Термины и определения. В настоящем стандарте применены термины и определения,
данные в ИСО 9000. В тексте стандарта термин "продукция" может означать также
"услугу".
4. Система менеджмента качества. Общие требования к системе, требования к
документации, использование принципов TQM.
5. Ответственность руководства (обязательства руководства, ориентация на
потребителя, политика в области качества, планирование, ответственность, полномочия и
обмен информацией, анализ со стороны руководства).
6. Менеджмент ресурсов (обеспечение ресурсами; человеческие ресурсы;
инфраструктура, производственная среда).
7. Процессы жизненного цикла продукции (планирование процессов жизненного цикла
продукции, процессы, связанные с потребителями, проектирование и разработка, закупки,
производство и обслуживание, управление устройствами для мониторинга и измерений).
8. Измерение, анализ и улучшение (мониторинг и измерение, управление
несоответствующей продукцией, анализ данных, улучшение, корректирующие и
предупреждающие действия).
7. В МС ИСО 9000 введен ряд новых терминов, например "валидация" и "верификация".
В МС ИСО 9000 введен ряд новых терминов,например "валидация" и "верификация".
Валидация - это подтверждение на основе представления
объективных свидетельств того, что требования,
предназначенные для конкретного использования или
применения, выполнены. Иными словами, валидация это процедура сопоставления того, что задумано сделать,
с тем, что необходимо потребителю для конкретного
применения. Фактически валидация предусматривает
сопоставление планируемого результата деятельности с
текущими выходными требованиями ("взгляд вперед").
Верификация - это подтверждение на основе
представления объективных свидетельств того, что
установленные требования были выполнены. Иными
словами, верификация - это процедура сопоставления
того, что сделано, с тем, что было задумано (предписано)
сделать. Фактически верификация - это сопоставление
закопченного результата с выходными требованиями
("взгляд назад").
8. Системы качества по ИСО 9000
Ответственность руководстваСистема качества
Оценка контрактов
Контроль документации
Закупка
Входной контроль
Контроль процессов
Контроль качества
Аналитическая аппаратура
Решения в случаях несоответствия
Действия по исправлению
Хранение и упаковка
Документация по качеству
Внутренний аудит качества
Подготовка кадров
Статистические методы
9.
Системы менеджмента вфармацевтической промышленности
базируются на стандартах GMP (Good
Manufacturing Practice — Надлежащая
производственная практика).
GMP — это комбинация
производственных и качественных
процедур, нацеленных на обеспечение
того, чтобы продукты изготовлялись
согласно установленным требованиям,
избегая загрязнения продукта из
внутренних и внешних источников.
10. Требования GMP в фармацевтической промышленности
1. Все производственные процессы должны быть четкорегламентированы и должны периодически пересматриваться с учетом
накопленного опыта. Следует контролировать стабильность
производства лекарственных средств с заданным качеством в
соответствии со спецификациями на них.
2. Следует проводить аттестацию (испытания) критических стадий
процессов производства, в том числе при внесении существенных
изменений в технологический процесс.
3. Следует обеспечить все необходимые условия для выполнения
требований настоящего стандарта, в том числе включая наличие:
• обученного и аттестованного персонала;
• необходимых помещений и площадей;
• соответствующего оборудования и системы обслуживания;
• материалов, средств упаковки и маркировки, удовлетворяющих
установленным требованиям;
• утвержденных инструкций и методик;
• требуемых условий хранения и транспортирования.
11.
4. Инструкции и методики должны быть конкретны, изложены ясно иоднозначно в письменной форме.
5. Персонал должен быть обучен правильному выполнению инструкций.
6. В процессе производства следует составлять протоколы (заполняемые
рукописным способом и (или) с применением технических средств),
документально подтверждающие фактическое проведение предусмотренных
инструкциями технологических стадий и получение продукции требуемого
качества в количестве, соответствующем установленным нормам. Все
отклонения необходимо расследовать и протоколировать в полном объеме.
7. Протоколы на серию продукции, в том числе на документацию по
реализации продукции, должны давать возможность прослеживать
изготовление каждой серии и храниться в полном объеме в доступной форме.
8. Порядок реализации (оптовой продажи) продукции должен сводить к
минимуму любой риск для ее качества.
9. Следует организовать систему отзыва любой серии продукции из продажи
или поставки.
10. Рекламации на качество продукции следует тщательно рассматривать, а
причины ухудшения качества расследовать с принятием соответствующих мер
по их предотвращению.
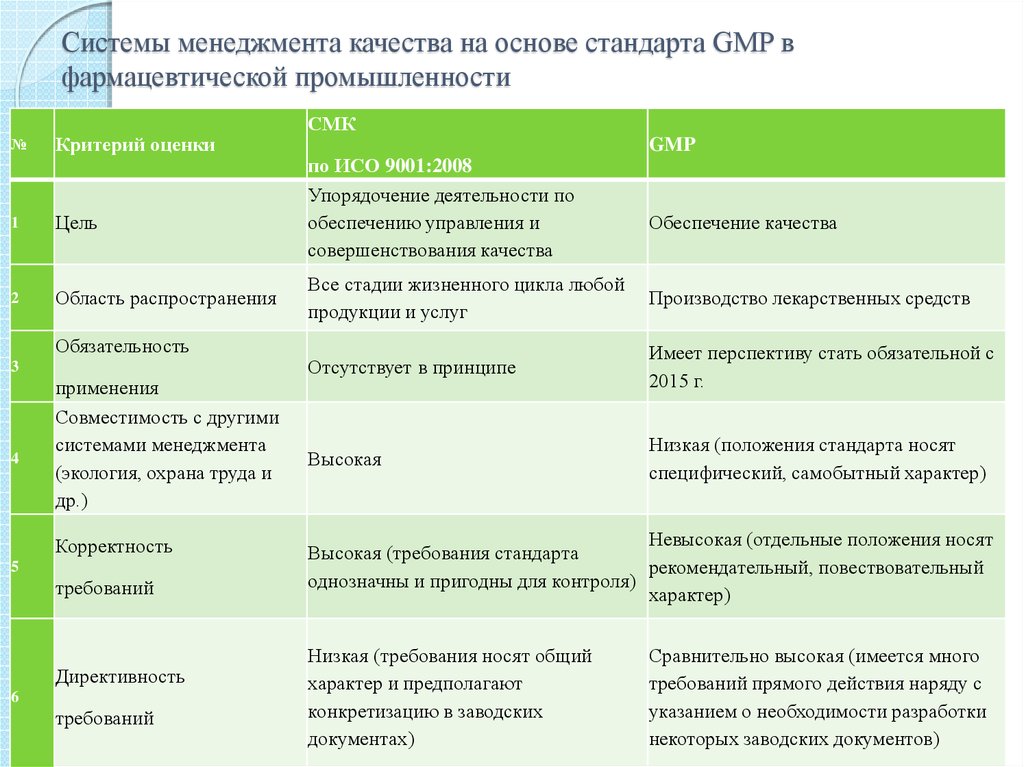
12. Системы менеджмента качества на основе стандарта GMP в фармацевтической промышленности
№Критерий оценки
1
Цель
2
Область распространения
Обязательность
3
4
применения
Совместимость с другими
системами менеджмента
(экология, охрана труда и
др.)
Корректность
5
требований
Директивность
6
требований
СМК
по ИСО 9001:2008
Упорядочение деятельности по
обеспечению управления и
совершенствования качества
GMP
Обеспечение качества
Все стадии жизненного цикла любой
продукции и услуг
Производство лекарственных средств
Отсутствует в принципе
Имеет перспективу стать обязательной с
2015 г.
Высокая
Низкая (положения стандарта носят
специфический, самобытный характер)
Невысокая (отдельные положения носят
Высокая (требования стандарта
рекомендательный, повествовательный
однозначны и пригодны для контроля)
характер)
Низкая (требования носят общий
характер и предполагают
конкретизацию в заводских
документах)
Сравнительно высокая (имеется много
требований прямого действия наряду с
указанием о необходимости разработки
некоторых заводских документов)
13. Сравнение ИСО и GMP
Выводы д-ра Л. ХартманаИСО 9000 – самая известная в мире система качества,
ставшая международным стандартом. Пересматривается
и совершенствуется. По этим причинам имеет
касательство к фарм. производству.
Правила GMP более подробны; требования ИСО 9000
шире.
При сопоставлении ИСО 9000 и GMP не выявлено
противоречий (есть расхождения).
ИСО не заменит и не может заменить GMP
В ИСО 9000 много формализма. При неправильном
понимании идеологии сертификация по ИСО может
принести больше вреда, чем пользы.
Вопрос не в том, что выбрать: ИСО или GMP.
Правильный ответ: ИСО и GMP.












 Право
Право








