Похожие презентации:
Хромопротеиды: биологическая роль. Синтез и распад гема. Метаболизм билирубина
1. Хромопротеиды: биологическая роль. Синтез и распад гема. Метаболизм билирубина.
2. План лекции:
1.2.
3.
4.
5.
Понятие о хромопротеинах, их классификация.
Строение и функции гемопротеинов.
Биосинтез гема.
Распад гемопротеинов.
Клинико-биохимические аспекты
метаболизма гемопротеинов.
3. 1. Понятие о хромопротеинах, их классификация.
• Белки бывают простые исложные. У сложных белков
имеется небелковая часть –
простетическая группа.
4.
• Хромопротеины – это сложныебелки, содержащие окрашенную
простетическую группу. По этой
причине молекулы
хромопротеинов окрашены в
определённый цвет (chromos краска).
5. В природе известны следующие виды хромопротеинов:
• магнийпорфирины (хлорофилл)• флавопротеины (рибофлавин)
• гемопротеины (гем)
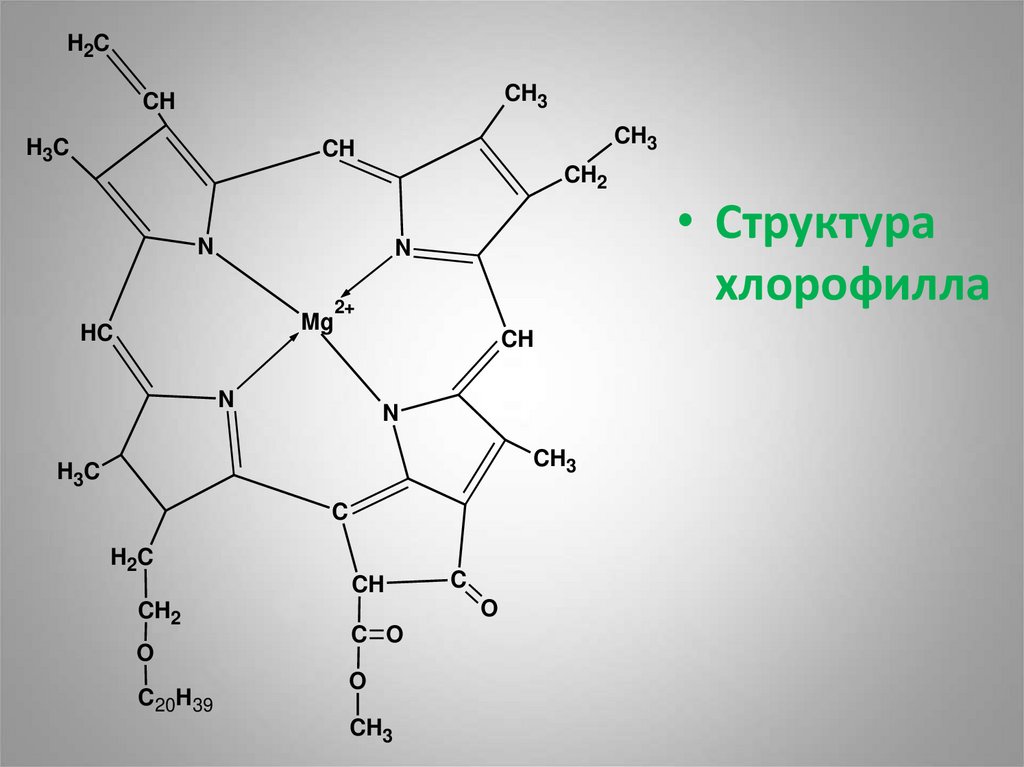
6. Магнийпорфирины – это зелёные хлорофилл содержащие белки. Они образуются в растениях и сине-зелёных водорослях.
Магнийпорфирины – это зелёныехлорофилл содержащие белки. Они
образуются в растениях и синезелёных водорослях.
7.
H2CCH3
CH
H3C
CH3
CH
CH2
N
N
Mg
HC
2+
CH
N
N
CH3
H3C
C
H2C
CH
CH2
O
C20H39
C
O
C O
O
CH3
• Структура
хлорофилла
8.
• Их функция – это преобразование солнечнойэнергии в энергию макроэргических связей
АТФ. Кроме того, именно хлорофилл
инициирует реакцию фотохимического
разложения воды:
2Н2О → О2 +
+
4Н +
4ē
• Благодаря этой реакции в атмосферу
постоянно выделяется кислород, а для
растений О2 – всего лишь побочный продукт.
9. Флавопротеины
• Это жёлтые белки, содержащие рибофлавин.Все они являются ферментами класса
оксидоредуктаз. Играют большую роль в
реакциях окислительного метаболизма.
• Нам они известны, как ФМН- и ФАД-зависимые
дегидрогеназы. Для образования
флавопротеинов организму животных
требуется поступление в достаточном
количестве витамина В2 – рибофлавина.
10.
OHH2C O P O
HO C H OH
HO C H
HO C H
HC H
H3C
CH
N
N
O
C
C
C
C
C
H3C
C
CH
C
N
NH
C
O
• Структура ФМН
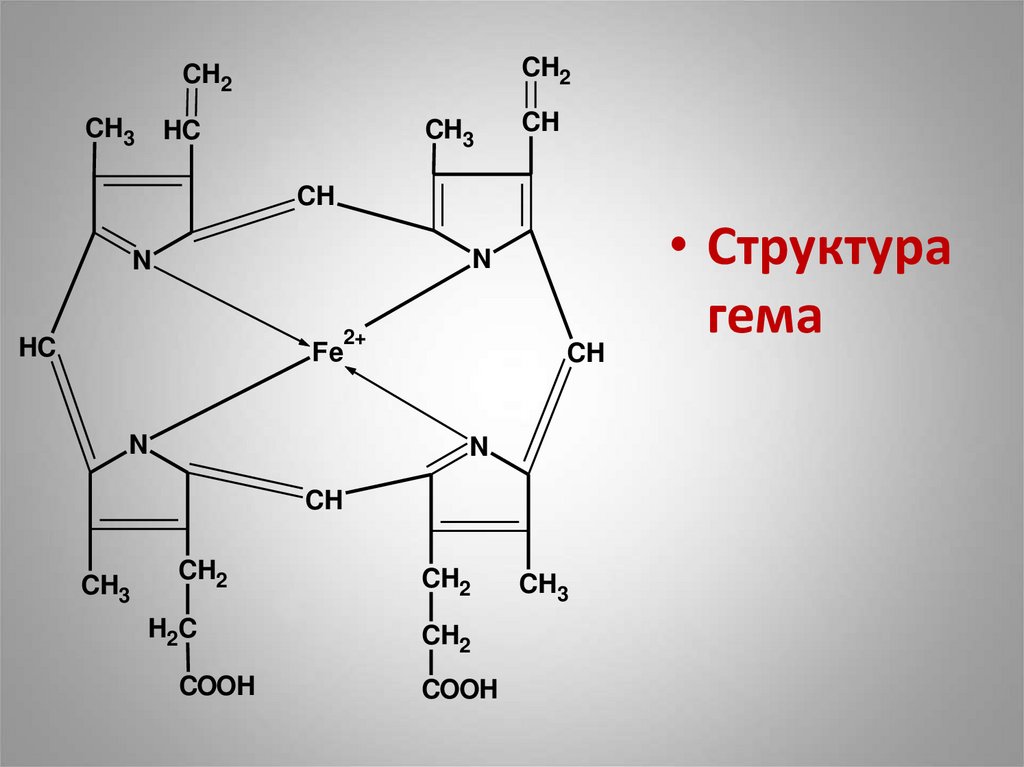
11. Гемопротеины
• В состав гемопротеинов входитгем, который придаёт им красное
окрашивание.
• Гем – тетрапиррольный цикл,
содержащий ион двухвалентного
железа.
12.
CH2CH2
CH3
CH3
HC
CH
CH
N
N
2+
HC
Fe
N
CH
N
CH
CH3
CH2
H2C
COOH
CH2
CH2
COOH
CH3
• Структура
гема
13. 2. Строение и функции гемопротеинов. Гемопротеины подразделяются на:
• Дыхательные белки(гемоглобин, миоглобин)
• Ферменты
14. Гемоглобин – белок четвертичной структуры, тетрамер.
15.
• Два олигомера α-цепей состоят из 141аминокислотных остатка, и два
олигомера β-цепей – из 146
аминокислотных остатка.
• Каждая субъединица нековалентно
связана с гемом. В одной молекуле
гемоглобина содержится 4 гема.
• Молекулярная масса гемоглобина
составляет около 68 000. В одном
эритроците насчитывается до 340 млн.
молекул гемоглобина.
16.
• Атом железа в гемоглобине может быть всостоянии Fe2+ или Fe3+, но только Fe2+
способен переносить кислород. Связывая
кислород, атом железа не меняет
степени окисления.
• Процесс связывания гемоглобина с
кислородом называется оксигенацией.
Одна молекула гемоглобина способна
переносить 4 молекулы кислорода.
Оксигенированный гемоглобин называют
оксигемоглобином.
17.
• Гемоглобин способентранспортировать и углекислый
газ – от тканей к лёгким (в виде
карбогемоглобина). Но
углекислый газ присоединяется к
свободным аминогруппам
молекулы глобина, а не к гему.
18.
• Очень высокое сродство гемоглобина кокиси углерода (СО). При их
взаимодействии образуется устойчивая
молекула карбоксигемоглобина. Она
теряет способность к транспорту
кислорода.
• Гемоглобин в присутствии некоторых
токсикантов окисляется до
метгемоглобина (Fe3+), который также
теряет транспортную функцию.
19. Миоглобин
• Миоглобин (молекулярная масса 16 000,состоит из 153 аминокислот) имеет
третичную структуру, одну
полипептидную цепь, один гем и может
связывать одну молекулу кислорода.
• Функция миоглобина заключается в
создании в мышцах кислородного
резерва, который расходуется по мере
необходимости, восполняя временную
нехватку кислорода.
20. Миоглобин
21. Гем-содержащие ферменты
• Если в составе дыхательныхгемопротеинов степень окисления железа
не меняется, то в составе ферментов
обязательно проявляется переменная
степень окисления железа. Это
необходимо для переноса электронов.
• Все гем-содержащие ферменты относятся
к окислительно-восстановительным (класс
оксидоредуктаз).
22. Важнейшие гем-содержащие ферменты:
• каталаза• цитохромы
• пероксидазы
23. 3. Биосинтез гема
24.
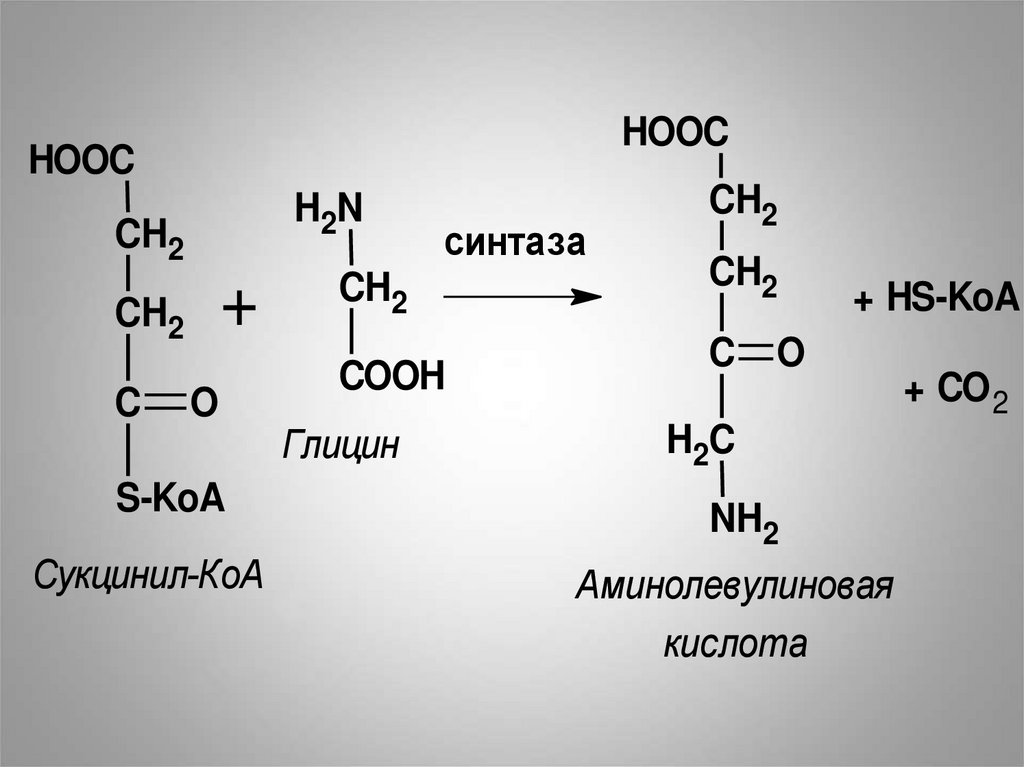
• Гем синтезируется во всех тканях, но снаибольшей скоростью в костном
мозге и печени.
• Первая реакция синтеза гема образование 5-аминолевулиновой
кислоты из глицина и сукцинил-КоА
идёт в матриксе митохондрий.
• Реакцию катализирует фермент
аминолевулинатсинтаза
(содержит витамин В6)
25.
HOOCHOOC
H2N
CH2
+
CH2
C
O
S-KoA
Сукцинил-КоА
синтаза
CH2
COOH
Глицин
CH2
CH2
C
+ HS-KoA
O
H2C
NH2
Аминолевулиновая
кислота
+ CO 2
26.
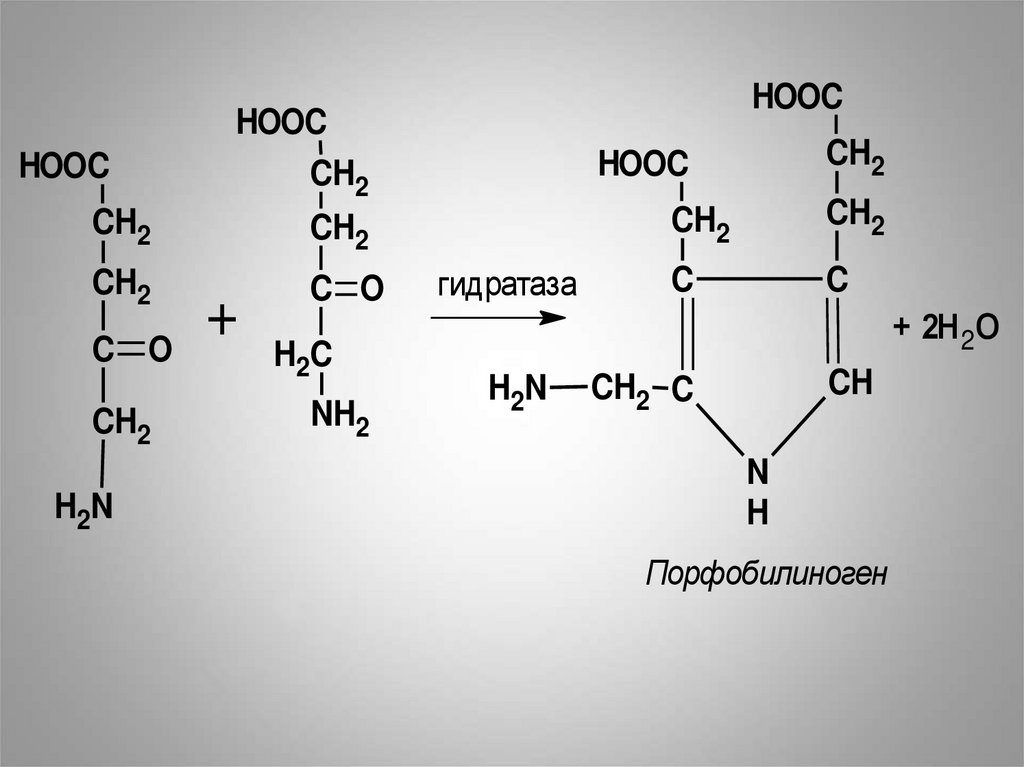
• Из митохондрий 5-аминолевулиноваякислота поступает в цитоплазму. В
цитоплазме проходят промежуточные
этапы синтеза гема. Рассмотрим
следующую реакцию.
• Под влиянием аминолевулингидратазы
происходит конденсация двух молекул
5-аминолевулиновой кислоты с
образованием порфобилиногена и двух
молекул воды.
27.
HOOCHOOC
CH2
CH2
CH2
CH2
C O
C O
CH2
H2N
HOOC
+
H2C
NH2
CH2
HOOC
гидратаза
CH2
CH2
C
C
+ 2Н 2О
H2N
CH
CH2 C
N
H
Порфобилиноген
28.
• Затем происходит рядпоследовательных реакций, в
результате которых образуется
тетрапиррольный цикл –
протопорфирин. Фермент
феррохелатаза, присоединяя к
протопорфирину двухвалентное
железо, превращает его в гем.
29.
CH2CH2
CH3
CH3
HC
CH
CH
N
N
2+
HC
Fe
N
CH
N
CH
CH3
CH2
H2C
COOH
CH2
CH2
COOH
CH3
30.
• Источником железа для синтезагема служит депонирующий железо
белок ферритин. Синтезированный
гем, соединяясь с α и βполипепептидными цепями
глобина, образует гемоглобин.
• Гем регулирует синтез глобина: при
снижении скорости синтеза гема
синтез глобина в ретикулоцитах
тормозится.
31. 4. Распад гемопротеинов
32.
• Рассмотрим распад хромопротеинов напримере гемоглобина, который
количественно превосходит все другие белки
этой группы.
• Продолжительность существования
эритроцитов в крови животного составляет
90–120 суток, а затем они разрушаются с
освобождением молекул гемоглобина.
• Их катаболизм происходит главным образом
в ретикулоэндотелиальных клетках
селезёнки, лимфатических узлов, костного
мозга и печени.
33.
• В течение суток в организмеживотного разрушается 1–2 %
эритроцитов крови. В одну
секунду в организме животного
разрушаются 3 млн. эритроцитов
крови.
34.
• Распад гема начинается с разрываодного метинового мостика между
двумя пиррольными кольцами с
сохранением на этой стадии атома
железа, глобина и циклической
структуры. Это приводит к получению
вердоглобина.
• Эта реакция катализируется ферментом
гемоксигеназой с участием 2О2 и
НАДФН2
35.
CH2CH2
CH3
CH3
HC
C
HO
O
CH
C
N
N
2+
HC
Fe
N
CH
N
CH
CH3
CH2
H2C
COOH
CH2
CH2
COOH
CH3
36.
• Далее, от вердоглобинаотщепляется ион железа и белок
глобин. В результате образуется
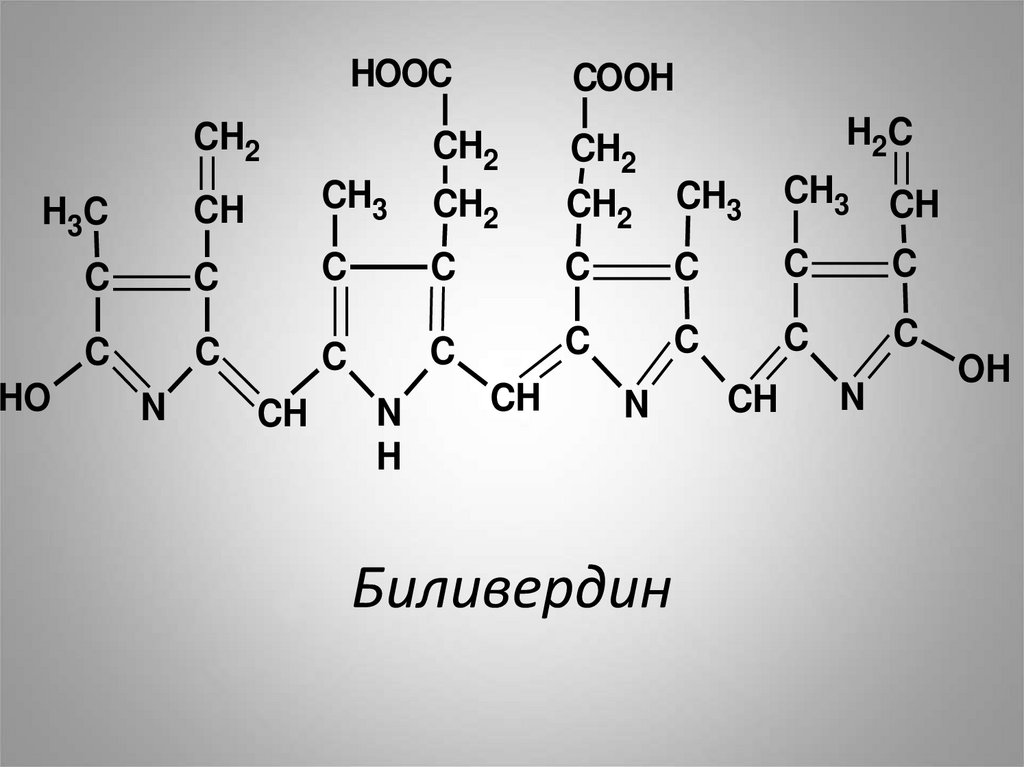
биливердин, который имеет
линейную структуру.
37. Биливердин
HOOCCH2
H3C
HO
C
C
CH2
H2C
CH
CH3
CH2
CH2
CH2
C
C
C
C
C
C
C
C
C
C
C
C
C
N
COOH
C
CH
N
H
CH
N
Биливердин
CH3
CH3
CH
CH
N
OH
38.
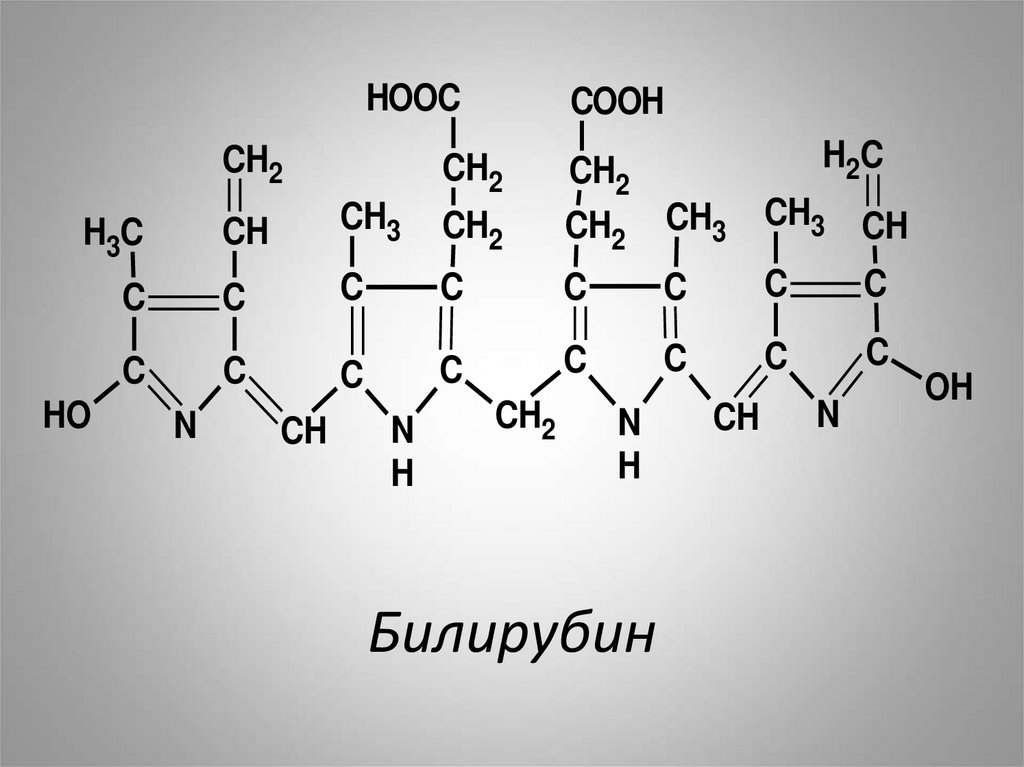
Под влиянием биливердинредуктазы биливердин при
участии НАДФН2
восстанавливается в другой
желчный пигмент –
билирубин:
39. Билирубин
HOOCCH2
CH2
H2C
CH
CH3
CH2
CH2
CH2 CH3
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
H3C
HO
COOH
N
CH
N
H
CH2
N
H
Билирубин
CH
CH3 CH
N
OH
40.
• Образовавшийся в селезенке билирубинпоступает в кровь. Билирубин плохо
растворим в воде, поэтому он связывается
с альбумином и транспортируется в
печень.
• Билирубин в комплексе с альбумином
называется свободный (неконъюгированный) или непрямой билирубин.
Образование таких комплексов не
позволяет выделяться билирубину с
мочой.
41.
• Из сосудистого русла в гепатоциты билирубинпопадает с помощью белков-переносчиков.
• Далее при участии белка лигандина он
транспортируется в ЭПР, где протекает реакция с
участием фермента
УДФ-глюкуронилтрансферазы
Билирубин + УДФ-глюкуроновая кислота
Билирубин-глюкуронид
Кроме глюкуроновой кислоты, в реакцию могут
вступать сульфаты, фосфаты, глюкозиды.
• Билирубин-глюкуронид получил
название связанный (конъюгированный)
или прямой билирубин. Он хорошо растворим в
воде.
42.
• После конъюгациибилирубин секретируются в
желчные протоки, в желчный пузырь
и далее в кишечник.
• В начальных отделах тонкого
кишечника прямой билирубин не
всасывается в кровь.
43.
• В подвздошной и ободочной кишках коньюгатыбилирубина атакуются бактериями и
деконъюгируются.
• Бактериальные ферменты восстанавливают
билирубин до уробилиногена.
• Часть этих продуктов обратно всасывается в
кровь, они вновь попадают в печень и
реэкскретируется через кишечник.
• Лишь 1 – 2 % и них выделяется с мочой. Во
внешней среде происходит их окисление
кислородом воздуха , в результате образуется
уробилин – жёлтый пигмент мочи.
44.
• Уробилиноген в толстом кишечникес помощью бактериальных
ферментов может присоединять
четыре атома водорода и
переходить в стеркобилиноген.
45.
• Большая часть метаболитовбилирубина выводится из организма
через кишечник. Во внешней среде
они окисляются до стеркобилина –
пигмента каловых масс.
46. 5. Клинико-биохимические аспекты метаболизма гемопротеинов.
47. Количество гемоглобина в крови животных разных видов (г/л)
Коровы Лошади СвиньиСобаки
100 – 130
110 – 170 100 – 140
80 – 140
90 – 110
Кошки
Куры
80 - 120
48. Основные причины снижения концентрации гемоглобина:
• Дефицит железа• Дефицит витаминов (В6, В12, фолиевой
кислоты)
• Кровопотери
• Алиментарное истощение
• Почечная недостаточность (терминальная
стадия)
• Злокачественные новообразования
49. Основные причины повышения концентрации гемоглобина:
• Обезвоживание• Гипоксия
50. Концентрация общего билирубина в крови животных разных видов (мкмоль/л)
КоровыЛошади
Свиньи
Собаки
Кошки
0,5 – 10,0
5,5 – 39,0
0,5 – 7,0
0,5 – 5,0
0,3 – 4,0
51. Причины увеличения концентрации билирубина:
• Гемолиз эритроцитов (повышаетсяконцентрация непрямого билирубина)
• Цитолиз гепатоцитов (повышается в
первую очередь прямой билирубин и в
меньшей степени непрямой)
• Нарушение эвакуации желчи, холестаз
(повышается прямой билирубин,
непрямой остаётся в норме). Прямой
билирубин всасывается в кровь из
желчных протоков и желчного пузыря.
52.
• Если билирубин обнаруживается вмоче, то это может быть только
прямой билирубин (непрямой в
мочу не фильтруется, так как
связан с альбумином)















































 Химия
Химия








