Похожие презентации:
Сульфиды и оксиды
1. Сульфиды
4Э + nS = Э4Sn Э = P, AsКлеточная
структура,
растворимы в CS2
1
2. Сульфиды
Э = As, Sb, Bi2ЭCl3 + 3H2S = Э2S3↓ + 6HCl (в р-ре HCl)
Э = As, Sb (Bi2S5 не существует)
2ЭCl5 + 5H2S = Э2S5↓ + 10HCl (в р-ре HCl)
As2S3, As2S5 – желтые
Sb2S3, Sb2S5 – оранжевые
Bi2S3 -черный
2
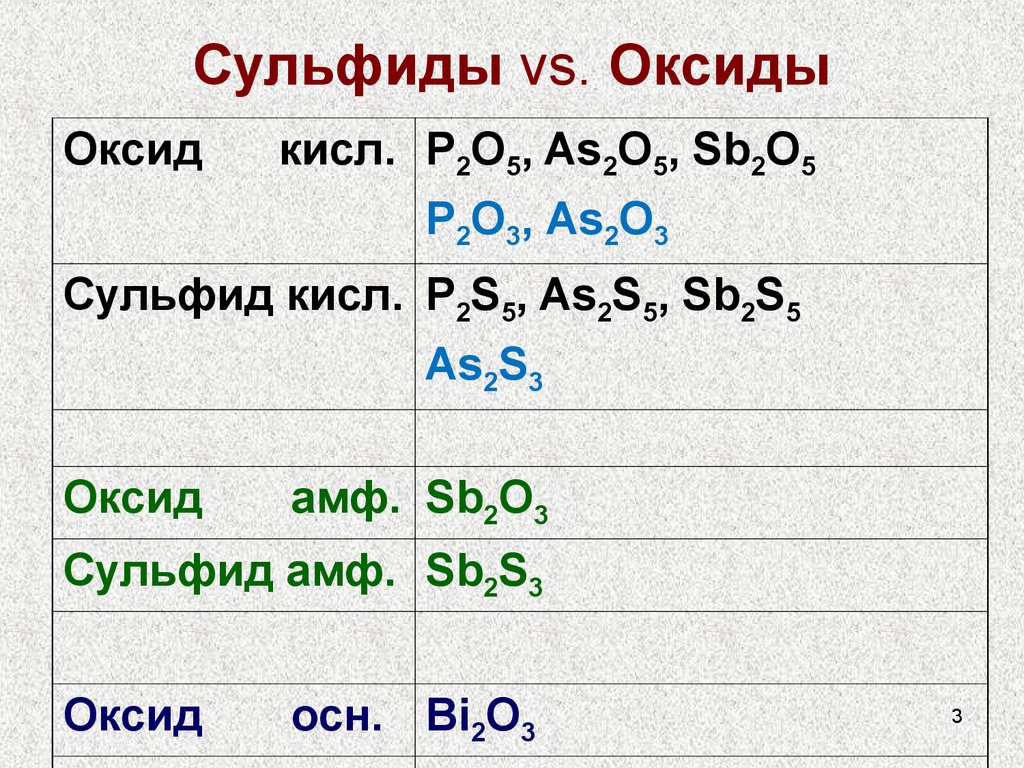
3. Сульфиды vs. Оксиды
Оксидкисл. P2O5, As2O5, Sb2O5
P2O3, As2O3
Сульфид кисл. P2S5, As2S5, Sb2S5
As2S3
Оксид
амф. Sb2O3
Сульфид амф. Sb2S3
Оксид
осн. Bi2O3
3
4. Тиосоли
Взаимодействие кислых оксидов(сульфидов) As и Sb с основаниями:
As2O3 тв. + Na2O тв. = 2NaAsO2 – арсенит
As2S3 тв. + Na2S р-р = 2NaAsS2 – тиоарсенит
Нет взаимодействия!
Bi2O3 тв. + Na2O тв. = нет реакции
Bi2S3 тв. + Na2S р-р = нет реакции
4
5. Тиосоли
Э3+ (Э = P, As, Sb): NaЭS2 и Na3ЭS3метаортоЭ5+ (Э = P, As, Sb): NaЭS3 и Na3ЭS4
метаортоПолучение сплавлением:
3Na + P + 3S = Na3PS3
3Na + P + 4S = Na3PS4
5
6. Тиосоли
Получение в растворе (Э = As, Sb):Э2S3↓+ Na2S = 2NaЭS2
Э2S5↓+ Na2S = 2NaЭS3
Э2S3↓+ Na2S2 = 2NaЭS3 + 2S
окислитель
Реакции с кислотами:
NaAsS2 + HCl = As2S3↓ + H2S + NaCl
As2S3 + 28HNO3 = 2H3AsO4 + 3H2SO4 +28NO2 +8H2O
КОНЦ.
6
7.
Побочнаяподгруппа
V группы
периодической
системы
7
8. Содержание в земной коре и минералы
• V – 22 место, рассеян, VS2.V2S5(патронит)
Добывают из железных руд.
• Nb – 64 место, рассеян и редкий,
M(NbO3)2 (M = Mn, Fe) – колумбит
• Ta – 65 место, рассеян и редкий,
M(TaO3)2 (M = Mn, Fe) – танталит
8
9. Открытие элементов
• V – 1801г. мексиканец Дель Рио, затем в1830 Н. Сефстрёмом - «Ванадис» древнеисландская богиня красоты
• Nb – 1801г. англ. Хатчет в минерале
колумбит и название колумбий.
1844 – Розе от греч. «Ниобея» - дочь
Тантала
• Ta – 1802 г. швед Экеберг, по имени
греческого полубога Тантала.
9
10. Простые вещества
Получение сложное,проблема разделения Nb и Ta
M2O5 + 5Ca = 5CaO + 2M
V – стали, танковая броня
Nb, Ta – химическая
аппаратура
Ta – костная и пластическая хирургия
10
11.
Известный "автомобильный король" Генри Форд сказал:"Если бы не было ванадия" - не было бы автомобиля".
Незначительная добавка (0,2%) ванадия к обычной
стали сообщает ей целый ряд ценных свойств:
увеличивается ее упругость, прочность на истирание и
сопротивление разрыву, что особенно важно для таких
ответственных частей автомобиля, как рессоры, оси,
валы, шестерни. Из ванадиевой стали изготовляют
самые важные детали автомобильных моторов,
цилиндры высокого давления, тормозные колодки. Если
бы не ванадиевая сталь, автомобиль весил бы в два
раза больше, в два раза увеличился бы расход горючего,
износ покрышек, сократился срок службы дорожного
покрытия.
11
12. Простые вещества
Химически инертные2V + 12HF = 2H[VF6] + 5H2
V + 6HNO3 = [VO2]NO3 + 5NO2 + 3H2O
3V + 5HNO3 + 3HCl = 3[VO2]Cl + 5NO+ 4H2O
Nb,Ta + царская водка = нет реакции
Nb + 5HNO3 + 7HF = H2[NbF7] +5NO2 +5H2O
[TaF8]34M + 12KOHрасплав + 5O2 = 4K3MO4 + 6H2O
12
13. ВАНАДИЙ
2+ VOосновные
3+ V2O3
свойства
H2SO4
VSO4
V2(SO4)3
[VO]SO4 сульфат ванадила
4+ VO2
K4V4OKOH
ванадит калия
9
[VO2]ClHCl
5+ V2O5
KOH
KVO3, K
3VO4
[VO]Cl2 + Cl2
HCl(к.)
ванадаты
13
14. Кислородные соединения V5+
V2O5 + H2O = 2HVO3 (V2O5*xH2O↓)(равновесие влево)
V2O5 + 2NaOH = 2NaVO3 + H2O (медленно в растворе,
быстро в расплаве), Na3VO4
2HVO3 + 2HXконц. = 2[VO2]X + 2H2O
X = 1/2SO42-, NO3Катализаторы на основе V2O5 , заменили платину при производстве
серной кислоты
14
15.
IV группапериодической
системы
15
16. C, Si, Ge, Sn, Pb
17. Распространенность и минералы
C – 11 место, CO2, CaCO3 (известняк, кальцит,мрамор), уголь, нефть, прир. газ
Si – 2 место; SiO2 (кремнезем, кварц),
силикаты, алюмосиликаты
Ge – 54 место, Cu3GeS4 (германит)
Sn – 27 место, SnO2 (касситерит)
Pb – 60 место, PbS (галенит), PbSO4, PbCO3
17
18. Открытие элементов
• C –известен с древнейших времен; лат.«карбон» - уголь
• Si – 1883 г., швед Берцелиус; от лат.
«силекс» - кремень
• Ge - предсказан Менделеевым
в 1871 г., открыт нем. Винклером в 1885
г., в честь Германии
• Sn – известен давно, от лат. «станнум» стойкий
• Pb – известен давно, происхождение
названия не ясно
18
19. Аллотропные модификации С
Алмаз, d(С-С) = 1,54 ÅГрафит, d(С-С) = 1,42 Å
sp3 гибридизация
sp2 гибридизация
С(графит) = С (алмаз) (T, P, катализатор)
rG = +2,9 кДж/моль
o
19
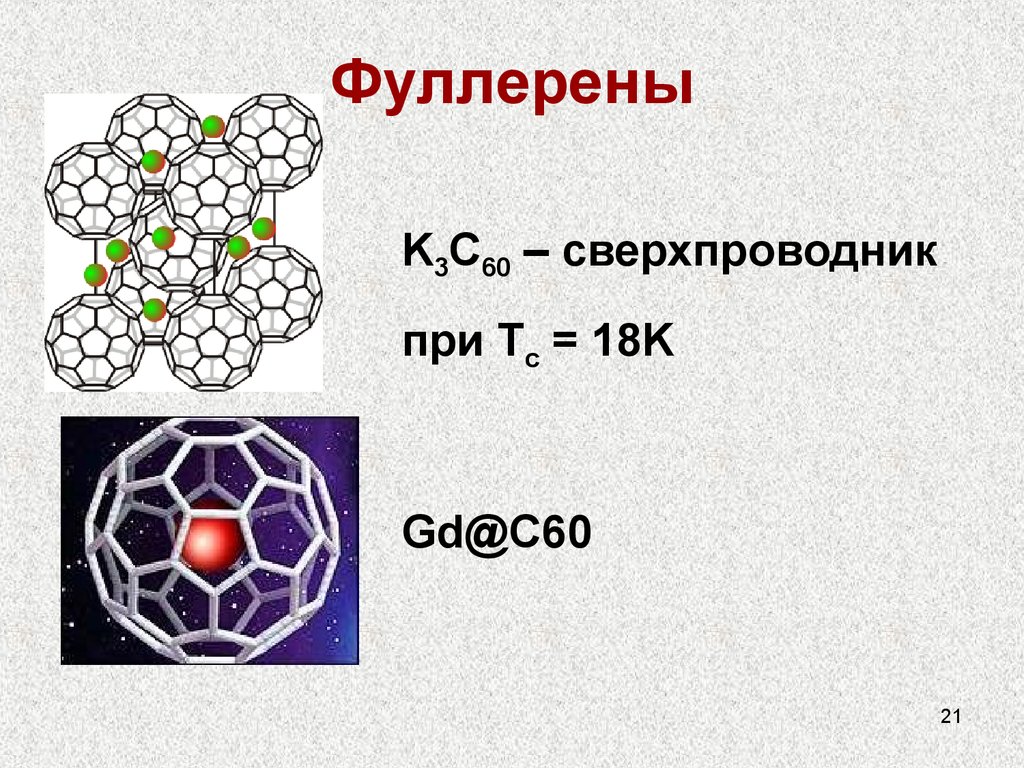
20. Фуллерены
С60Открыты в 1980 г., Нобелевская премия по химии
ПОЛУЧЕНИЕ: Электрическая дуга между
угольными электродами, далее сложная очистка
Молекулярная структура, растворимы в
органических растворителях
Сочетание 5-ти и 6-ти членных циклов
20
21. Фуллерены
K3C60 – сверхпроводникпри Tc = 18K
Gd@C60
21
22. Углеродные нанотрубки и луковицы
Углеродные нанотрубки – однослойные имногослойные; открытые и закрытые; модификация
поверхности и интеркалирование.
- Графен
Нобелевская премия по физике (2010)
23. Карбиды
Ионные – щелочные и щелочноземельныеметаллы и Al.
Металлоподобные – d и f металлы,
металлический блеск, проводимость, очень
твердые. WC – режущие инструменты,
аппаратура высокого давления. Fe3C –
составная часть чугуна и стали.
Ковалентные – B4C (правильнее B12C3) и SiС
(карборунд, структура алмаза, хрупкий),
очень твердые
23
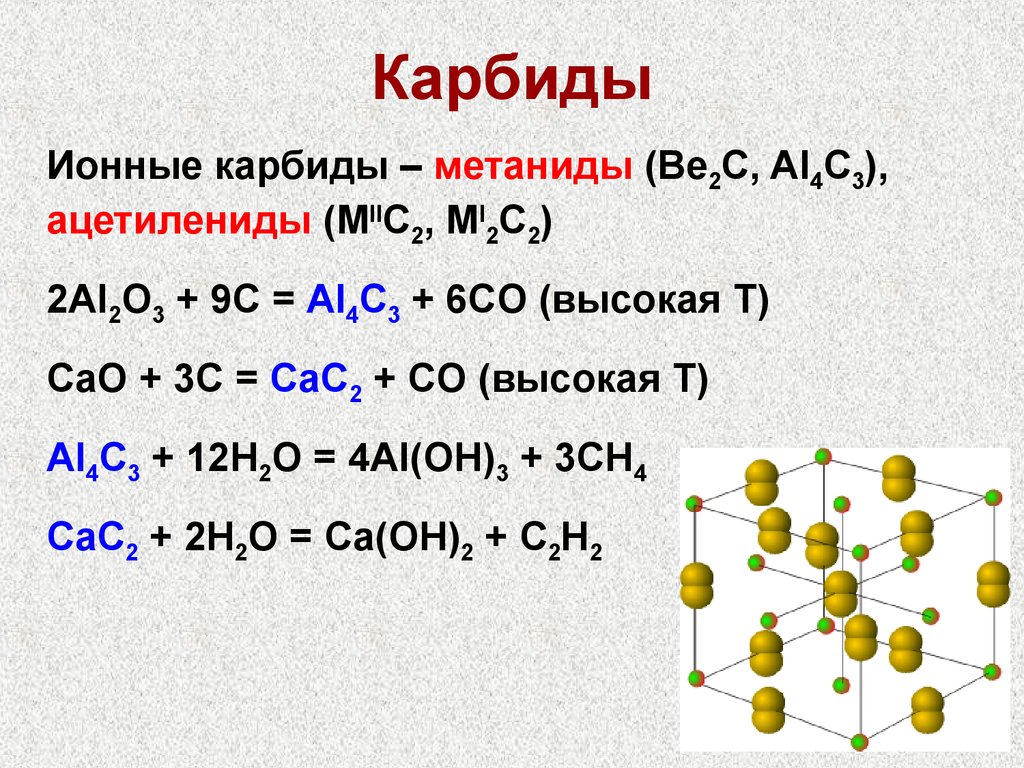
24. Карбиды
Ионные карбиды – метаниды (Be2C, Al4C3),ацетилениды (MIIC2, MI2C2)
2Al2O3 + 9C = Al4C3 + 6CO (высокая Т)
CaO + 3C = CaC2 + CO (высокая Т)
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
CaC2 + 2H2O = Ca(OH)2 + C2H2
24
25. СО (угарный газ)
Получение в промышленностиCO2 + C кокс = 2CO (при Т)
С + H2O = CO + H2 (при Т)
Получение в лаборатории
HCOOH = СO + H2O ( в конц. H2SO4)
H2C2O4 = СO + CO2 + H2O ( в конц. H2SO4)
25
26. Cвойства СО
Солеобразующий оксид:CO+NaOHр-р= HCOONa (120oC, 5 атм.)
Восстановительные свойства:
2CO + O2 = 2CO2
СO + PdCl2 + H2O = Pd + CO2 + 2HCl
Комплексы (карбонилы):
Ni + CO = Ni(CO)4
Fe + 5CO = Fe(CO)5
26
27. СO2
Получение в промышленности:СaCO3 = CaO + CO2 (1000oC)
Получение в лаборатории:
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
(в аппарате Киппа)
СВОЙСТВА:
Окислитель: Активные металлы (Mg, Na, K)
горят в СО2
2Mg + CO2 = 2MgO + C
27
28. Карбонаты и гидрокарбонаты
Растворимость в воде: 1V CO2 в 0,9V H2OКислотные св-ва: СO2 + H2O = H2CO3
(Ka1 = 4.10-7, Ka2 = 5.10-11)
2NaOH изб. + CO2 = Na2CO3 (техническая сода)
NaOH + CO2 изб. = NaHCO3 (питьевая сода)
Растворимые соли: Na+, K+, NH4+
Нерастворимые соли MCO3 (M = Mg, Ca, Cu, Zn,
Pb, Ba)
Растворимые карбонаты слабых оснований
(M= Al, Fe, Cr) гидролизуются полностью: 28
3+
2-
29. Галогениды и оксогалогениды
CX4, X = F, Cl, Br, I (газ -- твердое),не реагируют с водой
(хотя термодинамически эти реакции разрешены)
СCl4 + 4Na = 4NaCl +C (ВЗРЫВ)
СO + Cl2 = COCl2
Фосген - газ, сильно ядовит
COCl2 + H2O = CO2 + 2HCl
29

























 Химия
Химия