Похожие презентации:
Радиоактивность как свидетельство сложного строения атома
1. Радиоактивность как свидетельство сложного строения атома
2.
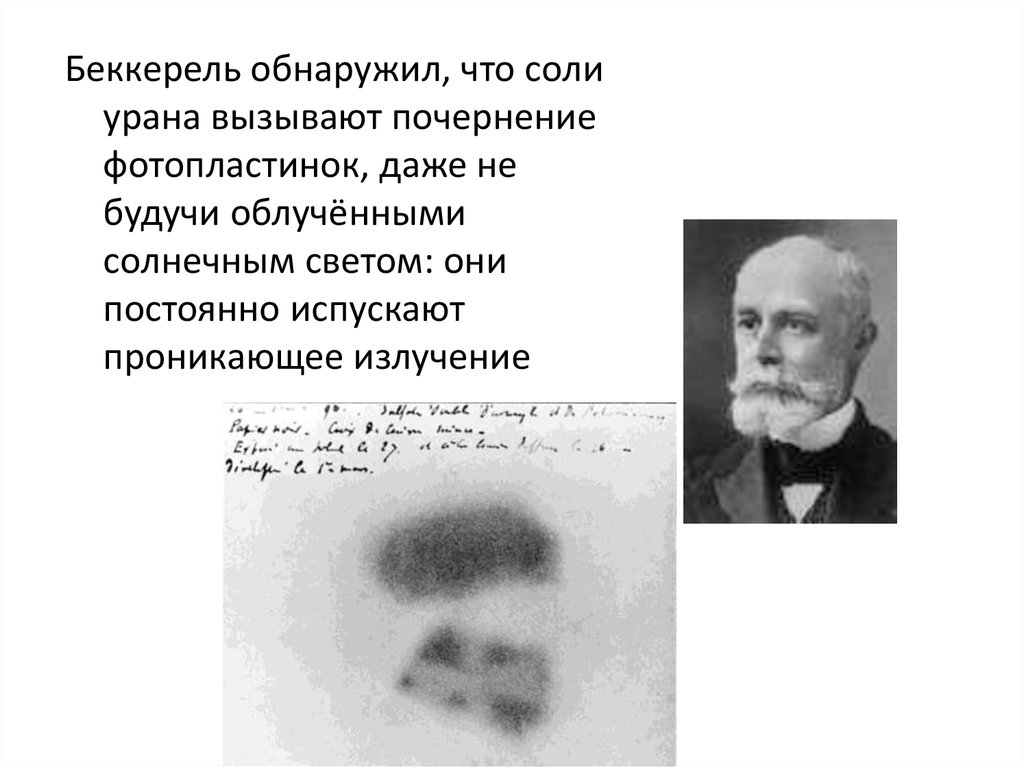
Беккерель обнаружил, что солиурана вызывают почернение
фотопластинок, даже не
будучи облучёнными
солнечным светом: они
постоянно испускают
проникающее излучение
3.
Историю возникновения самых общихпредставлений об атоме обычно
ведут со времен греческого
философа Демокрита (ок. 460 – ок.
370 до н. э.), много размышлявшего
о наименьших частицах, на которые
можно было бы поделить любое
вещество.
римский поэт и философ Лукреций
Кар, изложил учение в поэме «О
природе вещей», благодаря которой
оно и сохранилось для следующих
поколений.
4.
• В 1897-1898 гг. французскиеучёные Пьер Кюри и Мария
Склодовская –Кюри установили,
что испускание уранового
излучения является свойством
атома урана; это свойство не
зависит от того, в каком
соединении находится уран. В
1898 г. супруги Кюри
обнаружили, что таким же
свойством обладает и другой
элемент – торий.
5. Строение атома
• Джозеф Джон Томсон в 1903г. Предложил модель атома,
согласно которой атомы
представляют собой
однородные шары из
положительно заряженного
вещества, в котором
находятся электроны.
Суммарный заряд электронов
равен положительному
заряду атома.
6. Строение атома
Резерфорд• Внутри атома
находится ядро,
состоящее из
протонов и нейтронов
- нуклонов
7.
Опыт Резерфорда в 1906 году.Зондирование атома при помощи альфа-частиц.
(Исследование распределения положительного заряда,
а значит и массы внутри атома)
8.
Результаты эксперимента:Положительный заряд атома сосредоточен
в малом ядре.
Размер ядра порядка 10-12 см
Размер атома – 10-8 см
9. Резерфорд предложил планетарную модель атома
1. атомы состоят изположительно заряженной
части – ядра
2. В состав ядра входят
положительно заряженные
протоны и нейтральные
нейтроны
3. Вокруг ядра вращаются
электроны, образующие
электронную оболочку
10. Число протонов – зарядовое число Z Число нейтронов – N Число нуклонов A=Z+N – массовое число
АХZ
11.
Атом потерявший или приобретший один илинесколько электронов уже не будет
нейтральным и превратится в
положительный или отрицательный ион
12.
Атомы очень малы – их размеры порядка 10–10–10–9 м, а размеры ядра еще примерно в 100
000 раз меньше (10–15–10–14 м).
Поэтому атомы можно «увидеть» только
косвенным путем, на изображении с очень
большим увеличением (например, с помощью
автоэлектронного проектора).
Но и в этом случае атомы не удается рассмотреть
в деталях. Наши знания об их внутреннем
устройстве основаны на огромном количестве
экспериментальных данных, которые
косвенно, но убедительно свидетельствуют в
пользу сказанного выше.
13.
• http://www.youtube.com/watch?v=P7ojSW5pODk
http://www.youtube.com/watch?v=OKnpPCQ
yUec
14.
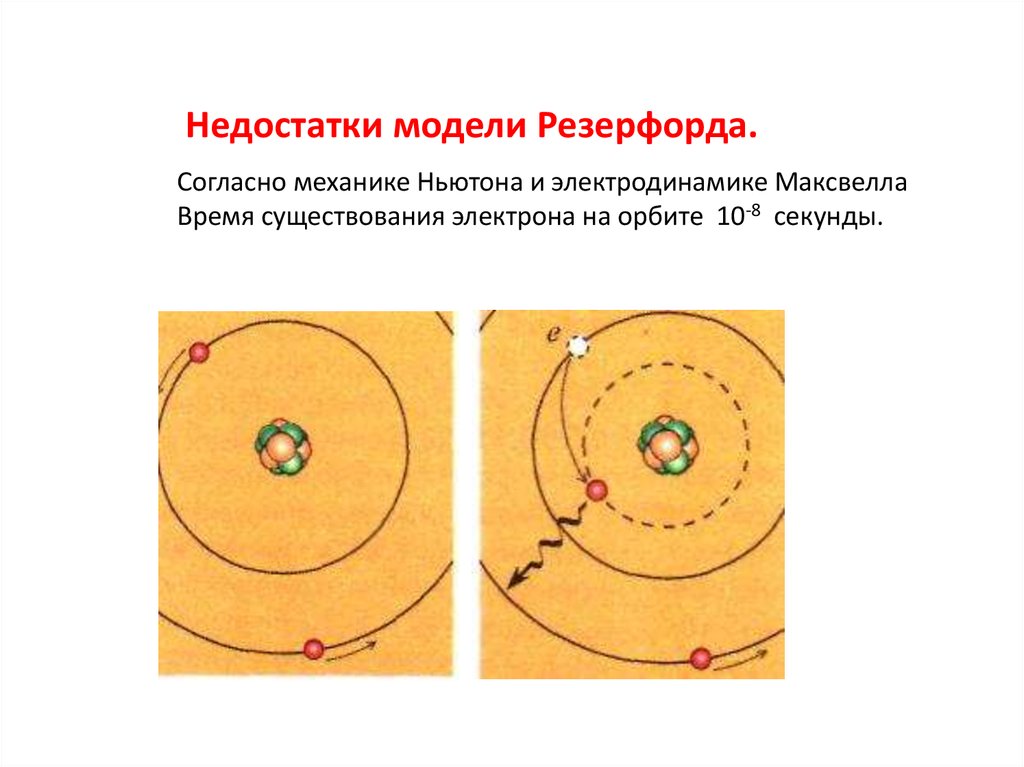
Недостатки модели Резерфорда.Согласно механике Ньютона и электродинамике Максвелла
Время существования электрона на орбите 10-8 секунды.
15. Теория Бора
• Согласно классической механике,движущиеся с ускорением вокруг ядра
электроны должны излучать
электромагнитные волны и терять энергию.
16.
1. Атомы движутся только поопределенным стационарным
орбитам
2. При переходе с одной
стационарной орбиты на другую
атом излучает или поглощает
электромагнитное излучение
определенной частоты
17. Спектры излучения и поглощения
Каждому цвету соответствуетэлектромагнитное излучение
определенной частоты
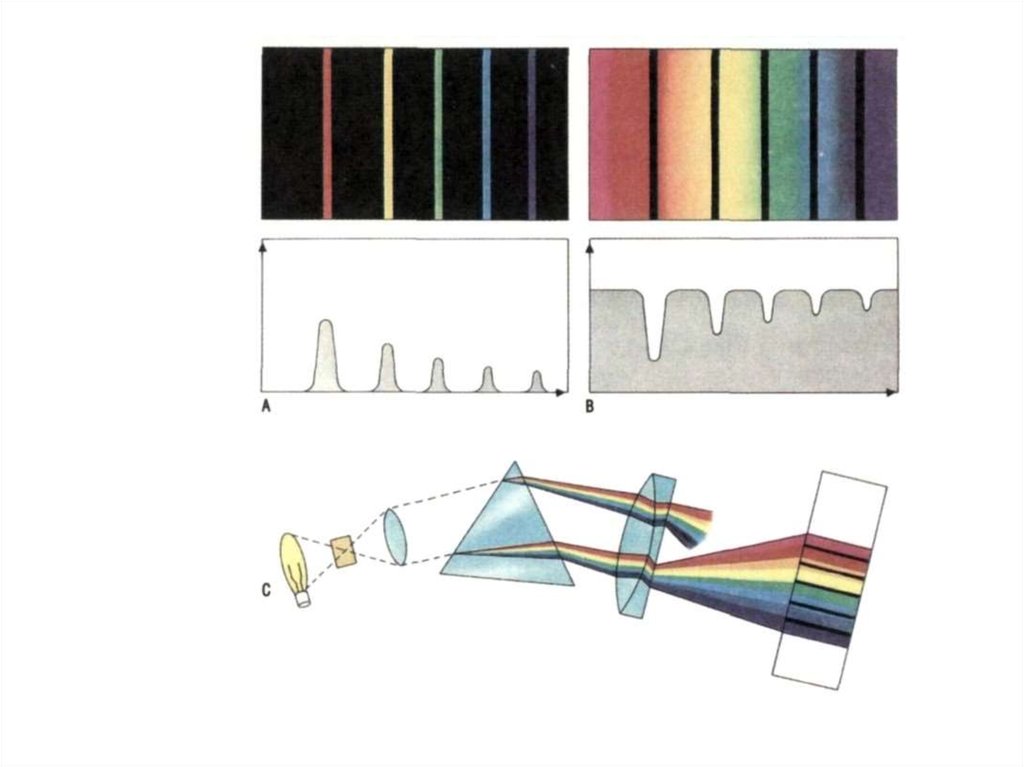
18. Спектры бывают
1. Сплошные – излучают раскаленныетвердые и жидкие тела
19. Спектр излучения натрия
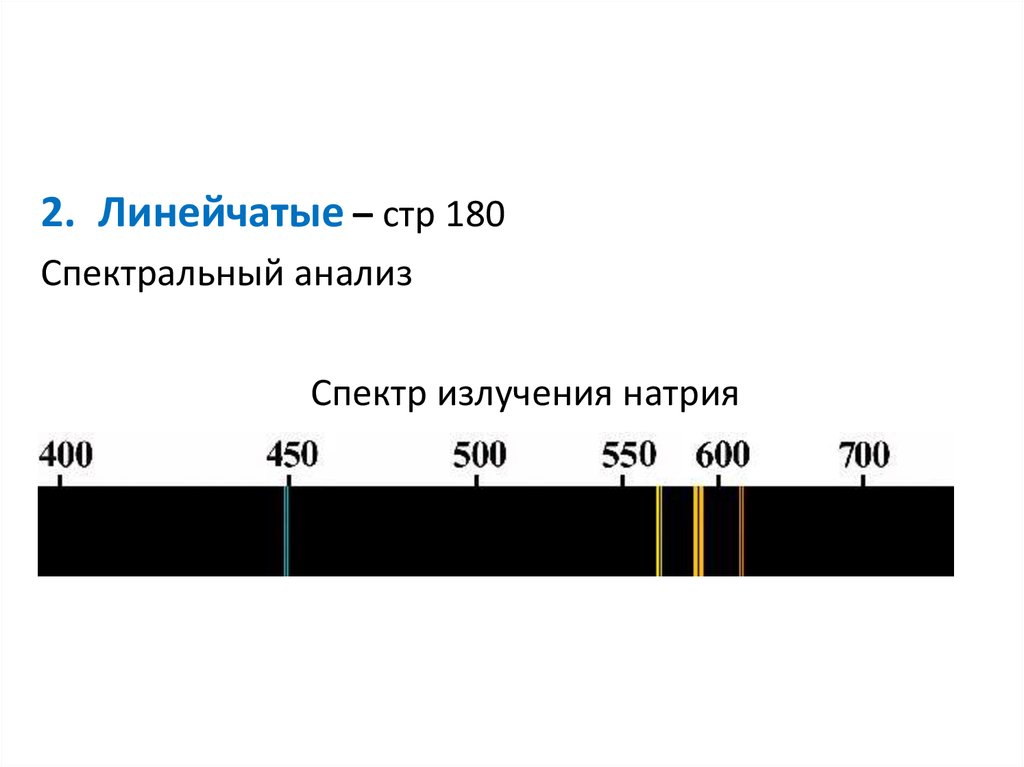
2. Линейчатые – стр 180Спектральный анализ
Спектр излучения натрия
20.
3. Полосатый- Состоит из отдельных цветныхполос, разделенных темными
промежутками. Эти полосы представляют
собой совокупность большого числа близко
расположенных линий, сливающихся
между собой.
21. Спектры поглощения
• Стр 182Йозеф Фраунгофер
22.
23.
• Атомы любого химического элемента даютспектр, непохожий на спектры всех других
элементов: они способны излучать и
поглощать строго определенный набор
длин волн.
На этом основан спектральный анализ метод определения химического состава
вещества по его спектру.
24.
• Медики давно обратиливнимание на то, что многие
болезни связаны с
недостаточностью
поступления и содержания в
организме определенных
макро- и микроэлементов.
Спектральный анализ волос
позволяет определить
содержания этих элементов
в организме человека.
Исследуя с помощью
спектрального анализа
волосы, срезанные в разное
время с головы Наполеона,
установили, что во время
пребывания на острове
Святой Елены его отравили
мышьяком, подмешивая в
небольших дозах в пищу.
25. С учебником
1. С помощью какихприборов наблюдают
спектры?
2. Почему спектры
представляют собой
линии, а не круги, пятна...?
3. Как по виду спектра
узнают, что он
принадлежит данному
химическому элементу?
1. В каком состоянии находятся
вещества, излучающие
линейчатый, полосатый,
сплошной спектр?
2. Какого типа спектр будет
получен от пламени свечи,
электрической лампы,
звезды? Почему?
3. Почему для получения
спектра поглощения натрия
поглощающие пары натрия
должны быть холоднее, чем
источник, излучающий
белый свет?
26.
1. На основании каких опытов возниклопредположение о сложном строении
атома?
2. Какие модели строения атома
существовали 100 лет назад?
3. Что такое спектральный анализ?
27. Атомное ядро. Радиоактивность
1. атомы состоят изположительно заряженной
части – ядра
2. В состав ядра входят
положительно заряженные
протоны и нейтральные
нейтроны
3. Вокруг ядра вращаются
электроны, образующие
электронную оболочку
28. Число протонов – зарядовое число Z Число нейтронов – N Число нуклонов A=Z+N – массовое число
АХZ
29.
Масса протона почти равна массе нейтронаМасса электрона
Заряд протона равен заряду электрона
30.
• В 1897-1898 гг. французскиеучёные Пьер Кюри и Мария
Склодовская –Кюри установили,
что испускание уранового
излучения является свойством
атома урана; это свойство не
зависит от того, в каком
соединении находится уран. В
1898 г. супруги Кюри
обнаружили, что таким же
свойством обладает и другой
элемент – торий.
31.
• В 1899 г. английский физик ЭрнестРезерфорд обнаружил неоднородность
уранового излучения: в магнитном поле
лучи разделяются таким образом, что
можно выделить две составляющих,
соответствующих потокам частиц с
положительными и отрицательными
зарядами.
• Поль Виллард в 1900 г. выделил ещё
один тип: лучи, не отклоняющиеся
магнитным полем.
• Резерфорд предложил обозначать эти
излучения первыми буквами греческого
алфавита: альфа-лучи, бета-лучи и
гамма-лучи
32. α-лучи представляют собой поток ядер гелия 2Не4
α-лучи обладают малой проникающейспособностью. Даже лист бумаги
толщиной 0,1мм для них непрозрачен
33. β-лучи – отрицательно заряженные частицы -1е0
Проникают сквозь алюминиевуюфольгу толщиной несколько мм.
Сильно отклоняются в магнитном и
электрическом поле
34. γ-лучи нейтральное излучение по свои свойствам схожее с рентгеновским
Проникает сквозь слой свинца толщиной в 1см.
γ-лучи – это электромагнитные волны с
длиной волны от 10-10 до 10-13м
35. Атомное превращение при α- излучении
MX
N
→ N-2YM-4 + 2Не4
Где Х -начальное вещество
У- вещество, получившееся в
результате превращения
N- зарядовое число
М- массовое число
36. Письменно
1. Запишите реакцию α-распада радия иобъясните, что обозначает каждый символ
2. Как называются верхние и нижние числа,
стоящие рядом с буквенным
обозначением элемента?
3. На примере α-распада радия объясните в
чем заключаются законы сохранения
заряда и массового числа?
37. Прочитайте параграф 18-19 и ответьте на вопросы
• Перечислите факты и явления подтверждающиесложное строение атома
• Как называется способность атомов некоторых
химических элементов к самопроизвольному
излучению?
• Как были названы частицы, входящие в состав
радиоактивного излучения?
• Какая часть атома – ядро или электронная оболочка –
претерпевают изменения в при радиоактивном
распаде?
• О чем свидетельствует явление радиоактивности?
• Какое из видов изучений α- β- γ- не отклоняется
электрическим и магнитными полями?
38. Вопросы
• Чем отличаются друг от друга атомы разныххимических элементов?
• Что является главной характеристикой
определенного химического элемента?
• Какие частицы входят в состав ядра? Как
образуются положительные и отрицательные
ионы?
• Почему масса водорода ненамного отличается
от массы протона? Намного ли отличаются
размеры протона и атома водорода?



































 Физика
Физика








