Похожие презентации:
Физические основы термодинамики
1. Физические основы термодинамики
12.
Первое начало термодинамикиЗакон сохранения энергии для макроскопических
явлений, в которых одним из существенных параметров,
определяющих состояние тел, является температура.
Возможны два способа передачи энергии от
термодинамической системы к внешним телам:
• с изменением внешних макропараметров системы;
• без изменения внешних макропараметров системы.
2
3.
Способ передачи энергии, связанный с изменениемвнешних макропараметров системы, называется работой;
без изменения внешних макропараметров, но связанный с
изменением нового термодинамического параметра
(энтропии), называется теплообменом.
Затрачиваемая работа (A) может пойти на
увеличение любого вида энергии; количество теплоты (Q)
может пойти непосредственно только на увеличение
внутренней энергии системы.
A и Q – имеют размерность энергии – Джоуль; не
являются видами энергии, а представляют собой два
различных способа передачи энергии и характеризуют
процесс энергообмена между системами.
3
4.
Принято считать, что A > 0, если она совершаетсясистемой над внешними телами;
Q > 0, если энергия передается системе.
Работа, совершаемая системой при бесконечно
малом изменении объема dV:
F
A Fdx dxS PdV
S
S – площадь поршня;
P – давление газа в сосуде;
dV=Sdx – изменение объема
сосуда при перемещении
поршня dx.
4
5.
Величины δA и δQ бесконечно малы, но не являютсяполными дифференциалами, т.к. Q и А задаются не
начальным и конечным состояниями системы, а
определяются процессом, происходящим с системой.
2
A
A
A
2
1
1
2
Q
Q
Q
2
1
1
5
6.
Внутренняя энергияЭнергия, связанная с внутренними движениями
частиц системы и их взаимодействиями между собой,
называется внутренней.
Величина внутренней энергии складывается из
кинетической энергии хаотического движения молекул и
потенциальной энергии их взаимного расположения:
U = Eкин + Евз
Для идеального газа, состоящего из N молекул:
3
U N kT
2
6
7.
Внутренняя энергия (U) – однозначная функциясостояния термодинамической системы: изменение
внутренней энергии ΔU при переходе системы из
состояния 1 в состояние 2 не зависит от вида процесса
перехода и равно: ΔU = U2 – U1.
Бесконечно малое изменение внутренней энергии
dU для идеального газа:
mi
dU
RdT
2
dU
> 0, если внутренняя энергия системы
увеличивается.
7
8.
Закон сохранения энергии для систем, в которыхсущественную роль играют тепловые процессы,
называется первым началом термодинамики:
Q dU A
Q U A
8
9.
ТеплоемкостьТеплоёмкость
тела
характеризуется
количеством теплоты, необходимой для нагревания
этого тела на один градус:
dQ
C
dT
Размерность
[C] = Дж/К.
теплоемкости:
Удельная теплоёмкость (с) – количество
теплоты, необходимое для нагревания единицы
массы вещества на один градус.
[с] = Дж/кг·К.
9
10.
Для газов удобно пользоваться молярнойтеплоемкостью сμ количество теплоты,
необходимое для нагревания 1 моля газа на 1
градус:
сμ = с· μ
Теплоёмкость термодинамической системы
зависит от того, как изменяется состояние системы
при нагревании.
Если газ нагревать при постоянном объёме,
то всё подводимое тепло идёт на нагревание газа,
то есть изменение его внутренней энергии.
Теплоёмкость в этом случае обозначается СV.
10
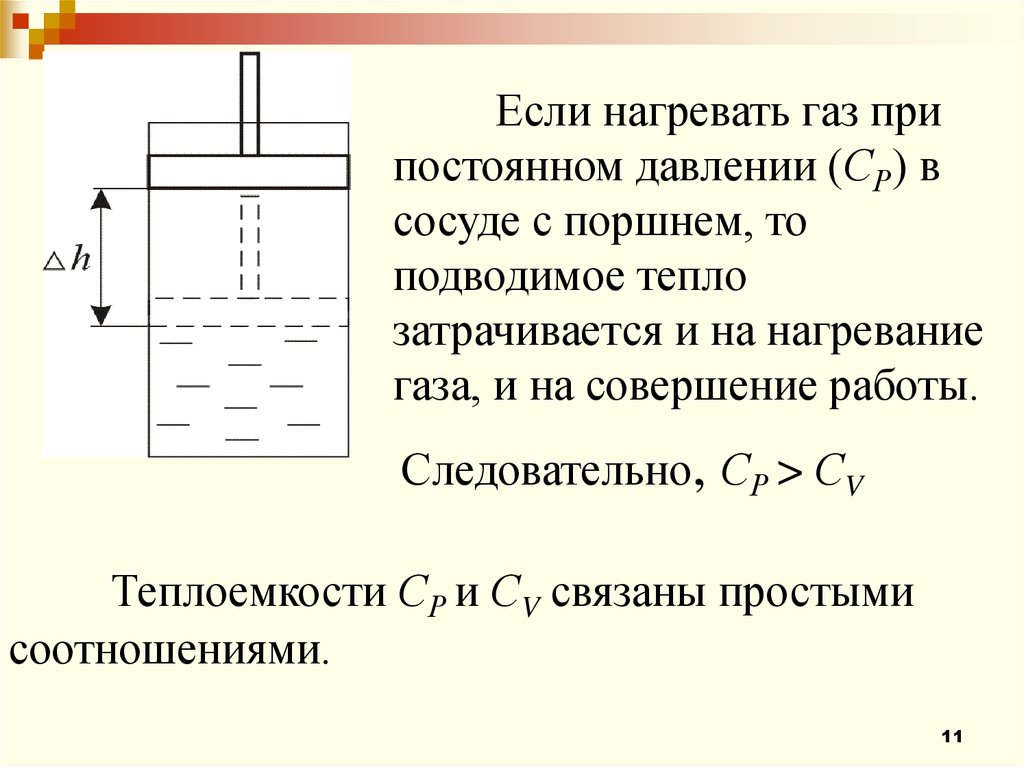
11.
Если нагревать газ припостоянном давлении (СР) в
сосуде с поршнем, то
подводимое тепло
затрачивается и на нагревание
газа, и на совершение работы.
Следовательно, СР > СV
Теплоемкости СР и СV связаны простыми
соотношениями.
11
12.
При нагревании одного моля идеального газапри постоянном объёме:
d'Q = dU
(d'А = 0)
d Q – бесконечно малое приращение количества теплоты, равное приращению внутренней
энергии dU.
d Q dU μ
CV
.
dT
dT
dUμ = CV dT
12
13.
TU μ CV dT CV T
U = CV T.
0
Формула справедлива для любого процесса,
т.к. внутренняя энергия идеального газа является
только функцией Т (и не зависит от V, Р и тому
подобных).
Для произвольной массы идеального газа:
m
U CV T
μ
13
14.
При изобарическом процессе кромеувеличения внутренней энергии происходит
совершение работы газом:
d QP = dUμ + РdVμ
dVμ
d QP dU μ
Cp
P
dT
dT
dT
Из основного уравнения МКТ имеем:
РVμ = RT
14
15.
СР = СV + R.- уравнение Майера для одного моля газа
Используя это соотношение, Роберт Майер в
1842 г. вычислил механический эквивалент
теплоты: 1 кал = 4,19 Дж.
СР СV R
μ
μ μ
R
сР сV .
15
16.
Применение первого началатермодинамики к изопроцессам
Изопроцесс – процесс, проходящий при
постоянном значении одного из основных
термодинамических параметров – P, V или Т.
► Изотермический процесс – процесс,
происходящий в физической системе при
постоянной температуре (T = const).
В
идеальном газе при изотермическом
процессе произведение давления на объем
постоянно – закон Бойля Мариотта:
PV const при T const .
16
17.
При изотермическом процессе внутренняяэнергия газа не изменяется, поэтому все
подводимое тепло идет на совершение газом
работы:
V2
V2
m
V2
dV
RT1ln
А PdV RT1
V
V
1
V1
V1
m
Q A
17
18.
► Изохорический процесс – процесс,происходящий в физической системе при
постоянном объеме (V = const).
P const при V const
T
- закон Шарля
При изохорическом процессе механическая
работа газом не совершается.
Q U
18
19.
► Изобарический процесс – процесс,происходящий в физической системе при
постоянном давлении (P = const).
V
T
const при P const
- закон ГейЛюссака
Q U А
19
20.
► Адиабатный процесс – процесс,происходящий в физической системе без
теплообмена с окружающей средой (Q = 0).
PV const
CP i 2
CV
i
уравнение Пуассона.
γ – показатель адиабаты.
А U
20
21.
Политропический процессПолитропический
процесс
–
процесс,
протекающий при постоянной теплоёмкости,
c = const.
pV const , n
n
c cp
c cV
,
где n - показатель политропы.
21
22.
Все изопроцессы являются частным случаемполитропического процесса:
pV const , n адиабата.
pV const , n 1 изотерма .
p const , n 0 изобара .
1
n
pV const , p V const ,
n
n V const изохора.
22
23.
Второе начало термодинамики.Цикл Карно с идеальным газом.
I начало термодинамики – закон сохранения и
превращения энергии в тепловых процессах.
I
начало термодинамики не указывает
направление протекания процесса, поэтому его
недостаточно
для
описания
термодинамических
процессов.
Это
и
определяет неполноценность I
начала
термодинамики.
23
24.
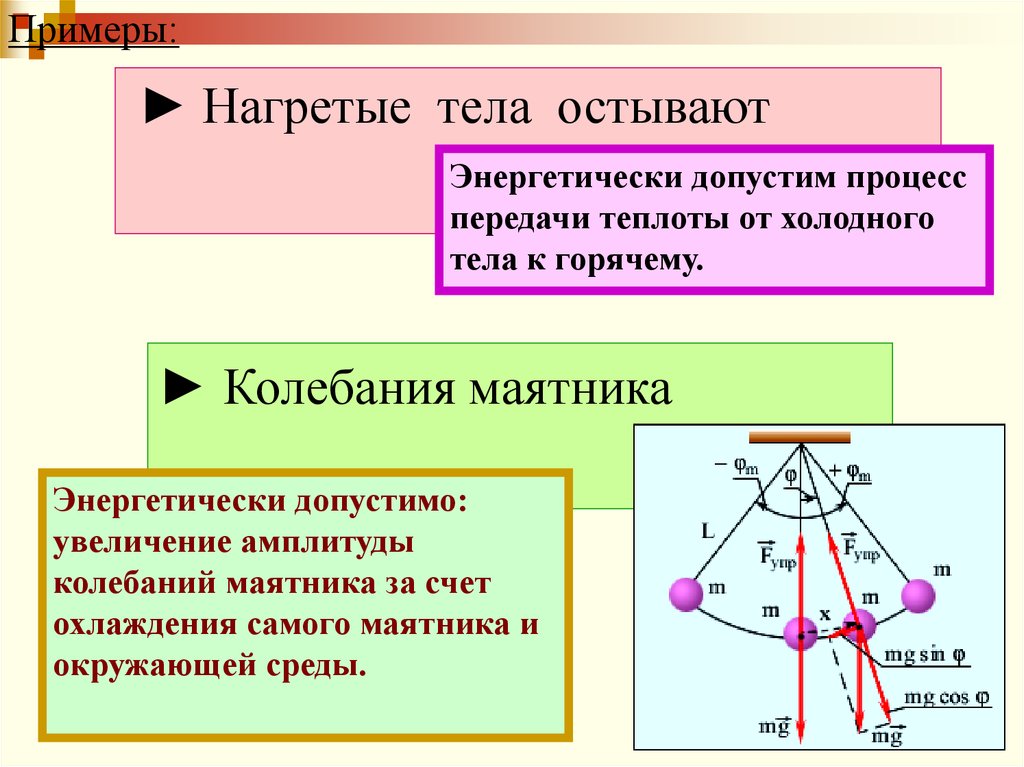
Примеры:► Нагретые тела остывают
Энергетически допустим процесс
передачи теплоты от холодного
тела к горячему.
► Колебания маятника
Энергетически допустимо:
увеличение амплитуды
колебаний маятника за счет
охлаждения самого маятника и
окружающей среды.
25.
II начало термодинамики:•вечный двигатель второго рода невозможен –
формулировка Томсона.
•вечный
двигатель
второго
рода
–
периодически
действующий
двигатель,
совершающий работу только за счёт охлаждения
источника тепла – формулировка Освальда
Его к.п.д. η = 1, т.е. это двигатель, работающий
только за счёт получения тепла извне.
25
26.
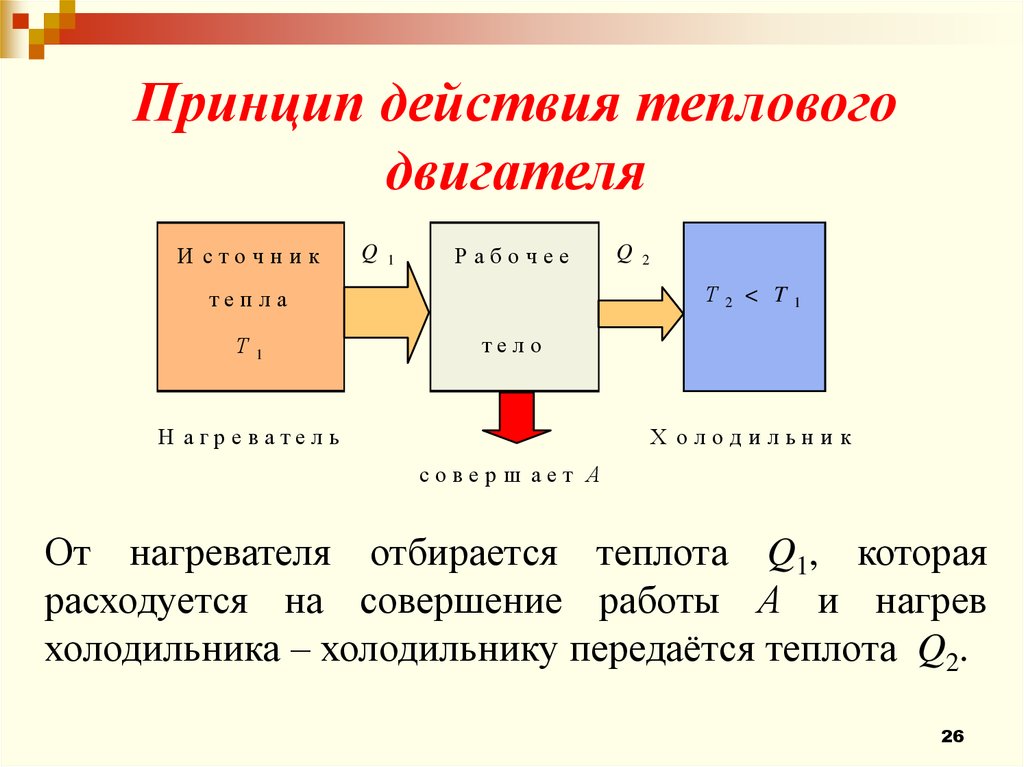
Принцип действия тепловогодвигателя
И сточник
Q
1
Рабочее
1
2
Т
теп ла
Т
Q
2
< T
1
тело
Н агреватель
Х олодильни к
соверш ает А
От нагревателя отбирается теплота Q1, которая
расходуется на совершение работы А и нагрев
холодильника – холодильнику передаётся теплота Q2.
26
27.
Если η = 1, то Q2 = 0 , т.е. тепловой двигатель имееттолько один источник тепла, а холодильника не имеет.
Это невозможно – доказано Карно (французский
физик и инженер, 1796 – 1832 гг.). Поток тепла в
тепловой машине от тела, более нагретого, к менее
нагретому Карно сравнивал с падением воды в
водяном двигателе с более высокого уровня на более
низкий.
27
28.
•Томсон: невозможен круговой процесс, единственнымрезультатом которого было бы производство работы за
счёт охлаждения теплового резервуара (источника
тепла, нагревателя).
•Клаузиус: теплота не может самопроизвольно
переходить от тела, менее нагретого, к телу, более
нагретому, т.е. невозможно создать какое-либо
устройство или придумать способ, когда без всяких
изменений в природе можно передавать тепло от
менее нагретого тела к более нагретому.
Но
если
процесс
не
самопроизвольный,
сопровождается изменениями в окружающей среде, то
это возможно, что, например, осуществляется за счёт
работы машины в холодильнике.
28
29.
Обратимые и необратимыепроцессы
Состояние изолированной системы, в которое
она переходит по истечении достаточно большого
промежутка времени, сравнимого или большего
времени релаксации, является равновесным.
Если термодинамическая система выведена из
состояния равновесия и предоставлена сама
себе, то она возвращается в исходное состояние.
Этот процесс называется релаксацией.
29
30.
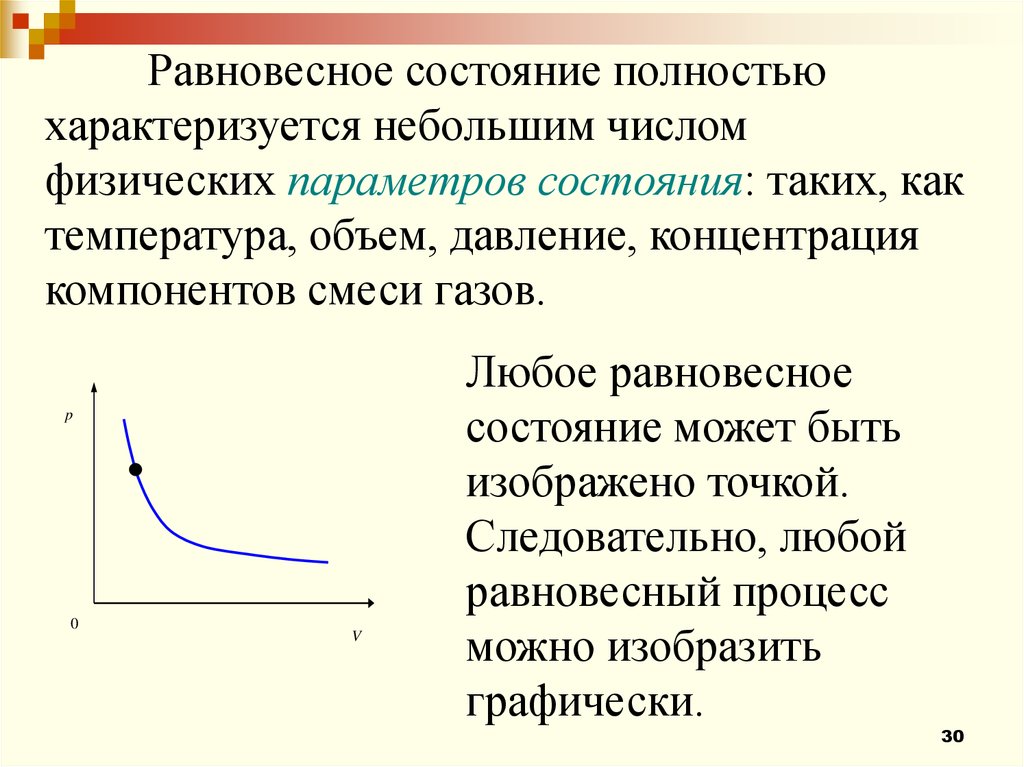
Равновесное состояние полностьюхарактеризуется небольшим числом
физических параметров состояния: таких, как
температура, объем, давление, концентрация
компонентов смеси газов.
p
0
V
Любое равновесное
состояние может быть
изображено точкой.
Следовательно, любой
равновесный процесс
можно изобразить
графически.
30
31.
При переходе из одного равновесногосостояния в другое под влиянием внешних
воздействий система проходит через
непрерывный ряд состояний.
Процесс, протекающий бесконечно
медленно и представляющий собой
последовательность равновесных состояний,
называется квазистатическим.
31
32.
Термодинамический процесс, совершаемыйсистемой, называется обратимым, если после
него можно возвратить систему, и все
взаимодействовавшие тела в их начальные
состояния таким образом, чтобы в других телах
не возникло каких-либо остаточных изменений.
Если
процесс
не
отвечает
принципу
обратимости,
то
он
называется
необратимым – все реальные процессы.
Примеры:
• тепло переходит от горячего тела к холодному,
• переход работы силы трения Fтр в тепло.
32
33.
Необходимое условие обратимостипроцесса – его равновесность.
Все равновесные процессы обратимы, т.к.
происходят с бесконечно малой скоростью и
представляют
собой
непрерывную
цепь
равновесных состояний.
Совокупность термодинамических процессов,
в результате которых система возвращается в
исходное состояние, называется круговым
процессом (циклом).
33
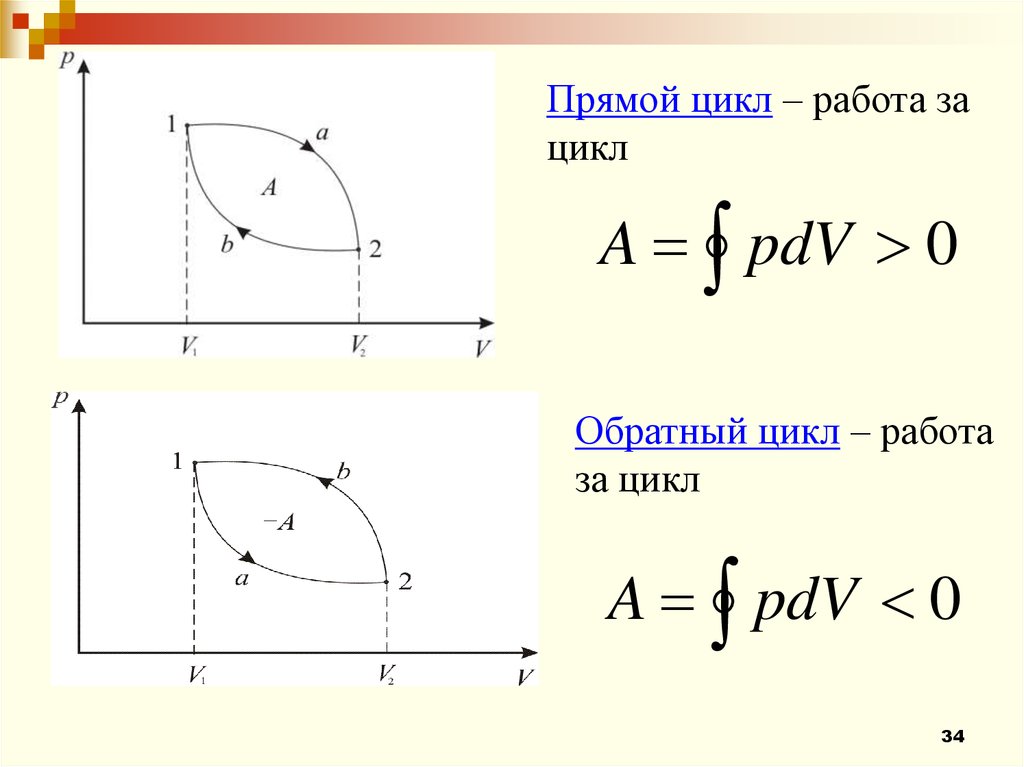
34.
Прямой цикл – работа зацикл
A pdV 0
Обратный цикл – работа
за цикл
A pdV 0
34
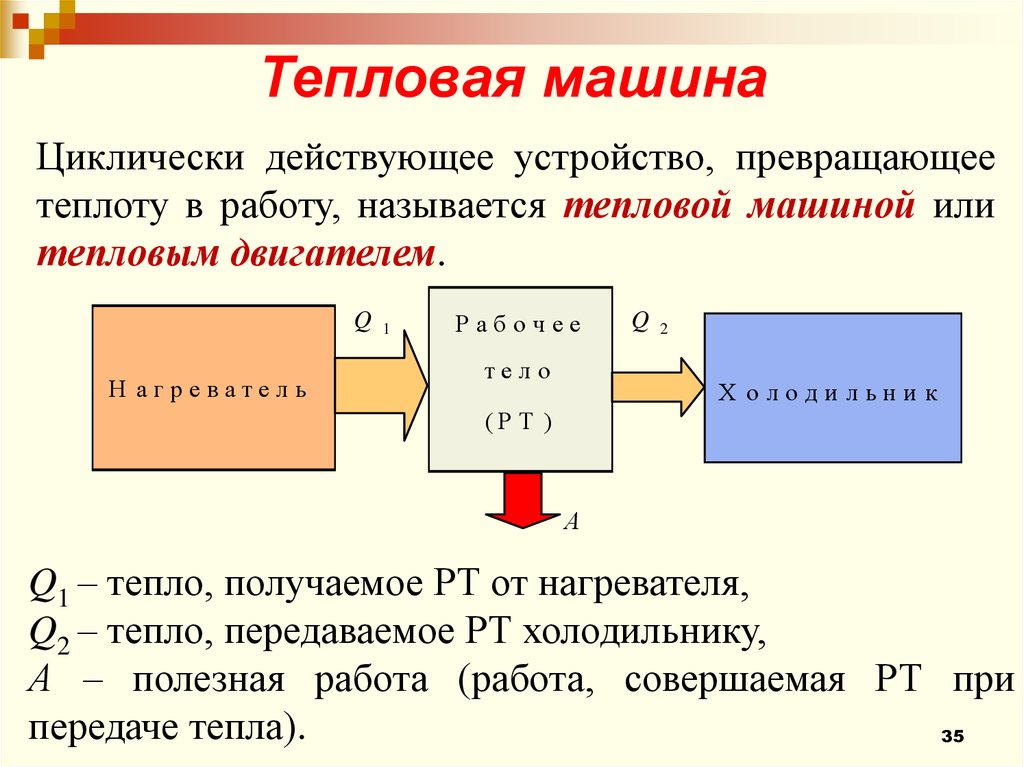
35.
Тепловая машинаЦиклически действующее устройство, превращающее
теплоту в работу, называется тепловой машиной или
тепловым двигателем.
Q
Н агреватель
1
Рабочее
тело
Q
2
Х олодильни к
(Р Т )
А
Q1 – тепло, получаемое РТ от нагревателя,
Q2 – тепло, передаваемое РТ холодильнику,
А – полезная работа (работа, совершаемая РТ при
передаче тепла).
35
36.
22
1
1
Q
p
a
1
b
-Q
Q
1
2
1
-Q
2
0
2
V
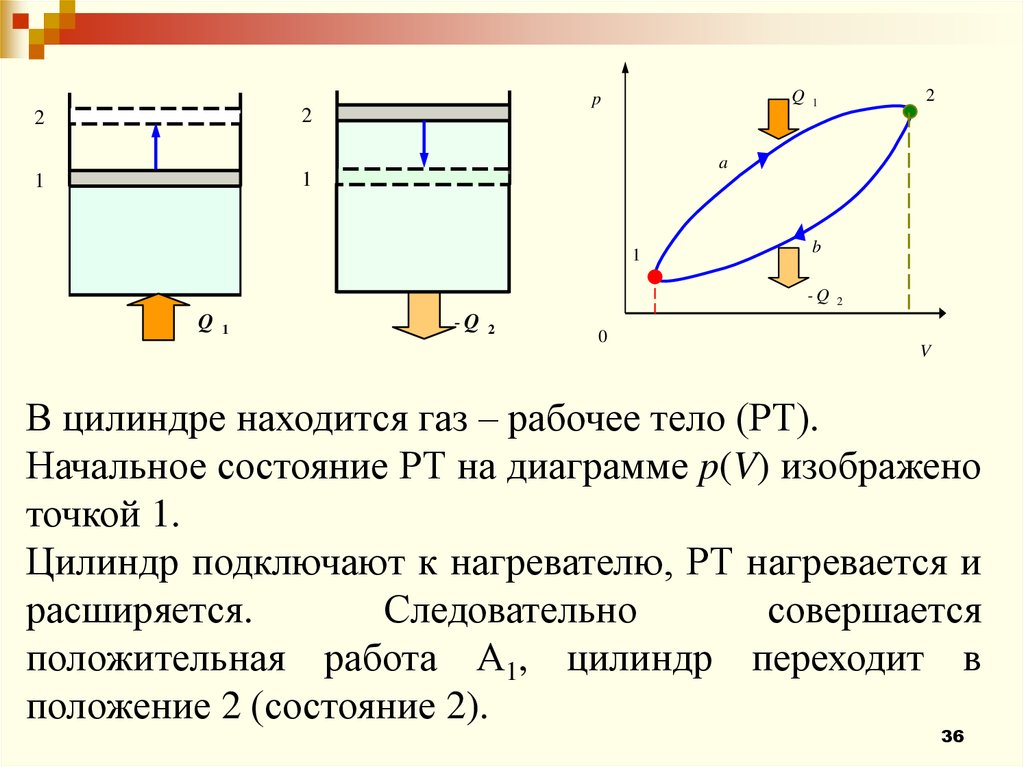
В цилиндре находится газ – рабочее тело (РТ).
Начальное состояние РТ на диаграмме p(V) изображено
точкой 1.
Цилиндр подключают к нагревателю, РТ нагревается и
расширяется.
Следовательно
совершается
положительная работа А1, цилиндр переходит в
положение 2 (состояние 2).
36
37.
Процесс 1–2: –Q
p
2
1
Q1 U 2 U 1 A1
a
1
-Q
0
первое начало термодинамики.
b
2
V
Работа А1 равна площади под кривой 1a2.
Чтобы поршень цилиндра вернуть в исходное
состояние 1, необходимо сжать рабочее тело,
затратив при этом работу – А2.
37
38.
Qp
2
1
a
1
b
-Q
0
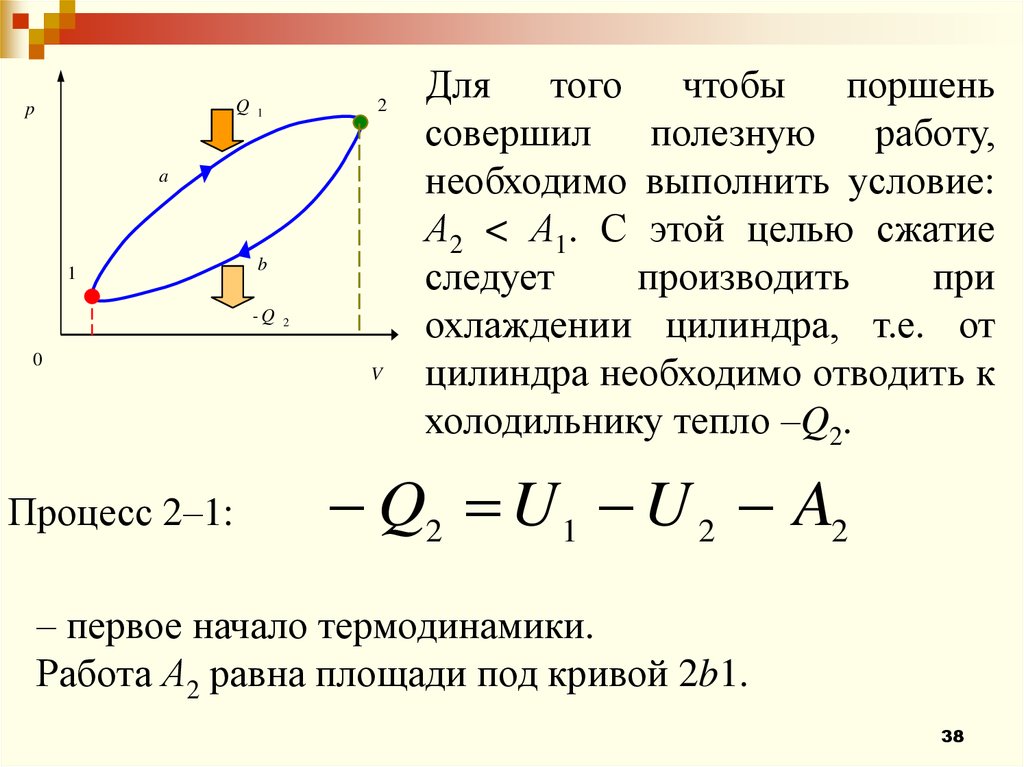
Процесс 2–1:
2
V
Для того чтобы поршень
совершил полезную работу,
необходимо выполнить условие:
А2 < А1. С этой целью сжатие
следует
производить
при
охлаждении цилиндра, т.е. от
цилиндра необходимо отводить к
холодильнику тепло –Q2.
Q2 U 1 U 2 A2
– первое начало термодинамики.
Работа А2 равна площади под кривой 2b1.
38
39.
Qp
2
1
a
Сложим два уравнения и
получим:
Q1 Q2 A1 A2 Aпол езная .
b
1
-Q
0
2
V
Рабочее тело совершает круговой процесс 1a2b1 – цикл.
К.п.д.
Аполезная Q1 Q2
Q2
1 .
Q1
Q1
Q1
39
40.
Qp
2
1
a
m
M
pV
RT T pV
;
M
Rm
1
b
-Q
2
0
V
при V const , pнагревателя p холодильника Т н Т х .
Процесс возвращения рабочего тела в исходное
состояние происходит при более низкой температуре.
Следовательно, для работы тепловой машины
холодильник принципиально необходим.
40
41.
Цикл КарноНикола Леонард Сади КАРНО – блестящий
французский офицер инженерных войск, в 1824 г.
опубликовал сочинение «Размышления о
движущей силе огня и о машинах способных
развить эту силу».
Ввел понятие кругового и обратимого
процессов, идеального цикла тепловых машин,
заложил тем самым основы их теории. Пришел к
понятию механического эквивалента теплоты.
41
42.
Карно вывел теорему, носящую теперь егоимя:
из всех периодически действующих
тепловых машин, имеющих одинаковые
температуры нагревателей и холодильников,
наибольшим КПД обладают обратимые
машины. Причем КПД обратимых машин,
работающих при одинаковых температурах
нагревателей и холодильников, равны друг другу
и не зависят от конструкции машины. При
этом КПД меньше единицы.
42
43.
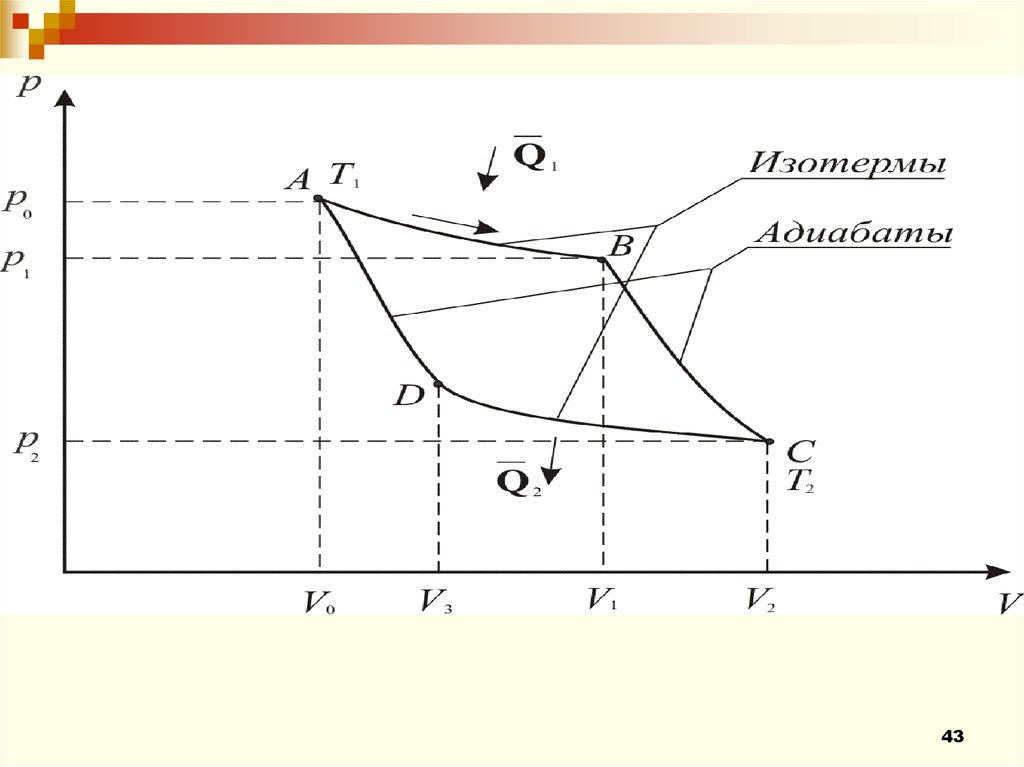
4344.
Процесс А-В – изотермическое расширениеV1
A1 RT1ln Q1 ,
V0
Процесс В-С – адиабатическое расширение.
γ 1
T1 V2
, – коэффициент Пуассона.
T2 V1
p1V1 (T1 T2 )
R T1 T2
A2
1
( 1)T1
44
45.
Процесс С-D – изотермическое сжатиеV3
A3 RT2ln Q2
V2
Процесс D-A – адиабатическое сжатие.
V3
V0
γ 1
T1
T2
R
A4
(T1 T2 )
1
45
46.
V1 R (T1 T2 )A RT1 ln
V0
1
V3 R(T1 T2 )
RT2 ln
V2
1
Q2
T2
A Q1 Q2
η
1
1
Q1
Q1
Q1
T1
46
47.
Если Т2 = 0, то η = 1, что невозможно, т.к.абсолютный нуль температуры не существует.
Если Т1 = ∞, то η = 1, что невозможно, т.к.
бесконечная температура не достижима.
КПД цикла Карно η < 1 и зависит от
разности температур между нагревателем и
холодильником (и не зависит от конструкции
машины и рода рабочего тела).
47
48.
Теоремы Карно.1. К.п.д. η обратимой идеальной тепловой
машины Карно не зависит от рабочего
вещества.
2. К.п.д. необратимой машины Карно не может
быть больше к.п.д. обратимой машины Карно.
48
49.
«Науку все глубже постигнуть стремись,Познанием вечного жаждой тянись.
Лишь первых познаний блеснет тебе свет,
Узнаешь: предела для знания нет.»
Фирдоуси
( Персидский и таджикский поэт 940–1030 г.г)




































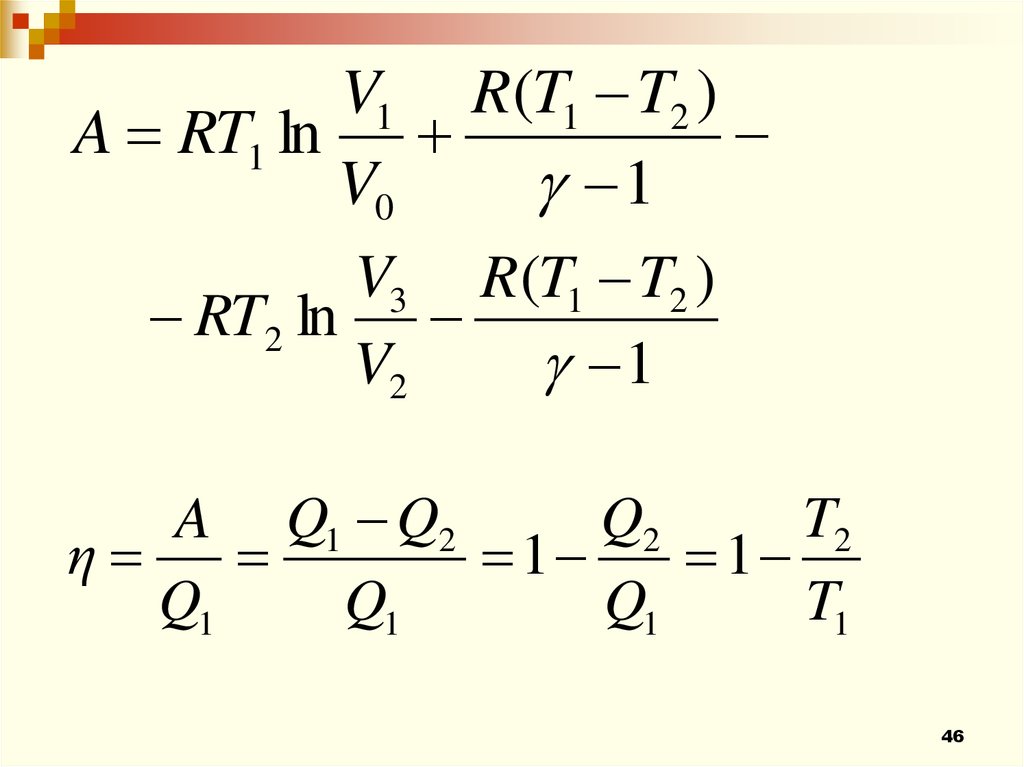



 Физика
Физика








