Похожие презентации:
Тотығутотықсыздану титрлеу әдістері. Дәріс № 7
1. ДӘРІС № 7
ТОТЫҒУТОТЫҚСЫЗДАНУТИТРЛЕУ
ӘДІСТЕРІ
2.
Электронның тасымалдануымен жүретінтотығу-тотықсыздану
реакцияларына
негізделген
титриметия
әдісі
редоксиметрия
(оксиметрия)
деп
аталады. Бұл әдістер алынған титранттың
атауы бойынша жіктеленеді, олардың ішінде
маңыздылары:
1) KMnO4 - Перманганатометрия
2) I2 - Йодометрия
3) K2Cr2O7 (K2CrO4) - Хроматометрия
4) NH4VO3 - Ванадатометрия
5) Ce4+ - ионның тұздары - Цериметрия
3.
Тотықтырғыш пен тотықсыздандырғыштыңнегізгі сипатамаларының бірі – олардың
эквиваленттік массалары мен тотығутотықсыздану
потенциалдарының
шамалары:
M Экв ( Х ) f Экв M Х
мұнда
f Экв
1
ne
4.
ТТРөткізу
барысында
сол
реакцияның
ЭҚК
шамасы
оған
қатысатын
тотықтырғыш
пен
тотықсыздандырғыштың
потенциалдарының айырмасына тең:
E т ш т сыз ш
Реакция тура бығытта жүреді, егер ЭҚК > 0
5.
ТТР өздігінен жүруі бос Гиббсэнергиясының
шамасымен
анықталады, ол сол реакцияның тепетеңдік контантасымен байланысты:
G RT ln K E nF
Реакция өздігінен жүреді, егер G < 0
6.
Тотықтырғыш не тотықсыздандырғыштыңпотенциалдары
температураға,
концентрацияға
тәуелділіктері
Нернст
теңдеуімен сипатталанады:
[aox ]
RT
ln
ne F
[ared ]
7.
МЫСАЛЫ:2KMnO4 10( NH 4 ) 2 Fe(SO4 ) 2 8H 2 SO4
MnSO4 K 2 SO4 5Fe2 (SO4 ) 3 10( NH 4 ) 2 SO4 8H 2 O
Тотықсыздандырғыштың
стандартық потенциалы:
Тотықтырғыштың
стандартық потенциалы:
E
Fe3 / Fe2
E
0,771B
MnO4 / Mn 2
1,51B
яғни реакцияның ЭҚК = 1,51 – 0,771 = 0,739В
8.
Редоксиметрия әдістерін тура, керіжәне жанама титрлеу жолдарымен өткізуге
болады.
Тотығу-тотықсыздану
титрлеу
әдістерінде Э.Н. бақылау үшін редоксиндикаторлар қолданады.
Редокс-индикаторлар
дегеніміз
жүйенің
тотығу-тотықсыздану
потенциалының шамасына тәуелді өз
бояуларын өзгертетін органикалық бояғыш
заттар.
9.
Ind ox ne Ind redтотыққан түрі
тотықсызданған түрі
Индикаторлық жүйенің потенциалы
Нернст теңдеуімен сипатталанады:
E Ind E
0
Ind
[ Ind ox ]
0,059
lg
[ Ind red ]
ne
10.
Сонда егер индикатордың бір түрініңконцентрациясы 10 есе арттса, сол кезде
ерітіндіде
оның
бояуының
өзгеруі
байқалады:
[ Ind ox ]
10
0,1
[ Ind red ]
немесе
[ Ind ox ]
1 lg
1
[ Ind red ]
11.
Осыдан,индикатордың
бояуының
ауысу аймағын алуға болады:
E Ind E
0
Ind
0,059
ne
12.
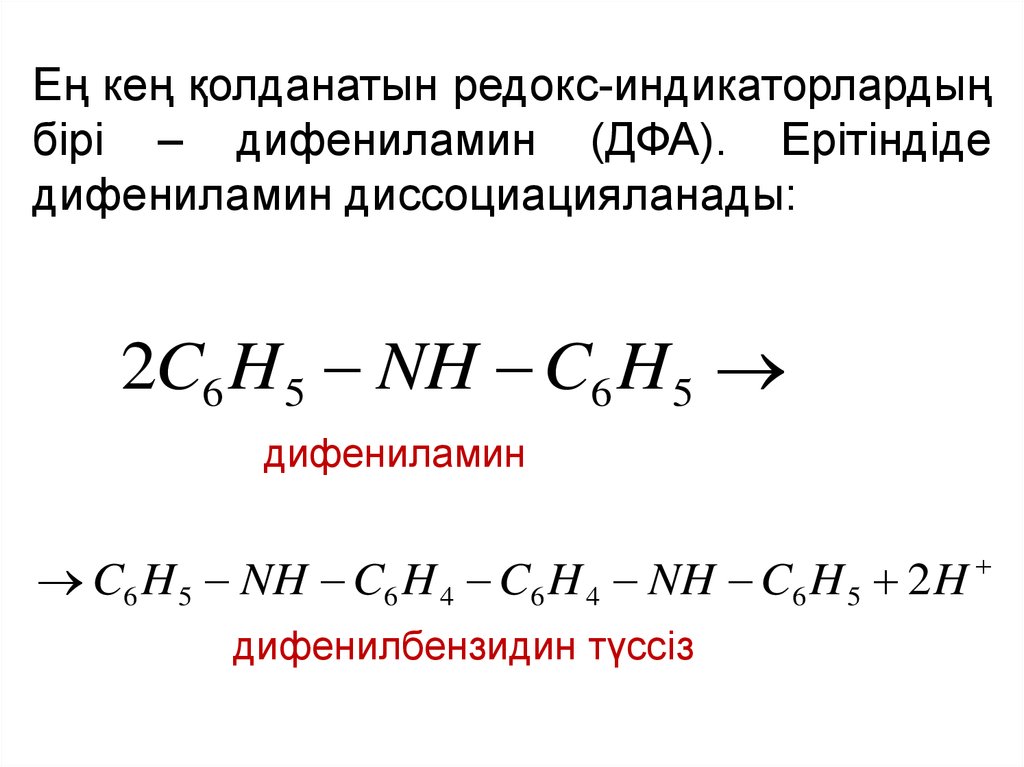
Ең кең қолданатын редокс-индикаторлардыңбірі – дифениламин (ДФА). Ерітіндіде
дифениламин диссоциацияланады:
2C6 H 5 NH C6 H 5
дифениламин
C6 H 5 NH C6 H 4 C6 H 4 NH C6 H 5 2 H
дифенилбензидин түссіз
13.
Әрі қарай тотықтырғыштың әсерінен ДФАкүлгін дифенилбензидинге (ДФБ) дейін
тотығады:
C6 H 5 NH C6 H 4 C6 H 4 NH C6 H 5
дифенилбензидин түссіз (тотыққан түрі)
C6 H 5 N C6 H 4 C6 H 4 N C6 H 5 2 H 2e
дифенилбензидин күлгін (тотықсызданған түрі)
14.
ДФА индикатордың бояуының ауысуаймағын есептегенде:
0,059
E ДФА E
0,76 В 0,029
2e
0,73B 0,79 B
0
ДФА
Сонда ДФА индикаторының бояуының
ауысу аймағы потенциал шамаларының
келесі аймағында жатады ЕДФА=0,73 –
0,79В, егер ЕДФА<0,73В онда оның бояуы
түссіз, ал егер ЕДФА>0,79В онда оның түсі
күлгін болады.
15.
Редокс-индикаторлардыңқасиеттеріне
фенилантранил
және
дифениламинсульфон
қышқылдары,
ферроин және т.б. заттар ие болады.
Кейбір
индикаторлар
тотықтырғыштың
артық
мөлшерінің
әсерінен бұзылып, бірден түссізденеді,
сондықтан мұңдай қайтымды (обратимые)
индикаторларды қолдануға онша ыңғайлы
емес (мысалы метилоранж, метил қызғылт
индикаторлары).














 Химия
Химия








