Похожие презентации:
Использование информационных технологий при обучении химии
1. Использование информационных технологий при обучении химии
Из опыта работы учителя химииКорякиной В.В.
2. Термин «информационные технологии» подразумевает использование компьютеров как новых средств подготовки, диагностики, контроля
и обучения предметам. Онипризваны помочь учителю в школе:
делать по-новому то, что делали всегда;
делать то, что без компьютера делать очень
сложно;
делать то, что не делали раньше.
3. Применение компьютера при обучении химии в школе целесообразно в тех случаях, когда обычных средств обучения уже недостаточно.
Проведение медиа-уроков сиспользованием компьютерных дисков.
Создание презентаций к урокам и
исследовательским работам учащихся.
Использование дисков для подготовки к
ЕГЭ и олимпиадам школьников.
4. Медиа- лекции:
«Углерод.Аллотропия.» (9 класс)
«Природные источники углеводородов»
(10 класс)
«Белки, их строение и свойства»
(10 класс)
«Основные понятия химии ВМС» (11
класс)
«Типы химических реакций» (11 класс)
5. Уроки комбинированного типа:
«Алюминийи его соединения»(9 класс)
«Многоатомные спирты» (10 класс)
«Качественные реакции в органической
химии» (10 класс)
«Теория электролитической
диссоциации» (11 класс)
6.
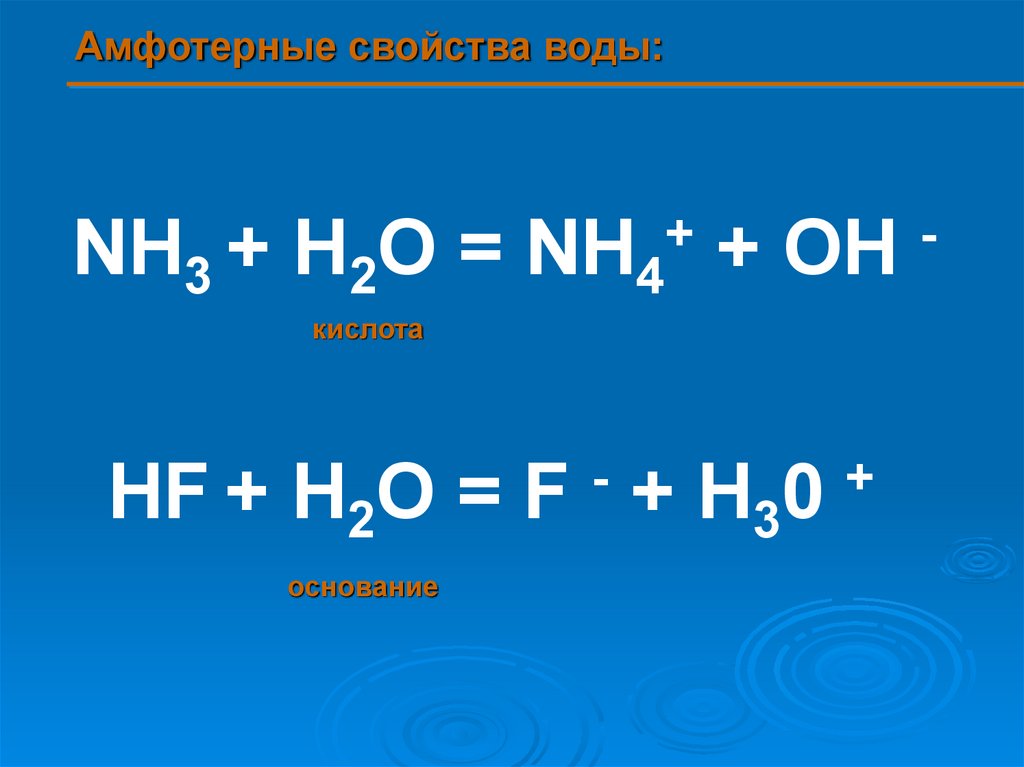
Амфотерные свойства воды:+
NH3 + H2O = NH4 + OH
кислота
-
HF + H2O = F + H30
основание
+
-
7.
Выберите правильные ответы:1. Катион – это:
а) ион меди; б) атом серы;
в) ион серы;
2. Анион – это:
а) ион натрия; б) ион аммония;
водорода.
г) атом меди.
в) карбонат-ион;
г) ион
3. Окраска фенолфталеина в растворе, полученном при
взаимодействии калия с водой:
а) синяя; б) малиновая; в) желтая; г) бесцветная.
4. Формула вещества, образующего при диссоциации сульфатионы:
а) Na2S; б) SO3;
в) Na2SO4;
г) BaSO4.
5. Формула вещества, образующего при диссоциации сульфатионы и ионы водорода:
а) КНS; б) КНSO3; в) Na2S; г) NaHSO4.
8.
Выберите правильные ответы:1. Катион – это:
а) ион меди; б) атом серы;
в) ион серы;
2. Анион – это:
а) ион натрия; б) ион аммония;
водорода.
г) атом меди.
в) карбонат-ион;
г) ион
3. Окраска фенолфталеина в растворе, полученном при
взаимодействии калия с водой:
а) синяя; б) малиновая; в) желтая; г) бесцветная.
4. Формула вещества, образующего при диссоциации сульфатионы:
а) Na2S; б) SO3;
в) Na2SO4;
г) BaSO4.
5. Формула вещества, образующего при диссоциации сульфатионы и ионы водорода:
а) КНS; б) КНSO3; в) Na2S; г) NaHSO4.
9.
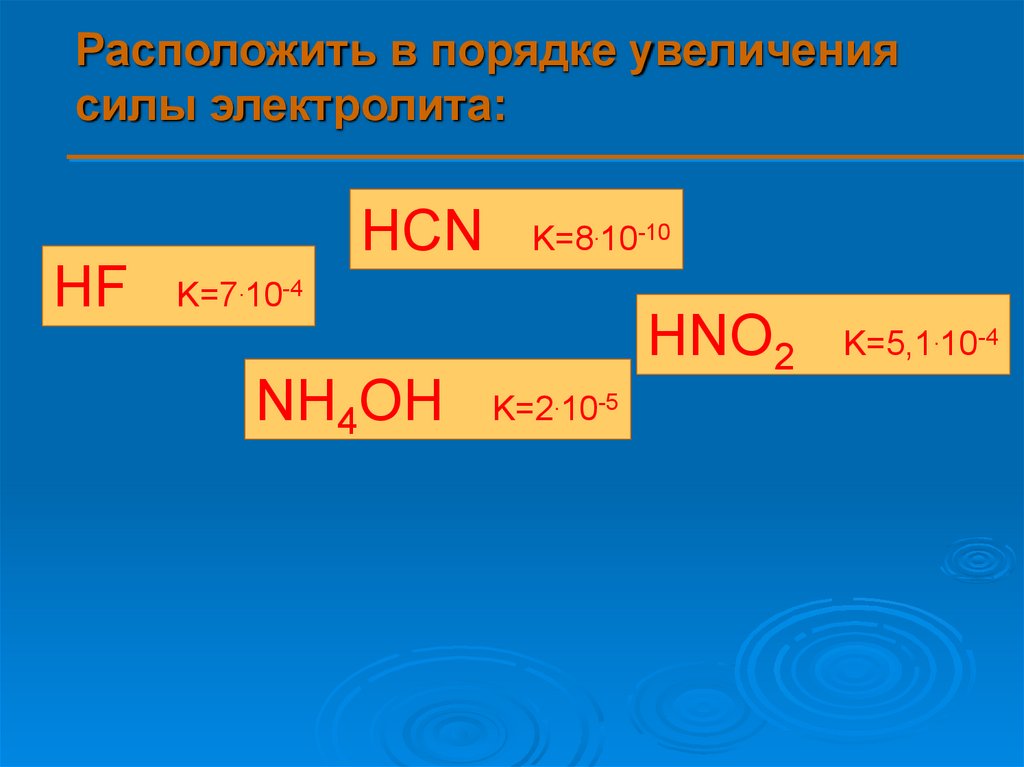
Расположить в порядке увеличениясилы электролита:
HCN
HF
K=8.10-10
K=7.10-4
HNO2
NH4OH
K=2.10-5
K=5,1.10-4
10.
Расположить в порядке увеличениякислотных свойств:
HCl
H2O
H2 SO3
NH3
11.
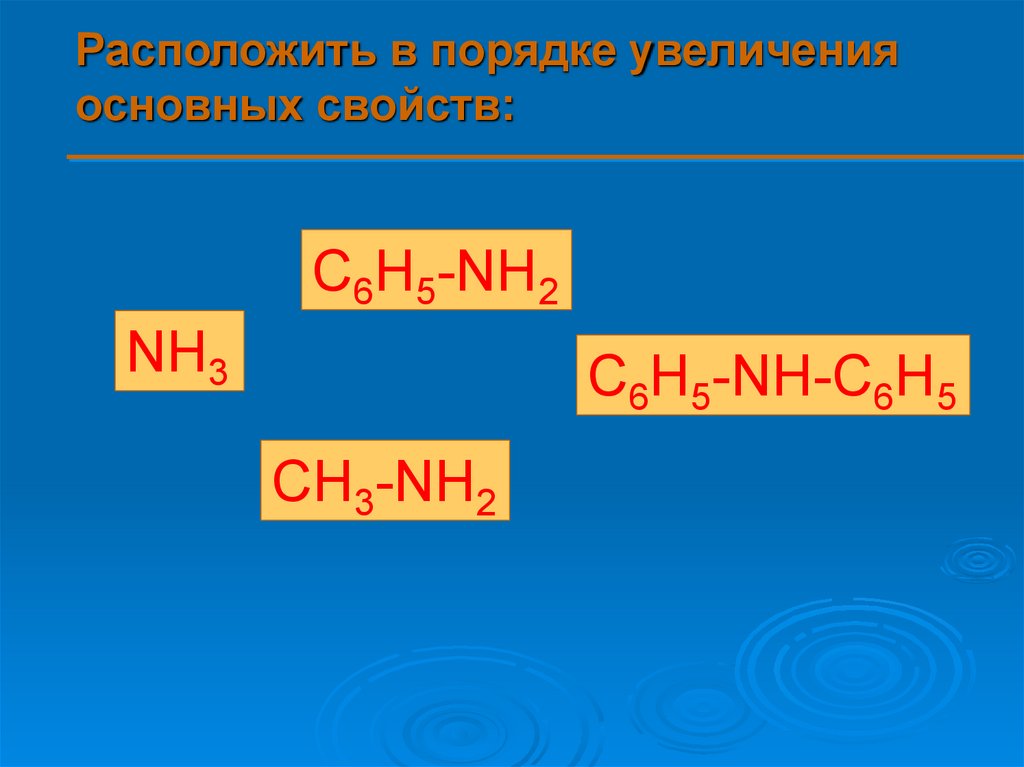
Расположить в порядке увеличенияосновных свойств:
C6H5-NH2
NH3
C6H5-NH-C6H5
CH3-NH2
12.
Укажи, допущены ли ошибки в тексте:1. На процесс диссоциации влияет растворение или расплавление
вещества.
2. Сернистая кислота – слабая, потому что она распадается на
сернистый газ и воду.
3. Основность кислоты не всегда совпадает с числом атомов водорода в
ней.
4. Все щелочи – сильные электролиты.
5. Константа диссоциации вещества по первой ступени всегда больше,
чем по второй.
6. Степень диссоциации зависит от температуры и концентрации
электролита.
7. Диссоциация электролитов – обратимый процесс.
8. Это реакция ионного обмена: 2КОН+SiO2 = K2SiO3 + H2O.
9. Отражает ли сущность реакции Cu(OH)2 + 2 HCl = CuCl2 + 2H2O
сокращенное ионное уравнение: H+ + OH- = H2O.
10. Реакции ионного обмена идут до конца (практически необратимо),
если ионы, соединяясь друг с другом, образуют нерастворимые,
малодиссоциирующие и газообразные вещества.
13.
Укажи, допущены ли ошибки в тексте:1. На процесс диссоциации влияет растворение или расплавление
вещества.
2. Сернистая кислота – слабая, потому что она распадается на
сернистый газ и воду.
3. Основность кислоты не всегда совпадает с числом атомов водорода в
ней.
4. Все щелочи – сильные электролиты.
5. Константа диссоциации слабой кислоты по первой ступени всегда
больше, чем по второй.
6. Степень диссоциации зависит от температуры и концентрации
электролита.
7. Диссоциация электролитов – обратимый процесс.
8. Это реакция ионного обмена: 2КОН+SiO2 = K2SiO3 + H2O.
9. Отражает ли сущность реакции Cu(OH)2 + 2 HCl = CuCl2 + 2H2O
сокращенное ионное уравнение: H+ + OH- = H2O.
10. Реакции ионного обмена идут до конца (практически необратимо),
если ионы, соединяясь друг с другом, образуют нерастворимые,
малодиссоциирующие и газообразные вещества.
14. Эффект применения компьютерных технологий зависит в наибольшей мере от умения использовать новые возможности.
Очевидно, что в самом ближайшембудущем умение учителя-практика
пользоваться компьютером в
учебном процессе станет
обязательным элементом его
профессиональной компетенции.











 Химия
Химия








