Похожие презентации:
Тотығу дәрежесі. Тотығу-тотықсыздану реакция теңдеулері
1.
Тақырып:Тотығу дәрежесі. Тотығу-тотықсыздану реакция
теңдеулері.
Оқу мақсаттары:
- тотығу бұл оттегінің қосылуы немесе сутектің
жойылуы екендігін білу
-тотықсыздану бұл сутегінің қосылуы немесе
оттегінің жойылуы екендігін білу
- үрдістер өзара байланысты екендігін және
әрқашан бірге өтетіндігін түсіну
- осы үрдістерді қосылу ретінде және
электрондардың жоғалуы ретінде қарастыруға
болатындығын түсіну
2.
Жетістік критерийлері:ОМ1: оқушы мақсатқа жетеді, егер
- оттектің күшті тотықтырғыш екенін білсе
ОМ2: оқушы мақсатқа жетеді, егер
- сутектің тотықсыздандырғыш екендігін білсе
ОМ3: оқушы мақсатқа жетеді, егер
- егер бір атомдар электрон берсе,екінші бір атомдар
сол
электрондарды
қабылдап
алатындығын
түсінсе(электрондар жоғалып кетпейді)
ОМ4: оқушы мақсатқа жетеді, егер
- тотығу бұл электрон беру екендігін түсінсе
- тотықсыздану электрон қабылдап алу екендігін
түсінсе
3.
Ойланыңдар!Неміс ғалымы Ян Каммерер химия пәнінің мұғалімі
болып жұмыс істеген.1820жылы ол өз шәкірттеріне
қауіпті тәжірибе жасап көрсетті. Балауыз тәріздес ақ
затты судың астында француз ғалымы Бертолле бөліп
алған түссіз кристалды тұзбен араластырып,оның
үстіне гуммиарабик(клей) қосқан. Пайта болған
«ұнға» теректен жасалған таяқшаны батырды.
Таяқшаларды кептіріп, оларды өз шәкірттеріне
таратып берді де, таяқшаларды столға үйкеулері керек
екендігін айтты. Барлық таяқшалар тұтанды, мұны
көрген оқушылардың қуанышында шек болмады.
Себебі бұл оқушылар ең алғашқы сіріңкені
қолдарында ұстап тұрған еді. Каммерер қандай
заттарды қолданды?
4.
5.
Блиц-сауалнама:- Элементарлы бөлшектерді ата
- Ядроның құрамында қандай элементарлы бөлшектер бар?
- Электрондар қайда орналасқан?
- Валентті электрондар деген не? (сыртқы энергетикалық
қабаттағы электрондар)
-Ион деген не?
- Ион қалай түзіледі?
- Келесі иондарды атаңдар;
- натрий
- хлор
- бром
- сульфид
-кальций
- мыс
- темір
6.
Проблемалық сауал: тотығудәрежесі деген не?
Тотығу дәрежесі – қосылыстар тек
иондардан тұрады деп есептегенде,
химиялық элемент атомының шартты
түрде алынған заряды.. Ол элементтің
қанша электрон беріп немесе қосып
алғандығын көрсетеді.
7.
8.
Келесіқосылыстардағы
әрбір
элементтің
тотығу
дәрежесін
анықтаңыздар:
Н2, О2, СО2, Na2O, K2SO4,
Al(NO3)2
9.
Кейбір элементтердің қосылыстарындағы типтіңтотығу дәрежелері
Тапсырма №1. Молекуладағы немесе иондардағы
элементтердің тотығу дәрежесін анықтап, сәйкес
ұяшыққа жазыңыздар:
NO2, NH4¯, N2O5, NO2¯, N2O, P2O5, Ca3P2, NO3¯, NO,
NH3, H3PO3, P2O3 , PH3, HNO2, PCl3, HNO3 , H3PO4,
H2PO4¯, HPO42¯, PO43¯, PCl5, H2SO4, S2¯¯, SO3, SO42¯¯,
SO2, SO32¯¯, HSO3¯¯, ClO4¯¯, H2S, Cl¯¯, HClO, ClO¯¯,
ClO3¯¯, HClO42¯¯, Cl2O7, HClO3, Cl2O, HCl, CrO,
Cr(OH)2, Cr2+ , Cr2O3, Cr(OH)3, Cr3+, CrO3, CrO4, Cr2O72, MnO, Mn(OH)2, Mn2+, MnO, MnO42-Mn2O7¯¯, MnO4¯¯,
Cu2O, CuCl, CuO, Cu(OH)2, Cu2+, Fe(OH)2,
Fe3+, Fe(OH)3, Fe2O3, Fe2+, Fe2O3, FeO.
10.
Бұл мәтінді 3 рет оқу қажет.Келесі сөздердің анықтамаларын
жазыңдар:
Тотығу Тотықтырғыш Тотықсыздану Тотықсыздандырғыш -
11.
- Сендер қалай ойлайсыңдар қандайреакциялар тотығу-тотықсыздануға
жатады? Неге?
А) CuSO4 +NaOH = CuSO4 +Cu(OH)2
B) CuSO4 + Fe = FeSO4 + Cu
12.
ШПАРГАЛКА!!!Оны есте сақтау үшін оқушыларға 2мин беріледі.
1.жай заттағы элементтің тотығу дәрежесі 0 тең болады;
2.барлық металдар оң тотығу дәрежесіне ие болады.
3.Бор және кремний қосылыстарда оң тотығу дәрежесін
береді;
4.Сутек қосылыстарда оң тотығу дәрежесін береді(+1),
тек гидридтерде бұл ереже бұзылады(гидридтер деген
бірінші,екінші а топшасындағы металдардың сутекпен
қосылыс,мысалыNa+H-)
5. Оттектің тотығу дәрежесі(-2), бұл ережеге оттектің
фтормен қосылысы жатпайды O+2F-2 және пероксидтер (
Н2О2 – оттектің тотығу дәрежесі (-1);
6.Фтордың тотығу дәрежесі (-1)
13.
Шпаргалканы еске түсіріңдер!!!14.
А) келесі қосылыстардағы элементтердің тотығу дәрежесінанықтаңыздар:
Na2O, Na, LiOH, Li, Mg, FeCO3, C, Ba(NO3)2 , N2, O3, Ba(NO3)2
Жай заттарды қоршап шығыңдар.
B) келесі қосылыстардағы элементтердің тотығу дәрежесін
анықтаңыздар:
K2O, LiOH, FeCO3, Ba(NO3)2 . Металдарды қоршап шығыңдар..
С) Бор мен кремнийдің тотығу дәрежесін анықтаңдар.
SiO2, H2SiO3, H3BO3 ,B2O3
D) Сутектің тотығу дәрежесін анықтаңдар:
Cu(OH)2, H2,, NaH, NaHCО3, CaH2, NH3, CH4, KH2PO4, BaH2
Тек қана гидридтердің астын сызыңдар.
D) Оттектің тотығу дәрежесін анықтаңдар:
Cа(OH)2, Н2О2, О2,, H2О, КHCО3, KH2PO4, OF2
Оттектің тотығу дәрежесі -2 болмайтын жағдайды қоршап
шығыңыздар.
Е) фтордың тотығу дәрежесі қай жерде қате ?
OF2, НF, К2F
15.
16.
Екінші мүмкіндік!!!17.
Элемент ең төменгі тотығу дәрежесінде тектотықсыздандырғыш,
ең
жоғарғы
тотығу
дәрежесінде тек тотықтырғыш, ал аралық тотығу
дәрежесінде
болса
әрі
тотықтырғыш,
әрі
тотықсыздандырғыш болады.
Бөлшек (атом, молекула) электронды
бергенде оның оң тотығу дәрежесі артса,
қосқанда оң тотығу дәрежесі кеміп, теріс
тотығу дәрежесінің абсолюттік мәні
артады.
18.
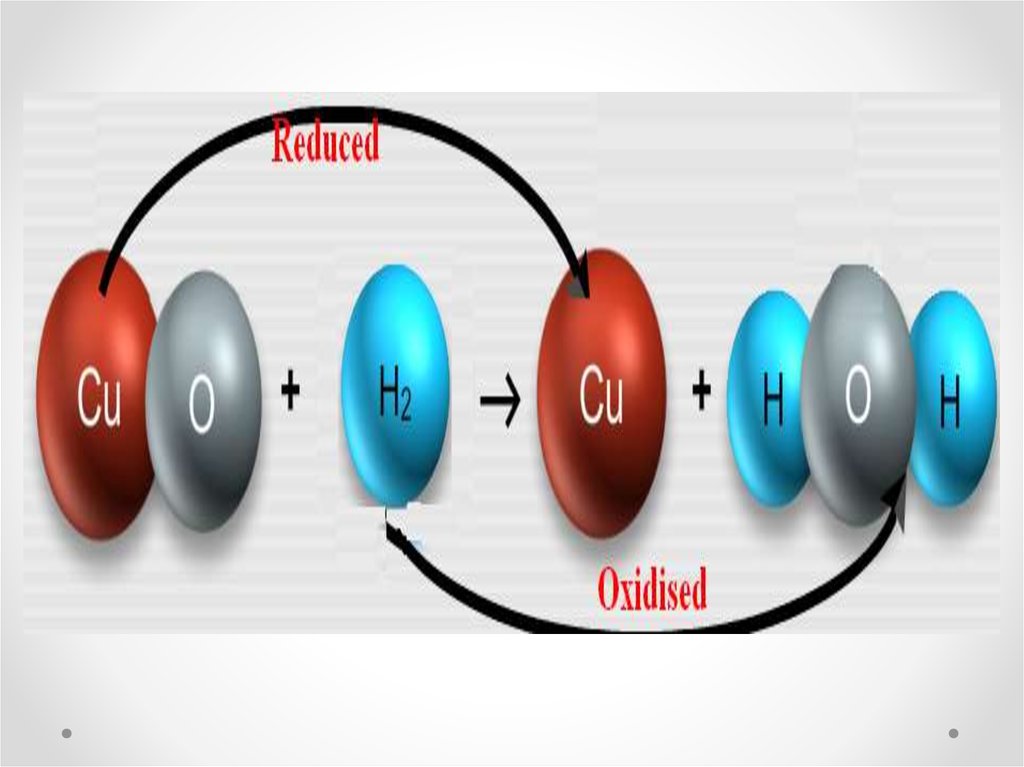
Тотығу – элементтің немесе заттың оттекпен әрекеттесупроцесі; тотығу-тотықсыздану реакциялары барысында
бөлшектің электрондарынан айрылу процесі. Тотығу кезінде
бөлшектің тотығу дәрежесі артады. Мысалы, атом
электронын берсе, оң зарядты ионға; теріс зарядты ион
электрон берсе бейтарап атомға, оң зарядты ионға айналады;
оң зарядты ион электрон берсе, оның оң заряды берген
электрон санына сәйкес өседі. Тотоығудың үш түрі белгілі.
19.
Тотықсыздану – тотығу-тотықсыздану реакцияларыбарысында атомның, молекуланың, ионның электрон қосып
алу процесі. Тотықсыздану кезінде бөлшектің тотығу
дәрежесі кемиді. Мыс., атом электрон қосып алса, теріс
зарядты ионға; оң зарядты ион электрон қосып алса заряд
саны кеміген оң зарядты ионға, бейтарап атомға, теріс
зарядты ионға айналады. Органикалық заттардың
Тотықсыздануы еселі (қос және үш) байланыстарды толық
немесе бөлшектеп қанықтыру арқылы жүретін сутекті
қосып алу реакциялары (гидрлеу), жай байланыстардың
сутекпен ыдырауы (гидрогенолиз), элиминирлеу (органик.
заттардан оттекті бөліп алу), т.б. болып табылады.
20.
21.
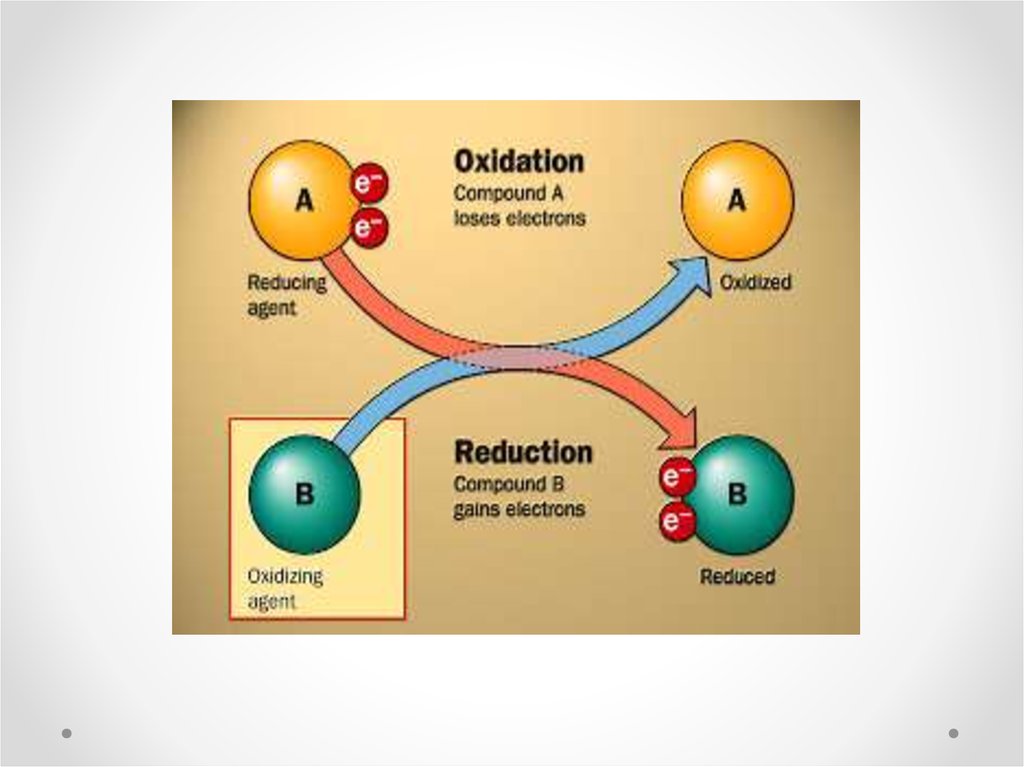
OIL RIGWhat this stands for is:
Oxidation Is Loss of electrons
Reduction Is Gain of electrons
Oxidation
Let's first look at a simple oxidation reaction. Remember, Oxidation Is Loss
of electrons:
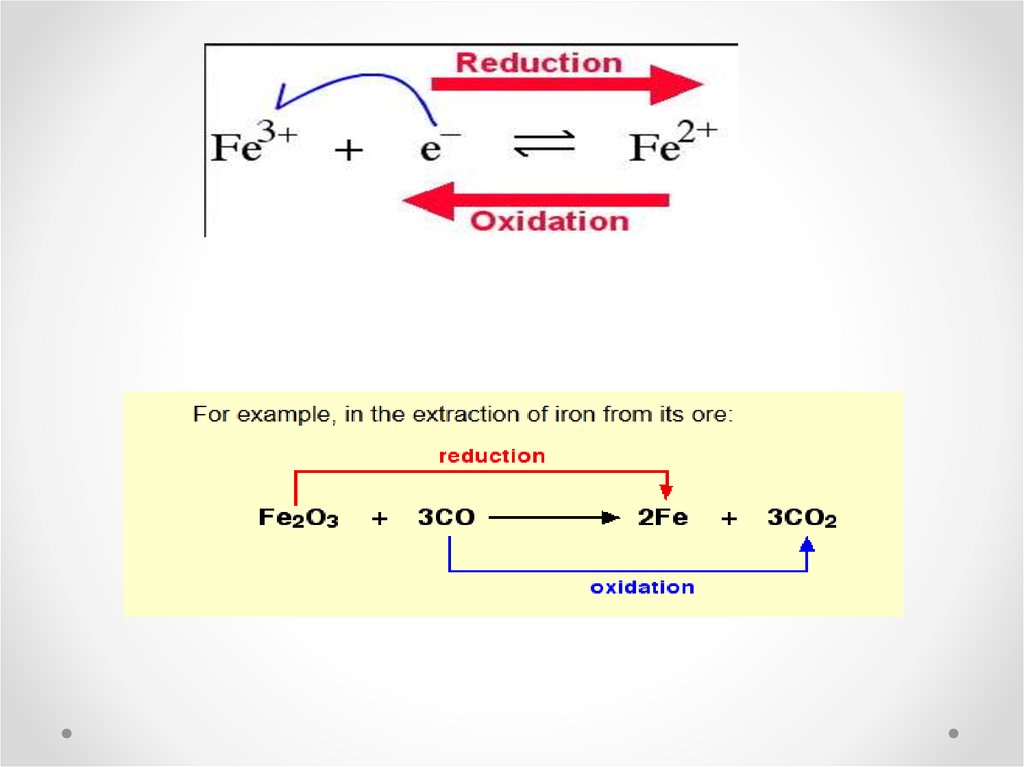
Fe2+
Fe3+ + eYou can see that in the reaction, from left to right the Fe becomes more
positive in charge, which you can also think of as becoming less negative.
Since electrons carry a negative charge, then the Fe must be losing electrons
if it is becoming less negative. Since the Fe is losing electrons, then this
reaction is an oxidation.
Reduction
Now let's look at a reduction reaction. Remember, Reduction Is Gain of
electrons:
Cu2+ + eCu+
Notice that for this reaction, from left to right the Cu becomes less positive in
charge, or more negative. So if the Cu is becoming more negative, it must be
gaining an electron, meaning that it is getting reduced (this is a reduction
reaction).


















 Химия
Химия








