Похожие презентации:
Кислая, нейтральная и щелочная среда. (Лекция 2)
1.
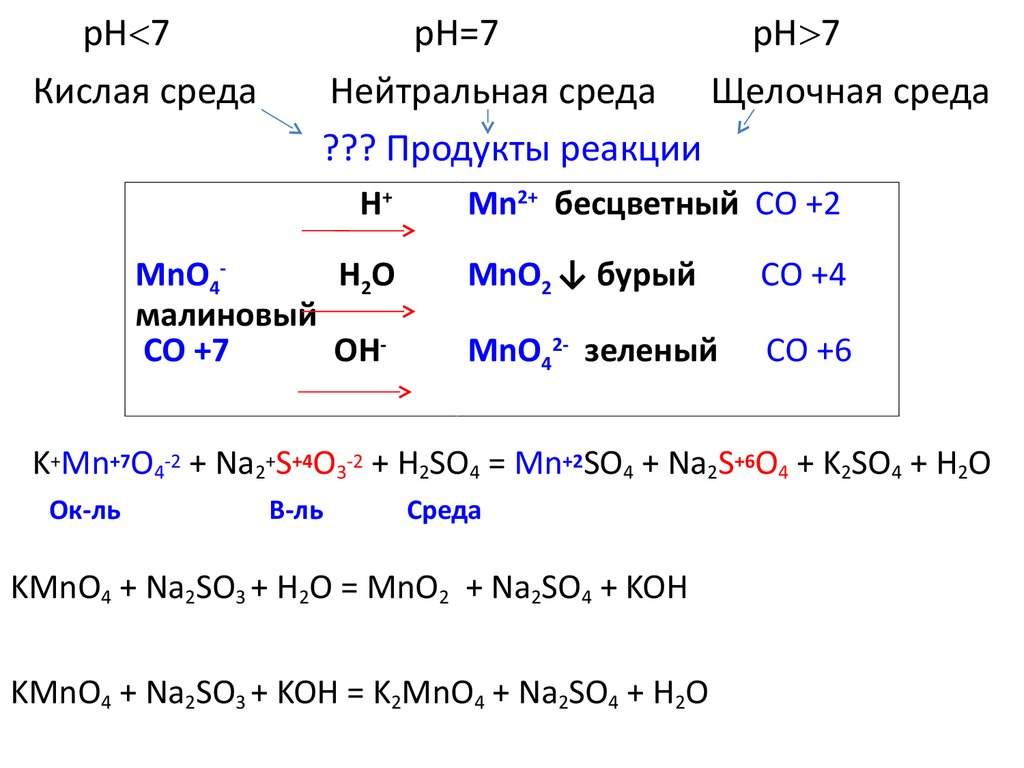
рН 7Кислая среда
рН=7
рН 7
Нейтральная среда Щелочная среда
??? Продукты реакции
Н+
MnО4Н2О
малиновый
СО +7
ОН-
Mn2+ бесцветный СО +2
MnО2 ↓ бурый
СО +4
MnО42- зеленый
СО +6
K+Mn+7O4-2 + Na2+S+4O3-2 + H2SO4 = Mn+2SO4 + Na2S+6O4 + K2SO4 + H2O
Ок-ль
В-ль
Среда
KMnO4 + Na2SO3 + H2O = MnO2 + Na2SO4 + KOH
KMnO4 + Na2SO3 + KOH = K2MnO4 + Na2SO4 + H2O
2.
Хромат-ионыОНCrO42Желтый
Cr(OH)3↓
Сине-зеленый
осадок
Н+
Сr2O72Оранжевый
Бихроматионы
Cr3+
Сине-зеленый
Изб. ОН[Cr(OH)6]3Сине-зеленый
раствор
2 Cr +6 O42- + 2 H+
Cr2 +6 O72- + H2O
СuSO4 +K2Cr2+6O7 +H2SO4 = Сu2(SO4)3 + Cr2+3(SO4)3 +K2SO4 +H2O
3.
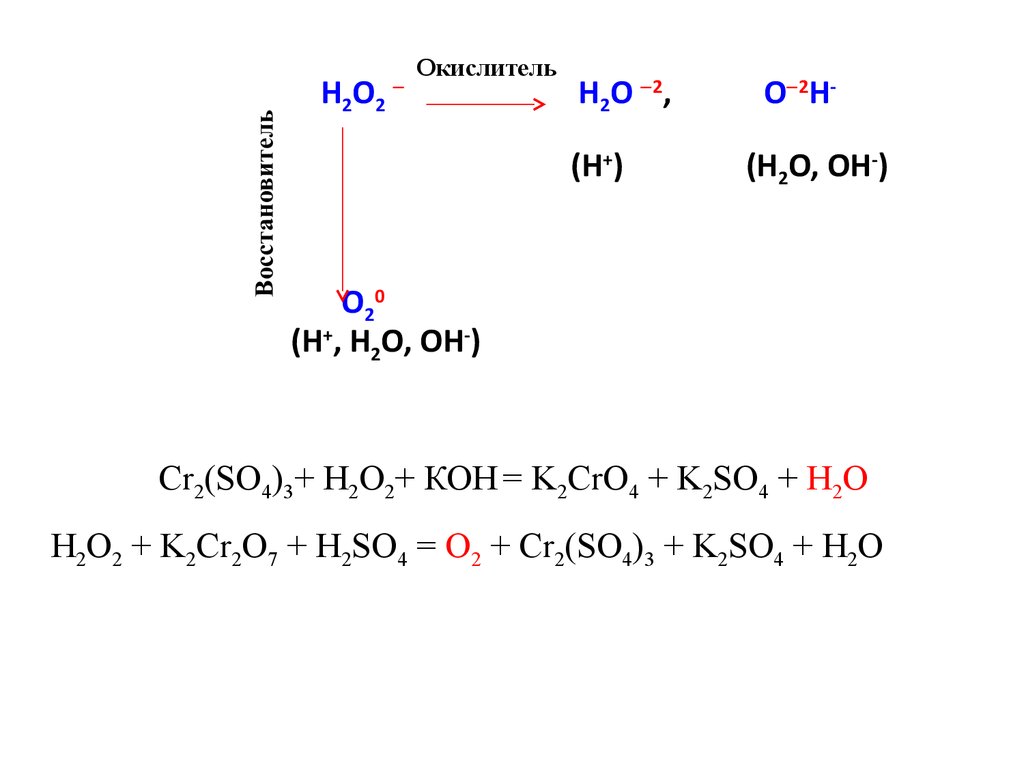
H2O2Окислитель
H2O 2,
(H+)
O 2H(H2O, OH-)
O20
(H+, H2O, OH-)
Cr2(SO4)3+ H2O2+ КОН = K2CrO4 + K2SO4 + H2O
H2O2 + K2Cr2O7 + H2SO4 = O2 + Cr2(SO4)3 + K2SO4 + H2O
4.
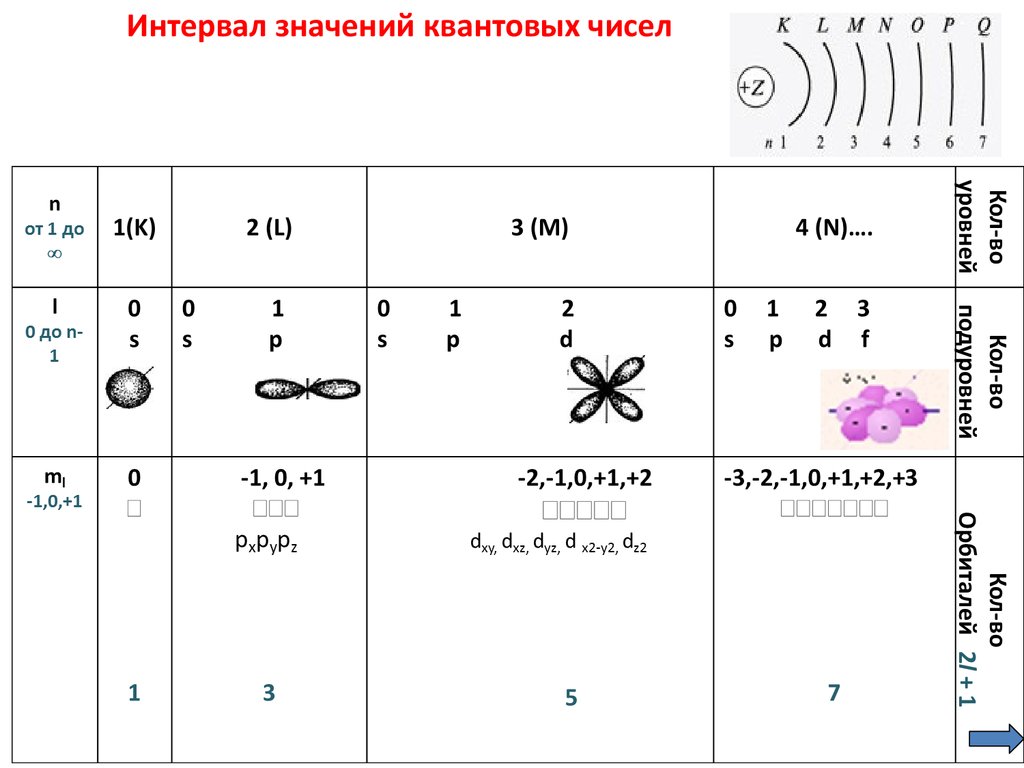
1. Главное квантовое число (n) – определяет энергиюэлектрона на орбитали, обозначает номер энергетического
уровня - номер периода в ПС, число уровней.
2. Орбитальное (побочное) квантовое число (l) –
определяет форму орбитали, тип подуровня, количество
орбиталей на уровне.
3. Магнитное квантовое число (ml) - число ориентаций
орбиталей в пространстве, количество орбиталей на
подуровне.
4. Cпиновое квантовое число (ms) – характеризует спин
электрона, т.е. вращение электрона вокруг собственной оси.
s = ½; ms: +½ ( ), - ½ ( ),
где «+» - по часовой стрелки,
«-» - против.
5. Интервал значений квантовых чисел
6.
«Проскок» или «провал» электронов - это переход электронов с подуровня с
большей энергией на ближайший подуровень с меньшей энергией для его
завершения. Такие переходы придают устойчивость атому. Устойчивыми считаются
завершенные и полузавершенные энергетические подуровни.
Важнейшими являются два типа подобных переходов:
1) (s → d)–переходы - это «провал» одного s-электрона с внешнего уровня n на
ближайший (n - 1)d –подуровень предвнешнего уровня:
(n - 1)dx ns2 → (n - 1)dx+1 ns1или0, где х – число d-электронов.
Такой «провал» характерен для следующих d-элементов периодической системы Д.И.
Менделеева: 29Сu, 47Ag , 79Au, 41Nb, 24Cr, 42Mo, 44Ru, 45Rh и 78Pt.
Пример: электронное строение атома 24Сr:
24
Сr [Ar] 4s2 3d4 → 24Сr [Ar] 4s1 3d5.
В атоме платины 46Pd происходит «провал» двух электронов.
Пример: электронное строение атома 46Pd:
46
Pd [Kr] 5s0 4d10.
2) (d → f) – переходы: (n 2)f x (n 1)dy ns2 → (n 2)f x+1 (n 1)dy-1 ns2,
где х – число f-электронов; y – число d-электронов.
Семейства лантана (искл. 64Cd и 71Lu) и актиния (искл. 91Pa, 92U, 93Np, 96Cm,
97
Bk и 103Lr.
7.
Пример:Для элемента селена 34Se:
1) Символическая электронная формула:
34
Se 1s2 2s22p6 3s23p63d10 4s24р44d4f;
34
Se 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р4.
2) Сокращенная электронная формула:
34
Se [18Ar] 3d10 4s24р44d4f;
34
Se [18Ar] 4s23d104р4.
8. 3) Электронно-графическая формула:
9.
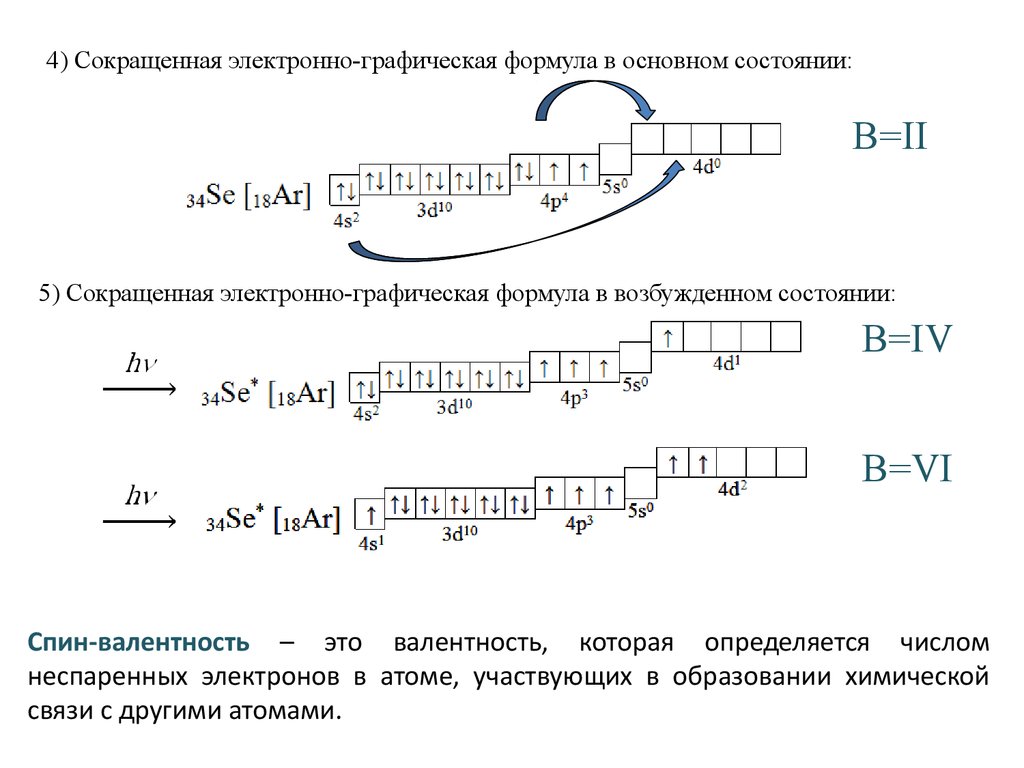
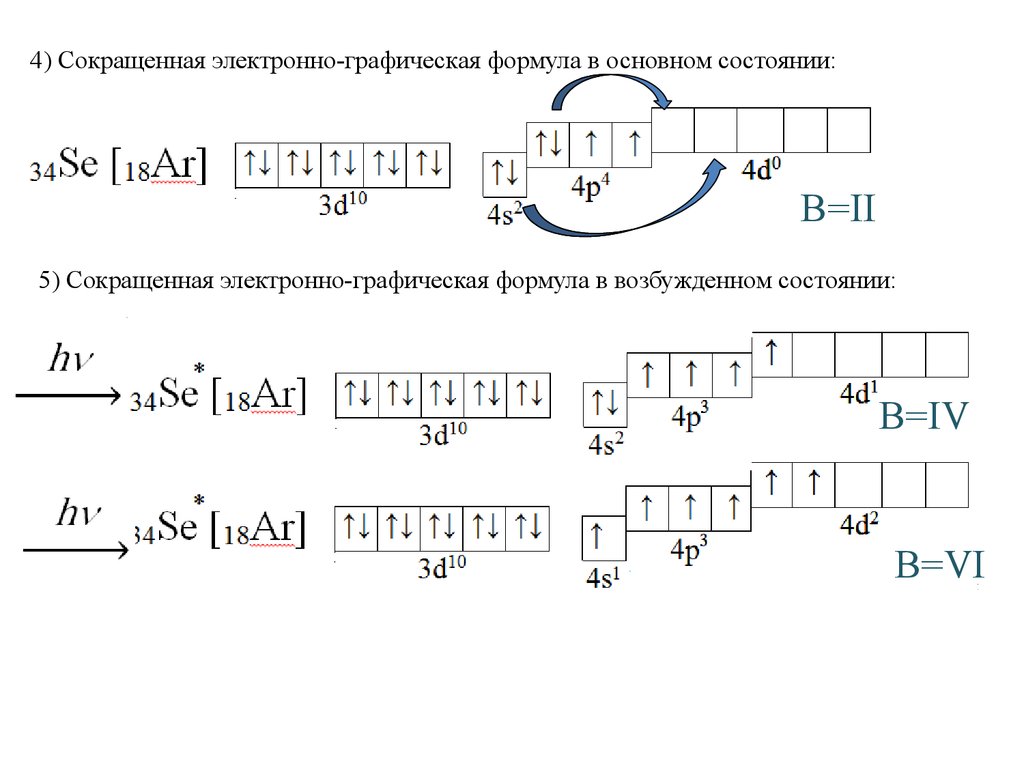
4) Сокращенная электронно-графическая формула в основном состоянии:В=II
5) Сокращенная электронно-графическая формула в возбужденном состоянии:
В=IV
В=VI
Спин-валентность – это валентность, которая определяется числом
неспаренных электронов в атоме, участвующих в образовании химической
связи с другими атомами.
10.
4) Сокращенная электронно-графическая формула в основном состоянии:В=II
5) Сокращенная электронно-графическая формула в возбужденном состоянии:
В=IV
В=VI
11.
6) Сокращенная электронно-графическая формула в ионном виде:Se0 + 2ē → Se2-
12.
7) Семейство элемента. Электронные аналоги 34Se:р-семейство; О, S, Te, Po - ns2 np4.
Электронные аналоги – это элементы, у которых электроны
расположены на орбиталях, описываемых общей для элементов
формулой.
Семейство элемента
Сокращенная электронная
формула
s
ns2
p
ns2 np6
d
ns2 (n-1)d10 np6
f
ns2 (n-2)f14 (n-1)d10 np6







 Химия
Химия








