Похожие презентации:
Алюминий және оның қосылыстары
1. Алюминий және оның қосылыстары
АЛЮМИНИЙ ЖӘНЕ ОНЫҢҚОСЫЛЫСТАРЫ
2.
Табиғатта таралуы:Алюминий – белсенді болғандықтан табиғатта бос
күйінде кездеспейді, ал қосылыстар құрамында ең көп
таралған металл.
Оның жер қыртысындағы үлесі 9%. Жер қыртысында
алюминий көптеген минералдар түзеді. Алюминийдің
маңызды өнеркәсіптік кендері: боксит (AI2O3*nH2O),
корунд (AI2O3), каолинит (AI2O3*2SiO2*2H2O), ортоклаз
(KAISi3O10). Елімізде алюминий кендерінің үлкен қоры
Арқалықта (Қостанай облысы) бар. Сол кенді
пайдаланып Павлодар алюминий зауыты жұмыс
істейді.
Корундтың мөлдір қоспаларымен боялған кристалда
белгілі: қызыл-рубин және
көк- сапфир, бұлар бағалы тас ретінде пайдаланады.
3.
Өнеркәсіпте алынуы:Алюминийді электролиз әдіспен алуға болады.
Алюминий өндірісінде, шикізат ретінде көбінесе
боскситтер жиі қолданады. Қыздырғанда олар
суын жоғалтып, алюминий оксидіне айналады.
Алюминий оксидінің балқу температурасы жоғары
(20450С) және ол электр тоғын өткізбейді.
Сондықтан AI2O3–ті фторидтерді қоса отырып
(CaF2, MgF2 немесе AIF3), балқытылған криолитте
ерітеді. Бұл қоспа шамамен 10000С температурада
балқиды.
Электролиз кезінде катодта-алюминий, ал
анодта –оттек бөлінеді. Электролиз
реакциясының жалпы теңдеуі:
AI2O3 электролиз→ 2AI+1.5O2
4.
Физикалық қасиеттері:Алюминий– жеңіл, күміс түстес ақ металл, оның
тығыздығы – 2,7 г/см3. Балқу температурасы –
660,240С, ал қайнау температурасы-25000С.
Алюминий иілгіштік қасиеті жоғары, оңай фольга
болып жайылады және сым түрінде созылады.
Алюминийдің электрөткізгіштігі,
жылуөткізгіштігі жоғары. Металдың беті жұқа
және өте тығыз оксид қабықшасымен қапталған.
Бұл қабықша оптикалық мөлдір және металдық
шағылдырғыш қабілетін сақтайды.
5.
6.
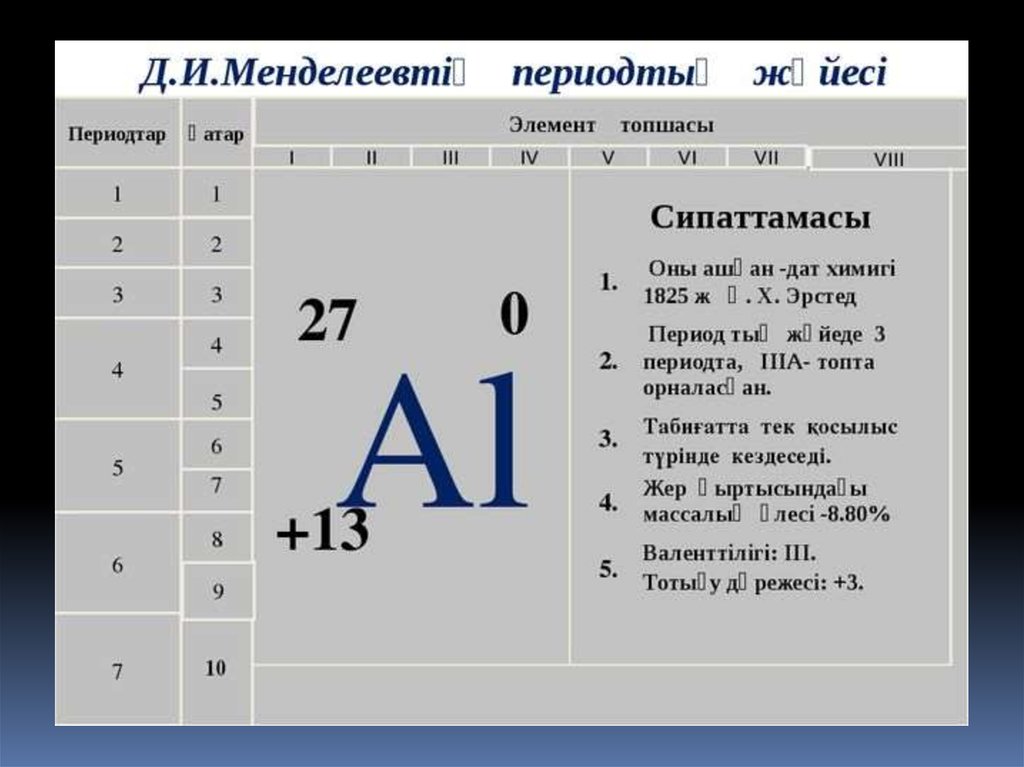
Периодтық жүйедегі орны1.Химиялық таңбасы-Al
2.Реттік нөмірі- 13
3.Ar(Al)- 27
4.Период нөмірі- ІІІ (кіші)
5.Топ нөмірі-ІІІ (негізгі)
Атом құрылысы:
1.Ядро заряды- +13
2.Электрон саны- 13
3.Протон саны- 13
4.Нейтрон саны -14
5.Энергетикалық деңгей саны -3
6.Валенттілік электрондары- 3
7. Электрондық конфигурациясы 1s2 /2s22P6/3s2 3p1
7.
электролиз→І. Алынуы: AI2O3
2AI+1.5O2
AICI3+3NaOH=AI(OH)3↓+3NaCI
8.
9.
Химиялық қасиеттері:Қышқылмен: AI(OH)3+3HNO3=AI(NO3)3+3H2O
Сілтімен: AI(OH)3+NaOH =Na[AI(OH)4]
Алюминий тұздарын сілтілермен сапалық реакция
бойынша анықтауға болады. Бұл кезде алюминий
гидроксидінің қоймалжың тұнбасы түзіледі. Тұнба
сілтінің артық мөлшерінде ериді.
AICI3+3NaOH=AI(OH)3↓+3NaCI
AI – құймалар алуда,электротехникада электр
сымдарын жасау үшін, жарылғыш заттар алуда,
химиялық аппаратураларды дайындауда,
құрлыстар салуда, ыдыстар жасауда т.б
қолданылады.
.
10.
AI2O3 – зергерлік істе, дәл аспаптарға (сағаттағы“тастар”) мойынтіректер мен тіректер,
пластинка ойнағыштың басына дыбыс түсіргіш
инелер жасайды.
AICI3–алюминий хлоридін органикалық синтезде
өршіткі ретінде;
AI2(SO4)3 – алюминий сульфаты суды тазалауда
және қағаз өндірісінде;
KAI(SO4)2*12H2O – алюмокалий ашудасы тері,
аяқкиім өнеркәсібінде теріні илеу үшін және
маталарды бояғанда өңдеу үшін қолданады.











 Химия
Химия








